Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Perspectivas en Nutrición Humana
Print version ISSN 0124-4108
Perspect Nut Hum vol.13 no.1 Medellín Jan./June 2011
ARTÍCULOS DE INVESTIGACIÓN
Estudio piloto sobre selenio plasmático en personas sanas de Antioquia, Colombia
Pilot study on plasma selenium in healthy individuals of Antioquia, Colombia
Jaime Carmona-Fonseca1; Valentina Guzmán-Pérez2
1 Grupo Salud y Comunidad César Uribe Piedrahíta, Universidad de Antioquia. Medellín-Colombia. jaimecarmonaf@hotmail.com
2 Departamento de Nutrición y Bioquímica, Facultad de Ciencias, Pontificia Universidad Javeriana. Bogotá-Colombia.
Artículo recibido: 16 de noviembre de 2010 Aprobado: 8 de abril de 2011.
Como citar este artículo: Carmona-Fonseca J, Guzmán-Pérez V. Estudio piloto sobre selenio plasmático en personas sanas de Antioquia, Colombia. Perspect Nutr Humana. 2011;13:11-20.
Resumen
Problema: en América Latina son muy pocos y en Colombia no existen estudios sobre el nivel de selenio sérico/plasmático. Objetivo: medir el selenio plasmático en un grupo de personas aparentemente sanas.Objetivo: medir el selenio plasmático en un grupo de personas aparentemente sanas. Materiales y metódos: se usó un diseño descriptivo transversal. Como indicadores de estado nutricional se midieron selenio, retinol, ferritina e índice de masa corporal. El selenio se cuantificó por espectrofotometría de absorción atómica con horno de grafito (atomización electrotérmica y corrección de fondo por efecto Zeeman). Resultados: se evaluaron 40 personas residentes en Turbo o El Bagre (Antioquia, Colombia). El selenio plasmático (µg/L) fue 43,5±12,7; intervalo de confianza 95% 39,5-47,5; 66% con <46 (límite inferior europeo). El retinol estuvo bajo (<20 µg/dL) en 11% de las personas y la ferritina fue baja en 44%. Conclusiones:se requieren más estudios y en grupos humanos de mayor tamaño y con apropiados criterios de selección, en diferentes regiones del país, con distintos sexos y edad, así como estudios de contenido de selenio en suelo y en alimentos, para construir un panorama adecuado en Colombia.
Palabras clave: selenio, retinol, ferritina, estado nutricional, índice de masa corporal, Colombia.
Abstract
Problem: In Latin America are few and in Colombia there are no studies on the level of serum/plasma selenium. Objective: To measure selenium in plasma in a group of apparently healthy people. Methodology: A descriptive and longitudinal study in which plasma selenium, retinol, ferritin and body mass index were measured. Selenium was measured by Graphite Furnace Atomic Absorption Spectrometry (electrothermal atomization and background correction by Zeeman effect). Results: In total, 40 individuals from Turbo or El Bagre (Antioquia, Colombia) were evaluated. Selenium level (µg/L): 43,5±12,7; confidence interval 95% 39,5-47,5; in 66% was <46 (lowest European reference level). Retinol was low (<20 µg/dL) in 11% of the individuals and ferritin levels were very low in 44%. Conclusions: In order to build an adequate snapshot of the situation in Colombia, we must develop more studies with larger groups of individuals, with appropriate selection criteria in different regions of the country, with both genders and different ages. Also, studies of Se content in soil and food.
Key words: selenium, retinol, ferritin, nutritional statuts, body mass index, Colombia.
INTRODUCCIÓN
El selenio (Se) es un micronutriente esencial para todas las formas de vida conocidas; induce apoptosis, es antioxidante, estimula el sistema inmunológico e interviene en el funcionamiento de la glándula tiroides; participa en la producción de energía mitocondrial junto con la vitamina E, estimula la producción de prostaglandinas y ubiquinona (coenzima Q10) y contribuye a la fertilidad; hay correlación entre la concentración de Se, la actividad de glutatión peroxidasa (GSH-Px) y otros parámetros de la defensa antioxidante en los componentes sanguíneos (1-5). Es cofactor de varias selenoproteínas funcionalmente activas (selenoenzimas) (6-7). Posee propiedades antimutagénicas y anticarcinogénicas, pero en exceso puede inducir efectos mutagénicos y cancerígenos (1, 8). Entre las enfermedades humanas asociadas con déficit de Se está la cardiomiopatía endémica juvenil de Keshan (en China) (1). La toxicidad por Se sucede casi siempre por penetración a través de la piel o por inhalación (1).
El Se eritrocitario es mayor que el plasmático y el sérico, en relación de 2:1 (9) las concentraciones plasmáticas y séricas son similares (10). Por la larga vida relativa de los elementos traza (como zinc, cobre, Se) y su lento recambio, su concentración en eritrocitos refleja en forma más precisa una deficiencia, especialmente como indicador a largo plazo. En contraste, el plasma y el suero son indicadores de corto plazo. La concentración en orina es sobre todo reflejo de exposición reciente (11).
Los niveles de Se, Cu, Zn dependen de factores como situación geográfica (suelos: uso y manejo), etnia, sexo, edad, condiciones fisiológicas y patológicas (12-15). El Se tiene localización ubicua pero muy escaso en la corteza terrestre (1, 16), cuya cantidad en humanos es determinada principalmente por los alimentos ingeridos, en los que su concentración está regida por factores geoquímicos, geológicos y temporales (17-18). Entra a la cadena alimentaria al consumir vegetales (selenometionina) y productos de origen animal (selenoanimoácidos o selenoproteínas) (19-20).
En la práctica clínica y epidemiológica los niveles de Se en sangre se usan para evaluar el estado del mineral, pero los experimentos animales sugieren que cuando se aumenta el consumo dietario, una vez se obtiene una adecuada captación, su concentración en sangre permanece constante (21-22). Si la captación llega a niveles tóxicos, su aumento se refleja de nuevo en los niveles en sangre. Las concentraciones de Se en la sangre humana parecen seguir un patrón similar al descrito y al parecer son reguladas a una concentración aproximada de 2000 µg/L (23)3 .
El nivel de Se en sangre necesario para obtener una expresión completa o saturación de la actividad de la enzima GSH-Px es aproximadamente de 95-100 µg/L de sangre total (24), valor similar a los 90 µg/L de sangre total referidos por otros (25). También se dice que el nivel de Se en eritrocitos necesario para obtener una actividad de GSH-Px en meseta es 140 µg/L de eritrocitos (9). De igual manera, se ha informado que cuando las selenoproteínas plasmáticas alcanzan un nivel de meseta, ellas contienen 70-90 µg/L (0,8-1,1 µMol/L) de Se (26), de tal manera que ese valor puede considerarse como la concentración ideal de Se en el plasma y el suero.
En Europa occidental los valores de Se sérico/plasmático varían, en general, entre 60 y 100 µg/L (10, 27). Sobre el Se sérico/plasmático humano en América Latina hay poca información (13 referencias pudieron hallarse; no citadas aquí): en adultos sanos, hombres y mujeres (cinco estudios), el promedio fue de 77,39 µg/L, con desviación estándar de 18, mientras el promedio para los niños (tres estudios) fue 94,37 µg/L; un informe para recién nacidos de menos de 25 horas de edad indica valores de 13 ± 3 µg/L. No sabemos de estudios colombianos en personas sanas, pero hay dos informes, de 2008, originados en pacientes con enfermedad gástrica, uno de ellos sobre Se en plasma (28) y otro en uñas (29). El estudio sobre Se ungueal se hizo en 142 pacientes con cáncer gástrico y 244 controles hospitalarios, afectados por enfermedades diferentes a cáncer, evaluados en tres hospitales públicos de Cali; el Se se midió por espectrometría de absorción atómica; los niveles hallados fueron altos en casos (1,078 µg/g; IC95% 1,025 a 1,135) y controles (0,945 µg/g; IC95% 0,896 a 0,995) (29). El estudio sobre Se en plasma se hizo en pacientes de la consulta externa de hospitales públicos de Túquerres y Tumaco (Nariño) (28); se examinaron 89 hombres adultos de 31 a 60 años con síntomas de dispepsia (44 en Túquerres -zona de alto riesgo de cáncer gástrico, según la frecuencia- y 45 de Tumaco -área de bajo riesgo-). El Se plasmático se midió por fluorometría. En los pacientes de Tumaco el Se en plasma fue 121 ± 1,4 µg/L y en Túquerres fue 107 ± 1,2 µg/L. Del total de 89 pacientes, a 70 se les hizo endoscopia digestiva y el resultado fue''normal'' o''sin gastritis atrófica'' en 32 (16 en cada ciudad) y mostró''gastritis atrófica multifocal'', o''metaplasia intestinal'' o''displasia'' en 38 (10 en Tumaco y 28 en Túquerres). En ninguna de las dos zonas hubo diferencia estadísticamente significativa en el Se plasmático entre los pacientes con y sin lesiones de tipo maligno.
En resumen, es creciente el interés clínico y epidemiológico por conocer los niveles de Se sérico/plasmático en diferentes grupos humanos sanos y enfermos y en buscar asociaciones con estados de salud y enfermedad.
Este escrito informa sobre un estudio piloto cuyo objetivo fue medir el nivel plasmático de Se en un grupo de personas de apariencia sana. Se planteó como trabajo piloto por la carencia de datos autóctonos sobre su concentración en plasma o suero y por la ausencia de experiencia en Colombia en la medición de Se, del que únicamente hallamos un laboratorio que lo midiera a partir de muestras clínicas .
MATERIALES Y MÉTODOS
Clase de estudio y diseño de la muestra
Estudio piloto, con diseño descriptivo transversal para medir Se en plasma de un grupo de personas aparentemente sanas, residentes en las zonas urbana o rural de los municipios de Turbo y El Bagre, departamento de Antioquia, sitios donde con frecuencia desarrollamos proyectos de investigación. Las personas estudiadas fueron halladas en sus casas o lugares de trabajo, fueron invitadas a participar en forma voluntaria y sin contraprestación. Quienes aceptaron y resultaron ''sanas'', según el examen de evaluación clínica y la anamnesis, se incluyeron en el estudio. Se captaron las primeras 40 personas. El tamaño muestral (n= 40) fue definido por conveniencia.
Criterios de inclusión
1. No tener procesos infecciosos.
2. No estar en embarazo.
3. No presentar enfermedad cardíaca congestiva ni falla renal o hepática.
4. No haber recibido suplementos de vitaminas o minerales en los pasados 45 días.
5. No ser fumador.
6. No ingerir alcohol en forma rutinaria y, específicamente, no haberlo consumido en los últimos 15 días.
7. No haber consumido ningún medicamento en los últimos 30 días.
8. Pertenecer a cualquier etnia, sexo o grupo de edad.
Evaluación del estado nutricional
Como parte del proceso de establecer el estado de salud de las personas, además de la evaluación clínica general (examen físico y anamnesis), se estudió su estado nutricional mediante antropometría y algunos indicadores bioquímicos (ferritina, retinol). Se midieron el peso, la estatura y la edad. La clasificación del estado nutricional se hizo con el índice de masa corporal (IMC) (un valor menor de 18,5 kg/m2 indica riesgo de deficiencia crónica de energía). Para medir el peso corporal, sin ropa exterior y sin zapatos, se usó una báscula electrónica con 100 kg de capacidad y 100 gramos de sensibilidad. Para medir la talla, que se tomó de pie y sin zapatos, se usó un estadiómetro flexible, fijo en la pared, de 2 m de capacidad y 0,1 cm de sensibilidad; las mediciones de peso y estatura se registraron dos veces cada una. Todos los índices antropométricos fueron construidos con el programa Epinut de EpiInfo 6.00.
Cuantificación del selenio en plasma
Se tomó, en tubo al vacío, muestra de sangre venosa anticoagulada con EDTA. El tubo fue protegido del aire, la luz y el contacto directo con hielo, y así se envió al laboratorio para el estudio. La medición de Se fue realizada en el laboratorio de análisis industriales de la Universidad del Valle. El Se fue determinado directamente, sin tratamiento previo, por espectrofotometría de absorción atómica con horno de grafito (espectrofotometría de absorción atómica con atomización electrotérmica y corrección de fondo por efecto Zeeman). En este método el plasma se inyecta en una cubeta de grafito, la cual se calienta gradualmente, secando y calcinando la materia orgánica presente y finalmente atomizando el Se que se encuentra en la matriz, el cual se determina cuantitativamente en la muestra. Una alícuota de plasma se diluyó con ácido nítrico y Triton X-100, la solución se inyectó directamente sobre el horno de grafito del espectrofotómetro de absorción atómica, el cual había sido calibrado antes y programado con las siguientes temperaturas: etapa de secado: 120 °C, etapa de precalcinación: 600 °C, etapa de calcinación: 1300 °C, etapa de atomización: 2200 °C. La concentración de Se fue calculada mediante una curva de adición de estándares, preparada entre 5 y 25 ppm, aplicando los correspondientes factores de dilución (30). El laboratorio de análisis consideró como bajos los niveles inferiores a 40 µg/L y como valores tóxicos los superiores a 100 µg/L.
Cuantificación de ferritina y retinol
Como marcadores bioquímicos del estado nutricional y entre muchos posibles, se decidió medir las concentraciones en sangre de ferritina y retinol. Para ello, se tomó, en tubo al vacío, muestra de sangre venosa anticoagulada con heparina. La determinación de ferritina se hizo en plasma heparinizado mediante inmunoensayo enzimático de micropartículas (MEIA). El análisis se hizo en el laboratorio clínico de la''IPS Universidad de Antioquia'' (Medellín). Se usó estuche Abbott AxSYM® System (referencia 7A58-20 B7A583 56-4324/R12, Abbott Laboratorios, USA). El volumen mínimo empleado para el procesamiento fue de 150 µL. El punto de corte empleado para definir bajos depósitos de hierro fue <12,0 µg/L (<12,0 µg/L) en ausencia de infección y 30 µg/dL (<30,0 µg/L) en presencia de esta (31). El retinol se evaluó en el Laboratorio de Nutrición del Instituto Nacional de Salud (Bogotá). La determinación del retinol en plasma de sangre venosa anticoagulada con EDTA se hizo por el método de cromatografía de alta resolución para líquidos (HPLC), con un cromatógrafo líquido Water 600 E con detector UV. Se tomaron como deficientes los valores inferiores a 20 µg/dL (0,698 µmol/L) (31).
Aspectos éticos
Cada paciente o acudiente aceptó la participación voluntaria mediante consentimiento informado y escrito. El proyecto fue aprobado por e Comité de Ética del Instituto de Investigaciones Médicas (IIM) de la Universidad de Antioquia.
RESULTADOS
En total se midió el Se en 40 personas, 67% hombres, con edad entre 15 y 54 años (27,1±10,3 años —promedio±desviación estándar—. Hubo una persona de 18 años con IMC <18,5 kg/m2 y cuatro (de 28 a 36 años) con IMC >24,9 (25,8 a 30,8 kg/m2).
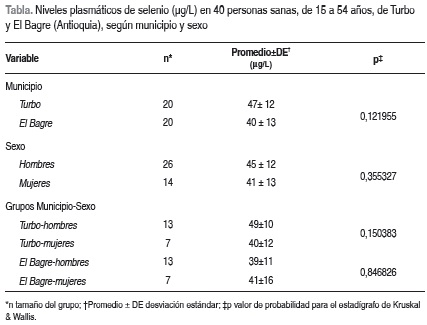
El promedio de Se en plasma fue 43,5 µg/L, la desviación estándar 12,7 µg/L y el error estándar 2,03; el intervalo de confianza de 95% para el promedio fue 39,5 a 47,5. Los valores mínimo y máximo fueron 22,7 y 77,8 µg/L. Al percentil 10 correspondió 25 µg/L, al 20 correspondió 30, al percentil 25 se asoció 35, al 40 correspondió 41, al 50 se asoció 43, al 60 correspondió 45, al percentil 75 se asoció 51, al 80 correspondió 52, al 90 se asoció 54 µg/L. Los promedios en hombres y mujeres fueron estadísticamente similares (p= 0,355327) (Tabla ). Excluida la persona con bajo IMC, 34% de las otras mostró Se menor de 40 µg/L.
El retinol tuvo niveles de 47,0 ±21,9 µg/L y la ferritina de 44,44 ±29,98 µg/dL. Solo una persona presentó simultáneamente bajos los niveles plasmáticos de retinol, ferritina y Se, pero tenía índice de masa corporal normal (19,7 kg/m2).
La concentración plasmática de Se no tuvo correlación significativa (siempre p>0,05) con ninguna de estas variables: edad (r= 0,15), peso corporal (r= 0,18), retinol plasmático (r= 0,16), ni ferritina plasmática (r= -0,05) .
DISCUSIÓN
Llama notoriamente la atención que 34% de las personas evaluadas presenten niveles de Se menores de 40 µg/L, a pesar de que ellas no tenían desnutrición según la evaluación antropométrica. Por esto mismo, también sorprende que 11% de las personas tengan bajo el retinol (<20 µg/dL) y que 44% posean ferritina baja (entre levemente y gravemente). Los datos, en consecuencia, demuestran que las evaluaciones antropométrica y bioquímica (retinol, ferritina, Se) no siempre concuerdan y esta falta de concordancia ya la hemos observado (32-33), pero otros han informado buena correlación entre la proteína de unión de tiroxina (PUT) y los indicadores peso/talla (riesgo agudo) y peso/edad (riesgo global), aunque no hallaron asociación con talla/edad (riesgo crónico) (34). Otros autores identificaron que la transtirretina (TTR) se correlaciona bien con el indicador talla/edad y mejor todavía con peso/talla (35).
Son muy pocos los informes sobre niveles de Se sérico/plasmático según la presencia y grado de desnutrición, sin la ocurrencia de otra enfermedad o estado mórbido. En niños marroquíes sin desnutrición o con desnutrición leve o grave se midieron en suero Se, retinol, alfa-tocoferol y carotenoides, que resultaron significativamente reducidos en los desnutridos; además, esos nutrientes se correlacionaron negativamente con la alfa-1 glicoproteína ácida(36). El Se sérico fue significativamente menor en niños con marasmo que en los controles (37). En adultos iraníes sin infección por virus de inmudeficiencia humana (VIH), pero sin clasificar el estado nutricional, el nivel de Se en suero (espectrofotometría de absorción atómica con horno de grafito) fue 91,7 ± 11,9 ug/L y en sujetos con infección VIH, aquellos con desnutrición moderada o grave tuvieron menos Se en suero que quienes no tenían desnutrición: 58, 50 y 86 µg/L, respectivamente (p= 0,004) (38).
La deficiencia de Se en los humanos se asocia con déficit del elemento en el ambiente, de tal manera que los alimentos que ingieren poseen poca cantidad (1, 39). La elevada proporción de nuestros sujetos con bajo nivel de Se no concuerda con afirmaciones según las cuales la deficiencia de Se en humanos es relativamente rara (40), teniendo en cuenta que es un elemento ubicuo y que son variadas las fuentes donde es posible hallarlo (pan, cereales, pescado, carnes, huevos) (1). En el departamento de Caldas, Colombia, hay bovinos con valores de GSH-Px compatibles con una deficiencia baja/marginal de Se en la dieta; la actividad de GSH-Px varía según la ubicación geográfica de la explotación y se observa la mayor frecuencia de animales con valores alterados en zonas altas (>2.000 msnm) (41).
Es necesario resaltar la profunda diferencia que existe en nuestro promedio (43,5 µg/L) y el encontrado en estudios en países europeos occidentales, que es alrededor de 80 µg/L (10). El promedio en los estudios latinoamericanos es, también, el doble del encontrado de este trabajo. Los valores de Se sérico/plasmático en Estados Unidos de América y en las regiones seleníferas son mucho más elevados que los de Europa (42). ¿A qué puede deberse esta gran diferencia? Los suelos europeos occidentales tienen, en general, bajo contenido de Se (10), mientras los escasos informes sobre Colombia refieren la presencia de mucho Se en los suelos y alimentos (16, 43-44), pero no se tienen estudios en la zona de Urabá. En Colombia, la selenosis (intoxicación natural por Se) en animales se presenta en las regiones secas de la cuenca del río Magdalena)(45). Entre los valores de Se más altos alguna vez encontrados en el suelo y en el trigo están los informados en Colombia (42). Una segunda explicación podría asociarse a la fuente de la muestra: el Se en plasma/suero es indicador de corto plazo del estado de ese elemento (11), comparado con los depósitos en eritrocitos, cabello o uñas, pero no hallamos razones para pensar en eventos recientes que, masivamente, hayan provocado un bajo nivel de Se. Una tercera explicación podría estar en función de la técnica de medición usada. En efecto, la técnica influye en el valor informado y se ha señalado que con las más modernas, como la usada en este trabajo, los valores tienden a disminuir y a tener distribución normal (gaussiana) (46). Los datos europeos provienen mayoritariamente de mediciones con espectrometría de absorción atómica, como lo hicimos nosotros, pero no puede descartarse que variaciones en las técnicas originen estas diferencias. Versieck en 1985 (47) y Zheng en 1993 (46), llamaron la atención sobre las grandes diferencias halladas en los datos publicados sobre elementos trazas en los líquidos y tejidos corporales y se afirmó que pruebas crecientes sugerían que la variación no era solo por factores biológicos (sexo, edad, dieta, condiciones fisiológicas), por exposición ambiental, circunstancias geográficas, o razones similares, sino que las inexactitudes técnicas y la inadecuada recolección y manipulación de las muestras eran asuntos críticos.
¿El bajo nivel plasmático de Se hallado en las personas de este estudio significa que tienen deficiencia de ese elemento? Según Bjerre y colaboradores, hay hiposelenemia sérica/plasmática si hay menos de 58,4 µg/L (<0,74 µMol/L), que es moderada si hay de 24,0 a 43,4 µg/L (0,30 a 0,55 µMol/L) e intensa si es menor de 24,0 µg/L (<0,30 µMol/L)(48). El nivel para definir hiposelenemia dado por estos autores (<58,4 µg/L) concuerda con lo que propusieron otros (49-50), pero no con lo planteado por algunos más, quienes elevan ese umbral hasta 80 µg/L (51). Cada vez más se demuestra que el agotamiento rápido e intenso de Se, en lugar de la''deficiencia'' de instalación lenta, está asociado con una gama de resultados de salud y es posible plantear argumentos teóricos para afirmar que la situación de Se por debajo de la óptima puede afectar la salud, pero la evidencia de una relación directa con los resultados de salud es muy limitada, pues la investigación es incipiente y hay escasez de datos. La deficiencia humana manifiesta de Se es escasa y aparece como enfermedad de Keshan, que es prácticamente desconocida fuera de las zonas de China. Con bajas ingestas de Se, sus concentraciones en plasma y la actividad de la enzima glutatión peroxidasa (GPx) tienen correlación lineal hasta el umbral de la concentración plasmática de Se (70-100 µg/L), más allá del cual la actividad de la GPx se estabiliza (hace meseta). Esta máxima concentración de GPx se piensa que representa llenamiento total (repleción) y la ingesta apropiada de Se constituye la base de los requisitos de la dieta recomendada (40). Aquí conviene anotar que uno de los estudios en Colombia, en sujetos con enfermedades gastrointestinales, residentes en la zona andina o en la costa Pacífica del departamento de Nariño, midió Se en plasma (con método fluorométrico) y no halló deficiencia en ninguno de los 89 pacientes y los valores promedios fueron 107 (zona andina) y 121 (zona costera) (28), niveles que son 2,5 y 3 veces los hallados en este estudio.
Se concluye que se requieren más estudios y en grupos humanos de mayor tamaño y con apropiados criterios de selección, en diferentes regiones del país, con distintos sexos y edades, así como estudios de contenido de Se en suelo y en alimentos, para construir un panorama adecuado en Colombia.
DECLARACION DE CONFLICTOS
Ninguno para manifestar.
FINANCIACIÓN
La investigación fue financiada por la Universidad de Antioquia: Comité para el Desarrollo de la Investigación CODI (código SIU32-1-161); Dirección de Regionalización (código IIM 2465); Facultad de Medicina (código IIM 2484); Estrategia de Sostenibilidad UdeA 2009-2010.
AGRADECIMIENTOS
A las personas participantes en el estudio y al personal y a los directivos del Hospital Francisco Valderrama (Turbo, Antioquia) y del Hospital Nuestra Señora del Carmen (El Bagre, Antioquia).
REFERENCIAS
1. Coppes Z. Selenio en la nutrición y el cáncer. Rev Asoc Quim Farm Uruguay. [revista en Internet]. 1999 [citado enero 2008];24: Disponible en: http://www.aqfu.org.uy/revista/revistas_1999/abril/selenio_nutricion_cancer.htm. [ Links ]
2. Institute of Medicine. Food and Nutrition Board. Dietary reference intakes for vitamin C, vitamin E, selenium and carotenoides. Washington: National Academy Press; 2000. p. 284-324. [ Links ]
3. Piekutowski K, Makarewicz R, Zachara B. The antioxidative role of selenium in pathogenesis of cancer of the female reproductive system. Neoplasma. 2007;54:374-8. [ Links ]
4. Selmi C, Tsuneyama K. Nutrition, geoepidemiology, and autoimmunity. Autoimmun Rev. 2009;9:A267-70. [ Links ]
5. Vinceti M, Maraldi T, Bergomi M, Malagoli C. Risk of chronic low-dose selenium overexposure in humans: insights from epidemiology and biochemistry. Rev Environ Health. 2009;24:231-48. [ Links ]
6. Burk R, Hill K. Selenoprotein P-expression, functions, and roles in mammals. Biochim Biophys Acta. 2009;1790:1441-7. [ Links ]
7. Gil del Castillo ML, Noguera-Velasco JA, Martínez-Hernández P. Determinación de selenio: importancia y medición. Actualidades Asoc Esp Farma Anal. 2005 [citado julio 2007];30:21-30. Disponible en: http://www.pncq.org.br/biblioteca/actualidades2005_03.pdf. [ Links ]
8. Schrauzer G Selenium and selenium-antagonistic elements in nutritional cancer prevention. Crit Rev Biotechnol. 2009;29:10-7. [ Links ]
9. Rea H, Thomson C, Campbell D, Robinson M Relation between erythrocyte selenium concentrations and glutathione peroxidase (EC 1.11.1.9) activities of New Zealand residents and visitors to New Zealand. Br J Nutr. 1979;42:201-8. [ Links ]
10. Rayman M The importance of selenium to human health. Lancet. 2000;356:233-41. [ Links ]
11. Hoet P, Lauwerys R. Metales y compuestos organometálicos. En: Lauwerys R, ed. Enciclopedia de salud y seguridad en el trabajo. 3 ed. Madrid: OIT; 2001. [ Links ]
12. Alfthan G, Neve J. Reference values for serum selenium in various areas-evaluated according to the TRACY protocol. J Trace Elem Med Biol. 1996;10:77-87. [ Links ]
13. Viegas-Crespo A, Pavfio M, Paulo O, Santos V, Santos M, Neve J. Trace element status (Se, Cu, Zn) and serum lipid profile in Portuguese subjects of San Miguel Island from Azores archipelago. J Trace Elements Med Biol. 2000;14:1-5. [ Links ]
14. García MJ, Alegría A, Barberá R, Farre R, Lagarda NJ. Selenium, copper and zinc indices of nutritional status. Influence of sex and season on reference value. Biol Trace Element Res. 2000;73:77-83. [ Links ]
15. Schaller K, Shiele R Selenio. En: Alessio L, Berlin A, Boni M, Roi R, eds. Indicadores biológicos para la valoración de la exposición humana a los productos químicos industriales: monóxido de carbono (EUR 12174 EN), etilbenceno, metilestireno, isopropilbenceno y selenio. Valencia: Generalitat Valenciana, Conselleria de Sanitat; 1997. p 49-78. [ Links ]
16. Matamoros-Veloza A. Distribución espacial de selenio en suelos y su comportamiento geoquímico local al oriente de los municipios de Útica y Villeta. Proyecto Compilación y Levantamiento de la Información Geoquímica. Bogotá: Ingeominas, Subdirección de Georreconocimiento; 2001. [citado julio 2007]. http://productos.ingeominas.gov.co/productos/OFICIAL/georecon/geoquimi/edetalle/pdf/utica/memoria.pdf. [ Links ]
17. Golubkina NA, Alfthan GV .The human Se status in 27 regions of Russia. J Trace Elem Med Biol. 1999;13:15-20. [ Links ]
18. Steinnes E. Soils and geomedicine. Environ Geochem Health. 2009;31:523-35. [ Links ]
19. Burk R, Levander O. Selenio. In: Shils M, ed. Nutrición en salud y enfermedad. 9 ed. México: McGraw-Hill Interamericana; 2002. p. 305-8. [ Links ]
20. Sunde R. Selenium. In: Stipanuk M, ed. Biochemical and physiological aspects of human nutrition. Philadelphia: Saunder; 2000. p. 782-809. [ Links ]
21. Burk R, Whitney R, Frank H, Peatson W. Tissue selenium levels during the development of dietary liver necrosis in rats fed torula yeats diets. J Nutr. 1968;95:420-8. [ Links ]
22. Scott M, Thompson J Selenium content of feedstuffs and effects of dietary selenium upon tisssue selenium in chick and poults. Poultry Sci. 1971;50:1742-8. [ Links ]
23. Burk RF. Selenium in man. In: Prasad A, Oberleas D, eds. Trace elements in human health and disease essential and toxic elements. New York: Academic Press; 1976. [ Links ]
24. Thomson C, Robinson M, Butler J, Whanger P. Long-term selenium supplementation with selenate and selenomethionine: and glutathione peroxidase (EC 1.11.1.9) in blood components of New Zealand women. Bri J Nutr. 1993;69:577-88. [ Links ]
25. Duffield AJ, Thomson CD, Hill KE, Williams S. An estimation of selenium requirements for New Zealanders. Am J Clin Nutr. 1999;70:896-903. [ Links ]
26. Hill KE, Xia Y, Akesson B, Boeglin ME, Burk RF. Selenoprotein P concentration in plasma is an index of selenium status in selenium-deficient and selenium-supplemented Chinese subjects. J Nutr. 1996;126:138-45. [ Links ]
27. Sabe R, Rubio R, Garcia-Beltrán L. Reference values of selenium in plasma in population from Barcelona. Comparison with several pathologies. Trace Elem Med Biol. 2002;16:231-7. [ Links ]
28. Camargo M, Burk R, Bravo L, Piazuelo M, Hill K, Fontham E, et al. Plasma selenium measurements in subjects from areas with contrasting gastric cancer risks in Colombia. Arch Med Res. 2008;39:443-51. [ Links ]
29. Koriyama C, Campos F, Yamamoto M, Serra M, Carrasquilla G, Carrascal E, et al. Toenail selenium levels and gastric cancer risk in Cali, Colombia. J Toxicol Sci. 2008;33:227-35. [ Links ]
30. Guzmán-Pérez V Respuesta terapéutica a la mefloquina y la amodiaquina según el CYP450 y el estado nutricional de pacientes con malaria falciparum [Trabajo de investigación Magister en Ciencias Básicas Biomédicas, área Microbiología y Parasitología]. Medellín: Universidad de Antioquia; 2005. [ Links ]
31. Castro L, Nicholls R. Deficiencia de hierro, vitamina A y prevalencia de parasitismo intestinal en la población infantil y anemia nutricional en mujeres de edad fértil, Colombia 1995-1996. Bogotá: Instituto Nacional de Salud; 1998. [ Links ]
32. Blair S, Carmona J, Correa A. Malaria en niños: relaciones entre nutrición e inmunidad. Rev Panam Salud Pública. 2002;11:5-14. [ Links ]
33. Carmona-Fonseca J, Alvarez G, Blair S. Apolipoproteína A1 para evaluar el estado nutricional en niños con y sin malaria. Iatreia. 2007;20:111-26. [ Links ]
34. Dao H, Delisle H, Fournier P Anthropometric status, serum prealbumin level and immune response to measles vaccination in Mali children. J Trop Pediatr. 1992;38:179-84. [ Links ]
35. Mokni R, Chakar A, Bleiberg-Daniel F, Mahu J-, Walravens PA, et al. Decreased serum levels of nutritional biochemical indices in healthy children with marginally delayed physical growth. Acta Paediatr. 1993;82:539-43. [ Links ]
36. Squali Houssaini F, Arnaud J, Richard M, Renversez J, Favier A. Evaluation of oxidative stress and antioxidant defences in malnourished Moroccan children. Ann Nutr Metab. 1997;41:149-59. [ Links ]
37. Tatli M, Vural H, Koc A, Kosecik M, Atas A. Altered anti-oxidant status and increased lipid peroxidation in marasmic children. Pediatr Int. 2000; 42:289-92. [ Links ]
38. Khalili H, Soudbakhsh A, Hajiabdolbaghi M, Dashti-Khavidaki S, Poorzare A, Saeedi A, et al. Nutritional status and serum zinc and selenium levels in Iranian HIV infected individuals. BMC Infect Dis. 2008;8:165. [ Links ]
39. Burguera JL, Burguera M, Gallignani M, Alarcon OM, Burguera JA. Blood serum selenium in the province of Merida, Venezuela, related to sex, cancer incidence and soil selenium content. J Trace Elem Electrolytes Health Dis. 1990;4:73-77. [ Links ]
40. Daniels L Selenium: does selenium status have health outcomes beyond overt deficiency?. Med J Austr. 2004;180:373-4. [ Links ]
41. Jaramillo S, Villa N, Pineda A, Gallego A, Tabares P, Ceballos A. Actividad sanguínea de superóxido dismutasa y glutatión peroxidasa en novillas a pastoreo. Pesq Agropec Bras. 2005;40:1115-21. [ Links ]
42. Ancízar-Sordo J Occurrence of selenium in soils and plants of Columbia, South America. Soil Sci. 1947;63:437-45. [ Links ]
43. Benavides S, Silva F. Seleniosis. Bogotá: Instituto Geográfico Agustín Codazzi; 1965. [ Links ]
44. Benavides ST, Mojica RFS. Seleniosis: ocurrencia de selenio en rocas, suelos y plantas. Intoxicación por selenio en animales y humanos. Bogotá: Instituto Geográfico Agustín Codazzi; 1959. [ Links ]
45. Restrepo-Arango J El suelo sano, soporte de vida sana. Rev Col Cienc Pec. 2004;17:198-203. [ Links ]
46. Zheng BS An analysis on the reported values of trace elements in human serum. Abstract Pubmed. Zhonghua Yu Fang Yi Xue Za Zhi. 1993;27:205-7. [ Links ]
47. Versieck J Trace elements in human body fluids and tissues. Crit Rev Clin Lab Sci. 1985;22:97-184. [ Links ]
48. Bjerre B, von Schenck H, Sörbo B. Hyposelenaemia: patients with gastrointestinal diseases are at risk. J Intern Med. 1989;225:85-8. [ Links ]
49. Díaz Romero C, López Blanco F, Henríquez Sánchez P, Rodríguez Rodriguez E, Serra Majem L. Serum selenium concentration in a representative sample of the Canarian population. Sci Total Environ. 2001;269:65-73. [ Links ]
50. Dubois F, Teby A, Belleville F, Nabet P, Paysant P. Common values of serum selenium in a population in Eastern France. Ann Biol Clin. 1990;48:28-32. [ Links ]
51. Hughes K, Chua L, Ong C. Serum selenium in the general population of Singapore, 1993 to 1995. Ann Acad Med. 1998;27:520-3. [ Links ]
Notas
3 En la literatura sobre selenio se usan diferentes unidades de medida que hacen difícil comparar los datos. En este escrito se usará casi exclusivamente la unidad en μg/L. Cuando las referencias citadas usen otras unidades, se hará la conversión adecuada para expresar en μg/L. Algunas equivalencias son: 1 mg/L = 1 μg/mL = 1 ppm 1 ng/mL = 1 μg/L 1 μg/mL = 1 μM/L * 0,0789899 μg/mL (* indica multiplicación) 1 μg/L = 1 μM/L * 0,0789899 x 1000 μg/L (* indica multiplicación)