Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Perspectivas en Nutrición Humana
versão impressa ISSN 0124-4108
Perspect Nut Hum vol.15 no.1 Medellín jan./jun. 2013
INVESTIGACIÓN
Extracto acuoso de uchuva (Physalis peruviana): actividades antiproliferativa, apoptótica y antioxidante
Aqueous extract of golden berry (Physalis peruviana):antiproliferative, apoptotic and antioxidant activities
Natalia Areiza Mazo1; María Elena Maldonado2; Benjamín Rojano3
1. Universidad de Antioquia, Medellín, Colombia.
2 Grupo Alimentación y Nutrición Humana, Escuela de Nutrición y Dietética, Universidad de Antioquia. Medellín-Colombia. mariaele@quimbaya.udea.edu.co
3 Grupo Ciencias de los Alimentos de la Universidad Nacional de Colombia. Medellín-Colombia.
Como citar este artículo: Areiza Mazo N, Maldonado ME, Rojano B. Extracto acuoso de uchuva (Physalis peruviana): actividades antiproliferativa, apoptótica y antioxidante. Perspect Nutr Humana. 2013;15:
Artículo recibido: 12 de diciembre de 2013; Aprobado: 20 de marzo de 2013
RESUMEN
Antecedentes: extractos etanólicos de P. peruviana han mostrado actividad citotóxica contra diferentes células cancerosas. Objetivo: estudiar la actividad anticancerígena de un extracto acuoso del fruto uchuva en células de cáncer de colon SW480 y SW620. Materiales y métodos: se analizaron citotoxicidad e índice de selectividad (SI) (MTT), antiproliferación (sulforodamina-B), apoptosis (ciclo celular, anexina-V, receptores TRAIL-DR4/-DR5 y caspasa-3), actividad antioxidante (contenido de flavonoides y carotenoides totales). Resultados: el extracto acuoso de uchuva mostró efecto citotóxico y antiproliferativo en células SW480 (IC50=44,2 mg/mL, SI=11,6) y SW620 (IC50=85,1mg/mL, SI=6,0). Las células hipodiploides SW480 y SW620 aumentaron 13% y 12%, respectivamente. Las células apoptóticas incrementaron 19% y 21% en SW480 y SW620, respectivamente, con incremento en la expresión de receptores TRAIL-DR4/-DR5 en SW480 (+59%/+53%) y SW620 (+67%/+65%), y activación de caspasa-3 en ambas líneas celulares. El extracto neutralizó radicales OH-, presentó baja capacidad reductora y atrapadora de especies reactivas del oxígeno y nitrógeno. El contenido de flavonoides y carotenoides fue 487,1 mg catequina y 0,9 mg β-caroteno por 100 g de liofilizado, respectivamente. Conclusiones: estos hallazgos sugieren que la uchuva puede ser una fuente prometedora de compuestos bioactivos con actividad quimiopreventiva en cáncer de colon humano.
Palabras clave: Physalis peruviana, cáncer colorrectal, ciclo celular, apoptosis, antioxidantes, anticancerígenos.
ABSTRACT
Background: Ethanolic extracts from P. peruviana showed cytotoxic activity against different cancer cell lines. Objective: To evaluate the antiproliferative activity of aqueous extract of the fruit golden berryin colon cancer cells. Materials and Methods: We analyzed cytotoxicity and selectivity index (SI) (MTT), antiproliferation (sulforhodamine-B), apoptosis (cell cycle, Annexin-V, receptors TRAIL-DR4/-DR5 and caspase-3), and antioxidant activity (content of total carotenoids and flavonoids). Results: The aqueous extract showed cytotoxic and antiproliferative effect on SW480 (IC50 = 44.2 mg/ml, SI = 11.6) and SW620 (IC50 = 85.1 mg/ml, SI = 6.0). The hypodiploid SW480 and SW620 cells increased 13% and 12% respectively as well as apoptotic SW480 and SW620 cells (19% and 21 %, respectively), expression of receptors TRAIL-DR4 /-DR5 (SW480: +59% / +53%; SW620: +67% / +65%) and activation of caspase-3. The aqueous extract scavenged OH- radicals, showed low oxygen radical capacity and low scavenging capacity for reactive oxygen and nitrogen species. The total flavonoids and carotenoids contente was 487.1 mg catechin y 0.9 mg β-carotene by 100 g powder, respectively. Conclusions: These findings suggest that golden berry may be a promising source of bioactive compounds with chemopreventive activity against human colon cancer.
Key words: Physalis peruviana, colorectal neoplasms, cell cycle, apoptosis, antioxidants, anticarcinogenic agents.
Introducción
Entre las frutas con alto potencial farmacológico pero escaso conocimiento sobre sus beneficios en la prevención y tratamiento del cáncer, se encuentra el fruto de la planta Physalis peruviana (uchuva), una baya de forma ovoide, color dorado brillante, protegida por un cáliz verde claro (1). Esta planta pertenece a las Solanáceas y aunque es el segundo fruto colombiano de mayor exportación su consumo interno es bajo (2).
P. peruviana, se postula como nutracéutico, por su alto contenido de vitaminas A, C, D, E y del complejo B; fitoquímicos como polifenoles que pueden actuar como ''barredores'' de radicales libres, otorgándole a la uchuva propiedad antioxidante, que brindan valor agregado con potencial benéfico para la salud (3). Algunas propiedades medicinales se han asociado con las lactonas como el 28 hidroxiwitanólido, witanólidos, physalinas, phygrina; y flavonoides como el kempferol y glucósidos de quercetina, que han mostrado actividad antioxidante y preventiva al daño peroxidativo en microsomas hepáticos y hepatocitos (4).
En relación con la actividad anticancerígena, las physalinas presentes en las hojas, han mostrado tener actividad citotóxica contra células de cáncer hepático (HA-22T), cérvix (HeLa), leucemia linfoide aguda (APM1840), leucemia promielocítica aguda (HL-60), leucemia mieloide aguda (KG-1), leucemia monolítica aguda (CTV-1) y cáncer nasofaríngeo (KB-16) (5-7). Quispe-Mauricio et al (8) encontraron que extractos etanólicos del tallo y hojas de P. peruviana seleccionaron e inhibieron significativamente el crecimiento de células de adenocarcinoma de colon (HT-29), cáncer de próstata (PC-3) y de leucemia mieloide crónica (K-562).
Por tanto, el desconocimiento científico de la actividad anticancerígena del fruto de la uchuva, invita a indagar sobre esta propiedad con base en la evaluación de su actividad citotóxica, antiproliferativa, apoptótica y antioxidante en un modelo in vitro de cáncer de colon mediante células de adenocarcinoma SW480 y sus derivadas metastásicas SW620, provenientes de un mismo paciente (9); y determinar el efecto selectivo ante células no-malignas VERO, una línea de células no-malignas de epitelio de riñón del mono verde africano, adulto y normal, Cercopithecus aethiops; con esta se estudiará la selectividad del extracto y se usará como control negativo (10).
MATERIALES Y MÉTODOS
Preparación del extracto acuoso
Se utilizaron frutas de uchuva del departamento de Cundinamarca (Colombia). Para obtener el extracto, 10 g de fruta madura y sana, fue lavada y desinfectada, posteriormente homogenizada con 50 mL de agua ultrapura en un Ultra Turrax® (Ika-Werke, Staufen, Germany) a 15.000 rpm por 20 seg, se filtró con papel Whatman N°1 y se liofilizó en un Labconco, Freezone 2.5 Plus System (Fisher Scientific, Pittsburg). El producto se almacenó a -20°C, protegido de la luz hasta el momento de su uso. Inmediatamente antes de usar, el extracto se filtró con membrana de 0,22 µm.
Cultivos celulares
Las células SW480, SW620 y VERO obtenidas del American Type Culture Collection (ATCC, Manassas, USA) se mantuvieron como fue descrito en Maldonado y colaboradores (11). Brevemente, se utilizó medio Dulbecco’s Modified Eagle Medium (DMEM), suplementado con 10% de suero de caballo inactivado, 100 U/mL de penicilina, 100 μg/mL de estreptomicina, y 1% de aminoácidos no-esenciales. Las incubaciones se hicieron a 37ºC en atmósfera húmeda con 5% de CO2. Para todos los experimentos, 24 h después de sembrar, se redujo la concentración del medio a 3% de suero, con 10 µg/mL de insulina, 5 µg/mL de transferrina, 5 ng/mL de selenio.
Ensayo MTT
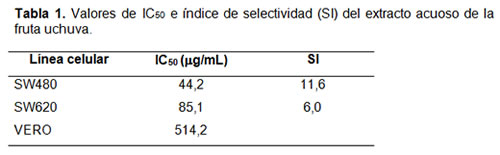
Basado en la reducción metabólica del 3-(4,5-dimetiltiazol-2-ilo)-2,5-difeniltetrazol (MTT) a formazán por la enzima mitocondrial succinato-deshidrogenasa (12). En platos de 96 pozos se sembraron 3.000 células viables/pozo, expuestas al extracto (0 a 400 µg/mL) y cúrcuma (100 µg/mL), como control positivo por 72 h a 37°C, 5% CO2. Luego, se adicionó 5mg/mL por pozo de MTT (4 h, 37°C, en oscuridad). Los cristales de formazán se disolvieron con isopropanol acidificado (0,4 N HCl). La cantidad de formazán – MTT directamente proporcional al número de células vivas fue determinado usando la densidad óptica (OD) a 540 nm mediante lector de platos de ELISA (GloMax ®-Multi Promega) y una longitud de onda de referencia a 750 nm. El porcentaje de inhibición se calculó con la fórmula: % Inhibición = (1-ODt/ODc) x 100. Donde ODt= densidad óptica tratadas y ODc= densidad óptica control. La concentración del extracto causante del 50% de inhibición del crecimiento celular (IC50) se calculó usando GraphPad Prism 5.0 (GraphPad Software Inc., San Diego, CA). El índice de selectividad (SI) se calculó usando la siguiente ecuación: SI =IC50 células VERO/ IC50 células cancerígenas (12). Si el valor SI es >1, indica que la sustancia es más citotóxica para las células tumorales que para las células normales, si es <1significa lo contrario.
Ensayo sulforodamina B (SRB)
Las células se incubaron como fue descrito en el ensayo de MTT. El medio DMEM 3% fue reemplazado cada 48 h con diferentes concentraciones del extracto. El cultivo celular se interrumpió con ácido tricloroacético 50% (v/v) por 1h a 4°C, y las proteínas celulares se colorearon con 0,4% (p/v) de SRB a las 24, 48 y 72 horas. La absorbancia de SRB es proporcional al número de células adherentes y vivas que fueron determinadas mediante densidad óptica a 490 nm, usando un lector de platos de ELISA (GloMax ®-Multi Promega) (13).
Análisis del ciclo celular
Se usó la tinción de yoduro de propidio (IP) para medir el porcentaje de población celular en la región Sub G0/G1, la cual exhibe un bajo contenido de DN inferior a 2n, característico de células muriendo que exhiben degradación de ADN (14). Esta aproximación permite determinar la cantidad de células muertas o muriendo en una población, pero no da información del proceso de muerte celular en curso como la apoptosis. Después del tratamiento, las células fueron centrifugadas y fijadas en 1 mL de metanol: tampón fosfato salino (PBS), (9:1, v/v) a -20°C por al menos 30 min, lavadas dos veces con PBS y resuspendidas en 200 mL PBS con 0.25 mg/ml RNAse A y 0.1 mg/mL IP, incubadas en la oscuridad a 37°C por 30 min. La fluorescencia se midió en un citómetro de flujo (EPICS XL, Coulter, Hialeah, Florida) a una velocidad de adquisición de 10000 eventos/seg y se analizó con el programa Windows Multiple Document Interface 2.8, WinmDI, (Scripts Research Institute, La Jolla, CA).
Detección de apoptosis
Mediante detección en superficie celular de fosfatidilserina (15), después de 48 h de tratamiento, las células se recolectaron por tripsinización y se usó el estuche comercial annexin-V–FLUOS staining, siguiendo las indicaciones del fabricante (Roche). La fluorescencia se midió en un citómetro de flujo (EPICS XL, Coulter, Hialeah, Florida) a una velocidad de adquisición de 10.000 eventos/seg y se analizó con el programa Windows Multiple Document Interface 2.8, WinmDI, (Scripts Research Institute, La Jolla, CA).
Detección de receptores de muerte TRAIL-DR4/DR5
Se utilizó el procedimiento descrito por Maldonado y colaboradores (11). Brevemente, después de 48 horas de tratamiento de las células con el extracto, se recolectaron por tripsinización, se lavaron con tampón fosfato salino (PBS), frío, y se incubaron en oscuridad (30 min, 4°C) con el anticuerpo monoclonal de isotipo anti-IgG de ratón acoplados al fluorocromo Isotiocianato de Fluoresceína (FITC) (BD Biosciences, Belgium); o se incubaron con los anticuerpos monoclonales anti-humano-DR4 y anti-humano-DR5 de ratón, ambos anticuerpos acoplados a FITC (Alexis Biochemicals Co., Lausana, Suiza). La fluorescencia se midió en un citómetro de flujo FACScan (BD Biosciences, Belgium) a una velocidad de adquisición de 10.000 eventos/seg y se analizó con el programa CellQuest Software (BD Biosciences, Belgium).
Actividad de la Caspasa-3
Se midió con el estuche comercial Caspase-3 Assay Colorimetric Kit (Sigma-Aldrich, Germany), siguiendo las indicaciones del fabricante. El ensayo se basa en la hidrólisis del péptido acetyl-Asp-Glu-Val-Asp p-nitroanilide (Ac-DEVD-pNA) por la caspasa-3, resultando en la liberación de pNA, cuya concentración se calculó a partir de la OD a 405 nm y la curva de calibración de pNA. Los resultados se ajustaron al contenido de proteína total, y la actividad se expresó como nmol de p-NA/h/mg de proteína.
Determinación del contenido total de flavonoides
Se empleó el ensayo colorimétrico con cloruro de aluminio usado por Debnath en 2011 (16). Se adicionaron a 25 µL de muestra o solución estándar 125µL de agua destilada, luego 5 µL de solución de nitrato de sodio al 5% (v/v). La mezcla se incubó por 5 minutos. Posteriormente, 10% (v/v) de solución de cloruro de aluminio fue mezclado con 15µL de la mezcla anterior. Finalmente la absorbancia se leyó a 510 nm y el contenido de flavonoides se expresó como mg catequina/100g de liofilizado.
Determinación de carotenoides
Se usó el método descrito por Biswas y colaboradores en 2011 (17). Se tomó en un tubo de ensayo con 1 g de muestra, se adicionaron 5 mL de acetona fría, se dejó reposar alrededor de 15 min en refrigerador (4°C), pasado este tiempo se agitó en vórtex por 2 min. El precipitado se re-extrajo con 5 mL de acetona fría y se repitió todo el proceso anterior. Ambos extractos acetónicos se mezclaron, luego se filtraron en papel Whatmann No. 42 y se determinó la absorbancia en un espectrofotómetro UV-Vis Thermo Scientific Genesys 20® a longitud de onda de 449 nm. La concentración de carotenoides se estipuló mediante la curva de calibración respectiva, utilizando β-Caroteno como sustancia patrón.
ORAC (Capacidad de absorción de radicales del oxígeno)
Se midió la actividad antioxidante del extracto contra el radical peroxilo 2,2 -Azo-bis(2-amidinopropano) dihydrochlorido (AAPH) generado a 37°C (18). La fluoresceína (FL) se usó como sonda, cuya disminución indica la cantidad del radical peroxilo inhibido. Los resultados se expresaron como µmol Trolox/100g de liofilizado respecto a una curva de calibración de Trolox.
Capacidad atrapadora de especies reactivas del oxígeno (ROS) y especies reactivas del nitrógeno (RNS) totales
Se mezclaron 0,3 M A2,2 -Azo-bis(2-amidinopropano) dihydrochlorido (AAPH), 2,4 mM 2,7-diclorofluoresceína diacetato y tampón fosfato salino (PBS) con o sin extracto por 10 min. Los resultados se expresaron como mmol de Trolox/100 g de liofilizado o L de solución del extracto (18).
Evaluación de la capacidad atrapadora de radicales hidroxilos
Se mezclaron tereftalato de sodio 1x10-4 M, tampón fosfato salino (PBS), el extracto de uchuva, ácido etilendiaminotetraacético (EDTA) 1x10-2 M y Fe+2 1 x 10-2 M. La mezcla se incubó por 6 min con aireación constante y a temperatura ambiente. Se midió la fluorescencia a excitación 326 nm y emisión 432 nm por 10 nm. Los resultados se expresaron como µmol DMSO / 100g liofilizado (18).
Análisis estadísticos
Los resultados se analizaron con GraphPad Prism versión 5.00 para Windows, (GraphPad Software, San Diego California, USA). Los datos se expresaron como promedio ± error estándar de la media (ESM). Las diferencias estadísticas se evaluaron con la prueba t-Student o ANOVA de una vía y post-test de comparaciones múltiples Tukey (p < 0,05).
RESULTADOS
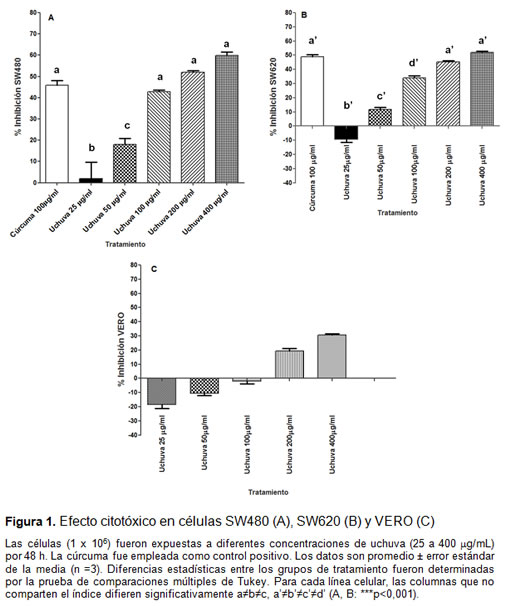
Efecto citotóxico selectivo y en el crecimiento celular
La citotoxicidad incrementó en forma dependiente de la dosis entre 25–400 µg/mL para SW480 (figura 1A) y a partir de 50 µg/mL para SW620 (figura 1B). Esto se ve reflejado a su vez en el aumento del porcentaje de inhibición de la viabilidad celular dependiente de la concentración del extracto, lo que indica un efecto citotóxico de la uchuva sobre estas células cancerígenas. Las concentraciones con mayor efecto citotóxico fueron 100, 200 y 400 µg/ml, las cuales alcanzan porcentajes de inhibición mayores de 30%, en SW620 y más de 40% en SW480 (figura 1A). En SW480 las concentraciones de 200 y 400 µg/ml inhibieron más del 50% de la viabilidad celular, superando la cúrcuma (control positivo), cuyo porcentaje de inhibición fue del 45%. En SW620 solo 400 µg/ml alcanza el 50% de la inhibición, lo que es igual al porcentaje de inhibición de la cúrcuma (figura 1B). El valor IC50 para el extracto de uchuva en células SW480 fue 44,2 µg/mL y para SW620 fue 85,1 µg/mL.
Para calcular el índice de selectividad se realizó el mismo tratamiento a células VERO con el extracto acuoso de uchuva, primero se calculó el % de inhibición de viabilidad, luego su IC50 y posteriormente se aplicó la ecuación descrita en la sección de materiales y métodos. Mientras que la viabilidad de las células VERO bajo las mismas condiciones fue 19,3% y 30,6% a 200 µg/mL y 400 µg/mL, respectivamente, cuyo IC50 fue 514,2 µg/mL (figura 1C). Al calcular el índice de selectividad (tabla 1) se encontró que el extracto acuoso fue más citotóxico para las células SW480 y SW620 que para las células no-malignas VERO, siendo más sensibles las células SW480.
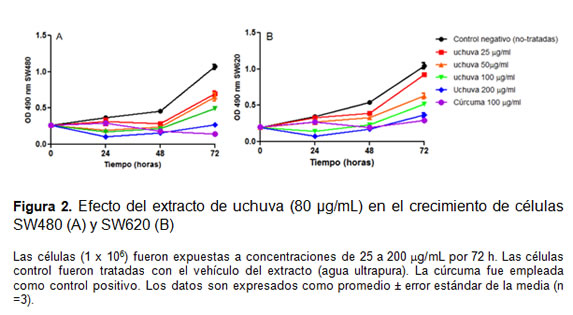
El crecimiento celular de SW480 y SW620 disminuyó en forma dependiente de la concentración y del tiempo de exposición al extracto de uchuva. El control positivo (cúrcuma 100 µg/mL) tuvo un efecto en la reducción del crecimiento de SW480 del 83% y del 72,3% con respecto a las células no-tratadas. La disminución del crecimiento de células SW480 fue 35% (25 µg/mL), 38,7% (50 µg/mL), 53,5% (100 µg/mL), y 74,8% (200 µg/mL) con respecto a las células no-tratadas (figura 2 A).
Un efecto similar se observó en las células SW620 (11,7% a 25 µg/mL, 40% a 50 µg/mL, 50,3% a 100 µg/mL y 64,9% a 200 µg/mL) a las mismas concentraciones (figura 2B).
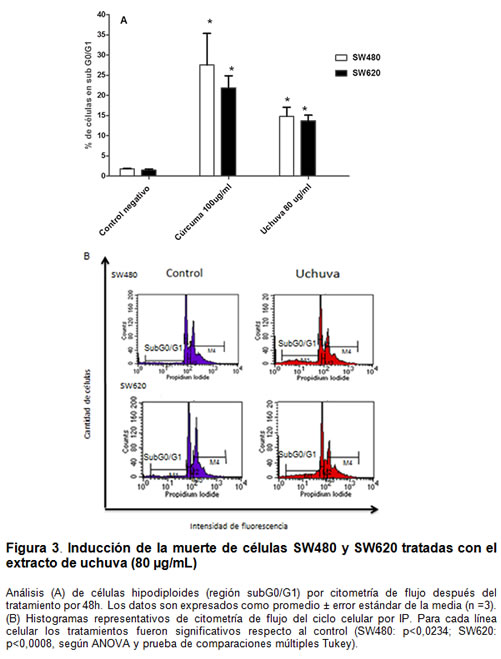
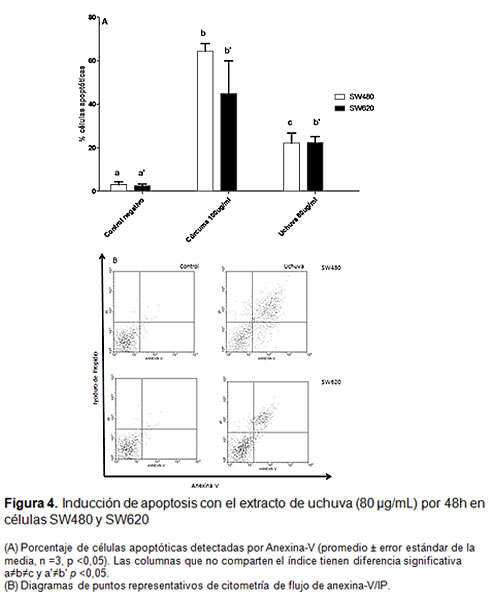
Efecto en la muerte celular
La figura 3 muestra que el porcentaje de células SW480 y SW620 en la región SubG0/G1 incrementó 14,8% y 13,7%, respectivamente, después de 48 h de tratamiento con el extracto de uchuva (80 µg/mL) en comparación con las células no-tratadas. Bajo estas mismas condiciones se indujo un aumento significativo de células apoptóticas en SW480 (19%) y SW620 (21%) con respecto a las células no-tratadas (figura 4).
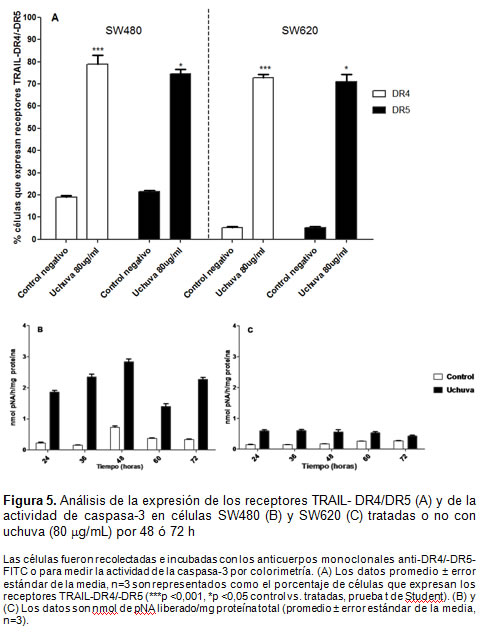
Expresión de receptores TRAIL-DR4/DR5 y actividad de la caspasa-3
En la figura 5A se muestra que en células SW480 tratadas con el extracto por 48 h, los receptores TRAIL-DR4 y –DR5 incrementaron hasta 79% y 73%, y en SW620 aumentaron hasta 70% y 67%, respectivamente, en comparación con las células no-tratadas (control). Adicionalmente, el extracto de uchuva incrementó la actividad de caspasa-3 en las células SW480 (figura 5B) y la prueba SW620 (figura 5C) durante 72 h, evento que ocurrió en paralelo con el aumento de células hipodiploides y apoptóticas en ambas líneas celulares con respecto a sus respectivos controles.
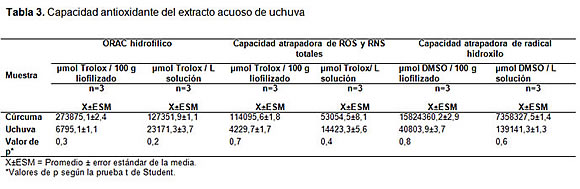
Análisis fitoquímico y actividad antioxidante
Se encontró un contenido mayor de flavonoides totales y menor de carotenoides en el extracto de uchuva liofilizado (tabla 2). Aunque la capacidad antioxidante del liofilizado de uchuva fue menor frente a la cúrcuma, en solución la actividad antioxidante de la fruta aumentó (tabla 3). Sin embargo, no se encontraron diferencias significativas para los valores de ORAC y la capacidad atrapadora de ROS y RNS entre el extracto acuoso de cúrcuma (control positivo) y el respectivo de uchuva.
DISCUSIÓN
En el presente estudio se observó por primera vez que el fruto de Physalis peruviana (uchuva) tuvo efecto citotóxico, selectivo y redujo el crecimiento de células de adenocarcinoma y metastásicas de colon, con alteración del ciclo celular, evidenciado con el aumento en el porcentaje de células hipodiploides y la inducción de apoptosis con activación de la caspasa-3 e incremento en la expresión de los receptores de muerte celular TRAIL-DR4/-DR5, estos últimos implicados en la transducción de señales apoptóticas (19, 20). La apoptosis es uno de los procesos de muerte celular más ampliamente reconocidos como mecanismo de quimioprevención para el cáncer colorrectal, porque permite desde un punto de vista preventivo eliminar las células anormales sin afectar las células vivas no-malignas (21).
La caspasa-3 es una proteína efectora que se activa tanto en la vía mediada por receptores (extrínseca) como en la vía intrínseca (mitocondrial). Su activación va seguida de contracción celular, condensación de la cromatina, fragmentación del ADN cromosómico y degradación de proteínas, que finalmente ocasionan la muerte celular (22). La diferencia de actividad de caspasa-3 observada entre SW620 y SW480, y la semejanza en el porcentaje de células apoptóticas y de la expresión de TRAIL-DR4/-DR5 en ambas líneas celulares, podría ser debido a que las vías de activación de la apoptosis son diferentes en cada línea celular, lo que requiere estudios adicionales para su descripción detallada.
Las células SW620 se caracterizan por no expresar TRAIL-DR4/-DR5, confiriéndole carácter resistente a su respectivo ligando TRAIL, que es producido por macrófagos o células asesinas naturales (23). Sin embargo, se ha demostrado que esta resistencia puede ser superada por la aplicación combinada de compuestos naturales con TRAIL (11, 24-25), capaces de aumentar la expresión de estos receptores o su sensibilidad al ligando, como estrategia promisoria para la terapia del cáncer.
Por otra parte, la actividad antioxidante de frutas y verduras es un atributo que puede favorecer con la disminución en la incidencia del cáncer, propiedad atribuida a las vitaminas C, E, A, el selenio y compuestos flavonoides y fenólicos por su capacidad antioxidante o de remoción de las especies reactivas del oxígeno (ROS), con efecto directo en la disminución del daño celular (21, 26). En este trabajo, el extracto acuoso de uchuva no mostró una actividad antioxidante relevante en comparación con otras frutas con actividad antioxidante mayor, como la Passiflora mollisima (18), Passiflora edulis, Anacardium occidentale (27) Vaccinium meridionale Swartz (28).
En el presente estudio se cuantificó el contenido de flavonoides y carotenoides totales, metabolitos secundarios determinantes en la actividad antioxidante de las frutas; se encontró en 100 g del extracto un contenido de 487,1 mg de flavonoides y 0,9 mg de carotenoides. Los flavonoides además de su actividad antioxidante, pueden afectar la carcinogénesis induciendo la fragmentación del DNA, deteniendo el ciclo celular, activando caspasas efectoras de muerte celular e induciendo apoptosis (29). Respecto a los carotenoides, pigmentos liposolubles que se presentan como a, b-, g, d y e-carotenos; son considerados agentes antioxidantes porque protegen los lípidos de la peroxidación por radicales libres (30). En uchuva se han encontrado 22 tipos de carotenoides principalmente todo-trans-β-Caroteno que corresponden al 76,8% de esta clase de moléculas (31). Sin embargo, el bajo contenido de estas sustancias en el extracto analizado puede ser debido a la baja solubilidad de los carotenos en el agua, lo que llevó a una pérdida considerable del contenido de los mismos y por ende la baja actividad antioxidante de la uchuva.
Otras sustancias como witanólidos y physalinas, las cuales se han detectado en este fruto y poseen capacidad antioxidante, citotóxica, antiinflamatoria, antimicrobial y antitumoral (31-33), pueden participar sinérgicamente en el efecto anticancerígeno aquí observado. Sin embargo, es necesario realizar estudios de fraccionamiento biodirigido para conocer el efecto individual de estos y encontrar los compuestos bioactivos responsables del efecto aquí descrito en las células de adenocarcinoma de colon y sus derivadas metastásicas.
En conclusión, el extracto acuoso de uchuva presentó actividad citotóxica, selectiva, antiproliferativa contra SW480 y SW620, mediante inducción de apoptosis. Estos resultados sugieren que la uchuva puede ser una fuente prometedora de compuestos bioactivos con aplicación quimiopreventiva en el cáncer de colon humano.
Agradecimientos
Universidad de Antioquia. Estrategia de Sostenibilidad 2010-2012. Dirección de Investigaciones, Universidad Nacional de Colombia, sede Medellín, Colombia.
REFERENCIAS
1. Puente LA, Pinto-Muñoz CA, Castro ES, Cortés M. Physalis peruviana Linnaeus, the multiple properties of a highly functional fruit: A review. Food Res Int. 2011;44:1733-40. [ Links ]
2. Asociación Hortofrutícola de Colombia. Plan frutícola nacional de Colombia 2006. [citado junio de 2012]. Disponible en: http://www.asohofrucol.com.co/archivos/biblioteca/biblioteca_8_PFN%20REGION%20CAFETERA.pdf [ Links ]
3. Castro AM, Rodríguez L, Vargas EM. Secado de uchuva (Physalis peruviana L) por aire caliente con pretratamiento de osmodeshidratación. Vitae 2008;15:226-31. [ Links ]
4. Wu SJ, Ng LT, Huang YM, Lin DL, Wang SS, Huang SN, et al. Antioxidant activities of Physalis peruviana. Biol Pharm Bull. 2005;28:963-6. [ Links ]
5. Chiang HC, Jaw SM, Chen PM. Inhibitory effects of physalin B and physalin Fon various human leukemia cells in vitro. Anticancer Res. 1992;12:1155-62. [ Links ]
6. Chiang HC, Jaw SM, Chen CF, Kan WS. Antitumor agent, physalin F from Physalis angulata L. Anticancer Res. 1992;12: 837-43. [ Links ]
7. Ismail N, Alam M. A novel cytotoxic fl avonoid glycoside from Physalis angulata. Fitoterapia. 2001;72:676-9. [ Links ]
8. Quispe-Mauricio A, Callacondo D, Rojas J, Zavala D, Posso M, Vaisberg A. Actividad citotóxica de Physalis peruviana (Aguaymanto) en cultivos celulares de adenocarcinoma colorrectal, próstata y leucemia mieloide crónica. Rev Gastroenterol Perú. 2009;29:239-46. [ Links ]
9. Hewitt RE, McMarlin A, Kleiner D, Wersto R, Martin P, Tsokos M, et al. Validation of a model of colon cancer progression. J Pathol. 2000;192:446-54. [ Links ]
10. Russo GL. Ins and outs of dietary phytochemicals in cancer chemoprevention. Biochem Pharmacol. 2007;74:533-44. [ Links ]
11. Maldonado ME, Bousseruel S, Gossé F, Minker C, Lobstein A, Raul F. Differential induction of apoptosis by apple procyanidins in TRAIL-Sensitive Human Colon Tumor Cells and Derived TRAIL-Resistant Metastatic Cells. J Cancer Molecules. 2009;5:21-30. [ Links ]
12. Moo-Puc R, Robledo D, Freile-Pelegrín Y. In vitro cytotoxic and antiproliferative activities of marine macroalgae from Yucatán, Mexico. Cienc Mar. 2009;35:345-58. [ Links ]
13. Vichai V, Kirtikara K. Sulforhodamine B colorimetric assay for cytotoxicity screening. Nat Protoc. 2006;1:1112-6. [ Links ]
14. Nicoletti I, Migliorati G, Pagliacci MC, Grignani F, Riccardi C. A rapid and simple method for measuring thymocyte apoptosis by propidium iodide staining and flow cytometry. J Immunol Methods. 1991;139:271-9. [ Links ]
15. Chung YC, Lin CC, Chou CC, Hsu CP. The effect of Longan seed polyphenols on colorectal carcinoma cells. Eur J Clin Invest. 2010;40:713-21. [ Links ]
16. Debnath T, Park PJ, DebNath NC, Samad NB, Park HW, Lim BO. Antioxidant activity of Gardenia jasminoides Ellis fruit extracts. Food Chem.2001;128:697-703. [ Links ]
17. Biswas AK, Sahoo J, Chatli MK. A simple UV-Vis spectrophotometric method for determination of Β-carotene content in raw carrot, sweet potato and supplemented chicken meat nuggets. Food Sci Technol. 2011;44:1809-13. [ Links ]
18. Rojano BA, Zapata-Acosta K, Cortés-Correa FB. Capacidad atrapadora de radicales libres de Passiflora mollissima (Kunth) L. H. Bailey (curuba). Rev Cubana Plantas Medicinales. 2012;17:408-19. [ Links ]
19. Henson E, Johnston J, Gibsn S. The role of TRAIL death receptors in the treatment of hematological malignancies. Leuk Lymphoma. 2008;49:27-35. [ Links ]
20. Shankar S, Chen Q, Sarva K, Siddiqui I, Srivastava RK. Curcumin enhances the apoptosis-inducing potential of TRAIL in prostate cancer cells: molecular mechanisms of apoptosis, migration and angiogenesis. J Mol Signal. 2007;2:10. [ Links ]
21. De Kok TM, Van Breda SG, Manson MM. Mechanisms of combined action of different chemopreventive dietary compounds: a review. Eur J Nutr. 2008;47:51-9. [ Links ]
22. Rajessh R, Sihna R. Apoptosis: molecular mechanisms and pathogenicity. EXCLI J. 2009;8:155-81. [ Links ]
23. Herbeuval JP, Lambert C, Sabido O, Cottier M, Fournel P, Dy M, et al. Macrophages from cancer patients: analysis of TRAIL, TRAIL receptors, and colon tumor cell apoptosis. J Nat Cancer Inst. 2003;95:611-21. [ Links ]
24. Lamy V, Roussi S, Chaabi M, Gossé F, Lobstein A, Raul F. Lupulone, a hop bitter acid, activates different death pathways involving apoptotic TRAIL-receptors, in human colon tumor cells and in their derived metastatic cells. Apoptosis. 2008;13:1232-42. [ Links ]
25. Kauntz H, Bousserouel S, Gossé F, Raul F.The flavonolignan silibinin potentiates TRAIL-induced apoptosis in human colon adenocarcinoma and in derived TRAIL-resistant metastatic cells. Apoptosis. 2012;17:797-809. [ Links ]
26. WHO, International Agency for Research on Cancer. World cancer report. Lyon: IARC; 2008. [ Links ]
27. Contreras-Calderón J, Calderón-Jaimes L, Guerra-Hernández E, García-Villanova B. Antioxidant capacity, phenolic content and vitamin C in pulp, peel and seed from 24 exotic fruits from Colombia. Food Res Int. 2011;44:2047-53. [ Links ]
28. Garzón GA, Narväez CE, Riedl KM, Schwartz SJ. Chemical composition, anthocyanins, non-anthocyanin phenolics and antioxidant activity of wild bilberry (Vaccinium meridionale Swartz) from Colombia. Food Chem. 2010;122:980-6. [ Links ]
29. Ramos S. Effects of dietary flavonoids on apoptotic pathways related to cancer chemoprevention. J Nutr Biochem. 2007;18:427-42. [ Links ]
30. Foote CS, Denny RW. Chemistry of singlet oxygen. VII. Quenching by b-carotene. J Am Chem Soc. 1968;90:6233-5. [ Links ]
31. Ramadan MF. Physalia peruviana: A rich source of bioactive phytochemicals for functional foods and pharmaceuticals. Food Rev Int. 2011;27:259-73. [ Links ]
32. Lan YH, Chang FR, Pan MJ, Wu CC, Wu SJ, Chen SL et al. New cytotoxic withanolides from Physalis peruviana. Food Chem. 2009;116:462-69. [ Links ]
33. Yen CY, Chiu CC, Chang FR, Chen JYF, Hwang CC, Hseu YC, et al. 4-Hidroxiwithanolide E from Physalia peruviana (golden berry) inhibits growth of human lung cancer cells through DNA damage, apoptosis and G2/M arrest. BMC Cancer. 2010;10:46. [ Links ]