Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Perspectivas en Nutrición Humana
Print version ISSN 0124-4108
Perspect Nut Hum vol.15 no.1 Medellín Jan./June 2013
ARTÍCULO DE REVISIÓN
El benzo(a)pireno en los alimentos y su relación con el cáncer
Benzo[a]pyrene from food and cancer
Yuly Nataly Franco Tobón1; Claudia María Ramírez Botero1
1 Grupo de Investigación Impacto de los Componentes Alimentarios en la Salud (ICAS). Escuela de Nutrición y Dietética, Universidad de Antioquia. Medellín-Colombia.
Como citar este artículo: Franco Tobón YN, Ramírez Botero CM. El benzo(a)pireno en los alimentos y su relación con el cáncer. Perspect Nutr Humana. 2013;15:
Artículos recibido: 5 de abril de 2013; Aprobado: 28 de mayo de 2013
RESUMEN
Antecedentes: el benzo(a)pireno es un hidrocarburo aromático policíclico con efectos adversos para la salud, una de las fuentes es la ingestión de alimentos, formados durante procesamiento industrial o en el hogar. Objetivo: indagar sobre la formación de benzo(a)pireno en los alimentos, su activación biológica, relación con el cáncer, contenido en los alimentos y la normativa que regula la cantidad en alimentos para humanos. Materiales y métodos: se realizó una búsqueda bibliográfica de artículos publicados en las bases de datos nacionales e internacionales. Resultados: el benzo(a)pireno ingerido con los alimentos se absorbe por el intestino, se metaboliza predominantemente en el hígado, allí se activa y puede inducir cáncer de diversa localización, como esófago, estómago, intestino, piel, vejiga, pulmón e hígado, evidenciado en estudios experimentales en animales. El benzo(a)pireno atraviesa la placenta y es potencialmente tóxico para el feto. Las cantidades en algunos alimentos exceden las máximas permitidas por la Comisión Europea entidad que periódicamente actualiza las normas sobre el tema. En Colombia no se encontró reglamentación. Conclusión: el benzo(a)pireno procedente de alimentos genera compuestos capaces de desarrollar cáncer principalmente del tracto gastrointestinal. La Comisión Europea actualiza periódicamente la normativa que regula el contenido de benzo(a)pireno en alimentos, Colombia carece de normas sobre el tema.
Palabras clave: benzo[a]pireno, cáncer, alimentos, xenobióticos, carcinogénicos, genotóxicos, mutagénicos, hidrocarburo aromático policíclico.
ABSTRACT
Background: Benzo[a]pyrene is a polycyclic aromatic hydrocarbon which has been related with adverse health outcomes. Food is a source of benzo[a]pyrene; which is produced during industrial processing or cooking. Objective: To review information about benzo(a)pyrene formation in food, biological activation, association with cancer, food content and regulation of benzo(a)pyrene content in human food. Methods: A literature search from national and international scientific databases was developed. Results: benzo[a]pyrene ingested is absorbed by the intestine metabolized and activated, predominantly, by the liver. Animal studies have associated benzo[a]pyrene with esophagus, stomach, intestine, skin, bladder, lung, and liver cancer. Benzo[a]pyrene is potentially toxic to the fetus, due to it passes trough placenta. Benzo[a]pyrene amounts in some foods exceed the maximum level allowed by the European Commission; which periodically updates legislation on this topic. In Colombia there is not regulation about benzo[a]pyrene. Conclusion: benzo[a]pyrene in food generates compounds that may be associated with cancer, mainly gastrointestinal cancer. The European Commission regularly updates regulation about benzo[a] pyrene content in foods. Colombia does not have regulation on this topic.
Key words: benzo[a]pyrene, food, anticarcinogenic agents, xenobiotics, carcinogenic, genotoxic, mutagenic, polycyclic hydrocarbons, aromatic.
INTRODUCCIÓN
Desde hace muchos años se conoce la relación entre la alimentación y la salud. Hipócrates describía la alimentación como una medicina y actualmente se advierte que existen factores alimentarios asociados fuertemente con el desarrollo de múltiples enfermedades, entre ellas el cáncer (1). La estrecha relación entre alimentación y salud obliga a ampliar la investigación de muchas sustancias presentes en los alimentos, consideradas peligrosas por tener consecuencias nocivas. Dentro de estas se encuentran los hidrocarburos aromáticos policíclicos (HAP), compuestos formados por combustión incompleta de la materia orgánica, son químicamente inertes y requieren activación metabólica para ejercer sus efectos biológicos (2).
Desde el año 1775 los médicos británicos Pott y Hill, observaron alta incidencia de cáncer de escroto en el personal encargado de la limpieza de las chimeneas (deshollinadores) (3). Cerca de cien años después se reportaron hallazgos similares en Alemania y Escocia, entre operarios de la industria del alquitrán de hulla y la parafina, estas observaciones llevaron a pensar que los derivados del petróleo y del carbón contenían sustancias capaces de inducir tumores, resultados que fueron confirmados en 1918, cuando los investigadores japoneses Yamagiwa y Ichikawa demostraron que el alquitrán aplicado en la piel de conejos inducía cáncer (4). Hallazgos similares en ratas fueron documentados en 1920, en Inglaterra por Kennaway reportados por Hugues. Sin embargo, puesto que el alquitrán y el hollín son mezclas de diversas sustancias y el aislamiento de los posibles compuestos químicos responsables de tales resultados era complejo, solo hasta 1920 se señalaron a los HAP aislados del alquitrán como los posibles responsables de producir tumores en la piel en ratones (5).
En 1931 fue aislado del carbón uno de los HAP, el benzo(a)pireno [b(a)p], en el mismo año fue sintetizado y se demostró que era responsable de la producción de tumores cancerosos en animales de experimentación. También fue hallado en el alquitrán de hulla, la brea y el hollín (6), uno de los primeros agentes carcinógenos identificados con claridad. En estudios epidemiológicos en trabajadores expuestos a hornos de coque, durante el proceso industrial de coquificación del carbón, en obras de asfalto, fundiciones e instalaciones de aluminio se detectó que tenían un índice de cáncer de pulmón más elevado que quienes no realizaban esas actividades laborales, lo que se atribuyó a la exposición a los HAP (7). Posteriormente, las investigaciones revelaron que los HAP también se encontraban en los alimentos consumidos por los humanos (8-9).
El Comité Mixto de Expertos en Aditivos Alimentarios de la FAO/OMS (10) y el Grupo de Expertos de Contaminantes de la Autoridad Europea de Seguridad Alimentaria (11) concluyeron que existen 16 tipos de HAP con clara actividad genotóxica, carcinogénica y mutagénica en animales de experimentación, estos son: benzo(a)antraceno, benzo(b)fluoranteno, benzo(j)fluoranteno, benzo(k)fluoranteno, benzo(g,h,i)perileno, b(a)p, criseno, ciclopenta(c,d)pireno, dibenzo(a,h)antraceno, dibenzo(a,e)pireno, dibenzo(a,h)pireno, dibenzo(a,i)pireno, dibenzo(a,l)pireno, indeno(1,2,3-cd)pireno, 5-metilcriseno. Este grupo de expertos, antes mencionado, recomendó utilizar como marcador de toxicidad para HAP la suma de cuatro de estos: (b(a)p + criseno + benzo(a)antraceno + benzo(b)fluoranteno).
En esta revisión se estudiará específicamente el b(a)p, debido a que es el HAP más estudiado y una de las primeras sustancias que demostró tener efecto carcinogénico. Además, está demostrada su formación en los alimentos y los efectos nocivos que genera en el organismo cuando se metaboliza. El objetivo de esta revisión es informar sobre el b(a)p, su transformación en organismo, sus efectos cancerígenos, genotóxicos y/o mutagénicos probados en animales, las cantidades presentes en los alimentos y la normativa que los regulan.
MATERIALES Y MÉTODOS
Se realizó una búsqueda bibliográfica de artículos relacionados con el b(a)p, su metabolismo y su relación con el desarrollo de algunos tipos de cáncer. Esta búsqueda se realizó en las bases de datos internacionales (Science Direct, PubMed, LILACS, Scielo, Medline, Ebsco y Jstore), en publicaciones nacionales y en las principales páginas web de organismos internacionales, como el Codex Alimentario y la Comisión Europea (CE). Para la búsqueda se utilizó un vocabulario controlado con las siguientes palabras: benzopyrene, foods, metabolism, carcinogenic, genotoxic, mutagenic, cytochrome P450, regulations.
RESULTADOS Y DISCUSIÓN
Descripción y fuentes del benzo(a)pireno en los alimentos
El b(a)p es un compuesto formado por cinco anillos de benceno fundidos, presenta un punto de fusión de 179°C y de ebullición de 495°C, es altamente volátil y soluble con los compuestos orgánicos lipofílicos. Se forma por la combustión incompleta de la materia orgánica (incendios forestales, carbón, petróleo), emisión de gases vehiculares, humo del cigarrillo y como derivado de varios procesos en la industria alimentaria y también en diferentes prácticas de cocción en el hogar (5,12). Entre los procesos sufridos por los alimentos, en los cuales se ha evidenciado la formación de b(a)p se encuentran: el ahumado, el secado, el tostado, el horneado, la fritura, la extracción de aceites (secado directo y a altas temperaturas de las oleaginosas antes de extraer el aceite) y la termo degradación de lípidos, como en el caso de los aceites comestibles que se someten a temperaturas elevadas (13). De igual manera, se asocian con la formación de HAP, el método y tiempo de cocción de los alimentos, la fuente de energía utilizada, la proximidad de la misma con el alimento, las altas temperaturas y el tipo de combustible usado (maderas muy resinosas, con alto contenido de lignina, diesel o hule) (12). Debido a la formación del b(a)p en los alimentos, la ingestión de estos se convierte en una de las principales rutas de exposición (14).
Absorción y distribución del benzo(a)pireno
El b(a)p es liposoluble, lo que no solamente facilita su adherencia a la grasa de los alimentos, sino que también favorece su difusión y transporte a través de las membranas celulares de animales y más específicamente de los mamíferos. Cuando se ingiere con los alimentos se absorbe en el intestino, pero también puede ingresar al organismo por fuentes no alimenticias, por ejemplo, por medio de los pulmones al ser inhalado, debido a que el compuesto en mención es altamente volátil o por vía cutánea. Por ser insolubles en agua los lípidos requieren la formación de micelas con sales biliares para su digestión intestinal y posterior absorción de los productos de la misma (15). Debido a que la mayoría de los compuestos hidrofóbicos que ingresan al tracto gastrointestinal no pueden disolverse en el medio acuoso, por lo que algunos factores involucrados en los procesos de digestión y absorción de los lípidos de la dieta, tales como la presencia de sales biliares, también afectan la absorción de los HAP (16).
El b(a)p ingresa desde la luz intestinal hasta el enterocito mediante transporte activo, su captación se incrementa con la inducción del citocromo P 450 (isoformas: 1A1, 1B1), estas isoformas han sido localizadas en la membrana apical del enterocito y aumentan la velocidad de absorción del compuesto de interés favoreciendo su paso hasta la membrana basolateral (14). Se ha demostrado, utilizando células Caco 2, que el b(a)p es metabolizado en el intestino generando productos altamente tóxicos (17).
Cavret y colaboradores (18) reportaron que el b(a)p se hidroxila en el enterocito más rápido que otros compuestos (fenantreno 45%, pireno 65% y benzopireno 96%), en un tiempo de seis horas, explicado por su carácter lipofílico que muestra gran afinidad por el epitelio intestinal. Esta capacidad de la mucosa intestinal para metabolizar xenobióticos, entre ellos el b(a)p, puede fomentar la producción de metabolitos carcinogénicos en el sitio e incrementar el riesgo de cáncer intestinal (19). Después de ser absorbido por el intestino, el b(a)p pasa al torrente sanguíneo y su captación tiene relación directa con el transporte unidireccional de los lípidos de la dieta (14,18).
Aunque parte del b(a)p procedente de los alimentos se modifica en el intestino, su metabolismo es básicamente hepático y su principal ruta de eliminación es la bilis, a pesar de que también se elimina como metabolitos conjugados con el glutatión, el ácido glucurónico o sulfatos por vía fecal y urinaria (16). El b(a)p y sus metabolitos se distribuye desde el hígado hacía todos los tejidos, especialmente aquellos que tienen mayor contenido de grasas, se destacan los riñones, los pulmones, el cerebro y las mamas (20). Debido a la formación del b(a)p en los alimentos, la ingestión de estos se convierte en una de las principales rutas de exposición (14).
Activación orgánica del benzo(a)pireno y efecto carcinogénico
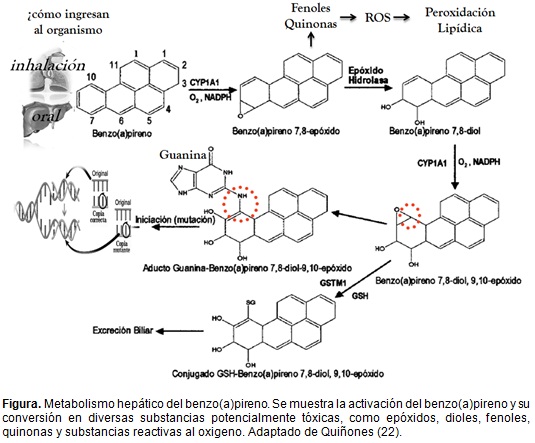
Se conocen varios caminos para la activación del b(a)p, sin embargo el más aceptado involucra al citocromo P450 con sus isoformas CYP1A1 y CYP1B1, que actúan en la región angular de la molécula sobre una zona de alta densidad electrónica, para formar compuestos conocidos como epóxidos (un epóxido es un radical formado por un átomo de oxigeno unido a dos de carbono, a su vez unidos entre sí por un átomo de carbono mediante enlace covalente) (16).
Los epóxidos pueden formar espontáneamente fenoles, y por acción de una prostaglandina H sintasa producir quinonas, que al ser atacadas por una quinona reductasa generan derivados de quinonas o pueden conjugarse con el glutatión, sulfato o el ácido glucurónico. Los epóxidos formados también pueden ser atacados por la enzima epóxido hidrolasa, para producir dihidrodioles, los cuales a su vez se pueden oxidar por las isoformas 1A1/1B1 del citocromo P450, generando fenoles dihidrodioles y dihidrodiol epóxidos, estos últimos se pueden hidrolizar a tetroles, conjugarse con glutatión o causar una modificación covalente de macromoléculas celulares, dando lugar a respuestas mutagénicas y cancerígenas (16, 21-22) (Figura).
La estereoquímica de los dihidrodiol epóxidos derivados del b(a)p desempeña un papel importante en la toxicidad asociada con este último. El (+) anti-benzo(a)pireno-7,8-dihidrodiol-9,10-epóxido es el estereoisómero que ha mostrado tener la mayor reactividad, la más alta actividad de iniciación de tumores y ser el metabolito predominante en la formación de aductos con el ADN en los tejidos de los mamíferos (2,16,23).
El (+) anti-benzo(a)pireno-7,8-dihidrodiol-9,10-epóxido puede sufrir una escisión carbono-oxígeno, provocando la apertura del anillo para formar un ión carbonilo en el carbono 10, es decir un átomo de carbono con carga positiva. Los iones carbonilo son especies muy reactivas que reaccionan con nucleófilos, tales como el ADN y las proteínas, para formar aductos covalentes (24-25).
Wei y colaboradores (24), confirmaron la formación de aductos del DNA con diversos metabolitos del b(a)p. El 8-hidroxilo del (+) anti-benzo(a)pireno-7,8-dihidrodiol-9,10-epóxido, se puede unir al nitrógeno de la posición tres de la guanina y al átomo de oxígeno de la desoxirribosa. Los enlaces de hidrógeno del 7-hidroxilo, del compuesto (+) anti-benzo(a)pireno-7,8-dihidrodiol-9,10-epóxido, se pueden unir a los átomos de hidrógeno en los nitrógeno en las posiciones uno y dos de la guanina y al átomo de oxígeno de la citosina formando aductos. Cuando los aductos no se corrigen debidamente por el sistema de reparación del ADN, lo pueden dañar e incluso inducir mutaciones (26-27), estas se han encontrado en el gen p53 (gen guardián), considerado indispensable para inducir la respuesta de las células ante el daño del ADN, deteniendo el ciclo celular en caso de mutaciones. Por su función en la apoptosis y el control del ciclo celular ante daños del ADN, se le conoce como gen supresor de tumores. Cuando este se altera puede permitir la proliferación de células anormales, dando como resultado cáncer. En tumores producidos por metabolitos del b(a)p se han encontrado mutaciones del gen p53 en los axones 157, 248 y 273 (28-29).
Algunos metabolitos del b(a)p se ligan covalentemente con el ADN y el ARN induciendo a la neoplasia y a la interacción macromolecular (16,30); siendo este el primer paso de la tumorogénesis y mutagénesis. Dichos metabolitos también pueden reaccionar con proteínas, como fue demostrado en peces por Helleberg y Prados (31-32), quienes encontraron que el isómero diol-epóxido se puede unir con proteínas hepáticas citosólicas y microsomales como la albúmina y la globulina. El 3-hidroxi-benzo(a)pireno se puede unir a la hemoglobina y a la albúmina en células de bovinos (33). De igual manera, reacciones de oxidorreducción generadas por quinonas, derivadas del metabolismo del b(a)p, podrían llevar a la formación de especies reactivas de oxígeno, las que pueden contribuir a transformaciones oncogénicas (16,34), estas especies reactivas de oxígeno pueden inducir la peroxidación lipídica que cataliza la oxidación de dioles a diol-epóxidos y estos a su vez tienen la posibilidad de unirse al ADN y a las proteínas (35-36).
Estudios experimentales en animales sobre benzoapireno
El b(a)p ha sido catalogado como un tóxico reproductivo que afecta la fertilidad en ratas y otras especies de animales, debido a que los metabolitos resultantes interfieren con la función normal del ovario (37-39). Tsai-Turton y colaboradores (40), en el año 2007, evaluaron la acumulación de metabolitos del b(a)p en microsomas de hígado y testículo de ratas, hámster y cerdos, encontrando que varios de estos interfirieren con la formación y función de los gametos, contribuyendo así a la infertilidad.
En tejidos celulares de hígado y ovario de varias especies (ratas, ratones, cabras, ovejas, cerdos y vacas) se pudo observar que al exponerse a 5 µg/g de b(a)p los metabolitos resultantes se adhieren al receptor de estrógenos, reduciendo la actividad de estos; la exposición prolongada al b(a)p provoca un secuestro de estos en las lipoproteínas de alta densidad que son esenciales para la biosíntesis de hormona esteroidea en el ovario, conduciendo a la reducción de la secreción de gonadotropinas, como la hormona folículo estimulante (FSH) y la hormona luteinizante (LH), con resultados negativos en las etapas finales del desarrollo folicular, disminuyendo la fertilidad (41-42).
Wester y colaboradores (43), demostraron el potencial carcinogénico del b(a)p ingerido oralmente, estos investigadores expusieron 104 ratas Wistar durante cinco días a la semana a cantidades de 0, 3, 10 o 30 mg de b(a)p por kg de peso corporal, durante dos años y posteriormente les realizaron estudios histopatológicos. Los resultados mostraron el desarrollo de tumores en el hígado en 99 de las 104 ratas, con una dosis estimada de 3-5 mg/kg, con un intervalo de confianza del 90%; de igual manera mostraron sarcomas en tejidos blandos, como piel y mamas con dosis de 10 mg/kg. Los tumores de piel al igual que los del hígado se consideran relevantes para el ser humano en dosis altas. También, los investigadores pudieron detectar en 13 ratas tumores en el intestino delgado, lo que debe considerarse en el ser humano, por la actividad local de los benzopirenos en el intestino; se concluyó que la exposición a 3 mg de b(a)p por kg de peso aumenta el riesgo de cáncer por exposición oral. Otros estudios en animales demostraron que los HAP pueden causar cáncer en el pulmón (44-48), en la piel y la vejiga (49-50), lo mismo que en el esófago y el estómago (51).
En un estudio efectuado en la India, sobre aceites de fritura de pescado reutilizados, se realizó un análisis por medio de cromatografía líquida HPLC y se evidenció la presencia de varios HAP, en total 685 μg /kg de aceite; de estos 497 μg /kg eran b(a)p; se expusieron microsomas hepáticos de ratas a esta sustancia, dando como resultado alta expresión de metabolitos hepáticos y formación de aductos, que, como se mencionó, pueden causar alteraciones en la estructura del DNA, lo que puede dar lugar a mutaciones y transformación maligna de las células (52).
Ozaki y colaboradores (26) evaluaron el efecto del b(a)p en el tejido cervical de ratas hembras, a las cuales se les administró concentraciones de 2,5; 5 y 10 mg/kg de dicho compuesto, disuelto en aceite de sésamo por vía oral y peritoneal por un periodo de 14 semanas y que fueron comparadas con un grupo de ratas hembras control que no tuvo ningún tipo de administración y un grupo denominado vehículo al que solo se administró por las vías anteriormente mencionadas, aceite de sésamo. Finalmente, se pudo demostrar que el tratamiento con b(a)p resulta en efecto tóxico sobre el cuello uterino, evidente a medida que aumenta el daño en el ADN y la expresión del gen p53. El b(a)p parece tener potencial para causar mutación del gen p53 en el cuello uterino de los ratones.
Los resultados sugieren que el b(a)p puede llevar a la ruptura de un filamento del DNA o inducir a mutaciones, siendo ambos eventos capaces de inactivar genes supresores de tumores, como el gen p53 (26), y se ha demostrado que una disminución en la función de este gen puede resultar en un amplio espectro de tumores malignos (53).
Estudios en humanos
Los estudios en humanos sobre los efectos nocivos del b(a)p asocian la exposición por vía oral a altos niveles de esta substancia, con el incremento de la toxicidad reproductiva femenina (19,54). Los HAP pueden atravesar la placenta. Perera y colaboradores (55-56) evaluaron la formación de aductos con el ADN después de una ingesta entre 0,5 y 15 ng/m3 de HAP en 867 madres y 822 recién nacidos en el norte de Manhattan, World Trade Center y sus alrededores, Polonia y China. Los resultados indican claramente la formación de aductos entre los HPA y el ADN, concluyendo que el feto en desarrollo puede ser diez veces más sensible que la madre al daño del ADN inducido por los HPA; según autores esta mayor susceptibilidad fetal a daños genéticos podría deberse a mayor absorción y retención de sustancias tóxicas por el feto, reducción de la desintoxicación y menor posibilidad de reparación del ADN, mayor tasa de proliferación celular durante las etapas de desarrollo y menor competencia inmunológica del feto.
Herbstman y colaboradores (57), midieron la exposición ambiental a HPA, en 164 mujeres gestantes no fumadoras, utilizando monitores personales de aire, y cuantificaron la eliminación urinaria de metabolitos de HAP. Los resultados revelaron que la exposición prenatal a HPA, incluyendo el b(a)p, en concentraciones entre 0,24 y 2,47 ng/m3, altera la metilación del ADN, proceso que puede influir en la formación de aductos con el ADN. Aunque se requieren más investigaciones para explicar la compleja acción molecular de la formación de aductos durante el periodo prenatal y las implicaciones para el feto de la ingesta oral de la madre de b(a)p, hay la posibilidad de que el b(a)p atraviese la barrera placentaria, y por tal motivo es posible que cuando la madre ingiera alimentos con alto contenido de HAP, los metabolitos de estos puedan llegar directamente al feto.
Cuantificación de benzo(a)pireno en alimentos
La ingestión de alimentos es una de las mayores fuentes de exposición al b(a)p (14). Kaseuroni y colaboradores (8), cuantificaron mediante cromatografía de capa fina y espectrofluorometría la cantidad de estos compuestos formada en los alimentos, los resultados revelaron que la mayor concentración de estos estaba en 112 g de filete de res asado al carbón y sometido a altas temperaturas (544 ng); seguido por 96 g de pollo con hueso y piel sometido al mismo método de cocción y temperatura (439 ng); en tanto que, una hamburguesa de res de 85 g, con el mismo método de cocción (no se define el valor de temperatura) contenía 129 ng, valor todavía más bajo fue encontrado en igual cantidad de hamburguesa asada en el horno a baja temperatura (0,8 ng). Los autores concluyeron que la cantidad de b(a)p formado depende del tipo de alimento, el tiempo de cocción, la fuente de energía utilizada y la proximidad de la misma con el alimento.
Djinovi y cololaboradores (58), en el año 2008, cuantificaron por medio de cromatografía de gases y espectrometría de masas la cantidad de b(a)p formado durante el asado de la carne, cuando se utilizaba carbón procedente de diez tipos de madera distintos, los investigadores concluyeron que efectivamente el tipo de madera empleada en el asado influye sobre la cantidad formada de este compuesto en la carne, los valores más bajos se encontraron con las maderas de manzano y aliso (6,04 µg/kg) y los más altos, cuando se utilizó la madera de pino (Picea conífera) (en el intervalo de 47,9 µg/kg y 470,91 µg/kg).
Wretring y colaboradores (59), en Suecia cuantificaron mediante la misma técnica de laboratorio empleada en los dos estudios anteriores la cantidad de b(a)p en 38 muestras de carne y 39 de pescado ahumando. Los resultados revelaron que en nueve de las muestras de carne de res ahumada las concentraciones eran muy altas (6,6-36,6 mg/kg), lo mismo que en seis de las muestras de pescado ahumado (8,4-14,4 mg/kg), valores que están por encima del permitido por la CE para este tipo de alimentos (5 mg/kg). Por el contrario, cuando los pescados y las carnes fueron sometidos a métodos de cocción con calor indirecto y sin ahumado, las concentraciones de b(a)p fueron muy inferiores a 5 mg/kg (60).
Essumang y colaboradores (9), en el año 2012, cuantificaron mediante cromatografía de gases el b(a)p contenido en 108 muestras de pescados ahumados, incluyendo sardinas y arenques, en los que encontraron concentración de 11,4 µg/kg, valor muy por encima del permitido por la CE (60). Los autores, resaltan el peligro de consumir pescado ahumado, por las altas concentraciones encontradas de HAP, entre ellos el b(a)p, debido al potencial cancerígeno de los mismos. Cuando se asa una carne, la grasa de esta cae sobre el carbón caliente produciendo su combustión incompleta, a su vez el carbón despliega una columna de humo que contiene HAP, entre ellos b(a)p, contaminando el alimento.
Cavret y colaboradores (61) cuantificaron el contenido de b(a)p en leche y productos lácteos y reportaron concentraciones entre 1,5 y 7,5 mg/kg. En múltiples estudios se han podido medir las cantidades de b(a)p en los alimentos, incluso en varios de estos las cantidades superan las concentraciones máximas permitidas por la CE (60). Es evidente que la ingesta de alimentos se convierte en una de las principales rutas de exposición al b(a)p para el ser humano.
Benzo(a)pireno en los alimentos, normativa vigente
No se encontró reglamentación vigente para Colombia sobre las concentraciones máximas de b(a)p permitidas en los alimentos. Algunos organismos internacionales han presentado propuestas al respecto; desde el año 2002, la CE con base en las investigaciones estimó que la ingesta máxima de b(a)p proveniente de los alimentos era de 420 ng por persona, equivalente a entre 6-8 ng/kg/día para una persona con un peso de 70 kg. Este valor es cerca de cinco a seis veces menor que las dosis capaces de producir tumores en animales de experimentación (62).
La CE ha reglamentado varis aspectos; la regulación N° 1881 de 2006, (ver tabla), en su sesión N° 6, específica para HAP, regula la concentración máxima de b(a)p en μg/kg peso fresco, para diferentes alimentos (60). La regulación antes mencionada fue modificada por la N° 835 de 2011 de la CE (63); la modificación se debió a que hasta la fecha se había considerado el b(a)p como el principal marcador de la toxicidad de los HPA; sin embargo en el año 2008, el Comité FAO/OMS de Expertos en Aditivos Alimentarios recomendó no solo al b(a)p como marcador sino la suma de 4 HAP: b(a)p + criseno + benzo(a)antraceno + benzo(b)fluoranteno) (10). El Codex Alimentario en el año 2009 propuso el código de prácticas para reducir la contaminación por HPA en los alimentos producidos por ahumado o secado directo (12); sin embargo, en este no se presta atención a las concentraciones finales de dichos compuestos en los alimentos.
CONCLUSIONES
Una de las principales vías de exposición al b(a)p es la ingestión de alimentos contaminados con dicho compuesto, bien sea durante el procesamiento industrial de los mismos o por los métodos de conservación y cocción a que son sometidos en el hogar. teniendo en cuenta la evidencia de genotoxicidad, mutagenicidad y carcinogénesis producidas por sus metabolitos dentro del organismo, principalmente en estudios experimentales en animales; se hace necesario ampliar el control en los procesos de cocción, fritura o asado a nivel del hogar y en los procesos de secado, asado, ahumado, tostado, fritura, extracción de aceites a nivel industrial, debido a que aunque estos procesos pueden ser beneficiosos, por favorecer la inactivación de factores anti nutricionales, mejorar la conservación, calidad y características organolépticas de los alimentos, también si no se controlan adecuadamente el tiempo de cocción, la temperatura, la proximidad del alimento con la fuente de calor, la fuente de energía utilizada, se puede favorecer la formación del b(a)p, su posterior ingestión al consumir los alimentos sometidos a estos procesos y como consecuencia el desarrollo de efectos nocivos para la salud, dentro de ellos el desarrollo de cáncer.
Muchos alimentos exceden la concentración máxima de b(a)p permitida por la CE. No se encontró una normativa específica para Colombia sobre el tema, por lo que se requiere contar con una legislación o al menos, que el país se la normativa propuesta por la CE. También, sería importante contar con investigaciones colombianas, en las que se cuantifiquen los HAP en los alimentos y su relación con los métodos de cocción de mayor uso entre la población; con el fin de ejercer, dentro de lo posible, un mayor control en la formación y la ingesta, buscando prevenir la aparición de cáncer de diferente localización.
AGRADECIMIENTOS
Las autoras agradecen al profesor de la Escuela de Nutrición y Dietética, Diego Alejandro Gaitán Charry por los aportes realizados al documento.
REFERENCIAS
1. Jakszyn P, González CA. Nitrosamine and related food intake and gastric and oesophageal cancer risk: a systematic review of the epidemiological evidence. World J Gastroenterol. 2006;12:4296-303. [ Links ]
2. Xue W, Warshawsky D. Metabolic activation of polycyclic and heterocyclic aromatic hydrocarbons and DNA damage: a review. Toxicol Appl Pharmacol. 2005;206:73-93. [ Links ]
3. Pott P. Cancer scroti. In: Pott P, ed. Chirurgical observations. London: Hawes, Clarke, Collins; 1775. p.179-80. [ Links ]
4. Agudo A. Los hidrocarburos aromáticos policíclicos (HAP). Acercamiento a su problemática como riesgo laboral. Madrid: Secretaría de Salud Laboral y Medio Ambiente MCA-UGT Federación de Industria 2010. Pág. 130. [citado abril de 2013]. Disponible en: http://www.ugt.es/saludlaboral/Hidrocarburos.pdf. [ Links ]
5. Ryser HJ. Chemical carcinogenesis. N Engl J Med. 1971;285:721-34. [ Links ]
6. Henry SA, Kennaway NM, Kennaway EL. The incidence of cancer of the bladder and prostate in certain occupations. J Hyg. 1931;31:125-37. [ Links ]
7. De la Cruz ER, Huaman JO. Formación de hidrocarburos aromáticos policíclicos y del 3,4 benzopireno en aceites comestibles alterados por recalentamiento. Tesis para optar por el título de Químico Farmacéutico. Lima: Universidad Nacional de San Marcos; 2002. [ Links ]
8. Kazerouni N, Sinha R, Hsu CH, Greenberg A, Rothman N. Analysis of 200 food items for benzo[a]pyrene and estimation of its intake in an epidemiologic study. Food Chem Toxicol. 200;39:423-36. [ Links ]
9. Essumang DK, Dodoo DK, Adjei JK. Polycyclic aromatic hydrocarbon (PAH) contamination in smoke-cured fish products. Ghana J Food Comp Anal. 2012;27. :128 -38. [ Links ]
10. FAO/WHO. Evaluation of certain food contaminants, sixty-seventh report of the Joint Expert Committee on Food Additives. Geneva; 2006. WHO Technical report series, N° 930. [ Links ]
11. Scientific opinion of the Panel on Contaminants in the Food Chain. (Question N° EFSA-Q-2007-136) adopted on 9 June 2008. Polycyclic aromatic hydrocarbons in food. EFSA J. 2008;724:2-114. [ Links ]
12. Codex Alimentario. Código de prácticas para reducir la contaminación por hidrocarburos aromáticos policíclicos (HAP) en los alimentos producidos por procedimientos de ahumado y secado directo: CAC/RCP 68-2009. Roma: FAO; 2009. [ Links ]
13. Lichtfouse E, Apitz S, Nanny M. Ancient polycyclic aromatic hydrocarbons in modern soils: 13C, 14C and biomark er evidence. Org Geochem. 1999;26:353-9. [ Links ]
14. Vasiluk L, Pinto LJ, Tsang WS, Gobas FA, Eickhoff C, Moore MM. The uptake and metabolism of benzo[a]pyrene from a sample food substrate in an in vitro model of digestion. Food Chem Toxicol. 2008;46:610-8. [ Links ]
15. Henkjan J, Verkade HJ, Tso P. Biophysics of intestinal luminal lipids. In: Mansbach CM. Intestinal lipid metabolism. New York: Kluwer Academic/Plenum; 2001. p. 1-19. [ Links ]
16. WHO, IARC. Monographs on the evaluation the carcinogenic risks to humans: some non-heterocyclic polycuclic aromatic hydrocarbons and some related exposures. Lyon; 2010. Vol. 92. [ Links ]
17. Buesen R, Mock M, Nau H, Seidel A, Jacob J, Lampen A. Human intestinal Caco-2 cells display active transport of benzo[a]pyrene metabolites. Chem Biol Interact. 2003;142:201-21. [ Links ]
18. Cavret S, Feidt C. Intestinal metabolism of PAH: in vitro demonstration and study of its impact on PAH transfer through the intestinal epithelium. Environ Res. 2005;98:22-32. [ Links ]
19. Boulenc X, Bourrie M, Fabre I, Roque C, Joyeux H, Berger Y, et al. Regulation of cytochrome P450IA1 gene expression in a human intestinal cell line, Caco-2. J Pharmacol Exp Ther. 1992;263:1471-8. [ Links ]
20. Kaarthik J. Modulation of gene expression and DNA adduct formation by chlorophyllin in human mammary cells exposed to benzopyrenes. West Virginia: Department of Plant and Soil Science Morgantown; 2006. [ Links ]
21. Slayne MA. Polycyclic aromatic hydrocarbons in vegetable oil. Int Rev Food Sci Technol. 2003;141:136-7. [ Links ]
22. Quiñones L, Lee K, Varela N, Escala M, García K, Godoy L, et al. Farmacogenética del cáncer: Estudio de variaciones genéticamente determinadas en la susceptibilidad a cáncer por exposición a xenobióticos. Rev Med Chile. 2006;134:499-515. [ Links ]
23. Ruan Q, Gelhaus SL, Penning TM, Harvey RG, Blair IA. Aldo-keto reductase- and cytochrome P450-dependent formation of benzo[a]pyrene-derived DNA adducts in human bronchoalveolar cells. Chem Res Toxicol. 2007;20:424-31. [ Links ]
24. Wei Y, Lin Y, Zhang AQ, Guo LH, Cao J. Evaluation of the noncovalent binding interactions between polycyclic aromatic hydrocarbon metabolites and human p53 cDNA. Sci Total Environ. 2010;408:6285-90. [ Links ]
25. Tarantini A, Maitre A, Lefebvre E, Marques M, Rajhi A, Douki T. Polycyclic aromatic hydrocarbons in binary mixtures modulate the efficiency of benzo[a]pyrene to form DNA adducts in human cells. Toxicology. 2011;279:36-44. [ Links ]
26. Gao M, Li Y, Sun Y, Long J, Kong Y, Yang S, et al. A common carcinogen benzo(a)pyrene causes p53 overexpression in mouse cervix via DNA damage. Mutat Res. 2011;724:69-75. [ Links ]
27. Mastrangelo G, Fadda E, Marzia V. Polycyclic aromatic hydrocarbons and cancer in man. Environ Health Perspect. 1996 Nov;104:1166-70. [ Links ]
28. Osborne MR, Crosby NT. Benzopyrenes: Cambridge monographs on cancer research. Boston: Cambridge University Press; 1987. p. 352. [ Links ]
29. Denissenko MF, Pao A, Tang M, Pfeifer GP. Preferential formation of benzo[a]pyrene adducts at lung cancer mutational hotspots in P53. Science. 1996;274:430-2. [ Links ]
30. Shemer H, Linden KG. DNA methylation analysis using CpG microarrays is impaired inbenzopyrene exposed cells. Water Res. 2007;41:853-61. [ Links ]
31. Helleberg H, Tornqvist M. A new approach for measuring protein adducts from benzo[a]pyrene diolepoxide by high performance liquid chromatography/tandem mass spectrometry. Rapid Commun Mass Spectrom. 2000;14:1644-53. [ Links ]
32. Padros J, Pelletier E. In vivo formation of (+)-anti-benzo[a]pyrene diol-epoxide-plasma albumin adducts in fish. . Mar Environ Res. 2000;50:347-51. [ Links ]
33. Sugihara N, James MO. Binding of 3-hydroxybenzo[a]pyrene to bovine hemoglobin and albumin. J Biochem Mol Toxicol. 2003;17:239-47. [ Links ]
34. Behrend L, Henderson G, Zwacka RM. Reactive oxygen species in oncogenic transformation. Biochem Soc Trans. 2003;31(Pt 6):1441-4. [ Links ]
35. Gower JD, Wills ED. The oxidation of benzo[a]pyrene-7,8-dihydrodiol mediated by lipid peroxidation in the rat intestine and the effect of dietary lipids. Chem Biol Interact. 1987;63:63-74. [ Links ]
36. Ruan Q, Kim HY, Jiang H, Penning TM, Harvey RG, Blair IA. Quantification of benzo[a]pyrene diol epoxide DNA-adducts by stable isotope dilution liquid chromatography/tandem mass spectrometry. Rapid Commun Mass Spectrom. 2006;20:1369-80. [ Links ]
37. Neal MS, Zhu J, Holloway AC, Foster WG. Follicle growth is inhibited by benzo-[a]-pyrene, at concentrations representative of human exposure, in an isolated rat follicle culture assay. Hum Reprod. 2007;22:961-7. [ Links ]
38. Ramesh A, Inyang F, Lunstra DD, Niaz MS, Kopsombut P, Jones KM, et al. Alteration of fertility endpoints in adult male F-344 rats by subchronic exposure to inhaled benzo(a)pyrene. Exp Toxicol Pathol. 2008;60:269-80. [ Links ]
39. Jurisicova A, Taniuchi A, Li H, Shang Y, Antenos M, Detmar J, et al. Maternal exposure to polycyclic aromatic hydrocarbons diminishes murine ovarian reserve via induction of Harakiri. J Clin Invest. 2007;117:3971-8. [ Links ]
40. Tsai-Turton M, Nakamura BN, Luderer U. Induction of apoptosis by 9,10-dimethyl-1,2-benzanthracene in cultured preovulatory rat follicles is preceded by a rise in reactive oxygen species and is prevented by glutathione. Biol Reprod. 2007;77:442-51. [ Links ]
41. Smith TL, Merry ST, Harris DL, Joe Ford J, Ike J, Archibong AE, et al. Species-specific testicular and hepatic microsomal metabolism of benzo(a)pyrene, an ubiquitous toxicant and endocrine disruptor. Toxicol In Vitro. 2007;21:753-8. [ Links ]
42. Harris DL, Huderson AC, Niaz MS, Ford JJ, Archibong AE, Ramesh A. Comparative metabolism of benzo(a)pyrene by ovarian microsomes of various species. Environ Toxicol. 2009;24:603-9. [ Links ]
43. Wester PW, Muller JJ, Slob W, Mohn GR, Dortant PM, Kroese ED. Carcinogenic activity of benzo[a]pyrene in a 2 year oral study in Wistar rats. Food Chem Toxicol. 2011;50:927-35. [ Links ]
44. Shimada T. Xenobiotic-metabolizing enzymes involved in activation and detoxification of carcinogenic polycyclic aromatic hydrocarbons. Drug Metab Pharmacokinet. 2006;21:257-76. [ Links ]
45. Simko P. Determination of polycyclic aromatic hydrocarbons in smoked meat products and smoke flavouring food additives. J Chromatogr B Analyt Technol Biomed Life Sci. 2002;770:3-18. [ Links ]
46. Miranda CL, Chung WG, Wang-Buhler JL, Musafia-Jeknic T, Baird WM, Buhler DR. Comparative in vitro metabolism of benzo[a]pyrene by recombinant zebrafish CYP1A and liver microsomes from beta-naphthoflavone-treated rainbow trout. Aquat Toxicol. 2006;80:101-8. [ Links ]
47. Lijinsky W. The formation and occurrence of polynuclear aromatic hydrocarbons associated with food. Mutat Res. 1991;259:251-61. [ Links ]
48. Jiang H, Gelhaus SL, Mangal D, Harvey RG, Blair IA, Penning TM. Metabolism of benzo[a]pyrene in human bronchoalveolar H358 cells using liquid chromatography-mass spectrometry. Chem Res Toxicol. 2007;20:1331-41. [ Links ]
49. Sang H, Zhang L, Li J. Anti-benzopyrene-7,8-diol-9,10-epoxide induces apoptosis via mitochondrial pathway in human bronchiolar epithelium cells independent of the mitochondria permeability transition pore. Food Chem Toxicol. 2012;50:2417-23. [ Links ]
50. Compagnone D, Curini R, D'Ascenzo G, Del Carlo M, Montesano C, Napoletano S, et al. Neutral loss and precursor ion scan tandem mass spectrometry for study of activated benzopyrene-DNA adducts. Anal Bioanal Chem. 2011;401:1983-91. [ Links ]
51. Culp SJ, Gaylor DW, Sheldon WG, Goldstein LS, Beland FA. A comparison of the tumors induced by coal tar and benzo[a]pyrene in a 2-year bioassay. Carcinogenesis. 1998;19:117-24. [ Links ]
52. Tso P. Intestinal lipid absorption. In: Physiology of the gastrointestinal tract. New York: Raven Press; 1994. p. 867-1907. [ Links ]
53. Ozaki T, Nakagawara A. p53: the attractive tumor suppressor in the cancer research field. J Biomed Biotechnol. 2010;2011:ID603925. doi: 10.1155/2011/603925. [ Links ]
54. Matikainen T, Perez GI, Jurisicova A, Pru JK, Schlezinger JJ, Ryu HY, et al. Aromatic hydrocarbon receptor-driven Bax gene expression is required for premature ovarian failure caused by biohazardous environmental chemicals. Nat Genet. 2001;28:355-60. [ Links ]
55. Perera F, Vishnevetsky J, Herbstman JB, Calafat AM, Xiong W, Rauh V, et al. Prenatal bisphenol a exposure and child behavior in an inner-city cohort. Environ Health Perspect. 2012;120:1190-4. [ Links ]
56. Perera F, Tang D, Whyatt R, Lederman SA, Jedrychowski W. DNA damage from polycyclic aromatic hydrocarbons measured by benzo[a]pyrene-DNA adducts in mothers and newborns from Northern Manhattan, the World Trade Center Area, Poland, and China. Cancer Epidemiol Biomarkers Prev. 2005;14:709-14. [ Links ]
57. Herbstman JB, Tang D, Zhu D, Qu L, Sjodin A, Li Z, et al. Prenatal exposure to polycyclic aromatic hydrocarbons, benzo[a]pyrene-DNA adducts, and genomic DNA methylation in cord blood. Environ Health Perspect. 2012;120:733-8. [ Links ]
58. Djinovic J, Popovic A, Jira W. Polycyclic aromatic hydrocarbons (PAHs) in different types of smoked meat products from Serbia. Meat Sci. 2008;80:449-56. [ Links ]
59. Wretling S, Eriksson A, Eskhult GA, Larsson B. Polycyclic aromatic hydrocarbons (PAHs) in Swedish smoked meat and fish. J Food Compos Analysis. 2010;23:264-72. [ Links ]
60. Comisión Europea. Regulación N° 1881/2010 por la cual se fija el contenido máximo de determinados contaminantes en los productos alimenticios. [citado febrero de 2013]. Disponible en: http://europa.eu/legislation_summaries/food_safety/contamination_environmental_factors/l21290_es.htm. [ Links ]
61. Cavret S, Feidt C, Le Roux Y, Laurent F. Study of mammary epithelial role in polycyclic aromatic hydrocarbons transfer to milk. J Dairy Sci. 2005;88:67-70. [ Links ]
62. Comisión Europea. Opinion of the scientific committee on food on the risks to human health of polycyclic aromatic hydrocarbons in food. Brussels; 2002. [ Links ]
63. Comisión Europea. Reglamento (UE) N° 835/2011. Modifica el Reglamento (CE) no 1881/2006 por lo que respecta al contenido máximo de hidrocarburos aromáticos policíclicos en los productos alimenticios. Brussels; 2011 [citado febrero de 2013]. Disponible en: http://europa.eu/legislation_summaries/food_safety/contamination_environmental_factors/l21290_es.htm. [ Links ]