Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Perspectivas en Nutrición Humana
Print version ISSN 0124-4108
Perspect Nut Hum vol.16 no.1 Medellín Jan./June 2014
INVESTIGACIÓN
Capacidad atrapadora de radicales oxígeno (ORAC) y fenoles totales de frutas y hortalizas de Colombia
Oxygen radical absorbance capacity (ORAC) and phenolic content of fruits and vegetables from Colombia
Sandra Zapata1; Ana María Piedrahita1; Benjamín Rojano1
1 Laboratorio de Ciencia de Alimento. Universidad Nacional de Colombia, Medellín, Colombia. brojano@unal.edu.co.
Como citar este artículo: Zapata S, Piedrahita AM, Rojano B. Capacidad atrapadora de radicales oxígeno (ORAC) y fenoles totales de frutas y hortalizas de Colombia. Perspect Nutr Humana. 2014;16: 25-36.
Artículo recibido: 13 de enero de 2014; Aceptado: 9 de abril de 2014
RESUMEN
Antecedentes: las frutas y hortalizas poseen un alto potencial nutricional y terapéutico, debido a la presencia de diferentes fitoquímicos, como los compuestos fenólicos que han sido relacionados con la actividad antioxidante. Con el fin de determinar la capacidad antioxidante en matrices alimentarias, uno de los métodos más utilizados es la capacidad atrapadora de radicales de oxígeno (ORAC). Objetivo: estimar el contenido de fenoles totales y la capacidad atrapadora de radicales de oxígeno (ORAC) en frutas y hortalizas colombianas. Materiales y métodos: el material vegetal fue liofilizado, seguido de un proceso de extracción para separar la fracción hidrofílica y lipófilica. El contenido de fenoles totales se determinó en la fracción hidrofílica por el método de Folin- Ciocalteu. La actividad antioxidante fue evaluada en la fracción hidrofílica y lipofílica por ORAC. Resultados: el contenido de fenoles totales varió entre 30,5 a 10.584,7 mg/100 g en las frutas y 12,4 a 1.377,2 mg/100 g en las hortalizas. Los valores ORAC obtenidos variaron desde 685,7 a 207.850,4 μmol trolox/100 g en las frutas y 372,3 a 32.047,9 μmol trolox/100 g en las hortalizas. La curuba y espinaca presentaron mejores propiedades antioxidantes de las frutas y hortalizas analizadas, respectivamente; con diferencias estadísticamente significativas frente a los demás alimentos de su grupo (p<0,05). Conclusión: los productos hortofrutícolas colombianos presentan posibles propiedades nutracéuticas por el aporte de compuestos fenólicos con actividad antioxidante.
Palabras clave: antioxidantes, sustancias protectoras, compuestos fenólicos, alimentos saludables, frutas, verduras.
ABSTRACT
Background: Fruits and vegetables have a high nutritional and therapeutic potential. It could be explained by presence of different phytochemicals, such as phenolic compounds, which have been associated with antioxidant activity. In order to determine antioxidant capacity in food matrices, one of the most widely used methods is oxygen radical absorbance capacity (ORAC). Objective: To estimate total phenolic content and ORAC in Colombian fruits and vegetables. Method and materials: Plant material was lyophilized, followed by an extraction process to separate hydrophilic and lipophilic fraction. Total phenolic content was estimated from hydrophilic fraction by Folin–Ciocalteu method. Antioxidant activity was evaluated in hydrophilic and lipophilic fractions by ORAC. Results: Total phenolic content varied from 30,5 to 10.584,7 mg/100 g in fruits, and 12,4 to 1.377,2 mg/100 g in vegetables. ORAC values were from 685,7 to 207.850,4 μmol trolox/100 g in fruits, and 372,3 to 32.047,9 μmol trolox/100 g in vegetables. Passion fruit and spinach had better antioxidant properties. Conclusions: Nutraceutical properties of Colombian fruits and vegetables may be explained by phenolic compounds content and antioxidant activity.
Key words: antioxidants, protective agents, phenolic compounds, health food, fruits, vegetables.
INTRODUCCIÓN
Las propiedades beneficiosas de las frutas y vegetales sobre la salud están asociadas con los metabolitos secundarios llamados fitonutrientes, los cuales pueden ser agrupados como fenoles, terpenos y derivados azufrados. El término fenoles de las plantas debería ser el más adecuado, sin embargo ha sido cambiado por polifenoles, debido a su utilización en el campo nutricional, la industria agrícola, cosmética y de alimentos. Los polifenoles son estructuras complejas y son los antioxidantes de mayor consumo en la dieta de humanos, con una alta implicación en la salud pública. Por lo tanto, es necesario proteger y educar las comunidades a través de un estilo de vida saludable que promueva la prevención de enfermedades mediante una ingesta alimentaria de productos naturales nutracéuticos (1-4).
Los compuestos polifenólicos son un grupo cercano a 8.000 sustancias que pueden ser clasificados de acuerdo con su estructura. Entre los más importantes están los flavonoides, que poseen una estructura básica C6-C3-C6, como las antocianinas, catequinas y epicatequinas. El subgrupo de los fenilpropanoides que incluye los derivados del ácido hidroxicinámico, como cafeico, ferúlico, sinápico y p-cumárico; estilbenoides, como el resveratrol, y derivados del ácido benzoico, como el gálico y algunos ácidos elágicos, entre otros. Además hay un grupo de moléculas simples, como los ácidos fenólicos y más complejas, como los taninos. Los polifenoles se encuentran generalmente glicosidados y por eso son generalmente solubles en agua. Los polifenoles en las frutas y hortalizas muestran una actividad antioxidante mayor que las vitaminas C y E, y desempeñan un papel importante en la prevención de enfermedades crónicas, tales como desórdenes cardiovasculares y neurodegenerativos, cáncer, diabetes tipo 2, osteoporosis, antimutagénicos y antitumorales (3,5-6).
Varias enfermedades neurodegenerativas, cardiovasculares, cerebrovasculares y algunas formas de cáncer están asociadas con el daño oxidativo generado por la presencia de radicales libres (2,7), que poseen uno o más electrones desapareados, que los hace altamente inestables y reactivos (8). Estas estructuras químicas para estabilizarse reaccionan rápidamente con moléculas adyacentes mediante reacciones de oxido-reducción, dañando biomoléculas, como carbohidratos, proteínas, lípidos y ADN, y, por consiguiente, afectando la membrana plasmática y organelas, como la mitocondria y el núcleo celular (5). El cuerpo humano desarrolla sistemas de protección contra radicales libres que resultan insuficientes con la edad, por lo cual las dietas ricas en frutas y hortalizas son una alternativa para la buena salud (3-4). Las propiedades benéficas de los polifenoles están asociadas a su estructura química que es capaz de interactuar con las especies reactivas de oxígeno y nitrógeno, que son los radicales libres más dañinos, mediante dos mecanismos: uno de transferencia de electrones (SET) y el otro de transferencia de un átomo de hidrógeno (HAT). En el mecanismo SET, el antioxidante (ArOH) puede donar un electrón al radical peróxilo, formando entre los productos un anión peróxilo y un catión radical del antioxidante (ArO•+); y en el mecanismo HAT, el antioxidante (ArOH) atrapa un radical peróxilo por donación de átomos de hidrógeno, generando un hidroperóxido y un radical antioxidante más estable químicamente (ArO•). Los mecanismos se describen a continuación (9):
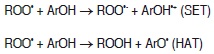
La cuantificación de los polifenoles totales es una forma directa de estimar el contenido de antioxidantes en una matriz alimentaria, siempre y cuando se correlacionen con medidas de la expresión de los mismos a través de una técnica que evalúe su actividad, como el método ORAC (Capacidad atrapadora del radical oxígeno) (10). Este método es un ensayo que mide la capacidad de un compuesto para atrapar el radical peróxilo, relevante en la oxidación de lípidos en los alimentos; mediante un mecanismo de transferencia de un átomo de hidrógeno HAT (11-12). En este ensayo, los radicales peróxilo (ROO•) generados por iniciadores de radicales libres, reaccionan con una sonda fluorescente para formar un producto no fluorescente; es decir, a medida que avanza la reacción la sonda fluorescente se consume y disminuye la fluorescencia. El antioxidante adicionado al medio compite con la sonda fluorescente, manteniéndose la fluorescencia (9,13). Además, este método puede medir la expresión antioxidante de compuestos hidrofílicos y lipofílicos en una muestra (14), y es muy utilizado para determinar la capacidad antioxidante de los alimentos y productos naturales (9-10). El estudio de las propiedades antioxidante de frutas y hortalizas y sus beneficios para la salud es un campo emergente en Colombia y con gran proyección, pero hasta ahora se desconoce el aporte de compuestos fenólicos como la actividad antioxidante de la mayoría de los productos hortofrutícolas del país. Por esta razón, el objetivo de este estudio fue establecer una base de datos de frutas y hortalizas con mayor potencial nutracéutico en Colombia, mediante la estimación de su contenido de fenoles totales y su capacidad atrapadora de radicales de oxígeno (ORAC).
MATERIALES Y MÉTODOS
Reactivos y equipos
El AAPH [2,20-Azo-bis (2-amidinopropano) dihidrocloruro] usado como una fuente de radicales peroxilos, Trolox (Acido 6-hidroxi-2,5,8-tetrametilcromano-2-carboxilico), fluoresceinato de sodio, BMCD (β –metil ciclodextrina) y ácido gálico fueron obtenidos de Sigma Chemical Co. (St Louis, MO). El metanol, acetona, ácido acético, hexano, fosfato ácido de sodio, fosfato básico de sodio, reactivo de Folin y carbonato de sodio fueron obtenidos de Merck (Alemania). Las medidas de absorbancia se realizaron en un espectrofotómetro UV-Vis Jenway 6405. Las lecturas de fluorescencia se realizaron en un espectrofluorímetro marca Perkin Elmer modelo LS- 55.
Muestras
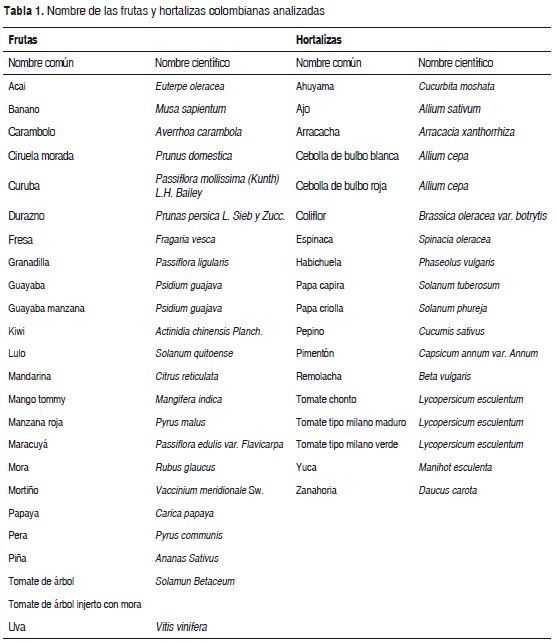
Se seleccionaron 24 frutas y 18 hortalizas colombianas de mayor interés comercial según la base de datos de Asohofrucol (Tabla 1). El material vegetal fue obtenido en el mercado local de la ciudad de Medellín-Colombia en madurez de consumo. Las muestras frescas fueron liofilizadas. Después de la liofilización, el material fue molido y almacenado a -20°C.
Extracción de las muestras
La preparación de las muestras se realizó siguiendo la metodología descrita por Prior y otros (12). Se pesó 1 g de muestra liofilizada en un tubo de centrífuga de 20 mL. El extracto lipofílico se obtuvo mezclando la muestra con hexano (2x10 ml) y centrifugando a 2.500 g durante 5 min. Los sobrenadantes se mezclaron, se evaporaron y se secaron con nitrógeno. El extracto hidrofílico se obtuvo mezclando el residuo de la extracción lipofílica seco con 10 ml de una solución de acetona/agua/ ácido acético (70;29,5;0,5 v/v/v). El tubo fue agitado durante 30 seg en un vortex, se agitó a 37°C por 5 min, se almacenó a temperatura ambiente por 10 min y finalmente se centrifugó a 2.500 g durante 5 min. El sobrenadante fue transferido a otro tubo. El extracto hidrofílico fue utilizado para cuantificar el contenido de fenoles totales y la actividad antioxidante por ORAC hidrofílico, y el extracto lipofílico para evaluar la capacidad antioxidante por ORAC lipofílico.
Determinación de fenoles totales
El contenido de fenoles totales se determinó por el método de Folin-Ciocalteu (15). Este método cuantifica el poder reductor de los compuestos fenólicos sobre el reactivo Folin-Ciocalteu, mediante la formación de un complejo azul que se lee a 760 nm. En un tubo de reacción se adicionaron 50 μL del extracto hidrofílico, 425 μL de agua destilada y 125 μL del reactivo Folin-Ciocalteu (grado analítico, Merck). Se agitó y luego se dejó en reposo por 6 min. Posteriormente se adicionaron 400 μL de Na2CO3 al 7,1%. Después de una hora en la oscuridad se leyó la absorbancia a 760 nm. Se usaron soluciones de ácido gálico (Sigma-Aldrich®) entre 50-500 μg/mL para construir la curva de calibración. Los resultados se expresaron como mg de ácido gálico/100 g de muestra liofilizada en base seca.
Ensayo ORAC
El ensayo ORAC se determinó por la metodología descrita por Ou y otros, con algunas modificaciones (6,16-17). Se prepararon 3 ml de la siguiente solución: 21 μL de una solución de fluoresceína 10 μM, 2899 μL de buffer fosfato 75 mM (pH 7.4), 50 μL de AAPH 600 mM y 30 μL de muestra o Trolox 500 μM (estándar). La fluorescencia se registró cada 60 seg a 37°C, usando un espectrofluorímetro Perkin Elmer LS55 con una multicelda termostatizada. Las lecturas se realizaron a una λ de excitación de 493 nm y una λ de emisión de 515 nm. El valor ORAC se calculó utilizando la siguiente ecuación y los resultados fueron expresados como valores TEAC (μmol de trolox/100 g de muestra liofilizada en base seca):

Donde AUC es el área bajo la curva y f es el factor de dilución de los extractos (16).
Para el ensayo de ORAC hidrofílico, las diluciones de los extractos hidrofílicos fueron preparadas en agua ultrapura. Para el análisis de ORAC lipofílico, se resuspendió el extracto lipofílico en 250 μL de acetona y luego se diluyó en 750 μL de una solución de BMCD al 7% (acetona / agua, 1:1, v/v). La solución de BMCD al 7% fue utilizada como blanco y para preparar el trolox y las diferentes diluciones de las muestras (12).
Análisis estadístico
Todas las determinaciones se realizaron por triplicado y se expresaron los valores como los promedios ± la desviación estándar (DE). Las diferencias estadísticas se determinaron mediante análisis de varianza (ANOVA) y test de mínima diferencia significativa (LSD) con un p<0,05 para comparación de medias en cada una de las variables analizadas (fenoles totales y ORAC), mediante el paquete estadístico Statgraphics Centurion XV.
RESULTADOS
Se determinó el contenido de fenoles totales y la capacidad antioxidante de 24 frutas y 18 hortalizas colombianas, por el método de Folin-Ciocalteu y ORAC, respectivamente.
Las tablas 2 y 3 muestran el contenido de fenoles totales en frutas y hortalizas colombianas. Los valores varían entre 30,5 a 10.584,7 mg/100 g en las frutas y 12,4 a 1.377,2 mg/100 g en las hortalizas. Las muestras fueron clasificadas en tres grupos según su contenido de fenoles totales: bajo (<100 mg/100 g), intermedio (100-500 mg/100 g) y alto (>500 mg/100 g). El primer grupo incluye: yuca, arracacha, durazno, maracuyá, ajo, ahuyama, mango tommy y banano, con un contenido bajo de fenoles totales. En el segundo grupo se encuentran la mayoría de productos hortofrutícolas analizados con un contenido intermedio de dichos metabolitos: papa capira, pera, papa criolla, papaya, pepino, zanahoria, tomate chonto, kiwi, tomate de árbol, mandarina, piña, uva, tomate tipo milano maduro, remolacha, habichuela, tomate de árbol injerto con mora, ciruela morada, lulo, tomate tipo milano verde, manzana roja, coliflor y acai; y en el tercer grupo se incluyen las muestras con alto contenido de fenoles totales, como la cebolla de bulbo blanca, granadilla, cebolla de bulbo morada, guayaba manzana, carambolo, pimentón, guayaba, mortiño, espinaca, fresa, mora y curuba. De los diferentes productos hortofrutícolas analizados, la curuba presentó significativamente mayor contenido de fenoles totales (10.584,7±260,6 mg/100 g). Entre las hortalizas estudiadas, la espinaca presentó mejor contenido de dichos metabolitos (1.377,2±26,1 mg/100 g); sin embargo, la mora y fresa exhibieron valores mayores que esta hortaliza (1.864,4±44,0 y 1.638,4±9,2 mg/100 g, respectivamente).
La actividad antioxidante medida por el método ORAC para las diferentes frutas y hortalizas colombianas se reporta en las tablas 2 y 3. Los valores obtenidos varían entre 685,7 a 207.850,4 μmol trolox/100 g en las frutas y 372,3 a 32.047,9 μmol trolox/100 g en las hortalizas. Los productos hortofrutícolas se pueden clasificar en tres grupos según su capacidad antioxidante. En el primer grupo se encuentra la yuca, mango tommy y arracacha, con un bajo potencial antioxidante (<1.000 μmol trolox/100 g). El segundo grupo está conformado por los productos con una actividad antioxidante moderada (1.000-5.000 μmol trolox/100 g): papaya, maracuyá, ahuyama, banano, pera, pepino, ajo, tomate chonto, papa capira, tomate tipo milano verde, tomate tipo milano maduro, piña, kiwi, tomate de árbol y papa criolla; y el tercer grupo está compuesto por el durazno, uva, zanahoria, remolacha, cebolla de bulbo blanca, habichuela, ciruela morada, granadilla, mandarina, tomate de árbol injerto con mora, pimentón, lulo, coliflor, guayaba, cebolla de bulbo morada, mora, guayaba manzana, manzana roja, carambolo, espinaca, mortiño, fresa, acai y curuba, que presentan una elevada capacidad antioxidante (>5.000 μmol trolox/100 g). De las frutas y hortalizas analizadas, la curuba presentó significativamente mayor actividad antioxidante (207.850,4±2906,5 μmol trolox/100 g). Entre las hortalizas estudiadas, la espinaca presentó mejor potencial antioxidante (32.047,9±1541,2 μmol trolox/100 g); sin embargo, el mortiño (34.825,6±819,7 μmol trolox/100 g), fresa (35.841,7±2.566,3 μmol trolox/100 g) y acai (43.795,7±1.674,1 μmol trolox/100 g) exhibieron mayores valores que la espinaca.
DISCUSIÓN
El contenido de fenoles totales y la actividad atrapadora de radicales oxígeno de frutas y hortalizas colombianas fueron clasificados en tres grupos según el aporte de compuestos fenólicos y la actividad antioxidante. Entre los productos hortofrutícolas analizados, la curuba presentó mayor contenido de fenoles totales. Este resultado es similar a los obtenidos en diferentes estudios. Se ha encontrado que el contenido de fenoles de la curuba es mucho mayor que todos los frutos del género Passiflora estudiados y que la mayoría de los vegetales, incluyendo diversos berries, frutas, granos y legumbres. Esta fruta es rica en flavonoides, ácidos fenólicos y taninos (18-21).
De las hortalizas estudiadas, la espinaca presentó mayor aporte de compuestos fenólicos. Esta hortaliza ha sido reportada como uno de los muchos vegetales ricos en componentes antioxidantes (22). Amin y otros, determinaron el contenido de fenoles totales de cinco hortalizas diferentes, siendo la espinaca la que presentó mayor contenido de este metabolito (23).
Es importante resaltar que existen varios factores internos y externos que afectan la calidad y/o cantidad de los compuestos fenólicos en las plantas, como la diversidad genética (variedad y origen de la muestra), etapa de madurez, variables ambientales (intensidad de la luz, clima, temperatura, uso de fertilizantes, heridas), método de extracción, procesamiento y almacenamiento (19-20,24).
En cuanto a la actividad antioxidante medida por el método ORAC, cabe aclarar que el consumo de aproximadamente 100 g de muchos de los productos hortofrutícolas analizados, podrían ejercer una potente protección antioxidante. Algunos investigadores sugirieron una ingesta entre 3.000 a 5.000 ORAC/día, con el fin de promover un equilibrio oxidativo en el plasma sanguíneo y los tejidos corporales (6,12,25).
Entre las frutas y hortalizas estudiadas, la curuba presentó mayor actividad antioxidante. El valor ORAC total encontrado para la curuba de 207.850,4 ± 2.906,5 μmol Trolox/100 g es más alto que la mayoría de granos, legumbres y frutas (26-27). Se han reportado algunos estudios que evidencian el potencial antioxidante de esta fruta. Botero y otros encontraron que la curuba posee mayor capacidad reductora comparada con 15 frutas colombianas, usando las técnicas FRAP y midiendo el potencial de ionización por voltametría cíclica (2). Contreras Calderón y otros obtuvieron diferencias significativas entre la capacidad antioxidante de la curuba y otras frutas colombianas por las técnicas ABTS+·, DPPH·y FRAP (20).
De las hortalizas estudiadas, la espinaca presentó mejor potencial antioxidante. Amin y otros demostraron el gran potencial antioxidante de la espinaca con respecto a otros vegetales (23). También, se ha reportado la habilidad de extractos de espinaca para atrapar radicales libres por el método de DPPH·(28).
La actividad antioxidante de estos productos hortofrutícolas puede relacionarse con el contenido de fenoles totales. En general, las frutas y hortalizas con una baja capacidad antioxidante presentaron un bajo contenido de compuestos fenólicos. Aquellas con una capacidad antioxidante moderada evidenciaron un aporte bajo a intermedio de fenoles totales, y las que exhibieron un elevado potencial antioxidante mostraron un aporte intermedio a alto de compuestos fenólicos. Numerosos estudios han demostrado que el contenido fenólico en frutas y vegetales puede contribuir significativamente a su capacidad antioxidante (19-20,29). Vasco y otros estimaron el contenido de fenoles totales y la capacidad antioxidante de diferentes frutas ecuatorianas. Ellos evidenciaron que las frutas ecuatorianas con una elevada capacidad para atrapar el radical DPPH·, exhibieron un moderado a elevado contenido de fenoles totales (19). Prior y otros encontraron una alta correlación entre el contenido de fenoles totales y la capacidad antioxidante, evaluada por ORAC, de diferentes cultivos de especies de Vaccinium (29).
Además, pueden existir correlaciones bajas o moderadas entre la actividad antioxidante y el contenido de fenoles totales, debido a la presencia de otros compuestos no fenólicos, como carotenoides y ácido ascórbico, con potencial antioxidante (19,30). De las frutas y hortalizas estudiadas, la curuba presentó un contenido de fenoles totales cinco veces superior al de la mora y su capacidad antioxidante fue 16 veces mayor; esto puede deberse a altos contenidos de carotenoides y ácido ascórbico en la curuba (19-20,31). Aunque la curuba evidenció un alto aporte de polifenoles y alto potencial antioxidante en las frutas analizadas y la espinaca en las hortalizas estudiadas, el consumo de ambas especies en Colombia es escaso. Según la Encuesta nacional de la situación nutricional de 2005 (ENSIN), solo 2% de las personas encuestadas incluyeron curuba en su dieta y 3,1% consumieron espina (32). Por lo tanto, se deberán implementar estrategias para promover el consumo de este tipo de productos hortofrutícolas, que tienen grandes efectos beneficiosos sobre la salud. Cabe resaltar que estas propiedades beneficiosas de las frutas y hortalizas dependerán de los metabolitos presentes en ellas y su biodisponibilidad en los organismos (33).
Entre las frutas y hortalizas de mayor consumo en Colombia, la cebolla de bulbo (conocida como cebolla de huevo o cabezona), tanto la roja como la blanca, mostraron alto contenido de fenoles y alta capacidad antioxidante. Casi la mitad de los colombianos la incluye en su dieta (47,7%), sin embargo se consume en baja cantidad (en promedio 13 g/día), debido a que es utilizada fundamentalmente como ingrediente para adobar o aliñar productos cárnicos, entre otros (32). El tomate, con un aporte intermedio de fenoles y una moderada capacidad antioxidante, es la verdura incluida en la alimentación de la mayoría de colombianos (59,2%), en muchos casos se usa como aliño en cantidades bajas (22 g/día) (32).
El hecho de que los alimentos difieran en su potencial antioxidante y, por ende, en su capacidad para disminuir los riesgos de padecer enfermedades crónicas, es un aspecto con frecuencia olvidado en las recomendaciones nutricionales para una dieta, que se basan fundamentalmente en necesidades de nutrientes. Sin embargo, se ha evidenciado que el consumo de alimentos con alto contenido de compuestos bioactivos, como los antioxidantes, contribuyen a una menor prevalencia de enfermedades crónicas degenerativas (3,5-6). Esto ha motivado a la comunidad a que en su dieta incluya alimentos con propiedades nutraceúticas, mediante la implementación de nuevos modelos, como la rueda de los alimentos antioxidantes en España (34).
En conclusión, la mayoría de frutas y hortalizas estudiadas presenta un aporte entre intermedio y alto de fenoles totales y entre moderada y elevada actividad antioxidante, lo que potencializa sus posibles propiedades nutracéuticas como sus beneficios para la salud.
CONFLICTOS DE INTERESES
Los autores declaran no tener conflicto de interés.
AGRADECIMIENTOS
A Colciencias por el apoyo a la Joven Investigadora Ana María Piedrahita. A la Dirección de Investigaciones (DIME) y al Laboratorio de Ciencia de los Alimentos de la Universidad Nacional de Colombia, sede Medellín, por el apoyo financiero.
REFERENCIAS
1. Quideau S, Deffieux D, Douat-Casassus C, Pouységu L. Plant polyphenols: chemical properties biological activities, and synthesis. Angew Chem Int Ed. 2011;50:586-621. [ Links ]
2. Botero ML, Ricaurte S, Monsalve C, Rojano B. Capacidad reductora de 15 frutas tropicales. Scientia Technica. 2007;33:295-6. [ Links ]
3. Gaviria C, Ochoa C, Sánchez N, Medina C, Lobo M, Galeano P, et al. Actividad antioxidante e inhibición de la peroxidación lipídica de extractos de frutos de mortiño (Vaccinium meridionale Sw). Blacpma. 2009;8:519-28. [ Links ]
4. Ninfali P, Mea G, Giorgini S, Rocchi M, Bacchiocca M. Antioxidant capacity of vegetables, spices and dressings relevant to nutrition. Br J Nutr. 2005;93:257-66. [ Links ]
5. Choksi RB, Boylston WH, Rabek JP, Widger WR, Papaconstantinou J. Oxidatively damaged proteins of heart mitochondrial electron transport complexes. Biochim Biophys Acta. 2004;1688:95-101. [ Links ]
6. Rojano B, Zapata K, Cortés F. Capacidad atrapadora de radicales libres de Passiflora mollissima (Kunth) L.H. Bailey (curuba). Rev Cubana Plantas Med. 2012;17:408-19. [ Links ]
7. Martínez-Lazcano JC, Boll-Woehrlen MC, Hernández-Melesio MA, Rubio-Osornio M, Sánchez-Mendoza MA, Ríos C, et al. Radicales libres y estrés oxidativo en las enfermedades neurodegenerativas. Mensaje Bioquim. 2010;34:43-59. [ Links ]
8. Halliwell B, Whiteman M. Measuring reactive species and oxidative damage in vivo and in cell culture: how should you do it and what do the results mean? Br J Pharmacol. 2004;142:231-55. [ Links ]
9. Prior RL, Wu X, Schaich K. Standardized methods for the determination of antioxidant capacity and phenolics in foods and dietary supplements. J Agr Food Chem. 2005;53:4290-302. [ Links ]
10. Jacobo-Velazquez DA, Cisneros-Zevallos L. Correlations of antioxidant activity against phenolic content revisited: a new approach in data analysis for food and medicinal plants. J Food Sci. 2009;74:R107-R13. [ Links ]
11. US. Department of Agriculture, Agricultural Research Service. Oxygen radical absorbance capacity (ORAC) of selected foods, release 2. Beltsville: Nutrient Data Laboratory; 2010. 46p. [ Links ]
12. Prior RL, Hoang H, Gu L, Wu X, Bacchiocca M, Howard L, et al. Assays for hydrophilic and lipophilic antioxidant capacity (oxygen radical absorbance capacity (ORACFL) of plasma and other biological and food samples. J Agr Food Chem. 2003;51:3273-9. [ Links ]
13. Jiménez-Álvarez D, Giuffrida F, Vanrobaeys F, Golay PA, Cotting C, Lardeau A, et al. High-throughput methods to assess lipophilic and hydrophilic antioxidant capacity of food extracts in vitro. J Agr Food Chem. 2008;56:3470-7. [ Links ]
14. Huang D, Ou B, Hampsch-Woodill M, Flanagan JA, Deemer EK. Development and validation of oxygen radical absorbance capacity assay for lipophilic antioxidants using randomly methylated beta-cyclodextrin as the solubility enhancer. J Agr Food Chem. 2002;50:1815-21. [ Links ]
15. Singleton Vl, Rossi JA. Colorimetry of total phenolics with phosphomolybdic-phosphotungstic acid reagents. AJEV. 1965;16:144-58. [ Links ]
16. Ou B, Hampsch-Woodill M, Prior R. Development and validation of an improved oxygen radical absorbance capacity assay using fluorescein as the fluorescent probe. J Agr Food Chem. 2001;49:4619-26. [ Links ]
17. Naranjo M, Vélez T, Rojano B. Actividad antioxidante de café colombiano de diferentes calidades. Rev Cubana Plantas Med. 2011;16:164-73. [ Links ]
18. Dhawan K, Dhawan S, Sharma A. Passiflora: a review update. J Ethnopharmacol. 2004;94:1-23. [ Links ]
19. Vasco C, Ruales J, Kamal-Eldin A. Total phenolic compounds and antioxidant capacities of major fruits from Ecuador. Food Chem 2008;111:816-23. [ Links ]
20. Contreras-Calderón J, Calderón-Jaimes L, Guerra-Hernández E, García-Villanova B. Antioxidant capacity, phenolic content and vitamin C in pulp, peel and seed from 24 exotic fruits from Colombia. Food Res Intern. 2010; 44: 2047-53. [ Links ]
21. Rautenbach F, Venter I. Hydrophilic and lipophilic antioxidant capacity of commonly consumed South African fruits, vegetables, grains, legumes, fats/oils and beverages. J Food Compos Anal. 2010;23:753-61. [ Links ]
22. Hunter KJ, Fletcher JM. The antioxidant activity and composition of fresh, frozen, jarred and canned vegetables. Innovat Food Sci Emerg Tech. 2002;3:399-406. [ Links ]
23. Amin I, Zamaliah MM, Chin WF. Total antioxidant activity and phenolic content in selected vegetables. Food Chem. 2004;87:581-6. [ Links ]
24. Vallejo F, Tomás-Baeberán FA, García-Viguera C. Effect of climatic and sulphur fertilization conditions, on phenolic compounds and vitamin C, in the inflorescences of eight broccoli cultivars. Eur Food Res Tech. 2003;216:395-401. [ Links ]
25. McBride J. Can foods forestall aging? Agr Res. 1999;47:14-7. [ Links ]
26. Wu X, Beecher GR, Holden JM, Haytowitz DB, Gebhardt SE, Prior RL. Lipophilic and hydrophilic antioxidant capacities of common foods in the United States. J Agr Food Chem. 2004;52:4026-37. [ Links ]
27. Zulueta A, Esteve MJ, Frígola A. ORAC and TEAC assays comparison to measure the antioxidant capacity of food products. Food Chem. 2009;114:310-6. [ Links ]
28. Amin I, Norazaidah Y, Emmyhanit KI. Antioxidant Activity and phenolic content of raw and blanching Amaranthus species. Food Chem. 2006;94:47-52. [ Links ]
29. Prior RL, Cap G, Martin A, Sofic E, McEwen J, O'Brien C, et al. Antioxidant capacity as influenced by total phenolic and anthocyanin content maturity and variety of Vaccinium species. J Agr Food Chem. 1998;46:2686-93. [ Links ]
30. Saura-Calixto F, Goñi I. Antioxidant capacity of the Spanish Mediterranean diet. Food Chem. 2006;94:442-7. [ Links ]
31. Quintero D, Escobar LM. Tabla de composición de alimentos. 2ed. Medellín: Centro de Atención Nutricional; 2001. 107p. [ Links ]
32. ICBF, Profamilia, Instituto Nacional de Salud, Universidad de Antioquia, Organización Panamericana de la Salud. Encuesta nacional de la situación nutricional en Colombia, 2005. Bogotá; 2006. [ Links ]
33. Epriliati I, Ginjom IR. Bioavailability of phytochemicals. In: Rao V, ed. Phytochemicals: a global perspective of their role in nutrition and health. Rijeka: In Tech, 2011. p. 401-28. [ Links ]
34. Martínez JR, Izquierdo M. La capacidad antioxidante de la dieta española, la rueda de los alimentos antioxidantes. Madrid: Sociedad Española de Dietética y Ciencias de los Alimentos; 2005. [citado noviembre de 2013]. Disponible en http://www.nutricion.org/recursos_y_utilidades/pdf/instrucciones_rueda_antiox.pdf. [ Links ]