Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Perspectivas en Nutrición Humana
Print version ISSN 0124-4108
Perspect Nut Hum vol.16 no.2 Medellín July/Dec. 2014
https://doi.org/10.17533/udea.penh.v16n2a06
INVESTIGACIÓN
doi: 10.17533/udea.penh.v16n2a06
Propiedades antioxidantes de extractos de curuba (Passiflora mollisima Bailey) en crema de leche
Antioxidant properties of curuba extracts (Passiflora mollisima Bailey) in milk cream
Clara Inés Ochoa Ospina1; José Uriel Sepúlveda Valencia1; María E. Maldonado2; Karol Zapata Acosta1; Benjamín Alberto Rojano1
1 Universidad Nacional de Colombia, Sede Medellín, Colombia. brojano@unal.edu.co.
2 Grupo Impacto de los Componentes de los Alimentos en la Salud, Escuela de Nutrición y Dietética, Universidad de Antioquia. Calle 70 N° 52-21, Medellín, Colombia.
Como citar este artículo: Ochoa CI, Sepúlveda JU, Maldonado ME, Zapata K, Rojano BA. Propiedades antioxidantes de extractos de curuba (Passiflora mollisima Bailey) en crema de leche. Perspect Nutr Humana. 2014;16: 186-199.
Fecha de recepción: 15 de junio de 2014; Fecha de aprobación: 6 de septiembre de 2014
RESUMEN
Antecedentes: la grasa láctea contribuye al sabor y aroma de los productos lácteos y ayuda a absorber las vitaminas liposolubles. Sin embargo es susceptible a reacciones de oxidación, que traen como consecuencia una disminución en la calidad de los productos. Objetivo: evaluar la capacidad antioxidante de la crema de leche suplementada con 0,40 0,60 y 0,80% p/p de extracto de curuba y la estabilidad oxidativa durante 25 días de almacenamiento a 4ºC. Materiales y métodos: para evaluar la oxidación lipídica se determinó el valor TBAR. La capacidad antioxidante se comprobó mediante las técnicas DPPH, ORAC-H, ORAC-L y Folin Ciocalteu. Resultados: los tratamientos mejoraron significativamente la estabilidad oxidativa de la crema de leche (p<0,05) durante los 25 días de almacenamiento, la presencia de 0,40; 0,60 y 0,80% p/p de extracto de curuba redujo la producción de malondialdehido con respecto el blanco en un 6, 15 y 22% respectivamente, el poder antioxidante de las muestras suplementadas fue superior al del blanco. En la evaluación sensorial se encontró diferencia entre la crema de leche con y sin extracto. Conclusiones: el extracto de curuba retrasa el proceso de oxidación de la crema de leche y puede estar asociado a la capacidad antioxidante del producto.
Palabras clave: Passiflora mollisima, crema de leche, productos lácteos, antioxidantes, peroxidación lipídica.
ABSTRACT
Background: Milk fat contributes to flavors of dairy products and contributes to fat-soluble vitamins absorption. However, it is susceptible to oxidation reactions that result in a decrease in the quality of products. Objective: To evaluate the antioxidant capacity of the milk cream supplemented with 0.40, 0.60 and 0.80 % w/w of Banana Passion Fruit extracts and oxidative stability during 25 days of storage at 4ºC. Materials and Methods: Lipid peroxidation was evaluated by the TBARS method. The antioxidant capacity was determined by DPPH, ORAC-H, ORAC-L and Folin-Ciocalteu assays. Results: Treatments improved significantly (p<0.05) the oxidative stability of the cream during 25 days of storage, the presence of 0.40, 0.60 and 0.80% w/w curuba extract reduced production of malondialdehyde by 6, 15 and 22% respectively compared to control, the antioxidant power of the supplemented samples was higher than control. In the sensory evaluation was found difference between the cream with and without extract. Conclusions: Banana Passion Fruit extract retards the oxidation process of the cream and may be associated with the antioxidant capacity of the product.
Keywords: Passiflora mollisima, milk cream, dairy products, antioxidants, lipid peroxidation.
INTRODUCCIÓN
La leche es un alimento complejo cuyo consumo confiere una serie de beneficios para la salud, como el ácido graso linoléico conjugado (CLA), los ácidos grasos omega-3 (n-3) con capacidad protectora contra algunas enfermedades crónicas no-transmisibles, como las enfermedades cardiovasculares, la obesidad, la diabetes, la osteoporosis, entre otras. Contribuye a la formación ósea y mejora el funcionamiento del sistema inmunológico (1-2). Además, los lípidos de la leche son una importante fuente energética (3-4) y son transportadores de vitaminas liposolubles. Así mismo, son responsables de las propiedades físicas, son determinantes de las características de fabricación y cualidades sensoriales de los productos lácteos terminados (5). Por otro lado, son los componentes más variables tanto en concentración como en composición.
La crema de leche es un derivado lácteo con un alto contenido de grasa, utilizado no solo como ingrediente para la fabricación de muchos productos alimenticios, sino para el consumo directo. Sin embargo, al igual que otras emulsiones de aceite en agua, puede sufrir reacciones de oxidación (6). Los procesos oxidativos son responsables del deterioro de los alimentos, los cuales producen alteraciones en la calidad nutricional y también provocan aroma y sabor desagradables. En los lípidos la oxidación es esencialmente una reacción en cadena de los radicales libres que involucra etapas de iniciación, propagación y terminación.
Los ácidos grasos insaturados se oxidan para formar hidroperóxidos inestables, inodoros e insípidos, que se descomponen para formar compuestos más volátiles, como los aldehídos y cetonas de cadenas cortas, muchos de los cuales contribuyen con los malos sabores de los productos lácteos (7), por lo tanto la estabilidad oxidativa de la leche y los productos lácteos son de gran interés para la industria láctea (8). Inhibir el progreso de oxidación de lípidos es un factor clave en el mantenimiento de la calidad de los alimentos (7), con el fin de prevenir o retrasar el deterioro oxidativo, los antioxidantes han sido ampliamente utilizados. En la actualidad los antioxidantes sintéticos, como el BHA, BHT y TBHQ, son los más utilizados en la industria de los alimentos y demás, sin embargo existe preocupación respecto a su seguridad, el butilhidroxianisol (BHA) y el butilhidroxitolueno (BHT) han exhibido efectos adversos a la salud, como el aumento del colesterol, hepatomegalia e inducción de cáncer hepático, entre otros (9-10). Por ello se ha dirigido el interés hacia el hallazgo y adición de antioxidantes naturales, como vitamina C y E, carotenoides, tocoferoles y flavonoides, debido a que se consideran más seguros, inocuos, actúan a bajas concentraciones y además de inhibir la oxidación, pueden tener efectos positivos sobre la salud (11-13).
Dado los antecedentes, las frutas frescas, sus jugos y extractos tienen potencial para ser utilizados como ingredientes funcionales en la industria alimentaria, incluyendo el sector lácteo. La adición de antioxidantes a la crema de leche se hace con el objetivo de retardar los procesos de rancidez, disminuir la posibilidad de generación de compuestos tóxicos, evitar la decoloración de los pigmentos, disminuir la pérdida de valor nutricional causada por la degradación de los ácidos grasos esenciales y por la destrucción de las vitaminas A, E y D, además de que estos compuestos naturales refuerzan la actividad de los sistemas antioxidantes endógenos, aportando una protección extra para el estrés oxidativo.
La curuba (Passiflora mollisima B) originaria de América y cultivada en Colombia durante todo el año, pertenece a la familia Pasiflorácea del género Passiflora y especie mollisima (14). Varios estudios han demostrado que la curuba posee una capacidad antioxidante alta, expresada por diferentes metodologías. Hallazgos hechos en los últimos diez años en América y el Caribe posicionan a la curuba larga (Passiflora mollisima) en el primer lugar en cuanto a actividad antioxidante y contenido fenólico, con valores muy superiores a los reportados para frutas de alta ingesta en el país, como el mango, la mora, la fresa, la guayaba, el lulo, la papayuela, el tomate de árbol, el melón, el maracuyá, la uchuva, la granadilla, la sandía y la piña (15-17). Sin embargo, sus propiedades antioxidantes no han sido investigadas en una matriz alimenticia como la crema de leche. El objetivo de este estudio fue evaluar el efecto de extractos de curuba (Passiflora mollisima Bailey) sobre la estabilidad oxidativa de la crema de leche.
MATERIALES Y MÉTODOS
Preparación de la crema de leche: se prepararon lotes de 10 kg de crema de leche con un contenido de materia grasa del 35%. La mezcla fue pasterizada, homogenizada y enfriada. Posteriormente se adicionó el extracto de curuba hasta obtener concentraciones finales de 0,40; 0,60 y 0,80% p/p, como blanco se utilizó crema de leche de igual formulación y proceso pero sin adición del extracto. Las muestras se almacenaron a 4°C durante 25 días. Se procedió mediante un diseño completamente al azar con tres repeticiones, utilizando tres niveles de extracto de curuba y un blanco. Los análisis fueron realizados cada cinco días durante el almacenamiento.
Método de extracción de la fase hidrofílica y lipofílica de la crema de leche: para extraer las fracciones hidrofílica y lipofílica de las muestras de crema de leche se empleó el método descrito por Stefanov (18). A la fase hidrofílica de la crema se le determinó el contenido de fenoles totales y se evaluó la capacidad antioxidante mediante la aplicación de las metodologías DPPH y ORAC, las cuales se detallarán más adelante. El seguimiento de la oxidación a la fase lipofílica se realizó mediante el valor TBARS.
Caracterización fisicoquímica de la crema de leche: se realizaron pruebas de acidez por titulación con NaOH 0,1N, utilizando como indicador fenolftaleína (AOAC 942.15, 1996) (19), el contenido de cenizas se determinó por gravimetría en mufla a 300°C, hasta peso constante (20). Materia grasa se llevó a cabo por el método de Babcock (AOAC 989.04) (20), la determinación de proteínas se realizó por el método de Kjeldahl según Norma Técnica Colombiana NTC 4657 (21), los minerales por el método de espectrofotometría ultravioleta (UV) NTC-4981 (22) para fósforo y por espectrofotometría de absorción atómica (AA) NTC-5151 para calcio (23).
Determinación de azúcares: se llevó a cabo según el protocolo de Borroto (24). Se utilizó un cromatógrafo líquido (Shimadzu, LC-20AD), equipado con un autoinyector SIL-20A /HT, un módulo de comunicación CBM-20A y un detector con índice de refracción (RID-10 A). La separación de los azúcares se llevó a cabo en una columna BIORAD (Aminex HPX-87H); el corrido fue isocrático, empleando ácido sulfúrico 5mM con un flujo de 0,6 mL/min.
Determinación de ácido ascórbico: la determinación de ácido ascórbico se cuantificó usando la metodología de Rizzolo (25), por medio de HPLC (Shimadzu, LC-20AD), equipado con un autoinyector SIL-20A /HT, un módulo de comunicación CBM-20A y un detector con arreglo de fotodiodos (PDA) SPD-M20A, empleando una longitud de onda de 245 nm. La separación del ácido ascórbico se llevó a cabo en una columna C-8; el corrido fue isocrático, empleando ácido fórmico 0,1% con un flujo de 0,8 mL/min.
Determinación de fenoles totales: se realizó por el método colorimétrico Follin-Ciocalteu (26), se construyó una curva patrón usando como estándar ácido gálico. A la fase hidrofílica de la crema se le adicionó agua destilada, reactivo de Follin- Ciocalteu y una solución de bicarbonato de sodio al 7,1%, las lecturas se realizaron a una longitud de onda de 760 nm en un espectrofotómetro Genesys 20 y los resultados son expresados como GAE (Equivalentes de ácido gálico: mg de ácido gálico / 100 L solución).
Actividad atrapadora del radical libre DPPH: se empleó el método de Brand-Williams (27) con algunas modificaciones. Se evalúo la capacidad de las muestras para atrapar el radical DPPH, por medio de la disminución en la absorbancia leída, luego de 30 min de reacción a una longitud de onda de 517 nm. En un tubo de ensayo se adicionó la fase hidrofílica de la crema y solución de DPPH. Los resultados se expresaron como valores TEAC (Trolox equivalent antioxidant capacity: μmol Trolox / L solución) mediante la construcción de una curva patrón usando Trolox como antioxidante.
Método ORAC (Oxygen radical absorbance capacity): este método evalúa la capacidad de una muestra para atrapar los radicales peroxilos (ROO•) responsables de la decoloración de la sonda fluorescente fluoresceína. Se usó el método descrito por Ou (28), para el ORAC-H y Wu (29) para el ORAC-L, ambas metodologías con algunas modificaciones: 30 μL de la muestra por evaluar fueron adicionados a 2899 μL de Buffer fosfato de sodio 75 mM - pH 7,4 (PBS), 21 μL de fluoresceína 10 mM preparada en PBS y 50 μL de AAPH 0,6 M en PBS (generador de radicales), la temperatura de reacción se ajustó a 37°C y el pH a 7,4. Las cinéticas de decoloración se realizaron mediante medidas en un espectrofluorímetro Perkin Elmer LS-55, durante 3.600 segundos, a un λ de excitación 493 nm y slit de excitación 10, λ de emisión 515 nm y slit de emisión 15 con placa atenuadora al 1%. El efecto protector antioxidante fue calculado usando las diferencias entre las áreas de decoloración en presencia y ausencia de la muestra comparada con la curva patrón (presencia de Trolox). Los resultados son expresados en función del patrón primario como μmol Trolox equivalente / L solución para ORAC-H, y en μmol Trolox / 100 g de aceite para ORAC-L, de acuerdo con la siguiente ecuación:
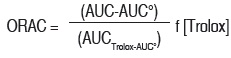
Donde AUC=Área bajo la curva de la muestra, AUC°=Área bajo la curva del control (ausencia de muestral), y AUCTrolox=Área bajo la curva usando Trolox como muestra referencia, f=factor de dilución de los extractos y [Trolox]=Concentración molar del patrón usado Trolox. Para el ensayo ORAC-H se preparó la muestra diluyendo un peso conocido en agua ultrapura, para el ensayo ORAC-L se encapsuló la muestra diluyéndola en acetona y β-metil-ciclodextrina al 7%.
Determinación del contenido de sustancias reactivas con el ácido 2-tiobarbitúrico (TBARS): se llevó a cabo mediante el procedimiento descrito por Stephan (30). En un tubo de reacción se adicionó la fase lipofílica de la crema, reactivo de TBA (ácido 2- tiobarbitúrico 0,7%) y reactivo TCA (ácido tricloroacético 15%), se agitó y se llevó a un baño de agua a 90°C. Posteriormente se enfrió en agua-hielo y se le adicionó butanol, el complejo fluorescente formado fue leído en un espectroflúorimetro Perkin Elmer LS 55, a un λ de excitación de 500 nm y slit de excitación 5, de emisión 550 nm y slit de emisión 15. Los resultados son expresados como equivalentes de malondialdehido (MDA) (nmol/ g de muestra).
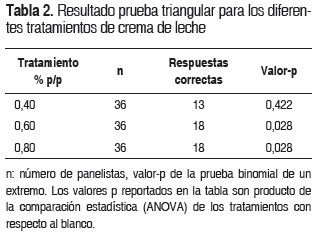
Evaluación sensorial: se realizó una prueba triangular (ISO, 4.120:2004) (31) con un total de 36 panelistas para evaluar las diferencias significativas perceptibles causadas por la adición del extracto de curuba a la crema de leche en las concentraciones de 0,40; 0,60 y 0,80% p/p en el día 25. Cada panelista recibió tres muestras codificadas: dos eran el mismo tratamiento y una era diferente. Se les pidió seleccionar la muestra que era diferente.
Análisis estadístico: se realizó análisis de varianza (ANOVA) y mínima diferencia significativa (LDS), con el paquete estadístico SAS 9.2. Las regresiones lineales se realizaron en el paquete estadístico STATGRAPHICS Centurion XV. Un p<0,05 fue seleccionado como el criterio de diferencias significativas.
RESULTADOS
Caracterización fisicoquímica
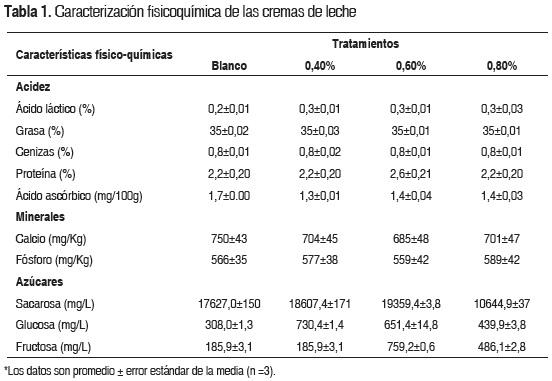
Los resultados de la caracterización fisicoquímica se presentan en la tabla 1. El contenido de calcio varió entre 685 y 750 mg/kg y el contenido de fósforo varió entre 559 y 589 mg/kg. Las cremas de leche presentaron porcentajes de proteína similares y sin diferencias estadísticamente significativas (p>0,05). Los valores en el índice de acidez fueron de 0,20; 0,26; 0,28 y 0,31% de ácido láctico para el blanco y los tratamientos a 0,40; 0,60 y 0,80% respectivamente. No se presentaron diferencias significativas entre el contenido de azúcares de las muestras tratadas (p>0,05), pero sí existieron diferencias de estas y el blanco y los tratamientos. Los valores variaron entre 19359,4 y 10644,8 (o 19359,4 y 10644,8) mg/L para sacarosa, 308,0 y 730,4 mg/L para glucosa y 185,9 y 759,2 mg/L para fructosa. El comportamiento de los azúcares determinados no muestra ninguna tendencia entre los tratamientos y el blanco, en el blanco el contenido de glucosa y fructosa fue menor que para los tratamientos, mientras que en el contenido de sacarosa el menor valor lo presentó el tratamiento 0,80% p/p.
Determinación de fenoles totales
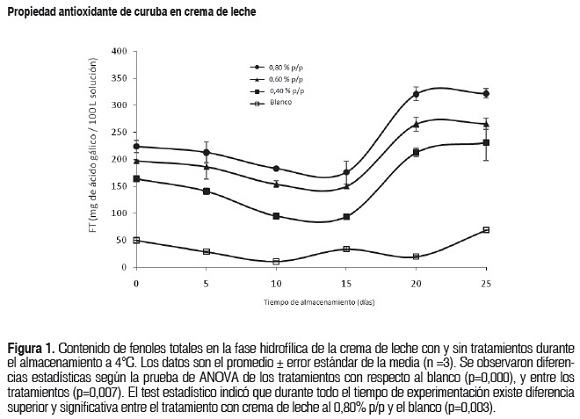
El contenido de fenoles totales (CFT) presentes en los diferentes tratamientos durante los días de almacenamiento se muestra en la figura 1. Durante el almacenamiento todos los tratamientos presentaron diferencias estadísticamente significativas (p<0,05) entre ellos, excepto los tratamientos 0,60 y 0,80% (p>0,05). Se observó una disminución gradual en el CFT en todos los tratamientos durante los primeros 15 días de almacenamiento, pero los valores aumentan el día 20 con valores máximos de (213,3 ± 32,9), (266,3 ± 10,4) y (321,2 ± 8,9) mg, ácido Gálico/L para 0,40; 0,60 y 0,80% p/p respectivamente. Entre los tratamientos 0,40 y 0,60% para el día 25 no hubo diferencias estadísticas significativas, sin embargo todos los tratamientos presentaron diferencias con el control (p<0,05).
Método ORAC
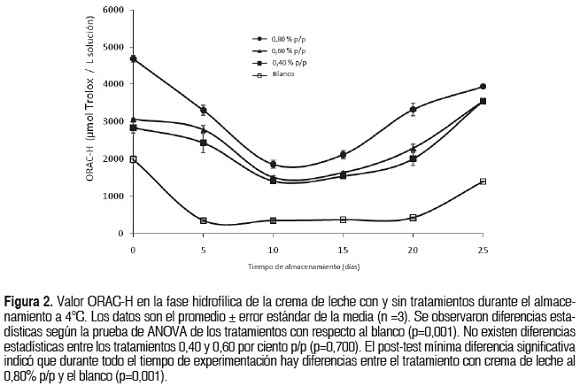
Los resultados para el ensayo ORAC-H se muestran en la figura 2. Los valores variaron entre 1396,5 y 1978,6 μmol Tx.L-1 para el blanco, 2825,7 y 3502,4 μmol Tx.L-1 para el tratamiento 0,40%, 3087,4 y 3591,4 μmol Tx.L-1 para el tratamiento 0,60% y 4681,7 y 3928,0 μmol Tx.L-1 para el tratamiento 0,80%. Existen diferencias estadísticamente significativas entre el blanco y los tratamientos en cuanto a su valor ORAC (p<0,05), mientras que los tratamientos 0,40 y 0,60% p/p no mostraron diferencia estadística (p>0,05). La capacidad antioxidante disminuye los primeros 15 días de almacenamiento. El tratamiento 0,80% exhibió el mejor potencial antioxidante seguido del tratamiento 0,60; 0,40 por ciento p/p y el blanco.
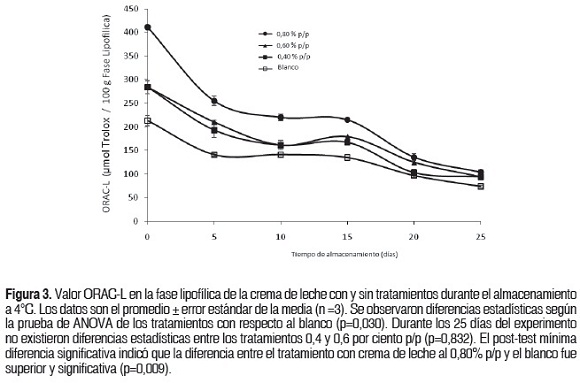
Los resultados para el ensayo ORAC-L en la fracción lipofílica se muestran en la figura 3. Los valores ORAC-L variaron entre 214,3 y 77,3 μmol Trolox / 100 g para el blanco, 252,3 y 92,1 μmol Trolox / 100 g para 0,40% p/p, 285,9 y 97,3 μmol Trolox / 100 g para 0,60% p/p y 411,3 y 104 μmol Trolox / 100 g para 0,80% p/p. Una disminución continua en los valores ORAC-L se observó en todos los tratamientos durante el tiempo de almacenamiento, presentando diferencias estadísticamente significativas (p<0,05). El tratamiento 0,80% p/p exhibió los valores más altos en todo el periodo de almacenamiento, con una diferencia significativa con respecto al blanco (p>0,05), mientras que los tratamientos 0,40 y 0,60% p/p no mostraron diferencias significativas (p<0,05).
Ensayo DPPH
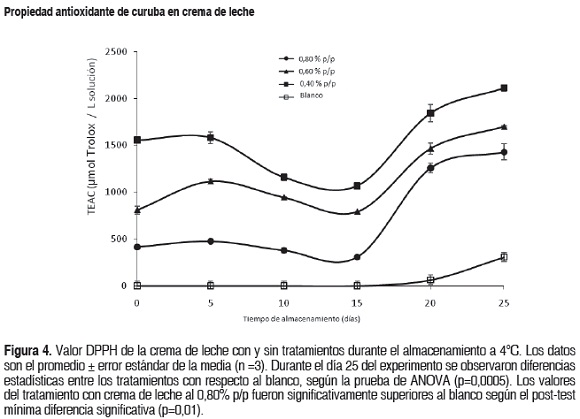
El efecto de los tratamientos sobre la capacidad atrapadora del radical DPPH se muestra en la figura 4. Todas las cremas de leche con adición de extracto de curuba presentaron mayor actividad antioxidante que el blanco durante todo el periodo de almacenamiento, con diferencias estadísticamente significativas (p<0,05), mostrando un efecto más intenso el tratamiento 0,80% p/p. Para los tratamientos se observó una disminución de la inhibición del DPPH los primeros 15 días de almacenamiento y posteriormente se presentó un incremento significativo entre los días 15 y 25 (p<0,05). El blanco no exhibió ningún efecto sobre la capacidad atrapadora del radical DPPH entre los días 0 y 20 (p>0,05), al final del tiempo de almacenamiento se observó un pequeño incremento en el valor TEAC.
Determinación del contenido de sustancias reactivas con el ácido 2-tiobarbitúrico (TBARS)
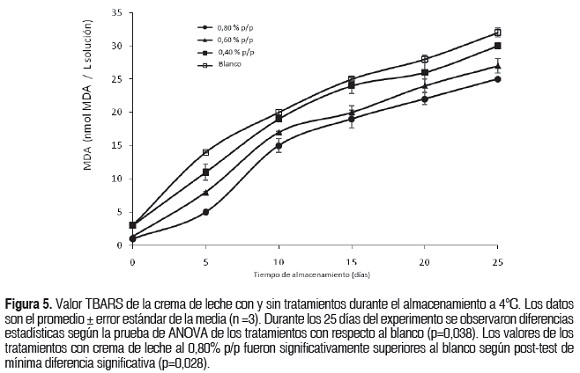
La figura 5 muestra el efecto de los diferentes tratamientos y el blanco sobre la formación de las sustancias reactivas con el ácido tiobarbitúrico (TBARS) en las cremas de leche durante el almacenamiento. Un incremento continuo del valor TBARS fue observado en todas las muestras. La muestra blanco alcanzó al final del almacenamiento el valor más alto de TBARS, seguido de las muestras suplementadas con 0,40; 0,60 y 0,80% p/p de extracto, respectivamente. Los tratamientos no mostraron diferencias estadísticamente significativas entre ellos (p>0,05).
Evaluación sensorial
La tabla 2 muestra los resultados para los tratamientos por medio del número de respuestas correctas y el valor-p con base en las tablas de Roessler y Watts (32) con un criterio de diferencias significativas p<0,05. El panel sensorial no fue capaz de discriminar entre el tratamiento 0,40% p/p y el blanco (p>0,05). Se observaron diferencias significativas en los tratamientos 0,60 y 0,80% p/p con respecto al blanco (p<0,05).
DISCUSIÓN
Los resultados obtenidos en el presente estudio fueron equiparables con investigaciones anteriores, la caracterización fisicoquímica arrojó resultados comparables con los reportados en la literatura, los valores de calcio fueron similares a los reportados por Olafur y colaboradores (33) y el contenido de fósforo estuvo ligeramente por debajo del valor reportado por los mismos autores. Esta información permite catalogar al producto final como una fuente importante de minerales, dado que la Organización Mundial de la Salud (OMS) recomienda una ingesta diaria de calcio y fósforo de aproximadamente 800 y 700 mg respectivamente. De la misma manera el contenido proteico está acorde con la información reportada por la literatura (34), generalmente las cremas presentan alrededor de 2% de proteína (34-35), estos resultados demuestran que este producto no es una buena fuente proteica, sin embargo constituye un ingrediente importante para otorgar propiedades texturizantes al producto terminado.
El contenido de cenizas está por debajo del valor reportado por algunas investigaciones Pachecho Delahaye (36) que obtuvieron valores de 0,97%. Todas las cremas de leche presentaron un porcentaje de grasa de 35%, valor mínimo permitido por la normativa colombiana (Resolución 2310 de 1986), además se verificó que la adición del extracto de curuba no afecta el contenido de grasa inicial de la crema. La acidez en las cremas suplementadas se da como resultado de la adición del extracto de fruta, se sabe que la curuba es fuente importante de taninos condensados que otorgan astringencia, y es fuente importante de ácido ascórbico de 61,5 mg/100 g de fruta fresca (17), ambos metabolitos no solo son responsables del sabor del producto sino que tienen comprobada acción antioxidante.
El comportamiento antioxidante durante el almacenamiento fue diverso. El CFT de las muestras con y sin tratamiento presentaron un declive y posterior aumento durante el almacenamiento, esto puede deberse a que una matriz alimenticia con ingredientes vegetales experimenta en los primeros días de almacenaje un alto consumo endógeno celular de metabolitos antioxidantes, como defensa a las especies reactivas celulares que se están generando producto del estrés ambiental, en ese punto se dice que el alimento está en su mínima capacidad antioxidante, sin embargo al transcurrir el tiempo y al aparecer la adaptación celular a las condiciones exteriores, se comienza a evidenciar un aumento en los niveles de compuestos polifenólicos y en consecuencia de la actividad antioxidante, se ha sabido por investigaciones anteriores que las alimentos con ingredientes vegetales que se almacenan durante periodos prolongados incrementan sus niveles de azúcares reductores a lo que se refieren como ''edulcorante en almacenamiento'', estos compuestos son utilizados como precursores para la síntesis de compuestos polifenólicos futuros (36). Otros autores afirman que un aumento en la actividad fenil alanina monoliasa, que se traduce en un incremento en la concentración de compuestos polifenólicos (37), junto con el bajo nivel de actividad polifenoloxidasa, pueden reducir la oxidación de sustratos fenólicos a quinonas, e influir en los altos niveles de estos compuestos durante el almacenamiento (38). Estas mismas explicaciones pueden ser utilizadas para concluir sobre el comportamiento de la capacidad antioxidante de las muestras durante el almacenamiento, valor DDPH y valor ORAC- μmolH. Se sabe que la capacidad antioxidante de una muestra está determinada por el contenido polifenólico de la misma, un CFT elevado generalmente se asocia con una mayor capacidad antioxidante (DPPH y ORAC-H). El coeficiente de correlación entre el valor ORAC-H y el CFT fue positivo y cercano a la unidad (r=0,85, p<0,05), y el coeficiente de correlación entre el valor DPPH el CFT fue de (r=0,96, p<0,05). La técnica DPPH mide el poder de los fenoles de neutralizar radicales libres por el método de transferencia electrónica (SET), además favorece la solubilización de metabolitos en medios orgánicos. El método ORAC, por su parte, evalúa la capacidad de los fenoles de neutralizar especies radicalarias por el método de transferencia de un átomo de hidrogeno (HAT), además favorece la solubilización de metabolitos en medios acuosos, es decir que ambas metodologías son necesarias para determinar el poder global antioxidante de una muestra. Los tratamientos presentaron mayor actividad antioxidante que el blanco, lo que es de esperarse debido al aporte de fitoquímicos del extracto de curuba. Zulueta y su equipo (39) determinaron la capacidad antioxidante de diferentes leches comerciales por el método ORAC y obtuvieron valores de 13606,0 µM equivalentes Trolox para leche entera UHT y 14124,0 µM equivalentes Trolox para leche entera pasteurizada. Estos valores difieren de los obtenidos para las cremas de leche porque estas últimas presentan un elevado contenido de fase grasa, en la cual se hallan importantes componentes antioxidantes, como las vitaminas A, E y el β-caroteno (39).
Una matriz con un elevado poder antioxidante presenta varias ventajas desde el punto de vista comercial y farmacológico, primero se constituye como un alimento funcional dado su aporte antioxidante, el cual ha sido ampliamente asociado con el mejoramiento de la salud del consumidor, y segundo puede retrasar los procesos oxidativos de un alimento y evitar alteraciones o el desarrollo de aromas y sabores desagradables, que son puntos clave en términos de calidad. Esta última premisa se verificó mediante el ensayo TBARS, que mide la cantidad de hidroperóxidos y aldehídos, tales como malondialdehido (MDA), indicadores de la peroxidación lipídica. Todas las muestras presentaron un comportamiento creciente del valor TBARS con el tiempo, indicando que la oxidación lipídica es un fenómeno inherente al almacenamiento de una emulsión, no obstante, el aumento de la cantidad de curuba suplementada implica una disminución del valor TBARS comparado con la muestra blanco. El mismo comportamiento fue observado por otros autores (40), quienes evaluaron la capacidad antioxidante del isoespintanol en mantequilla y reportaron una buena relación dosisrespuesta con el aumento de las concentraciones del isoespintanol. Aunque las muestras suplementadas con extracto de curuba presentaron menor producción de MDA en el tiempo, la metodología ORAC-L permite comprobar que a medida que se agotan los antioxidantes se produce el MDA.
Finalmente la evaluación sensorial permitió concluir que los panelistas son capaces de identificar el producto emergente y diferenciarlo del blanco siempre y cuando se usen cantidades del extracto superiores a 0,60% p/p. No solo es necesario mejorar las propiedades de estabilidad del producto sino también verificar el nivel de agrado del consumir frente al producto, esto si se tienen miras de mercado. El buen aroma y el sabor fueron algunas de las propiedades destacadas por los panelistas. Es necesario aclarar que la utilidad práctica de esta investigación es la elaboración de un producto tipo crema de leche saborizado, que no solo sea agradable sensorialmente al consumidor, sino que le otorgue bondades nutracéuticas, y que presente estabilidad oxidativa. Los resultados aquí obtenidos permiten concluir que el extracto de curuba podría ser un sustituto de antioxidantes sintéticos, o bien un ingrediente en la preparación industrial de ciertas alimentos. En ambos casos mejorará el poder endógeno antioxidante de la matriz y, en consecuencia, le ayudará al retroceso de sus fenómenos oxidativos y finalmente le otorga un valor nutracéutico importante.
En conclusión, la presencia del extracto de curuba en la crema de leche es beneficiosa, pues incrementa el poder antioxidante del producto final y retarda los procesos oxidativos de la fase lipídica de la emulsión, mejorando así no solo las propiedades organolépticas del producto sino nutracéuticas. Gracias al valor agregado del producto podría enmarcarse dentro de la definición de alimento funcional. Las concentraciones estudiadas del extracto de curuba fueron capaces de proteger la crema de leche contra la oxidación. El tratamiento 0,80% presentó significativamente mejor actividad antioxidante en los ensayos DPPH, ORAC y TBARS y el mayor contenido de fenoles totales durante el tiempo de almacenamiento. Además los panelistas percibieron diferencias en las cremas de leche que estuvieron bajo tratamiento de 0,60 y 0,80% p/p frente a la crema de leche sin tratar; por ello esta dosis es recomendada para el tratamiento del producto en cuestión.
AGRADECIMIENTOS
A la Dirección de Investigaciones de la Universidad Nacional de Colombia, sede Medellín.
REFERENCIAS
1. Nagao KT, Yanagita T. Conjugated fatty acids on food and their health benefits. J Biosci Bioeng. 2005;100:152-7. [ Links ]
2. Haug A, Hostmark AT, Harstad OM. Bovine milk in human nutrition-a review. Lipids Health Dis. 2007;6:25-41. [ Links ]
3. Calligaris S, Manzocco L. Nicoli MC. Effect of heat-treatment on the antioxidant and pro-oxidant activity of milk. Int Dairy J. 2004;14:421-7. [ Links ]
4. Lopez C. Milk fat globules enveloped by their biological membrane: Unique colloidal assemblies with a specific composition and structure. Curr Opin Colloid Interface Sci. 2011;16:391-404. [ Links ]
5. Bauman DE, Griinari JM. Regulation and nutritional manipulation of milk fat: low-fat milk syndrome. Livest Prod Sc. 2001;70:15-29. [ Links ]
6. Bandyopadhyay M, Chakraborty R, Raychaudhuri U. Antioxidant activity of natural plant sources in dairy dessert (Sandesh) under thermal treatment. LWT-Food Sci Tech. 2008;41:816-25. [ Links ]
7. O'Connor TP, O'Brien NM. Lipid oxidation. In: Fox PF. Advanced dairy chemistry. New York: Springer; 2005. vol 2., p.557-72. [ Links ]
8. Smet K, Raes K, De Block J, Herman L, Dewettinck K, Coudijzer K. A change in antioxidative capacity as a measure of onset to oxidation in pasteurized milk. Int Dairy J. 2008;18:520-30. [ Links ]
9. Wanasundara UN, Shahidi F. Antioxidant and pro-oxidant activity of green tea extracts in marine oils. Food Chem. 1998;63:342-55. [ Links ]
10. Barlow SM. Toxicological aspects of antioxidants used as food additives. In: Hudson BJF, ed. Food antioxidant. Amsterdam: Elsevier Science Publishing; 1990. p. 253-307. [ Links ]
11. Proestos C, Chorianopoulos N, Nychas GJE, Komaitis M. RP-HPLC analysis of the phenolic compounds of plant extracts investigation of their antioxidant capacity and antimicrobial activity. J Agr Food Chem. 2005;53:1190-5. [ Links ]
12. Hussain A, Anwar F, Sherazi STH, Przybylski R. Chemical composition, antioxidant and antimicrobial activities of basil (Ocimumbasilicum) essential oils depends on seasonal variations. Food Chem. 2008;108:986-95. [ Links ]
13. Miliauskas G, Mulder E, Linssen JP, Houben JH, van Beek TA, Venskutonis PR. Evaluation of antioxidative properties of Geranium macrorrhizum and Potentillafruticosa extracts in Dutch style fermented sausages. Meat Sci. 2007;77:703-8. [ Links ]
14. Ángulo-Carmona R. Frutales exóticos de clima frío. Bogotá: Bayer Crop Science SA; 2003. p. 120-31. [ Links ]
15. Contreras-Calderón J, Calderón-Jaimes L, Guerra-Hernández E, García-Villanova B. Antioxidant capacity, phenolic content and vitamin C in pulp, peel and seed from 24 exotic fruits from Colombia. Food Res Int. 2010;44:2047-53. [ Links ]
16. Vasco C, Ruales J, Kamal-Eldin A. Total phenolic compounds and antioxidant capacities of major fruits from Ecuador. Food Chem. 2008;111:816-23. [ Links ]
17. Zapata S, Piedrahita A, Rojano B. Capacidad atrapadora de radicales oxígeno (ORAC) y fenoles totales de frutas y hortalizas de Colombia. Perspect Nutr Humana. 2014;16(1):25-36. [ Links ]
18. Stefanov I, Vlaeminck B, Fievez V. A novel procedure for routine milk fat extraction based on dichloromethane. J Food Comp Anal. 2010;23:852-5. [ Links ]
19. Association of Official Analytical Chemists. Official methods of analysis. Basic calculations for chemical and biological analyses. Arlington, VA: AOAC; 1996. [ Links ]
20. Association of Official Analytical Chemists. Official methods of analysis of AOAC International.15° ed. Arlington, VA: AOAC; 1990. [ Links ]
21. Instituto Colombiano de Normas Técnicas y Certificación. Norma técnica colombiana 4657. Alimento para animales. Determinación del contenido de nitrógeno y cálculo del contenido de proteína cruda. Método Kjeldahl. Bogotá: Icontec; 1999. [ Links ]
22. Instituto Colombiano de Normas Técnicas y Certificación. Norma técnica colombiana 4657. Alimento para animales. Determinación del contenido de fósforo. Método Espectrofotométrico. Bogotá: Icontec; 2001. [ Links ]
23. Instituto Colombiano de Normas Técnicas y Certificación. Norma técnica colombiana 4657. Alimento para animales. Determinación de los contenidos de calcio, cobre, hierro, manganeso, potasio, sodio y zinc. Método usando espectrometría de absorción atómica. Bogotá: Icontec; 2003. [ Links ]
24. Borroto J. Contenido de carbohidratos asociados al crecimiento y desarrollo de cuatro variedades de caña de azúcar (Saccharumsp). Agron Costarr. 2003;27:91-100. [ Links ]
25. Rizzolo A, Brambilla A. Evaluation of sampling and extraction procedures for the analysis of ascorbic acid from pear fruit tissue. Food Chem. 2002;77:257-62. [ Links ]
26. Singleton VL, Rossi JA. Colorimetry of total phenolic with phosphomolybdic-phosphotungstic acid reagents. Am J Enol Viticult. 1999;16:144-58. [ Links ]
27. Brand-Williams W, Cuvelier ME, Berset C. Use of a free radical method to evaluate antioxidant activity. LWT-Food Sci Technol. 1995;28:25-30. [ Links ]
28. Ou B, Hampsch-Woodill M, Prior R. Development and validation of an improved oxygen radical absorbance capacity assay using fluorescein as the fluorescent probe. J Agr Food Chem. 2001;49:4619-26. [ Links ]
29. Wu X. Development of a data base for total antioxidant capacity in foods: a preliminary study. J Food Comp Anal. 2004;17:407-22. [ Links ]
30. Stern S, Potter T, Neun B. HEP G2 hepatocyte lipid peroxidation assay: NCL method, GTA-4 version 1.0. Frederick, MD: National Cancer Institute. Nanotechnology Characterization Laboratory; 2006. 9p. [ Links ]
31. British Standard ISO. Sensory analysis methodology triangle test: 4120:2004. 2 ed. London: ISO: 2004. 15p. [ Links ]
32. Roessler EB, Warren J, Guymon JF. Significance in triangular test. Food Res. 1948;13:503. [ Links ]
33. Olafur R. Minerals and trace elements in Icelandic dairy products and meat. J Food Compos Anal. 2011;24:980-6. [ Links ]
34. Pacheco de Delahaye E, Rojas A, Salinas N. Caracterización físico-química de cremas de leche. Fac Agron. 2008;25:303-17. [ Links ]
35. Salinas N, La-Rosa Y. Estudio sobre algunos cambios químicos y fisicoquímicos en un alimento de origen cárnico Caracas: C.I.T. Información Tecnológica; 1987. p.13. [ Links ]
36. Shabboo A, Salihin AB. Changes in yogurt fermentation characteristics, and antioxidant potential and in vitro inhibition of angiotensin-1 converting enzyme upon the inclusion of peppermint, dill and basil. LWT-Food Sci Technol. 2011;44:1458-64. [ Links ]
37. Shetty K, Randhir R, Shetty P. Functional foods and biotechnology: bioprocessing strategies to enhance L-DOPA and phenolic antioxidants in fava bean (Vicia faba). 2 ed. Boca Raton: Taylor & Francis Group/CRC Press; 2005. [ Links ]
38. Cantos E, Tudela JA, Gil MI, Espin JC. Phenolic compounds and related enzymes are not rate-limiting in browning development of fresh-cut potatoes. J Agric Food Chem. 2002;50:3015-23. [ Links ]
39. Zulueta A, Maurizi A, Frigola A, Esteve MJ, Coli R, Burin G. Antioxidant capacity of cow milk, whey and deproteinized milk. Int Dairy J. 2009;19:380-5. [ Links ]
40. Rojano B, Saez J, Schinella G, Quijano J, Vélez E, Gil A, et al Experimental and theoretical determination of the antioxidant properties of isoespintanol (2-Isopropyl-3,6-dimethoxy-5-me thylphenol). J Mol Struct. 2008;877:1-6. [ Links ]