INTRODUCCIÓN
La mayoría de las grasas están compuestas por triglicéridos, los cuales están conformados por ésteres de ácidos grasos y glicerol, de tal manera que los ácidos grasos representan gran parte de la composición de las grasas (1). Dentro de los grupos de ácidos grasos se encuentran los poliinsaturados (PUFAs), los cuales tienen efectos sobre la composición y función de las membranas celulares, la señalización celular, la regulación de la expresión genética y la síntesis de eicosanoides (2), cumpliendo así un papel fundamental en el adecuado desarrollo y funcionalidad del cerebro y del sistema nervioso central (3),(4); en este grupo se encuentran algunos ácidos grasos que no pueden ser sintetizados por el organismo y por lo cual son catalogados como esenciales, ya que se deben ingerir en la dieta en una determinada cantidad y proporción entre ellos (5); estos son el ácido linolénico (omega 3) y el ácido linoléico (omega 6), los cuales a su vez son precursores para la síntesis de los LC-PUFAs mediante diversos procesos enzimáticos, resultando el ácido docosahexahenoico (DHA) y el ácido eicosapentaenoico (EPA) como metabolitos específicos del ácido linolénico; y el ácido araquidónico (ARA) metabolito del ácido linoléico (6).
Los PUFAs en su conjunto tienen beneficios en la prevención de enfermedades cardiovasculares, cáncer de colon y enfermedades inmunológicas (7),(8). El papel protector de enfermedades se debe a que estos se incorporan en las membranas celulares, donde actúan como precursores de tromboxanos, leucotrienos, prostaglandinas y prostaciclinas (9), eicosanoides que tienen diferentes funciones según el PUFA del cual se deriven. Aquellos que provienen del ARA son potentes agentes proinflamatorios y mediadores del dolor, la fiebre y la permeabilidad vascular, mediante el estímulo de la liberación de citoquinas inflamatorias y el aumento de la actividad inmune (10). Por otro lado, los provenientes del EPA tienen también efectos vasoconstrictores y de agregación plaquetaria, pero son menos potentes que los derivados del ARA, siendo además catalogados como antiinflamatorios por una posible función antagónica (10),(11). También se han asociado a la disminución de triglicéridos y colesterol sanguíneo y de la presión arterial, protegiendo así la salud cardiovascular (12).
El DHA, por su parte, tiene efectos antiinflamatorios e inhibe la producción de citoquinas proinflamatorias, independiente de la producción de eicosanoides (11); se encuentra principalmente en el cerebro, retina y espermatozoides (13), cumpliendo un rol importante en la neurogénesis y sinaptogénesis en los primeros dos años de vida, asociándose con una mejor agudeza visual y habilidad cognitiva (7),(8); además, también se le atribuyen funciones neuroprotectoras en el envejecimiento cerebral, en enfermedades neurodegenerativas y en enfermedad cerebrovascular (14),(15).
Sin embargo, la transformación de ácido alfalinolénico (ALA) en DHA no es eficiente en el cuerpo humano, donde solo se metaboliza el 1 %, y el EPA entre un 0,2 a un 6 %, pues el organismo utiliza los PUFAs principalmente como fuente de energía (16),(14); razón por la cual se recomienda el consumo directo de EPA y DHA a partir de sus principales fuentes como son los peces grasos tipo atún, jurel, salmón, entre otros (9),(12).
Por lo anterior, es necesario reconocer qué especies de peces pueden aportar estos nutrientes en las cantidades adecuadas y recomendadas para la obtención de sus beneficios por parte de los individuos. Así, esta revisión tuvo como objetivo identificar el contenido de PUFAs y LC-PUFAs (EPA y DHA) de diferentes especies de peces y determinar si pueden ser consideradas fuente de estos ácidos grasos, mediante la recolección, revisión y selección de estudios realizados a nivel nacional e internacional acerca del perfil de ácidos grasos en estas especies.
MATERIALES Y MÉTODOS
La información reportada se obtuvo como resultado de la búsqueda en las bases de datos Pubmed, Lilacs, Scielo y Sience Direct, ingresando las palabras clave: peces, PUFAs, perfil de ácidos grasos, EPA. Para la selección de cada artículo se tuvo como criterios de inclusión aquellos en los cuales los peces evaluados fueran silvestres (no cultivados), teniendo como muestra filetes en crudo sin discriminar el hábitat (agua dulce o salda).
La clasificación de los peces como excelente o buena fuente de PUFAs se realizó bajo los requisitos establecidos por el Ministerio de Salud y Protección Social en la Resolución 333 de 2011 (17) para rotulado y etiquetado nutricional en Colombia, que declara un alimento como “alto” o “excelente fuente de” cuando “al menos un 45 % de los ácidos grasos presentes en el alimento proceden de grasas poliinsaturadas y las grasas poliinsaturadas aportan más del 20 % del valor energético del producto” (p. 19). (Tabla 1). Para los omega 3 (EPA y DHA) se declara “alto” o “excelente fuente de” cuando por 100 g de alimento y por 100 kcal del alimento hay al menos 0,6 g de ácido alfalinolénico, o al menos 80 mg de la suma de EPA y DHA; y es “fuente” o “buena fuente” cuando por 100 g y 100 kcal hay al menos 0,3 g de ácido alfalinolénico, o al menos 40 mg de la suma de EPA y DHA (Tabla 2).
Respecto al cumplimiento del segundo criterio para grasas poliinsaturadas (que aporten más del 20 % del valor calórico total [VCT] del producto), se tomó como referencia que 100 g de parte comestible de pescado suministran en promedio 160 calorías (18),(19).
Tabla 1 Contenido de grasa total, saturada, monoinsaturada y poliinsaturada, aporte calórico de las grasas poliinsaturadas y clasificación de la especie según el aporte de PUFAs en 100 g de parte comestible
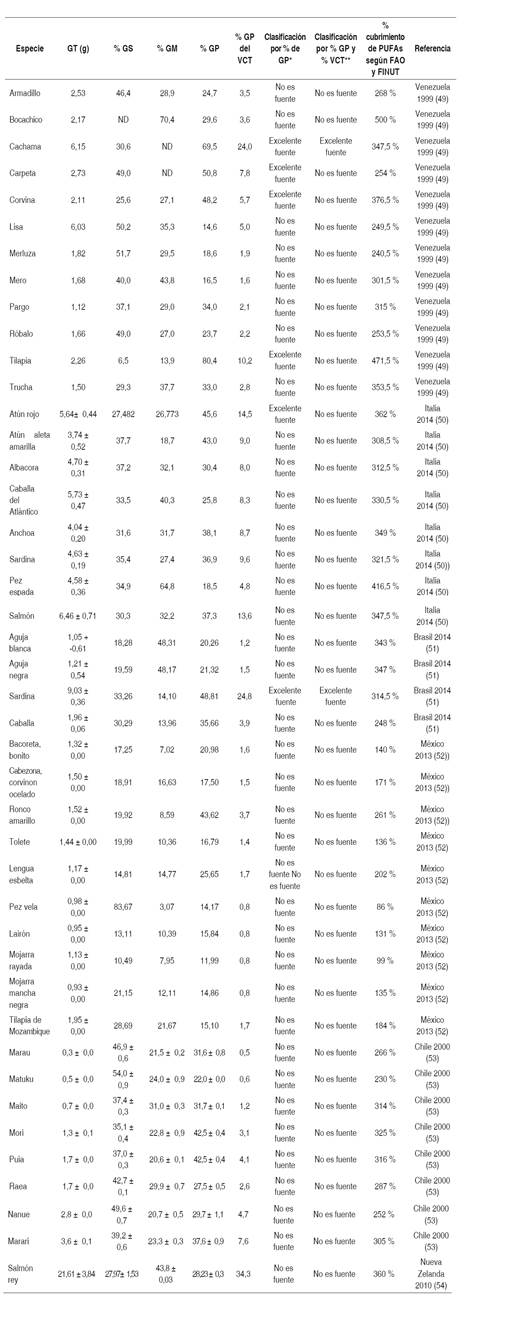
GT: grasa total, GS: grasa saturada, GM: grasa monoinsaturada, GP: grasa poliinsaturada. Los valores de GS, GM y GP son del total de grasa de la especie.
*Bajo el criterio de la Resolución 333/2011 del Ministerio de Salud y Protección Social “al menos un 45 % de los ácidos grasos presentes en el alimento proceden de grasas poliinsaturadas”.
**Bajo los dos criterios de la Resolución 333/2011 del Ministrio de Salud y Protección Social “al menos un 45 % de los ácidos grasos presentes en el alimento proceden de grasas poliinsaturadas y las grasas poliinsaturadas aportan más del 20 % del valor energético del producto”.
*** Los datos reportados en la tabla con ± corresponden a valores promedios ± desviación estándar.
Tabla 2 Contenido de EPA y DHA y la clasificación de la especie según el contenido de EPA+DHA en 100g de parte comestible
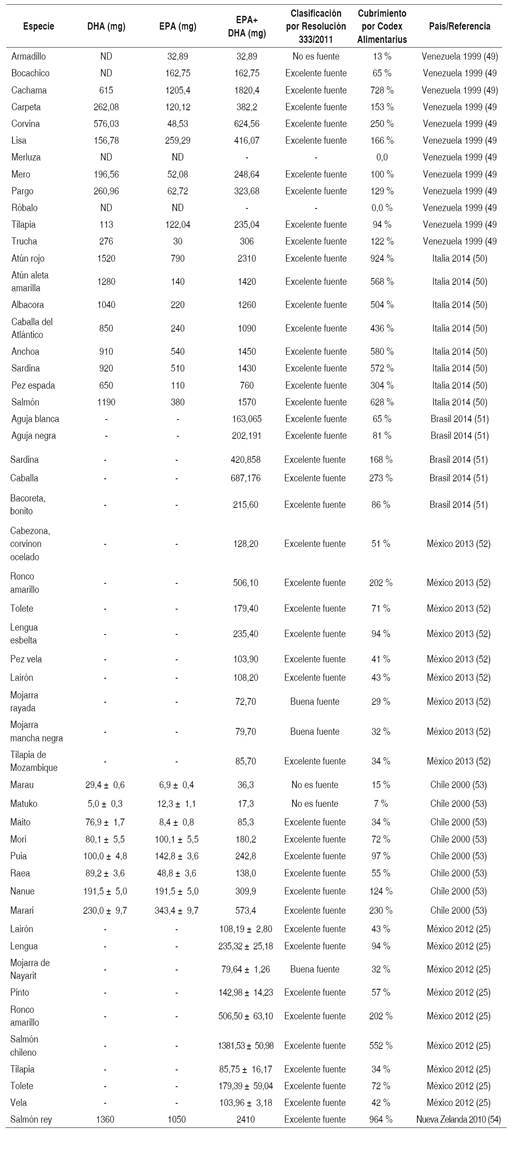
El cumplimiento de la recomendación de consumo de PUFAs según las cantidades recomendadas a nivel internacional se realizó con base en la consulta de expertos de la Organización de las Naciones Unidas para la Alimentación y la Agricultura (FAO) y de la Federación Iberoamericana de Nutrición (FINUT) en el 2012, que publicó como valor mínimo recomendado de ingesta de PUFAs el 6 % de la energía total/día para un individuo, con el fin de contribuir a la disminución del colesterol total y del colesterol de las Lipoproteína de Baja Densidad (LDL) e incrementar el colesterol de las Lipoproteína de Alta Densidad (HDL), este informe consideró además como consumo alto de PUFAs, con el cual puede producirse peroxidación lipídica, aquel superior al 11 % de la energía total/ día, especialmente cuando la ingesta de tocoferol es baja. Por tanto, el intervalo recomendable para los PUFAs es 6-11 % de la energía total/día para un individuo (20).
Para efectos de esta revisión se tomó un valor de 8 % de la energía total de una dieta con un aporte calórico de 2300 calorías/día (el promedio calórico para un individuo con peso saludable), es decir, el 8 % de 2300 calorías/día corresponde a 180 calorías, estas se deben dividir por 9, que es el equivalente calórico de 1 g de grasa, dando como resultado 20 g de grasa/día de PUFAS (Tabla 1).
Para identificar cuáles de las especies estudiadas podían cubrir por lo menos la tercera parte de la recomendación nutricional respecto a LC-PUFAs según normatividad internacional, se tomó la recomendación del Codex Alimentarius (21), el cual establece 0,250 g diarios de EPA+DHA (250 mg/día de ambos) para los varones adultos y las mujeres adultas no embarazadas ni lactantes, cantidad que parece ser suficiente para la prevención primaria de enfermedades cardiovasculares en sujetos sanos (Tabla 2).
Teniendo en cuenta las unidades de medida para establecer la clasificación: grasa poliinsaturada en % de la grasa total y EPA+DHA en miligramos por 100 g de pescado, se realizaron conversiones en aquellos artículos en los cuales el reporte de estos nutrientes estaban expresados en unidades diferentes.
Todos los aportes de ácidos grasos reportados en las tablas 1 y 2 están dados en 100 g de parte comestible de pescado.
RESULTADOS
El porcentaje de grasa saturada es mayor en el pez vela (83,67 %), el matuko (54,0 ± 0,9 %), la merluza (51,7 %) y la lisa (50,2 %); seguidos de especies como el armadillo, la carpeta, el róbalo, el marau y el nanue con valores entre el 45 y el 50 %. La tilapia (6,5 %), la mojarra rayada (10,49 %), el lairón (13,11 %) y la lengua esbelta (14,81 %) son las especies con menor contenido.
El pez espada, con un 64,8 % de grasa monoinsaturada, es la especie con mayor contenido, seguido de la aguja blanca (48,31 %), la aguja negra (48,17 %) y el salmón rey (43,8 %). Por el contrario, el pez vela, la bacoreta, la mojarra rayada y el ronco amarillo son aquellas especies con menor contenido, teniendo 3,07 %, 7,02 %, 7,95 % y 8,59 % respectivamente.
Con relación al contenido de PUFAS según la Resolución 333/2011 de Colombia bajo el criterio de que al menos un 45 % de los ácidos grasos presentes en el alimento proceden de grasas poliinsaturadas, como excelente fuente se encuentran la tilapia con un 80,4 %, la cachama con 69,5 %, la carpeta con 50,8 %, la sardina con un 48,8 %, la corvina con 48,2 % y por último el atún rojo con un 45,6 %.
Sin embargo, para el cumplimiento de los dos criterios de la normatividad nacional, solo se clasifican como excelente fuente la sardina por presentar el 48,8 % de PUFAs y aportar el 24,8 % del VCT desde estos, y la cachama por presentar el 69,5 % de PUFAs, y estos representan el 24,0 % del VCT.
La tabla 2 reporta la cantidad de EPA+DHA en 100 g parte comestible de pescado y su clasificación, en cada una de las especies, de las cuales la mayoría se clasificó como excelente fuente, según la Resolución 333/2011, siendo el atún rojo (2310 mg), la cachama (1820,4 mg), el salmón común (1570 mg), la anchoa (1450 mg), la sardina (1430 mg), el atún aleta amarilla (1420 mg), el salmón chileno (1381,5 mg), la albacora (1260 mg) y la caballa del Atlántico (1090 mg) las especies que reportaron mayor cantidad; tres especies se clasificaron como buena fuente: la mojarra mancha negra (79,7 mg), la mojarra de nayarit (79,6 mg) y la mojarra rayada (72,7 mg).
La cachama, el atún rojo y la sardina se clasificaron como excelente fuente según Resolución 333/2011 de PUFAs y fueron simultáneamente las especies con mayor cantidad de EPA y DHA superando los 1000 mg.
Con relación al contenido de PUFAs, la mayoría de los recursos pesqueros que reportan las investigaciones cubren más del 100 % de la recomendación de la FAO y la FINUT (asumida en este trabajo como al menos 8 % del valor calórico total) en una porción de 100 g de parte comestible, destacándose especies como el bocachico (500 %), la tilapia (471,5 %), el pez espada (416,5 %), la corvina (376,5 %), el atún rojo (362 %), el salmón rey (360 %) y la trucha (353,5 %). Solo dos especies no cubren el 100 % de lo recomendado, pero sí más del 75 %: el pez vela (86 %) y la mojarra rayada (99 %).
Respecto a la recomendación de omega 3 (EPA+DHA) según el Codex Alimentarius, la mayoría de las especies cubren más del 30 % de la recomendación internacional, destacándose especies que cubren más del 400 %: el salmón rey (964 %), el atún rojo (924 %), el bocachico (728 %), el salmón (628 %), la anchoa (580 %), la sardina (572 %), el atún aleta amarilla (568 %), el salmón chileno (552 %), la albacora (504 %) y la caballa del Atlántico (436 %); otras cubren entre el 50 y el 80 % de la recomendación diaria: la puia (97 %), la lengua (94 %), la tilapia (94 %), la aguja negra (81 %), el mori (72 %), el tolete (72 %), el bocachico (65 %), la aguja blanca (65 %), la raea (55 %), el pinto (57 %) y la bacoreta bonito (51 %); otras cubren entre el 30 y el 49 %: el lairon ( 43 %), la vela (42 %), el mozambique (34 %), la tilapia (34 %), el maito (34 %), la mojarra mancha negra (32 %), la mojarra de Nayarit (32 %); y se encontró que solo cuatro especies no alcanzan a cubrir el 30 %: el matuko (7 %), el pez armadillo (13 %), el marau (15 %) y la mojarra rayada (29 %).
DISCUSIÓN
El salmón es una de las especies marinas más reconocidas mundialmente por su aporte de ácidos grasos poliinsaturados, especialmente ácidos grasos poliinsaturados de cadena larga como el EPA y DHA (22), y es considerado el pez con mayor aporte de estos dos últimos. Chile es el primer exportador de esta especie, y tiene al salmón del Atlántico (Salmo salar) y al salmón del Pacífico o chileno (salmón coho) como las dos variedades más importantes (23),(24), las cuales tienen un contenido en EPA y DHA de 1570 mg y 1381,5 mg respectivamente (25).
No obstante, los resultados obtenidos en esta revisión (Tabla 1) evidencian que otros peces son también buena y excelente fuente de ácidos (PUFAs y LC-PUFAS) al superar el 45 % de contenido de PUFAs, y al aportar el 20 % o más de las calorías en forma de estos, además de cubrir hasta el 100 % y más de la recomendación diaria según el Codex Alimentarius.
Los peces que representan mayor fuente de PU-FAs de acuerdo con la Resolución 333 para Colombia son la tilapia, la cachama, la carpeta, la sardina, la corvina y el atún rojo al superar el 45 % de su grasa en forma de ácidos grasos poliinsaturados, sin embargo, esta normatividad no tiene como único requisito estos valores, pues para que un pez sea excelente o buena fuente de PUFAs, debe adicionalmente aportar el 20 % del VCT a partir de estos ácidos grasos, y en esta revisión solo dos especies cumplieron ambos requisitos: la cachama y la sardina, pues son las especies que mayor cantidad de grasa total contienen: 6,1 g y 9,0 g respectivamente, comparadas con la tilapia, que a pesar de tener un valor superior de 80,4 % de PUFAs solo contiene 2,2 g de grasa. Sin embargo, a pesar de no cumplir este requisito, sí cumple con la recomendación de la FAO y la FINUT según la cual todos los recursos que se incluyeron en esta revisión cubren entre un 100 % y un 500 % de los PUFAs y solo dos especies no cubren el 100 % pero sí más del 75 %.
Con relación a los LC-PUFAs, estas especies representan un muy buen aporte de estos ácidos grasos (entre el 30 % y 900 %) y solo cuatro no alcanzan a cubrir el 30 % de la recomendación internacional, por consiguiente, a nivel internacional es claro que el salmón no es el único recurso pesquero con buen aporte de estos ácidos grasos.
De igual forma, debe tenerse en cuenta que la cantidad de PUFAs contenidos en los peces no son reflejo de la calidad de sus ácidos grasos, es decir, el hecho de que una especie tenga un alto porcentaje de PUFAs no significa que sea proporcional al contenido de ácido linolénico y LC-PUFAS como el EPA y DHA; este es el caso de la tilapia, que en esta revisión fue la especie con mayor contenido de PUFAs (80,4 %) y menor contenido de ácidos grasos saturados (AGS) (6,5 %) pero en cuanto a EPA y DHA, a pesar de ser fuente de estos, su valor es menor (235,0 mg) con respecto a otras especies como el atún rojo, la cachama, la anchoa, el atún aleta amarilla, la sardina, la caballa del Atlántico, el salmón común y el chileno, los cuales presentaron valores superiores a 1000 mg. Además, en el caso de los PUFAs, la mayoría de las especies no fueron clasificadas como fuente de estos, pero al momento de hacer su clasificación de EPA y DHA son excelente fuente, a excepción del armadillo, el marau y el matuko que no son fuente de ninguno de los dos y que a su vez, el mayor porcentaje de su grasa total proviene de AGS, esta consideración es válida también al compararse con la normatividad del Codex, según la cual muchas especies cubren menos del 100 % de los LC-PUFAS; sin embargo, su aporte se puede clasificar como muy bueno, pues alcanzan a cubrir una tercera parte de la recomendación.
Adicionalmente, se identificó que la mayoría de los peces revisados según la Resolución 333 son excelente fuente de omega 3 (EPA y DHA) como el atún rojo, la cachama, el salmón común, la anchoa, la sardina, el atún aleta amarilla, la albacora, el salmón chileno y la caballa del Atlántico, los cuales tienen valores superiores a los 1000 mg, teniendo también como opción especies como la tilapia, la corvina, la trucha, el atún rojo, la aguja blanca, la aguja negra, la bacoreta, la lengua esbelta, el lairón, la tilapia de Mozambique y el salmón rey, las cuales a pesar de tener menos de 1000 mg siguen siendo una excelente fuente de omega 3 y aportan valores menores al 30 % de AGS, comparadas con las especies de más de 1000 mg que aportan entre el 30 y el 35 % de estos ácidos grasos.
Esta revisión permite diversificar las alternativas de consumo de peces con el objetivo de cumplir las recomendaciones del consumo de PUFAs de 2 g/día de ácido linolénico aportando un 0,5-2 % del valor calórico total y 250 mg/día de EPA y DHA (26),(20). Por otro lado, la American Heart Assosiation recomienda un consumo de diversos tipos de pescados al menos 2 veces por semana; en personas sanas y en aquellas diagnosticadas con enfermedad coronaria el consumo debe ser de aproximadamente 1 g/día de EPA+DHA preferiblemente a partir de pescados (27), lo cual coincide con la Japan Society for Lipid Nutrition que recomienda para la población japonesa en general el mismo consumo de EPA+DHA (28); en el caso de las mujeres en periodo de gestación, la OMS recomienda un consumo de 2,4 g de omega 3/día (20), bajo esta consideración y con la revisión realizada se puede decir que el consumo de una porción de 100 g de pescados como atún rojo, bocachico, anchoa, sardina, atún aleta amarilla, albacoca, caballa del Atlántico, entre otros descritos en la tabla 2, puede cubrir esta recomendación nutricional para personas con enfermedad coronaria y mujeres en periodo de gestación.
En las aguas colombianas habitan aproximadamente 2000 especies marinas y estuarinas, de las cuales el Caribe cuenta con 990 especies de peces y el Pacífico con 806; de estas 2000 especies, 449 especies de peces se consideran de importancia comercial actual o potencial. Referente a los peces dulceacuícolas, el país posee 1435 especies nativas, las cuales representan a nivel global el 5 % y en Latinoamérica el 29 % aproximadamente de todas las especies reconocidas actualmente (29).
Sin embargo, a pesar de tener esta gran variedad, según la Encuesta Nacional de Situación Nutricional (ENSIN) 2010, el 61,1 % de los colombianos consume pescado o mariscos una vez por mes y solo el 26,9 % los consume semanalmente (30), situación que puede fundamentarse en que el acceso al consumo de diversos alimentos depende de la capacidad adquisitiva de los mismos, y está condicionada por el perfil económico, demográfico y social de la población (31), un ejemplo de ello son las poblaciones costeras y ribereñas, las cuales, al tener un acceso bajo a carnes rojas y pollo, presentan un 90 % del consumo de proteína de origen animal a partir de pescado (29), indicando finalmente que de manera general la compra de peces está orientada a elegir aquellos de menor precio, de ahí la importancia de disponer de nuevas alternativas de consumo que brinden a la población los mismos beneficios nutricionales que aquellas especies importadas y con precios elevados, en un país en el que el 42,7 % de sus habitantes se encuentra en inseguridad alimentaria (30).
Esta situación no es muy diferente a nivel mundial, donde el consumo per cápita de pescado está en promedio en 3 kg por año (8 g/día) en los países con consumo bajo y 40 kg/año (111 g/día) en aquellos en los cuales el consumo es bueno (32); es adecuado aclarar que la ingesta baja de pescado es más representativa en la mayoría de países, lo cual está directamente relacionado con el consumo de PUFAs y LC-PUFAS, indicando que en general la población mundial también tiene una baja ingesta de estos nutrientes a partir de este alimento.
Se han adoptado otras opciones para el consumo de los LC-PUFAs, como el uso de productos encapsulados, que en general contienen entre 500 y 1000 mg de aceite de pescado cuyo aporte de EPA+DHA es en promedio de 250 a 300 mg dependiendo de la fuente de la que provengan (33). En muchos países los suplementos a base de omega 3, 6 y 9 vienen en un rápido crecimiento como una forma de impulsar la salud cardiovascular (34), un ejemplo claro es el de Estados Unidos, donde estos suplementos son los de más consumo común en la población adulta y los segundos más consumidos en los niños (35). Sin embargo, diversos estudios reportan que los LC-PUFAs consumidos de manera natural a través del pescado tienen una mejor disponibilidad, pues este ácido se comporta como un vehículo más eficiente (36).
Los aceites de pescado contenidos en las cápsulas de omega 3 están compuestos principalmente por triglicéridos, los cuales tienen como característica principal su condición apolar al contener mayor cantidad de ácidos grasos y por esta razón no pueden ser directamente incorporados en matrices principalmente acuosas, haciendo que su uso como vehículo de suplementación de LC-PUFAs sea muy limitado (37). También debe tenerse en cuenta la posibilidad de que algunos de los encapsulados que se encuentran en el mercado declaren una cantidad de EPA y DHA en su etiqueta que puede no coincidir con su contenido real, pues estos productos son susceptibles a la isomerización térmica y a la degradación oxidativa de sus ácidos grasos (38). Además, se ha encontrado en estudios experimentales con animales que su consumo en dosis farmacológicamente excesivas puede causar a la descendencia el albergue de patobiontes intestinales y alterar la homeostasis de las células inmunitarias, lo cual, sumado a una flora pobre en bacterias benéficas, podría desencadenar en el desarrollo de enfermedades crónicas como la diabetes, la obesidad y el síndrome metabólico (39).
En el estudio realizado por Harris et al. (40), se comparó el efecto del consumo de omega 3 a partir de pescado y en forma encapsulada, y se encontró un aumento significativo de EPA y DHA en eritrocitos y fosfolípidos plasmáticos después de 16 semanas, siendo más rápido el aumento en el grupo que consumió pescado; caso similar al encontrado por Visoli F. et al. (41), en el cual se evaluó el aumento de omega 3 en plasma en consumo de pescado comparado con el de cápsulas de aceite de pescado, y se concluyó que es más efectiva la incorporación de EPA y DHA en los lípidos de plasma cuando el omega 3 proviene de pescado que cuando es administrado en cápsulas. Adicionalmente, según los resultados de Rajiv Chowdhury et al. (42), la ingesta dietaria de LC- PUFAs se encuentra asociada con menor riesgo de enfermedad coronaria, mientras que sugieren que la suplementación de ácidos grasos omega 6 y 3 no producen una reducción estadísticamente significativa en el riesgo de las mismas, y a su vez reportan efectos limitados en la suplementación de estos ácidos grasos sobre la enfermedad en mención.
Por otro lado, en la investigación sistemática realizada por Yu Zhang et al. (43), la cual tuvo como objetivo determinar la asociación entre la ingesta de pescados y PUFAs y el riesgo de deterioro cognitivo leve o severo, se concluyó que los productos de la pesca se recomiendan como fuentes de estos nutrientes y estos se asocian con un menor riesgo de deterioro cognitivo, además el DHA derivado de peces se asoció con menor riesgo de demencia y Alzheimer, pero sin una relación dosis-respuesta.
Las Guías colombianas de cardiología afirman que los omega 3 provenientes de peces han mostrado su eficacia en la prevención primaria y reducción de problemas cardiovasculares, con asociación directamente proporcional al número de peces consumidos por semana y también en la mortalidad total coronaria y muerte súbita en la prevención secundaria; además, concluyen que en prevención primaria no hay suficiente evidencia científica que permita recomendar el uso de formas farmacéuticas de EPA y DHA y, en caso de hacerse, debe ser bajo supervisión médica (44).
Si bien es importante el consumo de omega 3 por todos los beneficios en salud anteriormente mencionados, debe tenerse en cuenta la importancia de una relación adecuada entre este y el omega 6, la cual debe ser menor de 10:1 (omega 6/omega 3), pues en niveles superiores puede traer consecuencias negativas (45), entre ellas el riesgo de obesidad mediante mecanismos de adipogénesis e inflamación sistémica, pues los metabolitos del ácido araquidónico juegan roles importantes en la maduración de los adipocitos (46). Este hallazgo es una razón más para incentivar el consumo de pescado, pues generalmente la relación de consumo de los omegas está por encima de lo recomendado (47), lo cual puede ser un riesgo, pues la población mundial ente los 18 y 64 años cada vez presenta mayor prevalencia de obesidad y sobrepeso (30). De esta manera, al consumir pescado se reduce el riesgo de obesidad y consecuentemente el padecimiento de enfermedades cardiovasculares asociadas a la misma.
CONCLUSIONES
La tendencia mundial a la producción y consumo de peces propende a aumentar sustancialmente (48); peces como el atún rojo, la anchoa, la sardina, el atún aleta amarilla, la albacora, la caballa del Atlántico, la tilapia, la cachama, la carpeta y la corvina son fuente de PUFAs y omega 3, según lo hallado en esta revisión, lo que los constituye en nuevas alternativas de consumo de estos nutrientes, contribuyendo al cubrimiento de las necesida- des de los individuos en las comunidades.
Se recomienda realizar estudios acerca del perfil de ácidos grasos de los peces característicos de las regiones, de manera que se puedan dar indicaciones de consumo según las especies propias de cada país.














