INTRODUCCIÓN
El pino piñonero (Pinus pinea L.) es una conífera nativa de las áreas costeras del Mediterráneo, que en la actualidad se cultiva en Asia, Australia, Medio Oriente y en Sudamérica, incluyendo Argentina y Chile (1). El piñón de pino es el fruto seco más caro del mundo, muy preciado por sus características organolépticas y nutricionales. Es un alimento de alta densidad energética (DE) que contiene sobre 30 g de grasa/100 g, en su mayor parte de tipo insaturada (2,3). En ratas, el aceite obtenido de algunos piñones de Pinus tiene un potencial reductor de lípidos sanguíneos (4,5), y en ratones disminuye el incremento ponderal pese a la alta ingesta calórica derivada de su consumo (6,7). Como es el caso para la mayoría de los frutos secos, en humanos el consumo regular de piñones de pino puede mejorar el perfil de lípidos sanguíneos (8), no aumenta el Índice de Masa Corporal (IMC) (9-11) y se asocia en forma inversa con la prevalencia de obesidad, con el síndrome metabólico y con la diabetes en individuos con alto riesgo cardiovascular (12). La evidencia de un efecto cardioprotector de los frutos secos ha sido reconocida por la FDA (Food and Drug Administration) de los Estados Unidos, la cual estableció la declaración de propiedad saludable que relaciona el consumo de frutos secos con la reducción del riesgo de enfermedad cardíaca (13). Los componentes cardioprotectores liposolubles del piñón incluyen ácidos grasos insaturados, fitoesteroles, tocoferoles, escualeno, entre otros compuestos bioactivos (2,3,14,15). El objetivo del presente estudio fue evaluar el efecto del consumo de piñón de pino en la ganancia de peso corporal y de órganos de ratas con dieta alta en grasas.
MATERIALES Y MÉTODOS
Animales y dietas
Ratas macho Sprague Dawley de 11 semanas de edad fueron adquiridas en el Bioterio de la Universidad de Valparaíso (Valparaíso, Chile). Los animales se alojaron en condiciones estandarizadas de laboratorio: temperatura 22±2 °C, humedad 55±10 %, ciclos de luz y oscuridad cada 12 h, alimento y agua ad libitum. Las ratas se distribuyeron en jaulas individuales de acero inoxidable y se dividieron aleatoriamente en tres grupos. El número de animales por grupo se definió teniendo en cuenta que la experimentación a través de estos modelos exige reducir al mínimo posible los animales a sacrificar, según el principio de las “tres R”: reducir, reemplazar, refinar (16), por lo que alcanzó a n=8 por grupo. Los animales tuvieron libre acceso a las diferentes dietas en polvo. Al comienzo del tratamiento dietético, el peso de las ratas fue 285,6±14,2 g. Las dietas se elaboraron sobre la base de las fórmulas estándares semipurificadas AIN-93 para ratas adultas, modificadas de acuerdo con el diseño experimental. Las fórmulas base se compraron en la empresa Research Diets® (New Brunswick, NJ, EE. UU.). Para evitar su oxidación, los piñones de pino cultivados en Chile se molieron semanalmente en un molino analítico (IKA® A11 basic). Las dietas se almacenaron en condiciones de oscuridad, ambiente seco, a 20 °C.
Luego de tres días de aclimatación a las condiciones experimentales, las ratas se alimentaron durante 28 días con una dieta control (C), cuya DE era 3,8 kcal/g, la que contenía 11,8 % kcal en forma de aceite de soya; con una dieta alta en grasa (AG) con una densidad calórica de 4,6 kcal/g, y 42,4 % kcal de aceite de soya como única fuente de grasa; y con una dieta alta en grasa con piñones de pino (AGP), con una DE igual a la dieta AG, de 4,6 kcal/g, con 42,4 kcal derivadas de aceite de soya y el aceite contenido en la incorporación de un 2 % de harina de piñones de pino. Ambas dietas altas en grasa contenían un porcentaje de calorías derivadas de grasas (G %) de 42,4 %. El piñón de pino cultivado en Chile contenía 340,9 g/kg de proteínas y 442,5 g/kg de grasa (3). La composición química de las dietas se presenta en la Tabla 1.
Tabla 1 Composición química de las dietas experimentales (g/kg)
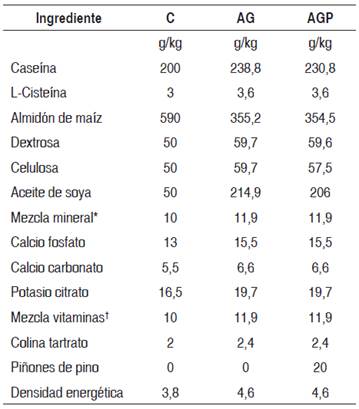
C: control; AG: alta en grasa; AGP: alta en grasa + piñones.
*Por kg: 500 g CaHPO4; 220 g C6H5K3O7·H2O; 74 g NaCl; 52 g K2SO4; 24 g MgO; 3,5 g Mn (48 %); 6,0 g Fe (17 %); 1,6 g Zn (70 %); 0,3 g Cu (53 %); 0,01 g KIO3; 0,55 g CrK(SO4)2·12H2O; 118 g sacarosa.
†Por kg: 600 mg tiamina HCl; 600 mg riboflavina; 700 mg piridoxina·HCl; 1,6 g vit B5; 3 g ácido nicotínico; 0,2 g ácido fólico; 1 g cianocobalamina (1 %); 2 g biotina (1 %); 80 mg menadiona (63 %); 5000 UI vitamina E; 100 000 UI vitamina D3; 400 000 UI vitamina A; 978 g sacarosa.
Para prevenir la oxidación del aceite contenido en las semillas de piñón de pino, la dieta AGP se preparó semanalmente, mezclando 4 g de harina de piñón con 369 g de los demás ingredientes de la dieta por 10 min a 58 rpm en una mezcladora (Kitchen Aid ARTISAN®). Todas las dietas experimentales contenían un porcentaje de calorías derivadas de proteínas (P %) de 21,2 %.
La ganancia de peso de los animales se registró semanalmente en balanza para animales (Shimadzu® AUX 220) y su consumo de alimento se controló a diario por diferencia de peso de cada comedero en balanza granataria (Sartorius® TE 6100). La eficiencia de la dieta se calculó como el porcentaje de peso corporal ganado en relación con la cantidad de alimento consumido durante el período experimental. El peso de órganos y grasa corporal se registró en una balanza analítica (Mettler Toledo® ML204).
Diseño experimental
Luego de 28 días de tratamiento dietético, los animales se pesaron tras un ayuno de 8-10 horas y se sacrificaron por dislocación cervical. Cada animal fue abierto en canal, se obtuvo y se pesó su panículo de grasa mesentérica, retroperitoneal, inguinal y de epidídimo. Asimismo, se extrajeron y se pesaron el hígado, los riñones y el corazón.
Análisis estadístico
Los valores se expresan como promedio ± error estándar de la media y se analizaron usando ANOVA de una vía seguida de la prueba de Tukey, para comparar medias de grupos. Se consideró significativo un valor de p<0,05.
Consideraciones éticas
Todos los procedimientos de manejo de los animales fueron aprobados por el Comité de Bioética de la Facultad de Farmacia, Universidad de Valparaíso, con fecha 28 de enero de 2014, cumpliendo con la Ley 20.380, vigente en Chile (17).
RESULTADOS
La ingesta de dieta, el cambio de peso corporal y la eficiencia de la dieta se muestran en la Tabla 2. El consumo de las dietas experimentales por 28 días tuvo un rango de 467,4 a 596,7 g para C; 457,3 a 527,1 g para AG, y 439,6 a 529,3 g para AGP. La ingestión de las dietas AG y AGP fue semejante, en tanto que el consumo de C fue más alto (p<0,05).
Tabla 2 Consumo de alimento y peso corporal y relativo de órganos y tejido graso de ratas según dieta experimental
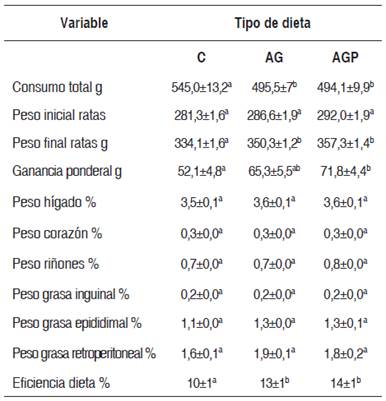
C: control; AG: alta en grasa; AGP: alta en grasa + piñones.
Valores presentados como promedio ± error estándar de la media. n=8.
Distintos superíndices indican diferencias significativas.
Las ratas que consumieron dieta AGP mostraron mayor incremento ponderal comparadas con C (p<0,05). Durante los 28 días, el grupo C aumentó 52,1±4,8 g, y los animales de los grupos con las dietas AG y AGP aumentaron 65,3±5,5 y 71,8±4,4 g. En consecuencia, el aumento de peso en los animales con AG fue 1,3 y 1,4 veces lo observado en el grupo C, respectivamente. El peso corporal final fue similar entre los grupos AG y AGP, mayor al observado en C (p<0,05). Como resultado, la eficiencia media de las dietas AG y AGP fue 13±2 % y 14±5 %, respectivamente, valores más altos que los observados en el grupo C, que alcanzó 9,6±1 % (p<0,05). El peso relativo del hígado, del corazón y de los riñones, así como el peso relativo de la grasa inguinal, epididimal y retroperitoneal, fue similar en las ratas de todos los grupos experimentales.
DISCUSIÓN
En este trabajo se estudió el efecto generado por la ingestión de dos dietas isocalóricas altas en grasa, una de las cuales fue adicionada con piñón de pino, comparándolas con el efecto de una dieta control, con el objetivo de obtener información sobre los efectos del consumo de este fruto seco en la ganancia de peso corporal y peso relativo de órganos y tejido graso en ratas macho adultos jóvenes. Todas las dietas experimentales contenían aceite de soya como fuente lipídica. En la dieta AGP se incorporó un 2 % de piñón de pino, ajustando la formulación para que las dietas AG y AGP presentaran la misma DE y P %. La cantidad de piñones de pino adicionada representaría aproximadamente un consumo de 10 g/día de este fruto seco en una dieta de 2000 kcal/día, es decir, alrededor de un tercio de la recomendación de consumo humano (18,19).
La ingesta de alimento fue más baja en ambas dietas altas en grasa en relación con la dieta control, a lo que puede deberse su aporte energético diferente. El grupo C consumió en promedio 19,5 g de alimento diario, equivalente a 74 kcal, en tanto que la ingesta en los grupos alimentados con dieta alta en grasa (AG y AGP) fue en promedio de 17,7 g/día, equivalente a 80 kcal, similar en ambas, lo que también fue observado por Marques et al. (20) en modelos similares. El consumo observado de ambas dietas altas en grasa refleja que la incorporación de 2 % de piñón de pino en la formulación no afectó la ingesta dietética. Amr et al. (21) incorporaron niveles de 5, 10 y 15 % de piñón de pino en la dieta experimental de animales que fueron alimentados por un período de seis semanas, y concluyeron que a mayor consumo de este fruto seco, los animales ingerían una menor cantidad de alimento. Estos autores aluden a un posible efecto del consumo de piñones de pino sobre la saciedad, derivado en gran medida de la necesidad de mayor masticación (22); sin embargo, en el presente estudio se descarta esta posibilidad, ya que estos se incorporaron en la dieta entregada en forma de polvo, como harina. La eficiencia de la dieta C mostró un rango de 6 a 13 % en los animales del grupo, mientras en la dieta AG fue de 10 a 19 % y en la dieta AGP fue de 12 a 18 %. En promedio, la eficiencia de las dos dietas altas en grasa fue similar y superior a C (p<0,05).
La acumulación de grasa en los tejidos metabólicamente activos, incluyendo la esteatosis hepática, contribuye al desarrollo del síndrome metabólico (23-26). En general, el consumo excesivo de dietas que contienen grasas saturadas lleva a que los lípidos que no se oxidan se depositan en forma de grasa corporal, incrementando el peso, en un efecto claramente obesogénico en ratas (27). De hecho, en numerosos estudios realizados previamente en roedores con dieta alta en grasa, mantenida por largos períodos de tiempo: 13 semanas (28), 15 semanas (29), 18 semanas (30), entre otros, se generó incremento ponderal y de tejido graso (31). En el modelo utilizado en este trabajo, la dieta se diseñó con grasas de buena calidad nutricional (aceite de soya), en las que predominan los ácidos grasos insaturados, y en una de ellas se agregó piñón de pino, que además contiene compuestos bioactivos liposolubles, tales como los fitoesteroles y tocoferoles, que pueden contribuir a producir un efecto saludable (3).
Si bien se podría haber esperado un efecto diferencial entre el incremento ponderal y de peso de órganos y panículo adiposo de los grupos con dieta AG y AGP, debido a la presencia de piñones de pino, este efecto no fue observado. Este resultado se puede atribuir a que la incorporación de harina de piñón en la dieta AGP se hizo a un nivel muy bajo (20 g/kg), sumado a que la administración de la dieta se realizó durante un corto período de tiempo (28 días). Estas condiciones se escogieron para hacer un estudio lo más cercano a la situación de un consumo ocasional de frutos secos en los humanos, sin forzar el modelo experimental a condiciones extremas, tales como una ingesta más elevada de piñones en la dieta diaria y un período de alimentación más prolongado, que no reflejan escenarios reales. Los resultados muestran claramente que, en las condiciones empleadas en el estudio, el consumo de piñón de pino no ejerció un efecto observable sobre los parámetros estudiados.
En conclusión, el consumo durante 28 días de las dietas experimentales altas en grasa (G % = 42,4) ocasionó un aumento de la ganancia ponderal en comparación con una dieta C normograsa (G % = 11,8) en las ratas. La presencia de 2 % de piñón de pino en la dieta AGP no indujo una disminución de la ganancia ponderal, el peso relativo de órganos, ni los depósitos de grasa en comparación con la dieta AG.














