INTRODUCCIÓN
El nuevo coronavirus, SARS-CoV-2 (síndrome respiratorio agudo severo coronavirus 2), responsable de la actual pandemia COVID-19 (1), ha tenido, hasta el 10 agosto del 2021, una repercusión de 203 295 170 casos y 4 303 515 muertes confirmadas (2), que constituyen un grave problema de salud pública. El SARS-CoV-2 es un virus de ácido ribonucleico (ARN), que pertenece a la familia Coronaviridae y es parte del grupo de los betacoronavirus (3). En años previos a esta pandemia, ocurrieron dos epidemias causadas por otros betacoronavirus: coronavirus del síndrome respiratorio agudo severo (SARS-CoV) y coronavirus del síndrome respiratorio del Medio Oriente (MERS-CoV) (4). El SARS-CoV-2 es similar a estos dos últimos virus, lo cual se sustenta en su proximidad genética.
Las estrategias terapéuticas para combatir la enfermedad COVID-19 se pueden dirigir a dos objetivos: al virus directamente y a las células del huésped. Sobre el SARS-CoV-2, las dianas serían la proteína de espiga(S), la proteasa similar a 3-quimotripsina (3Clpro), la proteasa similar a papaína (PL pro) y la ARN polimerasa dependiente de ARN(RdRp) (5). Sobre el huésped, específicamente sobre los receptores celulares, las dianas serían la enzima convertidora de angiotensina humana 2(ACE2) (6) y la proteína de choque térmico A5(HSPA5) (7), entre otros receptores en estudio. El sistema inmune sería otra diana del huésped, ya que se conoce que en la patogénesis de esta enfermedad se presenta una disfunción inmune, mediada por la liberación de citocinas y quimiocinas inflamatorias al torrente sanguíneo, reacción conocida como “tormenta de citoquinas”. Además, se ha reportado con frecuencia linfopenia (6). Este escenario crea la necesidad de investigar estrategias terapéuticas inmunomoduladoras.
A pesar de los grandes esfuerzos para manejar esta enfermedad, aún no hay terapias antivirales establecidas para los coronavirus (8). En este contexto, se justifica recurrir a diversas líneas de investigación, es el caso de los estudios de los compuestos bioactivos de los alimentos como fuente de moléculas con potencial efecto sobre la salud humana; en esta área de estudio el término más conocido es alimento funcional, el cual fue usado por primera vez en Japón para denominar a los alimentos que contienen ingredientes con funciones para la salud humana (9). Se ha reportado que algunos alimentos tienen efecto antiviral e inmunomodulador. Un precedente importante fue el descubrimiento del ácido shikímico en una especia de cocina, el Illicium verum (anís estrellado), compuesto que sirvió de base para el desarrollo del antiviral oseltamivir fosfato (10).
En medio de esta crisis global por COVID-19, el análisis del conocimiento de los principios bioactivos de los alimentos con propiedades antivirales e inmunomoduladoras es importante porque sería el primer paso para desarrollar nuevas líneas de investigación con compuestos activos como un potencial recurso de nuevos fármacos, lo que también ayudaría a verificar su uso en la prevención de esta enfermedad. Por tal motivo, el objetivo de la presente revisión fue reportar alimentos de uso común y sus componentes bioactivos con potenciales efectos antivirales e inmunológicos. Por lo tanto, se resume la información de los alimentos y su mecanismo de acción con base en artículos publicados que involucran información sobre coronavirus.
MATERIALES Y MÉTODOS
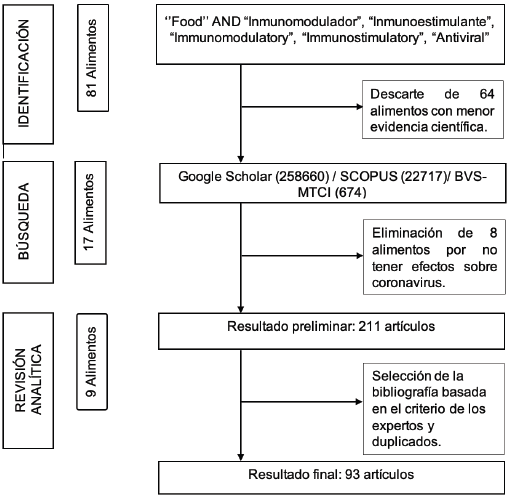
Se realizó una primera búsqueda en Google Scholar, Scopus y en la Biblioteca Virtual de Salud en Bases de datos de Medicina Tradicional, Complementaria e Integrativa (BVS-MTCI), otras bases de datos fueron excluidas por temas de tiempo y accesibilidad. Se cruzó el descriptor MESH food y los términos immunomodulatory, immunostimulatory y antiviral utilizando el operador booleano “AND” para cada uno de los cruces, tanto en español como en inglés. La búsqueda de artículos se realizó sin exclusión de año de publicación durante los meses de abril y mayo del 2020; se obtuvieron 290 artículos y se identificaron 81 alimentos con dichos efectos. Posteriormente, se seleccionaron los 17 alimentos con mayor evidencia científica.
En la segunda búsqueda, se cruzó el nombre científico, el nombre común y los descriptores immunomodulatory, immunostimulatory y antiviral utilizando el operador booleano “AND”, tanto en español como en inglés, con un resultado de 282 051 artículos científicos. En una tercera búsqueda, se cruzó el nombre científico, el nombre común y el descriptor MESH coronavirus; se obtuvieron nueve alimentos.
Se realizó una cuarta búsqueda para cada alimento seleccionado, cruzando el nombre científico, el nombre común y las variables immunomodulatory, immunostimulatory y antiviral, utilizando el operador booleano “AND” para cada uno de los cruces ya mencionados, tanto en español como en inglés. El resultado fue de 211 artículos, de los cuales se priorizó la selección de artículos origina-les y ensayos clínicos, mediante el criterio de los expertos. Se incluyeron revisiones narrativas con el fin de extraer información sobre las propiedades de los alimentos, su estructura y composición bio-química. Estas no aportan evidencia original para sustentar algún efecto farmacológico. El resultado final fue de 93 artículos. El proceso de selección de los artículos se muestra en la Figura 1.
RESULTADOS Y DISCUSIÓN
Efecto potencial inmunológico y antiviral
En la búsqueda realizada se encontraron nueve alimentos con potencial efecto inmunomodulador, inmunoestimulante y antiviral en coronavirus, que se describen en la Tabla 1.
Tabla 1 Actividad antiviral potencial sobre coronavirus y efecto inmunomodulador por compuestos bioactivos de alimentos

* ROC: Red orange complex, mezcla de jugo de naranja con altos niveles de antocianinas, flavanonas, ácidos hidroxicinámicos y ácido ascór- bico. † IBV: virus de la bronquitis infecciosa, un coronavirus tipo gamma que produce patogenia en aves. ‡ HCoVNL63: coronavirus humano VNL63, un coronavirus de tipo alfa que ocasiona enfermedad del tracto respiratorio alto y bajo (bronquiolitis, y neumonía). ACE2: enzima convertidora de angiotensina-2; PDB6LU7: proteasa principal de SARS-CoV-2; iNOS: óxido nítrico sintasa inducible; NO: óxido nítrico; TNF-α: factor de necrosis tumoral alfa; NF-kB: factor nuclear potenciador de las cadenas ligeras kappa de células B activadas; DADS: disulfuro de dialilo; ERK2/MAPK: extracellular signal regulated kinases-2/mitogen-activated protein kinases; IL: interleukina; DAS: dialil disulfuro; CTX, ciclofosfamida; COX-2: ciclooxigenasa-2; CRP: proteína C reactiva; TLR: receptor de tipo toll; ROC: Red orange complex; ICAM-1: molécula de adhesión intercelular-1; MCP-1: proteína quimiotáctica de monocitos-1; IFN-γ: interferón gamma; 3Clpro: proteasa similar a 3-quimotripsina; PLpro: proteasa similar a papaína; IFN-β: interferón-beta; PBMC: célula mononuclear de sangre periférica; HSPA5: miembro de la familia A de proteínas de choque térmico 5; TTP: proteína tristetraprolina; TGF-β: factor de crecimiento transformante beta; PGE-2: prostaglandina-E2; PPAR-γ: receptor gamma activado por proliferador de peroxisoma; GSPE: extracto de proantocianidina de semilla de uva; RSV: virus sincitial respiratorio; RdRp: ARN-polimerasa dependiente de ARN; AP1: proteína activadora-1; MPRO protease: proteasa MPRO; LPS: lipopolisacárido; MHV-A59: coronavirus murino “virus de la hepatitis de ratón-A59”; CCL26: ligando 26 de quimiocina con motivo C-C o citocina CCL26; C3XCR1: receptor 1 de quimiocinas con motivo C-X3-C1.
Allium sativum L.
Comúnmente llamado ajo, pertenece a la familia Amaryllidaceae, originaria de Asia, actualmente con una distribución cosmopolita. La parte de la planta que se utiliza es el bulbo, que tiene gran cantidad de compuestos organosulfurados como aliína, alicina, ajoeno, disulfuro de dialilo (DADS), entre otros. En el bulbo fresco e intacto, el componente principal es aliína, pero cuando se tritura, la aliína se transforma en alicina, el compuesto sulfurado más bioactivo (11). DADS es otro com-ponente importante responsable de los efectos biológicos (12). Además, se ha reportado la presencia de antocianinas (AT) y flavonoles como kaempferol, miricetina y quercetina (13).
En los últimos años, se ha realizado una amplia variedad de estudios con moléculas aisladas. La alicina ha demostrado efectos inmunomoduladores en macrófagos infectados con Mycobacterium tuberculosis, como la estimulación de la respuesta protectora Th1 en modelos murinos (14). Los fructanos (14-17 % en composición fresca), que se encuentran principalmente en el bulbo, son capa-ces de aumentar la actividad inmune a través de la proliferación de esplenocitos murinos, macrófagos peritoneales y actividad fagocítica in vitro (15).
El DADS también demostró un efecto inmunoestimulante con la expresión de MUC5B, proteína regulada por la vía de señalización Extracellular signal-regulated kinases/Mitogen-activated protein kinases (ERK 2/MAPK) de las células del epitelio respiratorio humano e involucrada en la protección y lubricación de la superficie del tracto respiratorio (12). Las lectinas presentes en el ajo también reportaron efectos mitógenos sobre linfocitos, basófilos y mastocitos (16). Una revisión de los componentes del género Allium muestra que la alicina reduce la expresión de la óxido nítrico sintasa inducible y la acumulación de óxido nítrico (NO), también reduce los niveles de factor de necrosis tumoral alfa (TNF-α), factor nuclear potenciador de cadena ligera kappa de células B activadas (NF-kB), Interleukina-1 (IL-1) e IL-6; mientras que el ajoeno, un metabolito de la alicina, inhibe la producción de NO y prostaglandina E2 (PGE-2), así como la expresión de citocinas proinflamatorias; otro efecto del DADS consiste en disminuir los niveles de TNF-α y otras interleucinas (17).
Una gran cantidad de virus son sensibles al extracto de ajo. Los efectos antivirales de los componentes de un extracto se evaluaron en virus ADN como el virus del herpes simple tipo 1, el virus del herpes simple tipo 2 y el virus vaccinia, y en virus ARN como el virus de la parainfluenza tipo 3, el virus de la estomatitis vesicular y el rinovirus tipo 2. El orden de los componentes de mayor actividad antiviral in vitro fue el ajoeno (solo presente en el extracto de ajo añejo), seguido de la alicina, el alil metil tiosulfinato y el metil alil tiosulfinato (18). En otro estudio, los extractos etanólico y metanó-lico de A. sativum mostraron un ligero efecto en la hemaglutinación y fueron capaces de inhibir la actividad de la polimerasa viral y la síntesis de nucleoproteínas del virus de la influenza A (H1N1) pdm09 (19).
En la familia de los coronavirus, se ha reportado el efecto del extracto acuoso de ajo (conformado por varios compuestos organosulfurados, con predominio del DADS) sobre dos cadenas del virus de la bronquitis infecciosa aviar (IBV), 4/91(intervet) y el M41. Este experimento fue realizado en embriones de pollo, en los que se observó un efecto antiviral significativo (20). En un estudio in silico, el efecto de 17 compuestos organosulfurados del aceite esencial sugirió la acción de estos en el SARS-CoV-2. Se observó especialmente en el disulfuro y trisulfuro de alilo (que representan el 51,3 % del aceite esencial), que actuarían inhibiendo la proteína ACE2, lo cual bloquearía la unión del virus a esta molécula, e inhibiendo a la proteasa principal PDB6LU7 del SARS-CoV-2, esto a su vez evitaría la maduración de las proteínas del virus y, en consecuencia, la propagación de la infección (21).
Además, deben mencionarse las propiedades inhibidoras de la agregación plaquetaria del ajo. Se considera que la alicina tiene un papel importante, aunque otros argumentan que sería el ajoeno. Los mecanismos de acción incluyen la reducción de la síntesis de tromboxanos a través de la inhibición de la ciclooxigenasa y lipoxigenasa, junto con el efecto inhibidor sobre los receptores plaquetarios de adenosina difosfato, colágeno y fibrinógeno, y sobre la activación de los trombocitos (22). Esta propiedad del Allium sativum podría disminuir los eventos trombóticos presentes en la fisiopatología de la COVID-19; sin embargo, se necesita más investigación.
Allium cepa L.
Esta especie se conoce comúnmente como cebolla y pertenece a la familia Amaryllidaceae. El bulbo es la parte comestible y posee hojas modificadas gruesas y en capas. Estas tienen las propiedades bioactivas de la planta gracias a compuestos como fitoesteroles, saponinas y son una gran fuente de flavonoides (flavonoles y AT). Dentro de este último grupo, los compuestos más conocidos son la quercetina, el kaempferol, la miricetina y la catequina, los cuales presentan propiedades antioxidantes, antibacterianas, antialérgicas, antiinflamatorias y antivirales (23).
Dado que el ajo y la cebolla pertenecen a la misma familia de verduras, ambos comparten propiedades inmunoestimuladoras. En un experimento en pollos alimentados con ajo y cebolla con 10 g/kg en polvo de cada complemento alimenticio, se observó el aumento de volumen de tejidos linfoides, especialmente con el ajo. Ambos componentes aumentaron la producción de anticuerpos contra el virus Newcastle, y en respuesta a la inoculación de eritrocitos de oveja (24).
El extracto metanólico de cebolla, estandarizado con 60 % de flavonoles y 16 % de quercetina, ha demostrado efecto potencial antiinflamatorio a través de la modulación de la expresión de cito-cinas proinflamatorias (reduciendo IL-6, IL-8 y TNF- α) en ratas con hiperplasia de próstata (25). El extracto también se ha estudiado en enfermedades inflamatorias como el asma, en las que la disminución de citocinas Th2, como IL-4, IL-5 e IL- 13b, reduce la señalización de la vía NF-kB (26).
Sus propiedades inmunomoduladoras se han descrito en diferentes compuestos tales como el sulfuro de dialilo (DAS) y DADS que aumentan la celularidad del tejido linfoide (27). Otros componentes bioactivos como los fructooligosacáridos aumentan la actividad fagocítica en macrófagos murinos (28). Las lectinas han mostrado inmunoestimulación incluso en casos de ratas inmunodeprimidas con ciclofosfamida, por aumento de moléculas proinflamatorias como ciclooxigenasa (COX-2), NO y TNF-α (29). Su efecto también se ha observado en líneas celulares murinas normales que mostraban un aumento de citocinas proinflamatorias (TNF-α e IL-12) y la estimulación de la respuesta Th1 (30).
En cuanto al efecto antiviral, la revisión de Batiha et al. (31) resume una amplia gama de virus que han sido afectados por la cebolla, como el virus linfotrópico de células T humanas-1 y el virus de la encefalitis japonesa. El flavonoide quercetina ha demostrado actividad contra el virus del dengue tipo 2 y el virus de la hepatitis C, el virus de la diarrea epidémica porcina y el virus de la influenza A. Este compuesto también se ha estudiado en los coronavirus, y se ha demostrado la inhibición del virus del pseudotipo HIV-luc/SARS en células Vero E6 in silico (32). Otros estudios de acoplamiento molecular mostraron la inhibición de 3CLpro de SARS-CoV, una proteína necesaria para la replicación del virus (33). Este último efecto sugiere que el mecanismo de acción en la infección por coronavirus es similar al efecto del ajo. La evidencia en estudios preclínicos y clínicos es escasa; sin embargo, su efecto predominantemente inmunoestimulador sugiere una potencial acción preventiva de este alimento frente a las infecciones virales.
Cinnamomum zeylanicum Blume
Comúnmente llamado canela, es un árbol perenne perteneciente a la familia Lauraceae, es originario de Asia y actualmente se cultiva en todo el mundo. Contiene principalmente cinceilanina, ácido ferúlico, ácido cafeico, ácido gálico, ácido vanílico, ácido protocatecuico y p-cumárico junto con polifenoles. Es importante señalar que el cinamaldehído es la sustancia más abundante que se extrae del aceite esencial de la corteza y tiene efectos pleiotrópicos, es decir que puede modular múltiples vías de señalización molecular, lo que implica diferentes efectos farmacológicos (34).
Varios estudios muestran la actividad inmunomoduladora de la canela, entre los que se puede mencionar una investigación realizada con macrófagos murinos RAW 264.7, en los que se evaluó el extracto polifenólico de la canela. Los resultados obtenidos sugieren que este extracto modula la respuesta inmune a través de los genes que codifican la tristetraprolina TTP (proteína con efecto antiinflamatorio al desestabilizar ARNm proinflamatorio) y promueve citocinas proinflamatorias (35). En otro estudio, se verificó la capacidad del extracto etanólico para reducir los niveles de citocinas proinflamatorias como TNF-α e IL-1β y el aumento de la producción del factor de crecimiento transformante beta (TGF-β), que tiene propiedades antiinflamatorias (36). Asimismo, el extracto acuoso redujo el IFN-γ en ratones (37).
Sobre su efecto antivírico, la cinzeylanina obtenida de una purificación del extracto acuoso de Cinnamomum zeylanicum y Cinnamomum cassia mostró una capacidad inhibitoria contra la proliferación del virus HSV-1 en células Vero, mediante un ensayo de reducción de placa (38). También, se ha probado la actividad del cinamaldehído contra la infección por adenovirus in vitro; además, se han documentado daños directos al virus y una inhibición de la replicación viral dependiente de su concentración (39). Una procianidina aislada del extracto etanólico de canela también posee actividad contra el virus del VIH, durante la fase de infección, cuando el virus luego de adherirse al receptor CD4 de los linfocitos pasa a unirse a los correceptores X4 y R5, allí es donde actúa el extracto de canela inhibiendo a estos dos correceptores, además regresa la función de los linfocitos a la normalidad (40).
Una serie de fitocompuestos fueron evaluados en experimentos de acoplamiento molecular; se demostró que tienen una fuerte afinidad de unión por HSP-A5 de la superficie celular, que es otro receptor del huésped que también es reconocido: la proteína spike (S) del SARS-CoV-2, por lo que los compuestos que se unen a este receptor pueden interferir con la unión de este virus a la célula. El cinamaldehído fue uno de estos com-puestos que mostró que puede unirse fuertemente a HSP-A5, lo que implica que puede afectar el reconocimiento y unión de la proteína S de SARS-Cov-2 (7).
En general, la canela es una especia que tiene compuestos activos como los polifenoles, que exhiben una actividad inmunomoduladora; además, la cinnzeilanina y el cinamaldehído, que presentan una actividad antiviral.
Citrus sinensis L.
Conocida como naranja dulce, pertenece a la familia Rutaceae. Su fruto es comúnmente uti-lizado como alimento y su cáscara se consume como bebidas de infusión en algunas partes de Asia y África. El extracto de su cáscara es rico en flavonoides, limoneno y linalol (41). El contenido de flavonoides, en orden descendente, es hespe-retina, hesperidina, naringenina, neohesperidina, naringina y nobiletina (42). En una mezcla de jugo de variedades de Citrus sinensis (Moro, Tarocco, Sanguinello), llamada red orange complex (ROC), se determinó los altos niveles de AT, ácidos hidro-xicinámicos, ácido ascórbico y flavanonas (43). El jugo de naranja (JN) es principalmente una fuente de vitamina C y flavanonas (hesperidina, naringenina), estas últimas son flavonoides de gran biodisponibilidad (44).
Con respecto a su efecto antiviral, el extracto etanólico de la cáscara de naranja disminuyó la replicación in vitro de un tipo de coronavirus, el MHV-A59 (45). En un estudio de acoplamiento molecular, la hesperetina, la naringina y la naringenina mostraron afinidad de unión al receptor ACE-2, inhibiendo potencialmente la unión del SARS-CoV-2 a la célula huésped (42). En otro estudio in silico, se reportó que la herperidina inhibe la proteasa 3Clpro del SARS-CoV-2, mientras que la neohesperidina inhibe las proteasas PLpro y 3Clpro, mecanismos inhibitorios de la replicación viral (5).
La naringina del extracto de cáscara de naranja inhibió la expresión de citocinas proinflamatorias (COX-2, iNOS, IL-1β, IL-6) en un modelo inflamatorio inducido por LPS in vitro (42). El ROC es capaz de inhibir la producción de la molécula de adhesión intercelular-1 (ICAM-1), IL-8 y la proteína quimioatrayente de monocitos 1(MCP-1) en queratinocitos normales estimulados con IFN-γ e histamina.
En este experimento, el ROC tuvo mejor efecto antiinflamatorio que la hidrocortisona (43). En una revisión de ocho ensayos clínicos, se evaluaron los efectos del consumo del JN sobre marcado-res inflamatorios (NF-kB,CRP,IL-1,IL-6,TLR) en individuos sin enfermedad cardiovascular o metabólica establecida, después de su consumo en el período posprandial o después de tomarlo durante al menos 7 días. El resultado fue una disminución de estos marcadores inflamatorios y de la expresión de genes proinflamatorios MCP-1, C-C Motif Chemokine Ligand 26 (CCL26) y C-X3-C Motif Chemokine Receptor 1 (CX3CR1) (44).
La evidencia sugiere que los compuestos activos actuarían de una forma sinérgica para cumplir sus propiedades antivirales, inmunomoduladoras y antiinflamatorias, aspecto importante en la búsqueda de un fármaco integral con dichas propiedades contra la COVID-19.
Curcuma longa L. Conocida como cúrcuma o “palillo”, es una planta perenne herbácea perteneciente a la familia Zin- giberaceae. La parte de la planta que se utiliza es el rizoma (46) y sus principios activos más importantes son los curcuminoides (curcumina, demetoxicurcumina y bisdemetoxicurcumina) (47) y los aceites esenciales como la arturmerona, α-turmerona y β-turmerona, entre otros (48). De los curcuminoides mencionados, la curcumina es el más estudiado y es el polifenol más abundante de la Curcuma longa.
La curcumina es una molécula pleiotrópica, cuya actividad inmunomoduladora fue comprobada en una investigación realizada en células caninas de riñón Madin-Darby (MDCK) con el virus de la influenza aviar (H5N1), en la que se observó la regulación de los niveles de IFN-β y de TNF-α, así como la expresión del RNAm (49,50).
También actúa regulando los niveles de citocinas inflamatorias como la MCP-1, la IL-6 y la TNF-α, efecto observado en la infección con el virus de la influenza tipo A en la línea celular de cáncer de pulmón humano A549 (51).
El efecto antiinflamatorio de la curcumina se evidenció en un estudio in vivo sobre lesiones de ratones. Esta actúa disminuyendo la TLR4 y NF-κB, además evita una respuesta autoinmune en ratones infectados con la K. pneumoniae al reducir la infiltración leucocitaria a los pulmones y los niveles de NO y TNF-α (52). Otros componentes de la cúrcuma, como sus aceites esenciales (α-turmerona y ar-turmerona), han demostrado efecto antiinflamatorio utilizando macrófagos y ejerciendo actividades moduladoras sobre células mononucleares de sangre periférica (PBMC) de humanos (53). Estos hallazgos ponen en evidencia que diferentes compuestos de esta especie tienen efecto inmunomodulador, lo que implica la importancia de usar la cúrcuma como extracto total, en el que sus diferentes compuestos actuarían sinérgicamente.
Respecto a la actividad antiviral, la curcumina demostró efectividad al reducir la formación de partículas virales infecciosas del virus de la encefalitis japonesa en células de neuroblastoma infectadas a través de la desregulación del sistema ubiquitina-proteasoma; además posee una actividad antioxidante que ayuda a reducir los niveles de especies reactivas de oxígeno protegiendo a las células de apoptosis (54). También inhibe la replicación del virus de la hepatitis C a través de la vía PI3K/Akt (55) y la infección del virus de la hepatitis B al alterar la acetilación de las histonas ligadas a ADN circular cerrado covalentemente (ADNccc) (56). Así también, la curcumina reduce la replicación del virus de la influenza A y evita la unión de las partículas virales con su receptor de ácido siálico en la superficie celular, este último mecanismo ha sido comprobado también en un subtipo del virus de la influenza H6N1(57).
En otras infecciones respiratorias causadas por virus como el MERS-CoV y el SARS-CoV, ha sido comprobada la efectividad del tratamiento con curcumina tanto sola como en combinación con la vitamina C y el ácido glicirricínico; su mecanismo de acción consiste en promover la proliferación de células Th1, así como anticuerpos específicos para estas infecciones y, al mismo tiempo, regula los subconjuntos Th1/ Th2 a fin de prevenir una respuesta autoinmune en etapas más avanzadas de la infección, por lo que es importante mencionar que este análisis biológico sistemático requiere de estudios in vivo e in vitro para validar estos resultados (58). En otro estudio, la curcumina y otros fitocompuestos demostraron niveles significativos de actividad anti-SARS-CoV con células Vero E6 (59).
Es importante señalar que esta planta también tiene una acción antitrombótica al inhibir el factor liberador de plaquetas y la agregación plaquetaria del ácido araquidónico, posiblemente al interferir con la síntesis del tromboxano A2 (60).
Punica granatum L.
Conocida comúnmente como granada, es un arbusto caducifolio que pertenece a la familia Lythraceae. Nativa de Irán y el Medio Oriente, actualmente es una especie cosmopolita (61). Los principales compuestos de esta especie son los polifenoles, en especial las AT y los taninos hidrolizables (HT), estos últimos se agrupan en elagitaninos (ET) y galotaninos (GT). La cáscara de su fruto es rica en HT, con predominio de ET, también contiene ácido elágico, punicalagina, entre otros; los flavonoides abundan en el arilo, el jugo y la cáscara (62).
Con respecto al efecto inmunomodulador y su rol en la inflamación, se ha reportado in vitro una serie de mecanismos en el extracto y principios activos como el ácido elágico y taninos de la granada que son capaces de reducir distintos marcadores inflamatorios, disminuyendo así la respuesta innata por acción de los macrófagos (63,64). Los estudios ponen en evidencia que el extracto de granada en macrófagos logra disminuir los niveles de expresión, activación, fosforilación y translocación nuclear de MAPK, ERK1/2, JNK, p38 y NF-κB; por consiguiente, es capaz de atenuar los niveles de mediadores inflamatorios como IL-6, IL-17, IL-12, IL-8, IL-13, IL-5, IL-4, IL-18, PGE-2, NO, iNOS, COX-2, IL-2, e IL-1β, entre otros (65).
Por otro lado, también se ha reportado un efecto inmunoestimulante. Los polisacáridos de la cáscara de granada indujeron la liberación de mediadores como NO, IL-1β, TNF-α, IL-6 e IL-10 en macrófagos in vitro (66), mientras que, en otro estudio, estos polisacáridos estimularon la proliferación y secreción de linfocitos esplénicos y aumentaron notablemente la expresión de inmunoglobulinas (Ig-A, Ig-G e Ig-M) y la liberación de citocinas (TNF-α, IL-2 e INF-γ) en ratones inmunosuprimidos inducidos por ciclofosfamida (67). Adicional a esto, la granada ha sido analizada entre una serie de sustancias sintéticas y nutricionales, con el fin de encontrar un potencial abordaje inmunomodulador de la sobreproducción de citocinas para el tratamiento viral agresivo de la enfermedad pulmonar causada por COVID-19. Su mecanismo antiinflamatorio sería a través de la activación del receptor PPAR-γ (68).
Con respecto a su efecto antiviral, hay una serie de estudios in vitro que demuestran que el extracto de cáscara de granada inhibe la replicación del virus de la influenza A (69). Se plantea que dicho mecanismo se asocia con la inhibición de la adsorción viral y la transcripción del ARN viral (70). En otros estudios, se ha evidenciado que el extracto estandarizado con 93 % de polifenoles también tuvo una potente actividad antiviral contra cepas de la influenza A (X31, PR8, H1N1) y la cepa de coronavirus MHV A59 (71). Se ha probado que los polifenoles del extracto de granada (como la punicalagina) tendrían un papel clave al inhibir al virus de la influenza A, in vitro. Además, dicho extracto, al ser evaluado junto con el fármaco oseltamivir, logró potenciar el efecto de dicho fármaco (72). Por ello, los compuestos activos de esta fruta pue-den ser una fuente prometedora para desarrollar nuevos medicamentos.
Sambucus nigra L.
Comúnmente conocida como sauco, pertenece a la familia Adoxaceae. La parte de la planta que se utiliza es el fruto y las bayas, en las que se encuentran componentes tales como ácidos orgánicos (ácido cítrico, málico, shikímico y fumárico), AT (principalmente cianidina 3-glucósido y cianidina 3-sambubiósido) y flavonoides (principalmente, quercetina 3-rutinósido y quercetina 3-glucósido) (73).
Respecto a la actividad inmunomoduladora, en modelos in vitro se ha reportado la disminución de la producción de mediadores inflamatorios TNF-, IL-6, PGE-2 y NO, por acción de extracto del fruto, como en el caso del extracto etanólico (74,75). Por otra parte, el uso del jugo de saúco, mediante el compuesto cianidina 3-glucósido, incrementó significativamente la producción de IL-6, IL-8 y TNF (76). En estudios in vivo con especies murinas, el extracto de Sambucus nigra rico en polifenoles aumentó los valores de TNF-α y IFN-γ (77).
Con respecto a la actividad antiviral del saúco, se ha observado un efecto contra el virus de la influenza aviar H9N2 probado en embriones de pollos tratados, previamente a la infección, con extracto de sauco (78). Otro estudio elucidó que los flavonoides son los principales contribuyentes a la actividad antiinfluenza del extracto de saúco: estos incapacitan a los virus H1N1 para ingresar a las células huésped, previniendo efectivamente la infección (79). El extracto etanólico mostró su potencial efecto inhibidor de coronavirus IBV, al inactivarlo y comprometer la integridad de su membrana y otras estructuras del virión en células Vero (80). El extracto etanólico de una de las variedades del sauco, el Sambucus formosana Nakai, también presentó actividad contra la replicación de un coronavirus, el HCoVNL63 (81).
El extracto etanólico de Sambucus nigra demostró un efecto inmunomodulador y presentó actividad contra el virus de la influenza y el subtipo H1N1. Además, un miembro del género Sambucus tiene potencial actividad contra un tipo de coronavirus humano, el HCoVNL63.
Vitis vinifera L.
Es un fruto cosmopolita comúnmente conocido como uva, que pertenece a la familia Vitaceae. Es consumido en distintas presentaciones: fruto, jugo, vino y orujo de uva (82). Dentro de sus principales compuestos están los fenoles, los cuales incluyen a los estilbenoides, siendo el más estudiado de este grupo el resveratrol (83). Este compuesto es una fitoalexina que actúa como un antimicrobiano producido por las plantas en respuesta a infecciones fúngicas o estrés fisiológico. Las semillas de la uva contienen proantocianidinas (84).
El resveratrol modula la respuesta inflamatoria de forma pleiotrópica, tiene efecto antioxidante y se está estudiando su importancia en el tratamiento de infecciones virales, in vitro e in vivo (85). Se tiene evidencia de que el resveratrol disminuye los niveles del virus de la pseudorrabia en lechones infectados (86); este compuesto también demostró su capacidad para inhibir la replicación del coronavirus del MERS-CoV in vitro, a través de la inhibición de la producción de ARN viral intracelular, entre otros mecanismos (87).
El extracto de semilla de uva, rico en flavonoides y fenoles, puede inhibir la expresión de citocinas derivadas de la respuesta Th2, como la IL-6, e inducir selectivamente la producción de citocinas derivadas de Th1 por PBMC, en quienes muestra efectos variables en la producción de IFN-γ (88). El principal oligómero de este extracto es la procianidina B1, que tiene efectos antihepatitis C mediante la supresión de la expresión celular de COX-2 a través de la inactivación de las vías de señalización NF-κB y ERK / JNK MAPK (89).
Las proantocianidinas, un tipo de flavonoides presentes en la semilla de uva, pueden tener efectos estimuladores sobre la inmunidad celular, promover la proliferación de linfocitos, mejorar la fagocitosis de macrófagos peritoneales y aumentar la liberación de moléculas efectoras producidas por macrófagos (90). En un estudio clínico, el extracto de proantocianidina de semilla de uva (EPSU) se utilizó como pretratamiento para regular la respuesta inmune, suprimiendo la expresión de IL-1β, IL-6 e IL-8 inducida por el virus sincitial respiratorio (VSR). Esto sugirió que el EPSU es un agente preventivo en enfermedades respiratorias inducidas por el VSR (84).
Esta fruta contiene tres compuestos activos (resveratrol, proantocianidinas y fenoles) con potencial efecto contra la replicación viral de tres tipos de coronavirus, entre ellos el SARS-CoV-2. Asimismo, su evidente efecto regulador en la respuesta celular es un factor importante en la defensa contra infecciones virales.
Zingiber officinale Rosc
Conocida comúnmente como kion o jengibre, es una planta que pertenece a la familia Zingiberaceae y es nativa de la India o el Sudeste Asiático. Se cultiva en todas las zonas tropicales del planeta y se aprovechan sus rizomas medicinales y alimenticios. En los rizomas frescos, los gingeroles son los principales compuestos activos, siendo el más destacado el 6-gingerol. Los gingeroles, al ser deshidratados, se convierten en shogaoles, por lo que, en sus rizomas secos, el shogaol es el compuesto predominante (91,92). Los principales compuestos fenólicos y flavonoides hallados son el ácido clorogénico y la hesperidina, mientras que los principales aceites esenciales son el curcumeno y el linalol (93).
Su acción inmunomoduladora se evidencia en su efecto antiinflamatorio a través de la inhibición de linfocitos Th1 y Th2, supresión de genes que expresan IFN-γ e IL-4, así como la disminución del factor de transcripción Activator-protein 1 (AP1) y de la vía NF-κB por acción del 6-gingerol (94). También se han reportado dichos efectos en el extracto acuoso de kion (rico en gingeroles, shogaol y paradol), en roedores con edema plantar inducido por carragenina. El resultado de la dosis dependiente de la inhibición del edema fue equiparable al efecto de la indometacina; el mecanismo involucrado fue la inhibición de la activación de macrófagos y neutrófilos, y de la migración de monocitos y leucocitos. A nivel molecular, se observó la disminución de citoquinas proinflamatorias (TNFα, IL-6, IL-1β, MCP-1) y quimiocinas, así como la restauración de la capacidad antioxidante (91).
El efecto antiviral de esta especie se evidencia en estudios contra el VSR, VIH-1 pseudovirus y en coronavirus (95,96). Un estudio in silico contra SARS-CoV-2 muestra que el 6-gingerol posee potencial afinidad a residuos activos 31 Lys y 353 Lys del receptor de la ACE2, lo cual dificultaría el ingreso del virus (97).
En un ensayo clínico aleatorizado, realizado en 120 adultos mayores de entre 50 a 70 años con diagnóstico de osteoartritis, se administró una cápsula de 500 mg de jengibre en polvo dos veces al día durante tres meses. Se evidenció que las concentraciones séricas de TNF-α e IL-1β eran menores en el grupo experimental. También se observó la inhibición de PGE-2 y la supresión de la enzima COX-2 (98). En otro ensayo clínico, con 32 pacientes diagnosticados con síndrome de dificultad respiratoria aguda, se evaluó el efecto de una dieta enteral enriquecida con extracto de kion; el resultado fue una disminución en los niveles séricos de IL-1, IL-6, TNF-α y leucotrieno B4 en el décimo día de estudio. No se observó diferencia en cuanto a la mortalidad de los grupos de estudio (99). Lo anterior sugiere que el Zingiber officinale posee efectos inmunomoduladores, antivirales y antiinflamatorios prometedores para futuras investigaciones.
En conclusión, la evidencia sugiere la potencialidad de estos compuestos presentes en los alimentos, muchos consumidos en una dieta cotidiana, como principios activos farmacológicos con propiedades inmunomoduladoras, inmunoestimulantes o antivirales. En esta revisión, se lograron identificar nueve alimentos con dichas propiedades contra el coronavirus, de los cuales cuatro alimentos reportaron efectos en SARS-Cov-2. Cabe resaltar que la mayoría de estas investigaciones son estudios de acoplamiento molecular y experimentales, por lo que aún faltan investigaciones preclínicas y clínicas para verificar su acción potencial contra el nuevo coronavirus. Además, es importante que los nuevos estudios evalúen también la efectividad que estos alimentos tienen desde un enfoque preventivo mediante su consumo.