INTRODUCCIÓN
La esclerosis múltiple (EM) es una enfermedad de tipo crónico, no transmisible y se localiza sobre todo en el sistema nervioso central (SNC). Es de fácil detección en la materia blanca 1, se caracteriza por desmielinización en múltiples partes del SNC, lo que lleva a pérdida visual monocular (neuritis óptica), debilidad de extremidades inferiores y superiores, pérdida sensorial por mielitis transversa, visión doble causada por disfunción del tallo cerebral o ataxia 2,3. En el transcurso de la enfermedad, los síntomas son variables; algunas personas experimentan episodios de recaídas que contribuyen con la discapacidad, los cuales son o no reversibles dependiendo del daño neurológico ocasionado en el organismo. Aunque la EM puede padecer progresión y regresión de manera inesperada, existen cuatro patrones de progresión: remitente-recurrente, primaria progresiva, secundaria progresiva y primaria recurrente 4.
En cuanto a su epidemiología, para el año 2020 se reportaron 2,8 millones de personas con EM alrededor del mundo, es decir, una de cada 3000 personas vive con esta condición 5 y es tres veces más común en mujeres que en hombres. Si bien la edad de aparición suele ser entre los 20 y los 40 años, la enfermedad puede presentarse a cualquier edad 6. Para el caso colombiano, en el periodo de 2009-2013, la prevalencia media fue de siete por cada 100 000 habitantes 2. A pesar de presentar una baja prevalencia en Colombia, es una de las enfermedades más caras para el sistema de salud. Según datos del Sistema de Información de Precios de los Medicamentos (SISMED), los costos farmacológicos para el año 2014 fueron de 85 990 322 849 pesos colombianos 2, cifra que puede superarse si se tienen en cuenta las complicaciones en salud que requieren de tratamiento, como el deterioro de la movilidad, fatiga, visión doble, vértigo, disfagia, temblor cerebeloso, infecciones en el tracto urinario, estreñimiento y deterioro cognitivo 7.
Hasta la fecha no se ha encontrado la causa de la enfermedad; sin embargo, se han detectado diversos factores que pueden aumentar el riesgo de padecer EM, como virus, bacterias, autoinmunidad, trastornos metabólicos, y factores de estilos de vida entre los que se encuentra la alimentación 8-10. Por lo general, las intervenciones realizadas a los pacientes con EM se han enfocado en áreas como la farmacológica. En la actualidad, se ha dado importancia al reconocimiento de intervenciones secundarias que puedan contribuir a mejorar la sintomatología propia de la enfermedad para disminuir la carga en estos pacientes crónicos.
En relación con esto, la intervención nutricional se presenta como una opción simple, de bajo costo y de riesgo disminuido si se compara con tratamientos farmacológicos, de manera que contribuye en la reducción de la gravedad, la duración de las recaídas y en la disminución del deterioro del paciente 11,12. Nutrientes como la vitamina D y los ácidos grasos omega-3 han sido ampliamente estudiados, a la fecha se cuenta con revisiones sistemáticas que muestran un panorama del estado del arte en estos dos nutrientes 13-16. Los resultados sugieren efectos beneficiosos sobre la reducción de la tasa de recaídas, los marcadores inflamatorios y la mejoría de la calidad de vida de los pacientes con EM y la necesidad de continuar con los estudios que permitan aportar la mejor evidencia debido a que aún hay resultados contradictorios. El objetivo de este trabajo fue describir aspectos nutricionales y alimentarios en los pacientes con EM que pueden tener importancia en la etiología y progresión de la enfermedad.
MATERIALES Y MÉTODOS
Criterios de elegibilidad
La búsqueda se limitó a investigaciones originales de estudios observacionales y de intervención realizadas en humanos, mayores de edad, con EM, que presentaron datos de al menos una de las variantes alimentarias de interés que se describen en la estrategia de búsqueda y publicados en los buscadores seleccionados, sin restricción de idioma, entre el 2009 y agosto del 2020. Durante la búsqueda fueron excluidos los artículos duplicados, las investigaciones en modelos celulares o animales, aquellos que evaluaran de forma concomitante fármaco y nutrientes y los que no abordaron como tema central la alimentación en la EM.
Fuente de información
Las bases de datos seleccionadas como fuente de información fueron Scopus, Pubmed, Lilacs, Embase y SciELO. En el caso de no encontrar los artículos en texto completo, se contactó a los autores.
Estrategia de búsqueda
La búsqueda en las bases de datos se ejecutó utilizando Encabezados de Temas Médicos (Medical Subject Headings: MeSH), obtenido de los Descriptores en Ciencias de la Salud (DeCS). Para garantizar la especificidad de la búsqueda se seleccionaron como palabras clave cada uno de los macronutrientes y micronutrientes de interés. Los términos MeSH en inglés empleados fueron (“Dietary fats” OR “Dietary proteins” OR “Dietary fiber” OR “Dietary carbohydrates” OR “Nutritional supplementation” OR “Dietary supplements” OR “folate” OR “Acid Folic” OR “Vitamin B12” OR “Magnesium” OR “Manganese” OR “Selenium”) AND (“Multiple sclerosis”).
Selección de los artículos y control de sesgos
Al menos dos de los tres revisores evaluaron de manera independiente cada artículo; analizaron el título y el resumen. Los estudios potencialmente relevantes fueron seleccionados para su lectura completa; la calidad de los estudios se evaluó mediante las directrices para la comunicación de estudios observacionales y el sistema de puntuación de Oxford para los estudios experimentales. Los desacuerdos presentados en la selección de los artículos se resolvieron con la intervención del tercer evaluador. Por último, se clasificó la información en estudios observacionales y experimentales; la extracción de la información de los estudios incluidos se hizo en una base de datos en la que se incluyó autores, país, tipo de estudio, número de participantes, patrón de progresión, edad, condición nutricional evaluada y resultados principales.
RESULTADOS
Estudios incluidos
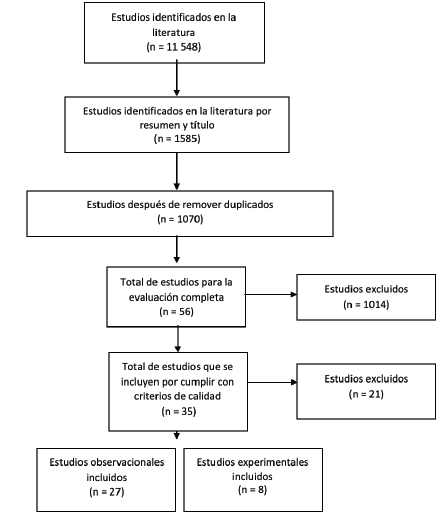
En la figura 1 se muestra la información del proceso de búsqueda y selección de bibliografía. Un total de 35 artículos coincidieron con los criterios de selección antes mencionados y se incluyeron para su revisión. Las tablas 1 y 2 proporcionan una descripción de las características y resultados principales. Cinco aspectos se hicieron evidentes en los estudios incluidos: el primero fue el estado nutricional y los patrones dietarios, el segundo co rrespondió a los suplementos dietarios y herbales, el tercero fue sobre los ácidos grasos, el cuarto sobre los antioxidantes y el quinto correspondió a las concentraciones séricas de nutrientes. A continuación, se presentarán los resultados de los principales aspectos evaluados y su relación con la EM.
Estado nutricional y patrón dietario
Teniendo en cuenta los resultados en promedio del Índice de Masa Corporal (IMC), e independiente de los patrones de progresión, el estado nutricional varió entre 24,3±4,2 y 25,0±5,0 kg/m2 (17-23. A pesar de la tendencia de un IMC adecuado o con sobrepeso, se ha descrito pérdida de masa muscular medida por dinamometría manual. Redondo et al. 20 evaluaron la fuerza de agarre y encontraron a más del 70 % de la población de estudio por debajo de los rangos de normalidad, en comparación con el 37 % del grupo control. En su interés por documentar la malnutrición en pacientes con EM moderada-avanzada y su evolución a doce meses, los autores encontraron que un 6,5 % de los pacientes presentaba riesgo de desnutrición; un 1,6 %, desnutrición, de acuerdo con la valoración global sub jetiva, y el 12 % refirió una pérdida de peso mayor al 5 %. Luego del seguimiento de doce meses, no se observó diferencias estadísticamente significativas en el número de pacientes malnutridos o con riesgo de malnutrición, ni cambios antropométricos, a excepción del índice de masa libre de grasa que se encontraba más bajo que la medida basal. En un estudio de cohorte se evaluó la asociación entre el IMC con medidas de neurodegeneración indicadas por resonancia magnética, los resultados mostraron menor materia gris y pérdida del volumen del parénquima cerebral normalizada a mayor IMC, lo que trae como consecuencia mayor discapacidad 19.
En cuanto a la ingestión de alimentos, en los sujetos con EM se observó un consumo menor de azúcar agregada. Akbulut et al. 18 observaron en las mujeres una disminución en la ingesta de queso, pan blanco, gaseosas, carne roja y azúcar después del diagnóstico; en cuanto a los hombres, no hubo diferencia en el consumo de alimentos, a excepción de legumbres y bebidas carbonatadas. Además, se resaltó que tanto antes como después del diagnóstico el consumo de pescado fue bajo. En otros estudios las dietas más comunes fueron las bajas en grasa, las bajas en azúcar, las bajas en carbohidratos, sin gluten y las bajas en energía proveniente de carbohidratos 24-26.
Por su parte, el estudio de Armon-Omer et al. 17 reportó una ingesta significativamente menor de un amplio número de aminoácidos y micronu trientes (hierro, calcio, magnesio, fósforo, potasio, sodio, zinc, cobre, tiamina, riboflavina, niacina, vitamina B6 y folato) en comparación con el grupo sano. Cabe anotar que la tiamina y el zinc fueron significativamente más bajos en comparación con la ingesta recomendada. Ramsaransing et al. 27 investigaron las diferencias en la ingesta nutricional en pacientes con diferentes cursos de la enfermedad; encontraron que las personas con EM progresiva secundaria tenían ingestas más bajas del 20 % de magnesio, y del 15 % de calcio, en comparación con pacientes con EM leve o primaria progresiva. En comparación con un grupo sano, la ingesta fue menor en cuanto a proteína, grasa total, colesterol, folato, magnesio y cobre; además, los micronutrientes mencionados junto con el zinc y el selenio estuvieron por debajo de las recomendaciones diarias.
Cortese et al. 28 investigaron en mujeres la asociación entre la ingesta de minerales y el riesgo de la EM. En su estudio, la ingesta de los minerales con excepción del potasio estuvo dentro del rango de las recomendaciones; el estudio no encontró una asociación entre la ingesta de micronutrientes y la EM.
Cuatro estudios exploraron la asociación entre los factores dietéticos y los diversos aspectos como la calidad de vida relacionada con la salud, la discapacidad, la tasa de recaída y la depresión. Hadgkiss et al. 29 reportaron las probabilidades de tener menor calidad de vida y un nivel más alto de discapacidad; estas fueron significativamente más bajas para aquellos que pertenecían a los grupos de mayor consumo de frutas, verduras y grasas saludables. A pesar de que los análisis bivariados mostraron asociación entre menor discapacidad y no consumir carne ni lácteos, este hallazgo no se mantuvo después de controlar por variables de confusión. Para aquellos con EM remitente-recurrente, la dieta saludable predijo significativamente una tasa de recaída más baja; sin embargo, el ajuste del modelo fue deficiente. En cuanto al estudio de Moravejolahkami et al. 23, estos reiteraron la asociación entre el patrón dietario basado en el consumo de las frutas, verduras (en especial crucíferas, cebollas, pimientos, curry, tomate y calabaza), lácteos bajos en grasa y el patrón similar al mediterráneo (cereales integrales, carnes blancas, frijoles, nueces, aceites con contenido de omega-3 y 6 e ingestas de dos tazas de café por día) con un puntaje más alto de calidad de vida, más bajo en la medición de la fatiga aguda y crónica, y menores tasas de recaídas, entre los sujetos con EM remitente-recurrente y EM progresiva-recurrente al compararse con los sujetos que seguían una dieta occidental. Asimismo, los patrones que tenían todos los tipos de omega-3 y 6 se asociaron negativamente con la tasa de recaída.
Tabla 1 Resumen de tablas de estudios observacionales
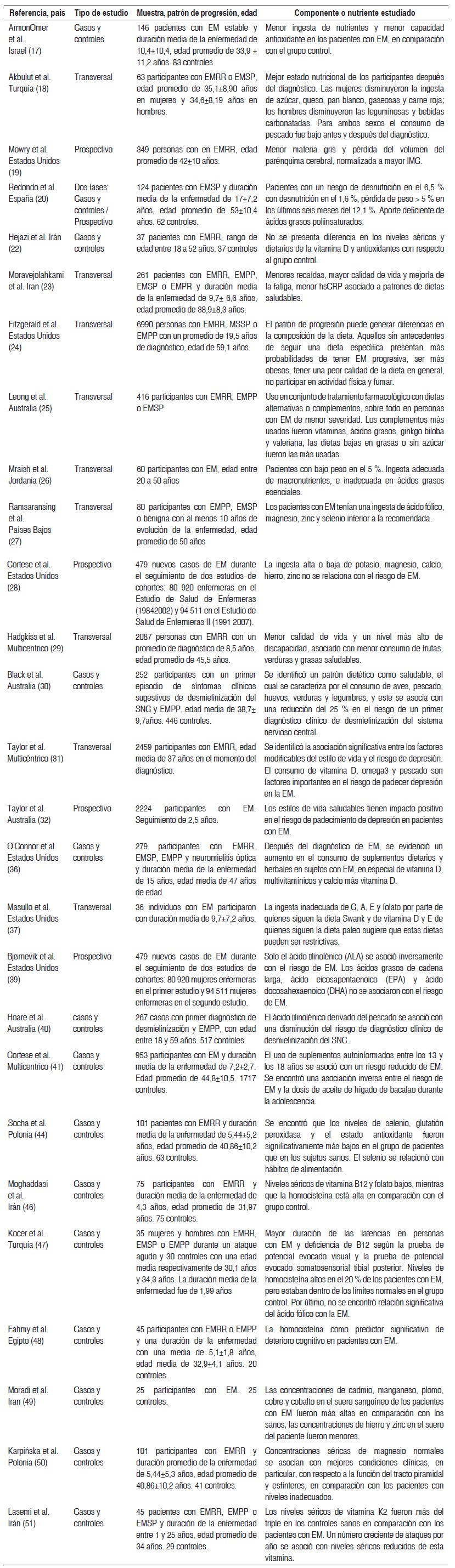
EM = esclerosis múltiple; EMRR = esclerosis múltiple recurrente remitente; EMSP = esclerosis múltiple secundaria progresiva; EMPP = esclerosis múltiple progresiva primaria; SNC = sistema nervioso central; IMC = Índice de Masa Corporal; hsCRP = proteína C reactiva ultrasensible.
Asimismo, otro trabajo determinó que no hay una asociación estadísticamente significativa (p = 0,11) entre una dieta occidental (rica en carnes rojas, carnes procesadas, lácteos con alto contenido de grasa y con bajo consumo en cereales integrales, nueces, fruta fresca y lácteos bajos en grasa) y el primer diagnóstico clínico de desmielinización del SNC. No obstante, el incremento en una desviación estándar en el puntaje de la dieta saludable (alta ingesta de aves de corral, pescado, huevos, vegetales y legumbres) se relacionó con un menor riesgo de tener un primer diagnóstico de desmielinización del SNC en mujeres en un modelo ajustado (OR 0,72; 95 % CI 0,56, 0,93; p = 0,011). En los hombres, a pesar de que mostró la misma tendencia, no hubo significancia estadística (OR 0,91; 95 % CI 0,43, 1,93; p = 0,808) 30.
Tabla 2 Resumen de tablas de estudios experimentales
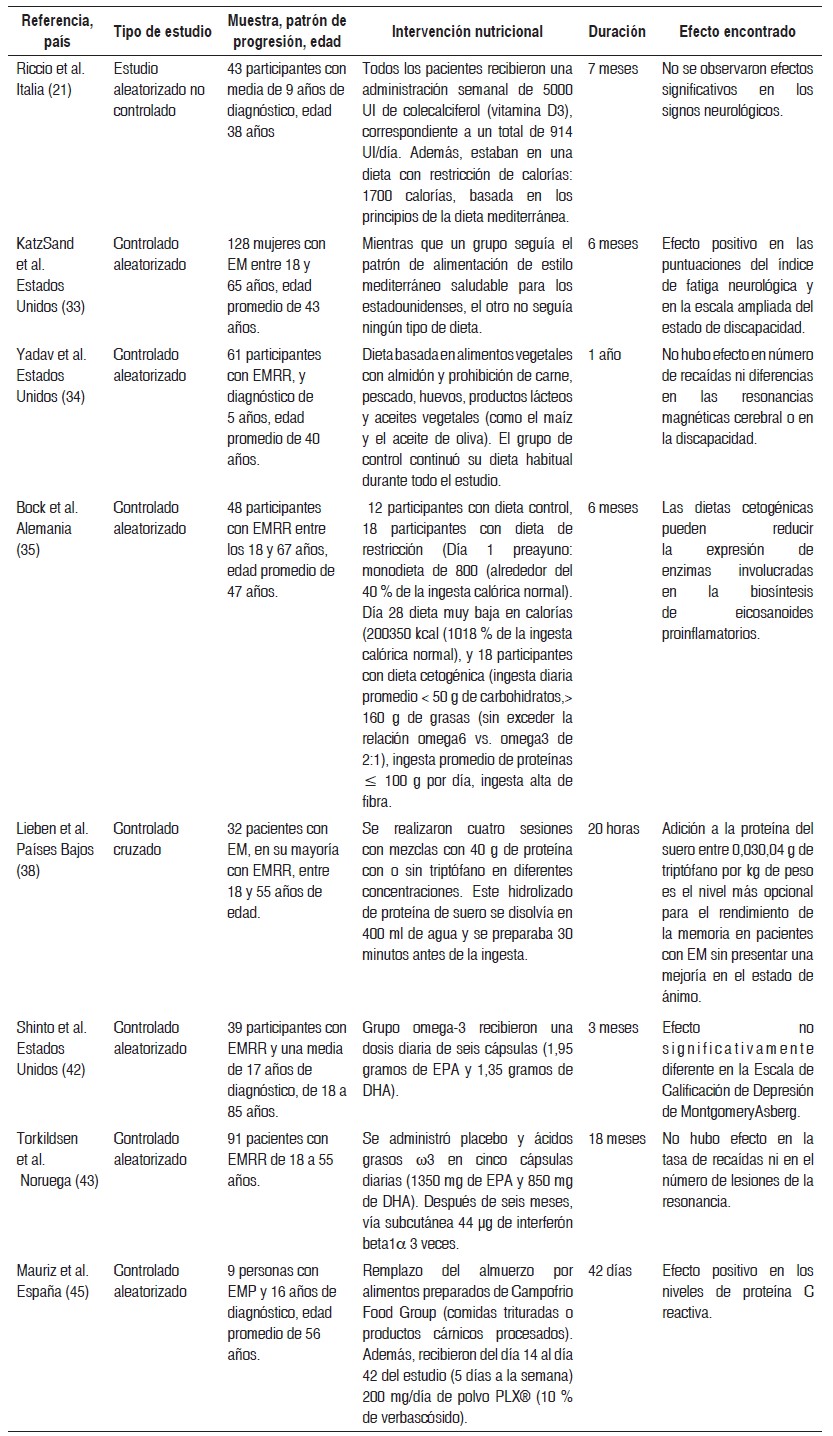
EM = esclerosis múltiple; DHA = ácido docosahexaenoico; EPA = ácido eicosapentaenoico; EMRR = esclerosis múltiple recurrente remitente; EMSP = esclerosis múltiple secundaria progresiva; EMPP= esclerosis múltiple progresiva primaria; EMP = esclerosis múltiple progresiva; SNC = sistema nervioso central; TRP = triptófano.
Taylor et al. 31, en su estudio transversal, encontraron que el grupo de participantes que recibió suplementos de ácidos grasos omega-3 proveniente del aceite de linaza, y además tuvo consumo frecuente de pescado, recibió suplementos de vitamina D, realizaba meditación y tenía consumo moderado de alcohol, presentó un riesgo significa tivamente menor de depresión. Luego, investigadores del mismo grupo de trabajo, en un estudio longitudinal de 2,5 años, examinaron la asociación entre estilo de vida, incluyendo la dieta, y el riesgo de depresión. Si bien hubo algunos indicios de asociaciones positivas entre el consumo de carne, productos lácteos y suplementos de ácidos grasos omega-3, estas se perdieron luego del ajuste por variables de confusión. Por otro lado, la aso ciación entre menor depresión y consumo de suplementos de vitamina D persistió después de los ajustes 32.
Con respecto a los estudios experimentales, se abordaron cuatro intervenciones distintas. Tras su investigación, Katz-Sand et al. 33 reportaron que al seguir la dieta mediterránea, por lo menos seis meses, sin suplementos exceptuando la vitamina D prescrita por el médico tratante, se puede reducir la fatiga neurológica, una tendencia hacia la reducción de la escala de impacto de la EM y la discapacidad, en comparación con un grupo de intervención. Asimismo, Yadav et al. 34 encontraron que seguir dieta basada en plantas (alimentos vegetales con almidón como los frijoles, panes, maíz, pastas, papas, batatas y arroz) con la adición de frutas y verduras sin almidón al menos por un año mejoró la fatiga; aunque no tiene efecto sobre la discapacidad, en la frecuencia de las recaídas ni en la calidad de vida. Los autores sugieren interpretar el resultado de la fatiga con cautela, debido a que hubo un desequilibrio inicial en las puntuaciones de fatiga entre los grupos de intervención y control. Riccio et al. 21 reportaron que en pacientes con EM primaria progresiva y en pacientes con EM remitente-recurrente -tras una dieta semivegetariana restringida en calorías, distribuida 50 % de carbohidratos, 30 % de grasa (sobre todo de aceite de oliva, pescado y grasas vegetales) y 20 % de proteínas suplementada con vitamina D, ácidos grasos y multivitamínicos- no hubo cambios en los puntajes de fatiga, ni en los de calidad de vida después de tres y seis meses de tratamiento; sin embargo, se estableció en 12 de los 29 pacientes una tendencia hacia la dismi nución de la inflamación.
Por último, un trabajo exploró el impacto de las dietas cetogénicas en la expresión de genes de enzimas claves para la formación de eicosanoides pro y antiinflamatorios en leucocitos periféricos; los resultados mostraron una disminución en la expresión de genes citocromo C oxidasas 1 y 2 y la araquidonato 5-lipooxigenasa, que codifican para enzimas involucradas en la biosíntesis de ei cosanoides proinflamatorios en comparación con la dieta regular 35.
Suplementos dietarios y herbales
Luego del diagnóstico de EM, los pacientes consideran pertinente el inicio de la suplementación dietaría o herbal para retrasar la progresión de la enfermedad o tratar un síntoma en específico. En los estudios observacionales, se encontró que los tipos de suplementos más usados fueron multivitamínicos, la vitamina D y los ácidos grasos 25,32,33,36. Adicionalmente, en el estudio de O’Connor et al. 36, los pacientes con EM informaron un mayor uso de complejo B, vitamina B12, calcio más vitamina D y de suplementos herbales como el aceite de onagra, seguido del extracto de fruta de arándano. También ingirieron hierba de san Juan, equinácea, arroz de levadura roja, aceite de linaza, ginkgo biloba, valeriana, ginseng, entre otros, en comparación con el grupo control. El estudio no mostró evidencia en cuanto al uso de estos suplementos con el curso progresivo de la enfermedad y, por el contrario, advierte sobre posibles interacciones negativas entre el uso de suplementos herbales y los medicamentos. Leong et al. 25, por su parte, reportaron el ginkgo biloba y la valeriana como los productos herbales más comunes. Entre las creencias de los pacientes para su uso se encontraron prevención de los ataques y recaídas, mejoría del sueño, tratamiento de las piernas inquietas, la neuralgia y la desintoxicación 37.
En un estudio experimental en pacientes con EM, se examinaron los efectos sobre las funciones afectivas y cognitivas de una mezcla de proteína whey enriquecida con triptófano. Los autores concluyeron que una adición de triptófano a la proteína del suero, entre 0,03-0,04 g por kg de peso, mejoró la memoria sin afectar el estado de ánimo 38.
Ácidos grasos
Dos estudios evaluaron el perfil nutricional en fase moderado-avanzado. En ambos, los pacientes con EM presentaron una ingesta menor de ácidos grasos poliinsaturados con respecto al grupo control, ningún grupo cubrió los reque rimientos diarios establecidos para ácidos grasos polinsaturados 17,20. Por otra parte, se reportó un consumo menor al 50 % de ingesta diaria recomendada de ácidos grasos poliinsaturados totales, omega-3 y omega-6 26. Adicionalmente, tres estudios observacionales se centraron en la relación de la ingesta de los ácidos grasos y Bjørnevik et al. 39 encontraron que una baja ingesta de ácidos grasos poliinsaturados aumentaba el riesgo de padecer EM. Hoare et al. 40 reportaron la asociación entre su baja ingesta y el riesgo del primer diagnóstico clínico de desmielinización del SNC. Mientras que para Bjørnevik et al. 39 el ácido α-linolénico (ALA) derivado de las plantas fue el único ácido graso con un efecto protector.
Para Hoare et al. 40, el ALA derivado de los pescados fue el más benéfico. Ahora bien, Cortese et al. 41 dedujeron que comenzar una suplementación con aceite de bacalao de una cucharada diaria (aproximadamente 600 a 800 UI de vitamina D) desde la infancia o adolescencia, mas no desde el nacimiento, puede asociarse con un menor riesgo de padecer EM.
En cuanto a los estudios experimentales, se encontró uno que no reveló ningún efecto sobre la depresión, ni en la calidad de vida de los pacientes con EM de la terapia complementaria de la suplementación de omega-3 (1,95 g de ácido ei cosapentaenoico [EPA] + 1,35 g de ácido docosahexaenoico [DHA] /día), durante tres meses 42.
Torkildsen et al. 43 no detectaron efectos benéficos en el grupo suplementado en comparación con el grupo placebo, ni en el número acumulado de lesiones por resonancia magnética ni en el número de recaídas, ni una mejoría en el puntaje de la escala del estado de incapacidad, como tampoco en la escala de valoración funcional; tampoco cambios en la fatiga o calidad de vida, luego del consumo de 1350 mg de EPA y 850 mg de DHA/ día, durante seis meses de tratamiento, ni cuando se combinó con interferón beta 1 α iniciado a partir del sexto mes.
Antioxidantes
Al ser la EM una enfermedad inflamatoria, los antioxidantes podrían estar implicados directamente en su aparición o progresión. En los estudios observacionales se evaluaron principalmente los niveles sanguíneos de antioxidantes, los cuales reportaron concentraciones más bajas de la capacidad antioxidante total en el suero de pacientes con EM en comparación con controles sanos 17,44. Por su parte, el estudio de Armon-Omer et al. 17 mostró mayor compromiso en pacientes con EM severa; aunque no se encontró una asociación entre la ingesta de vitaminas antioxidantes y la progresión de la enfermedad. El estudio de Socha et al. 44 indicó una concentración sérica de selenio y la actividad de glutatión peroxidasa disminuida en personas con EM en comparación con sujetos sanos. Con respecto a la ingesta, señalaron que un frecuente consumo de aves de corral, productos de panadería, legumbres y pescado parecía aumentar la concentración sérica de selenio en los pacientes con EM, mientras que el consumo rutinario de mantequilla, pan integral, bebidas dulces y azúcar lograba lo contrario. Cabe resaltar que también observaron una disminución de la capacidad antioxidante total en aquellos pacientes que estaban recibiendo medicamentos inmunomoduladores.
Hejazi et al. 22 no hallaron diferencias significativas entre los casos y controles en los niveles séricos de antioxidantes; para ambos grupos reportaron una ingesta por debajo de las referencias de la ingesta dietética, solo con la vitamina C cerca a la dosis recomendada. En cuanto a los estudios de intervención, Mauriz et al. 45 valoraron el efecto de una dieta baja en grasas con suplementación de 200 mg/día de verbascósido, un componente antioxidante sobre marcadores oxidativos e in flamatorios. El estudio mostró una disminución significativa de los niveles de proteína C reactiva, niveles más bajos de isoprostanos 8-iso-PGF2α e interleucina IL-6 en el grupo de intervención al compararlo con el grupo placebo.
Concentraciones séricas de nutrientes
Los exámenes bioquímicos contribuyen a la interpretación del estado nutricional. En un estudio demostraron que los pacientes con EM tenían valores de hierro más bajos en comparación con los controles 17. Redondo et al. 20 observaron un menor nivel de albúmina, vitamina D, vitamina E y bilirrubina en comparación con voluntarios sanos. Los pacientes con discapacidad avanzada tenían un nivel más bajo de albúmina, transferrina, folato y niveles más altos de proteína C reactiva. Moravejolahkami et al. 23 encontraron una concentración menor de proteína C reactiva ultrasensible en aquellos participantes que llevaban una dieta rica en frutas o verduras o mediterránea en comparación con la dieta occidental.
Dos estudios determinaron que las personas con EM tenían niveles más bajos de vitamina B12 y folato sérico, mientras que la homocisteína estaba alta en comparación con el grupo control 46,47. Moghaddasi et al. 46 encontraron que los niveles más altos de homocisteína se correlacionaron positivamente con la duración de la enfermedad, con el tratamiento del interferón β y fueron más jóvenes en presentar el primer ataque de desmielinización. Por su parte, Kocer et al. 47 observaron que los pacientes que tenían niveles más bajos de B12 exhibieron latencias prolongadas de potenciales evocados visuales y somatosensitivos. Fahmy et al. 48 no encontraron diferencias entre los niveles de B12, folato y homocisteína entre pacientes y controles; sin embargo, identificaron una asociación entre los cambios atróficos cerebrales con concentraciones séricas bajas de B12 y altos valores de homocisteína; además, hallaron cifras más altas de homocisteína en personas con EM progresiva secundaria que en la EM remitente-recurrente. Por último, bajo un modelo de regresión lineal, se determinó a la homocisteína como predictor significativo del deterioro cognitivo en pacientes con EM.
En cuanto a los metales pesados, Moradi et al. 49 evaluaron las concentraciones sanguíneas de plomo, cadmio y cobalto, y la eliminación urinaria de aluminio, mercurio y plomo en pacientes con EM residentes en zonas industriales. Los investigadores encontraron que las concentraciones de plomo, cadmio y cobalto fueron significativamente más altas que en los sujetos sanos, y que la eliminación urinaria de aluminio, mercurio y plomo superó a la del grupo control. Asimismo, los niveles sanguíneos del hierro y el zinc estuvieron más bajos en las personas con EM.
En lo que respecta al magnesio, Karpińska et al. 50 identificaron que más de la mitad de los pa cientes con EM tenían concentraciones de magnesio menores, lo cual se relacionó con peores puntuaciones en la Escala de Estado de Discapacidad Extendida (EDSS), específicamente en la función del tracto piramidal y los esfínteres. Acerca de la vitamina K, encontraron valores sanguíneos más bajos de vitamina K2 con respecto al grupo control. Estas concentraciones fueron significativamente más bajas en las mujeres y fueron más bajas a mayor edad; la reducción fue de 10 % por cada década. Aquellas personas con déficit de vitamina K fueron más propensas a tener un número creciente de ataques por año y se observó mayor prevalencia en los pacientes con lesiones del nervio óptico 51.
DISCUSIÓN
Estado nutricional
El estado nutricional en el que se encuentran los pacientes con diagnóstico de EM podría tener implicaciones en la calidad de vida, estado psicológico y progresión de la enfermedad. Esto es consecuencia del patrón alimentario seguido por cada uno de ellos antes y después del diagnóstico médico. La gran mayoría de los pacientes inician con la aplicación de dietas específicas, las cuales pueden alterar o no su estado nutricional. Akbulut et al. 18 atribuyeron la reducción del consumo de azúcar, pan blanco, gaseosas, entre otros, a la información suministrada por los medios de comunicación que enfatizan una relación de estos productos con el aumento del colesterol y triglicéridos y a las complicaciones en la salud. Por otro lado, sugirieron que los factores socioeconómicos son posibles causas de la reducción del consumo de carne, en especial, en participantes con bajo estrato socioeconómico.
Un número importante de estudios reportaron ingestas inferiores al requerimiento de ácidos grasos poliinsaturados y de micronutrientes (tiamina, zinc, calcio, magnesio, selenio, entre otros) 17,20,26,27, todos ellos esenciales para el correcto funcionamiento y regulación de funciones vitales en el organismo, pero, adicionalmente, con funciones en el sistema nervioso. La tiamina es una vitamina que desempeña una función importante en el metabolismo de los carbohidratos por medio de la formación de la coenzima pirofosfato de tiamina. Esta desempeña una función neuromoduladora en el sistema de neurotransmisores de acetilcolina, distinto de sus acciones como cofactor durante los procesos metabólicos, además contribuye a la estructura y función de las membranas celulares, incluidas las neuronas y la neuroglia 52. La tiamina se relaciona con la incidencia y progresión de la EM, aunque este hallazgo solo ha sido validado en ensayos con modelos de ratones 17.
En cuanto al zinc, además de ser un cofactor en numerosas reacciones, este se encuentra de forma abundante en el cerebro, hace parte de la homeostasis del SNC y su funcionamiento normal, sobre todo en vesículas de neuronas presinápticas y plasticidad sináptica; su deficiencia se ha asociado con la inducción de apoptosis y los excesos con neurotoxicidad 17,53. Se ha reportado que el magnesio tiene características neuroprotectoras con respecto a los daños neuronales en la sustancia blanca del SNC; sin embargo, es incierto el mecanismo usado por este nutriente que interviene en más de 300 procesos metabólicos 17,27. El selenio, adicional a su papel relevante como cofactor de la enzima glutatión peroxidasa implicada en procesos de óxido reducción, también se ha relacionado con tener un papel importante en la regulación de la migración, proliferación, activación de células inmunológicas 54. En cuanto al calcio, aunque todavía se desconoce la ruta, en modelos animales cuando tenían una dieta rica en calcio se obtenía un efecto protector mayor de la vitamina D en la prevención de la enfermedad 27. La dieta con mayores beneficios fue un patrón nutricional saludable en la que se incluye un aporte importante de frutas y verduras y la dieta mediterránea, la cual, por su alto aporte de antioxidantes, grasas poliinsaturadas (sobre todo ácidos grasos omega-3), fibra, vitaminas y minerales, y la ausencia de nutrientes proinflamatorios como los carbohidratos concentrados, logró una reducción de la fatiga neurológica y de la fatiga aguda y crónica, en la escala de impacto de EM. En el primer episodio clínico desmielinizante, logró una mejoría en la calidad de vida y un menor nivel de discapacidad 23,29,33,34. Taylor et al. 31 encontraron que tomar suplementos de vitamina D < 5000 UI diarias se asoció con menor presencia de depresión, lo que no sucedía con dosis menores.
Bock et al. 35, en su estudio experimental, realizaron una intervención durante seis meses en la que encontraron que el índice de calidad de vida según el cuestionario Múltiple Sclerosis Quality of Life-54 tenía una relación inversa con los genes proinflamatorios que fueron reducidos con dieta cetogénica al disminuir la expresión de la 5 lipoxigenasa y la cicloxigenasa, los cuales tienen efecto en las enfermedades neuroinflamatorias, mientras que la reducción de calorías tuvo efecto en la reducción del IMC y los niveles de insulina. El papel de la 5 lipoxigenasa todavía es controversial, puesto que tanto en animales como en humanos no se han obtenido datos concluyentes.
Por último, la ingesta adecuada de micronutrientes puede contribuir a la prevención y progresión de la enfermedad, además de aportar al tratamiento de la sintomatología; no obstante, todavía se requieren estudios para determinar tanto los nutrientes directamente implicados como los mecanismos de acción.
Suplementos dietarios y herbales
Luego de revisar los artículos encontrados en este apartado, se obtuvo evidencia que posterior al diagnóstico médico de EM los pacientes inician la ingesta de suplementos dietarios o herbales, bien sea por convicción propia o por recomendaciones específicas del médico. Se debe tener en cuenta que estos pueden tener posibles efectos positivos en la salud, como el mejoramiento de la memoria, y efectos negativos, como la interacción negativa con algunos fármacos y toxicidad. O´Connor et al. 36 demostraron que el uso de equinácea puede afectar la eficacia o toxicidad de fármacos, los cuales son metabolizados en el citocromo P450; la equinácea se considera inmunoestimulante y puede interactuar con inmunosupresores. Así como la equinácea, se considera que la hierba de san juan disminuye la eficacia de la ciclofosfamida.
En el estudio realizado por Masullo et al. 37, se expuso que se debe estudiar con mayor rigurosidad la ingesta de nutrientes y las modificaciones dietéticas en este tipo de pacientes, en cuyo tratamiento los nutricionistas tienen una función importante, debido a que algunas dietas suelen ser limitantes o deficientes en algunos micronutrientes como vitamina A, D, C, E, ácido fólico, por lo que requieren de un acompañamiento individual con el fin de mantener un estado nutricional óptimo.
Ácidos grasos
Los ácidos grasos omega-3, en forma de DHA y EPA, son los nutrientes más investigados en torno a la EM. Estos ácidos grasos desempeñan funciones destacadas en la modulación inmune, puesto que inhiben marcadores proinflamatorios, reducen la síntesis del leucotrieno proinflamatorio B4 y la prostaglandina E2 disminuyendo la formación de eicosanoides proinflamatorios, dando como consecuencia la reducción de los radicales libres, lo cual podría llevar a menos recaídas 14. En cuanto al ALA, este puede disminuir los marcadores inflamatorios al intervenir en la vía inmunológica de la EM.
Por otro lado, EPA y DHA pueden reducir los niveles de metaloproteínasa de la matriz extracelular 9, la cual es una proteína marcadora de la migración de células inmunitarias hacia el SNC, ya que induce la ruptura de la barrera hematoencefálica hasta el punto de la degradación 55. Se ha encontrado que la suplementación permite una mejoría de ≥ 50 % en la Escala de Calificación de Depresión de Montgomery-Asberg y menos limitaciones motoras según la escala EDSS. La depresión incrementa la producción de citocinas proinflamatorias, que se acentúa aún más cuando las personas con EM pasan por una recaída. Debido a las características antes descritas de los ácidos grasos omega-3, se identificó una disminución en el riesgo de padecer depresión en aquellos pacientes que se suplementaban 31,32. Con respecto a la ingesta de alimentos, un bajo consumo de ácidos grasos poliinsaturados incrementa el riesgo de padecer EM, mientras que un consumo diario de aceite de bacalao desde la infancia o adolescencia se asoció con un menor riesgo 41.
Antioxidantes
El papel de los antioxidantes se centró en su poder antinflamatorio evidenciado en los niveles de pro teína C reactiva. Además de identificar menores niveles de antioxidantes totales, el selenio fue mucho menor en los pacientes con EM.
El selenio es uno de los antioxidantes más reconocidos por su función antinflamatoria involucrado como componente activo en reacciones de oxido-reducción de diferentes enzimas como la glutatión peroxidasa, en las que protege las membranas del daño oxidativo. La disponibilidad del selenio se verá afectada por el medioambiente, es decir, por la concentración de este mineral en el suelo, y por la ingesta de azúcar refinada, debido a que puede lixiviar los minerales del cuerpo 44.
El verbascósido es un compuesto al cual se le han observado propiedades antinflamatorias, en especial, en las estructuras de las membranas de los fosfolípidos en contexto del ejercicio de resistencia, la enfermedad inflamatoria intestinal, las afecciones articulares y ahora en la EM. El efecto benéfico de este componente se ha visto reforzado por la correlación entre los ácidos grasos de la membrana y la proteína C reactiva, pues, como consecuencia del uso del verbascósido, los va lores de dicha proteína fueron inferiores al grupo placebo 45.
Concentraciones séricas de nutrientes
Se determinó que las personas con EM suelen tener niveles sanguíneos más bajos de magnesio, vitamina K, vitamina B12, folato, hierro y zinc; el magnesio se relaciona con peores puntuaciones en la Escala de Estado de Discapacidad Exten dida; la vitamina K, con un mayor número de ataques en el año, sobre todo en el nervio óptico, con un mayor déficit de esta vitamina en mujeres y con el aumento de la edad; la vitamina D es más deficiente en personas con EM avanzada (5 a 6 años) y mujeres, y la vitamina B12 infuye en la disminución de la función cognitiva y prevalente en personas con EM secundaria progresiva.
La homocisteína es un compuesto que se produce mediante el metabolismo de la metionina, en el que es eliminada por la conversión en cisteína (interviene la vitamina B6 como cofactor) o por remetilación de la metionina (la vitamina B12 y el folato son cofactores) 47. Cuando los niveles de homocisteína son elevados, hay una reducción en la S-adenosilmetionina, la cual interviene en las reacciones de metilación y de la homeostasis neuronal. Si hay hipometilación, se puede detener la remielinización y se desestabilizan las estructuras de la mielina; además, la homocisteína puede dar como resultado especies oxidativas reactivas, las cuales generan toxicidad neuronal, lo que conlleva una necesidad aumentada de vitamina B12, vitamina B6 y folato como medida para eliminar la homocisteína, en especial, la vitamina B12 46,47.
En cuanto al magnesio, los pacientes con EM suelen tener concentraciones más bajas en los tejidos del SNC y en órganos como el corazón, los pulmones, el riñón y el hígado, además este déficit de magnesio reduce la actividad de la enzima superóxido dismutasa cobre/zinc y síntesis de glutatión. En un estudio de Karpińska et al. 50, los pacientes en promedio ingirieron 240 mg/día/ persona de magnesio (mucho menos de lo recomendado) y fueron más propensos a tener puntuaciones más altas de fatiga.
Respecto a los metales pesados, los niveles más altos fueron para plomo, cadmio, cobalto, aluminio y mercurio. Se debe resaltar que las concentraciones de estos metales pesados dependerán en gran parte de las características del aire, del suelo, del agua y de la resistencia de los seres vivos a estos contaminantes 49.
Esta revisión abarca la relación de varios nutrientes con la EM teniendo en cuenta tanto estudios observacionales como experimentales. Pese a los resultados, hay varios aspectos que se deben considerar para la interpretación de los resultados: varios datos obtenidos de los estudios observacionales fueron autodiligenciados y con percepciones propias del paciente; para ambos tipos de estudios el tamaño de la muestra, la distribución por sexo, las posibles variaciones entre las poblaciones y la ubicación geográfica pueden llevar a modificaciones de los resultados. En cuanto a los estudios experimentales, en algunos casos, el tiempo de intervención fue limitado. Tanto los síntomas presentes en la EM como las intervenciones nutricionales son diversas; sin embargo, la cantidad de investigación que se enfoca en una sola característica es insuficiente.
En conclusión, los pacientes con EM presentan un consumo por debajo de las recomendaciones, en especial, de tiamina, zinc, selenio y ácidos grasos poliinsaturados, este último es el más reportado. Su alimentación hasta el momento no debe cumplir con requerimientos especiales, solo es necesario obtener la ingesta diaria recomendada de todos los nutrientes y evitar las restricciones o dietas extremas. Niveles séricos más bajos comparados con los controles fueron descritos en la vitamina D, vitamina E, vitamina K, folato, B12, magnesio, hierro y zinc. Las personas con deficiencias de algunos de los nutrientes podrían beneficiarse de la suplementación. Una dieta dentro de un patrón similar al mediterráneo se correspondió con la disminución en la fatiga y menores tasas de recaída. Por su parte, altos niveles de homocisteína fueron predictores de deterioro cognitivo. La deficiencia de vitamina K se relacionó con lesiones del nervio óptico. Las funciones antiinflamatorias, antioxidantes y reguladoras de los nutrientes, como los ácidos grasos poliinsaturados, el selenio, el zinc, el magnesio, la vitamina B12 y la vitamina K, contribuyen al manejo integral del paciente con EM. A pesar de los resultados, se requiere y se hace necesario un número mayor de estudios que permita precisar la efectividad y el impacto de la intervención nutricional según la evolución de la enfermedad.