Introducción
Durante los últimos 20 años, significativos avances en el desarrollo de hipótesis filogenéticas alrededor de las ranas dendrobátidas han permitido en parte evaluar, delimitar, direccionar y entender las relaciones evolutivas de este complejo grupo biológico (Coloma, 1995; Vences et al., 2000; Grant y Rodríguez, 2001; Vences et al., 2003; Santos et al., 2003; Grant et al., 2006; Páez-Vacas et al., 2010; Pyron y Wiens, 2011; Santos et al., 2014; Grant et al., 2017).
Sin embargo, aún hoy en día existe una gran dificultad para cualquier taxónomo de establecer un diagnóstico contundente en base a rasgos morfológicos del grupo para diferenciar los géneros Hyloxalus y Allobates, así se empleen combinaciones de estado de caracteres (Anganoy, 2013). Tal dificultad se debe a la ambigüedad existente en aquellos rasgos que han sido propuestos como una novedad evolutiva que permite diferenciar a un taxón de otro, lo que resulta en que pocos caracteres (sinapomorfías únicas) sirven de diagnóstico (Tabla 1). Así es como se evidencia que parte de las propuestas vigentes en la asignación genérica con base en rasgos morfológicos son imprecisas y están soportadas únicamente desde una perspectiva molecular donde a medida que se agregan más taxones terminales a la matriz o más genes secuenciados e incluidos, la clasificación resultante puede cambiar (Zardoya y Meyer, 1996; San Mauro et al., 2004; Grant et al., 2017).
Tabla 1 Resumen de los rasgos morfológicos empleados en las diagnosis vigentes de los géneros Allobates e Hyloxalus (Grant et al., 2006, 2017). Acorde con Grant et al. (2017) el género Hyloxalus carece de sinapomorfias fenómicas optimizadas.
| Carácter | Hyloxalus (sensuGrant et al. 2006) | Allobates (sensuGrant et al. 2006) | Allobates (sensuGrant et al. 2017) |
|---|---|---|---|
| 1) Coloración dorsal | Usualmente críptica (gris, café a negro) | Críptica en muchas especies | - |
| 2) Banda lateral oblicua | Presente | Presente/ausente | Presente difusa |
| 3) Banda dorsolateral pálida | Ausente (mayoría)/ presente | Ausente/presente | - |
| 4) Banda ventrolateral pálida | Ausente usualmente | Ausente/presente | Presente |
| 5) Textura dorsal de la piel | Posteriormente granular | Posteriormente granular/muy granular en el grupo femoralis | - |
| 6) Membrana interdigital pedial | Ausente (mayoría), basal o extensiva | Ausente, basal (mayoría) | - |
| 7) Tercer dedo manual en los machos (*= cuarto dedo sensu Grant et al. 2017) | No expandido | Expandido/No expandido | Expandido |
| 8) Relación entre los dedos I-II manual (II-III manual sensuGrant et al. 2017) | I más corto que el dedo II | I más largo que el dedo II en la mayoría de las especies (igual o más corto en algunas). | - |
| 9) Discos de los dedos manuales | Estrechos a moderadamente expandidos | Débilmente expandidos | - |
| 10) Proceso lingual medial | Ausente | Ausente | - |
| 11) Posición del tubo cloacal larval | Dextral | Dextral | - |
| 12) Forma del disco oral de las larvas | Normal (no umbeliforme) | Normal (no umbeliforme) | - |
| 13) Disco oral | Emarginado | Emarginado | - |
| 14) Alcaloides lipofílicos | Ausentes | Ausentes | - |
| 15) Número de cromosomas | 2n = 22 (conocidos en 3 especies) | 2n = 22 (conocidos en 3 especies) | - |
| 16) Coloración de los testículos | Despigmentados en muchas especies | Despigmentados | - |
| 17) Collar en la garganta | Ausente | Ausente | - |
| 18) Relación del dedo manual IV con el tubérculo subarticular distal del dedo III (*= V con el tubérculo subarticular distal del IV, sensu Grant et al. 2017; | - | Alcanza la mitad distal (ver definición Allobatinae sensuGrant et al. 2006) | No alcanza |
Durante trabajos de campo en los bosques subandinos de las montañas del municipio de Santa María en el departamento de Boyacá desarrollados en abril de 2017, se obtuvo una serie de ejemplares en diferentes estados de desarrollo biológico (larvas libres, ejemplares nodriza y formas maduras de ambos sexos), pertenecientes a una forma indescrita que según evidencia morfológica (sensuGrant et al., 2006) pertenece al género Allobates (carácter 8 en Tabla 1), siendo similar en su morfología con Allobates picachos.
Recientes análisis filogenéticos (Grant et al., 2017) transfieren a A. picachos, junto con A. cepedai, al género Hyloxalus. Esto evidencia la problemática de la ambigüedad frente a los caracteres morfológicos, debido a que estas dos especies presentan el tercer dedo manual ensanchado (condición considerada ausente en la diagnosis para Hyloxalus, sensuGrant et al., 2006 [= cuarto dedo manual sensuGrant et al., 2017]), y en el caso de Hyloxalus cepedai presenta una banda pálida ventrolateral (considerada una sinapomorfia sin ambigüedades optimizadas para el género AllobatesGrant et al., 2017).
El género Hyloxalus en Colombia está representado por 22 especies nominales (Acosta-Galvis, 2017, http://www.batrachia.com) con mayor riqueza en los Andes. Se distribuyen desde las tierras bajas hasta los páramos, concentrando el mayor número de especies en los bosques de niebla (Boulenger, 1912; Cochran y Goin, 1970; Silverstone, 1971; Edwards, 1974; Silverstone, 1975; Lynch, 1982; Rivero y Serna, 1986; Rivero y Granados, 1990 “1989”; Myers, 1991; Rivero y Serna, 1991; Rivero, 1991; Rivero y Serna, 1995; Grant y Castro, 1998; Ardila-Robayo et al., 1999; Ardila-Robayo y Acosta-Galvis, 2000; Grant y Ardila-Robayo, 2002; Morales, 2002, “2000”; Grant et al., 2006; Bernal y Lynch, 2008; Sánchez, 2013; Anganoy, 2013).
De las especies reportadas para el país, ocho se distribuyen en la cordillera Oriental (Figura 1), de las cuales tres habitan en las estribaciones cisandinas. Una de ellas es endémica de las estribaciones orinoscences (Hyloxalus cepedaiMorales, 2002, “2000”) con reportes en los departamentos de Boyacá, Casanare, Cundinamarca y Meta entre los 500 -1123 m s.n.m.) (Morales, 2002, “2000”; Lynch, 2006; Angarita-Sierra et al., 2013; Pedroza-Banda et al., 2014; Acosta-Galvis, 2017) y dos especies de las estribaciones amazónicas al suroriente de la cordillera Oriental (Hyloxalus saltuarius (Grant y Ardila-Robayo, 2002) e Hyloxalus picachos (Ardila-Robayo et al., 1999), de los bosques subandinos (1200-1600 m s.n.m.) en el departamento de Caquetá, endémicas del Parque Nacional Natural Los Picachos) (Ardila-Robayo et al., 1999; Grant y Ardila-Robayo, 2002; Bernal y Lynch, 2008).
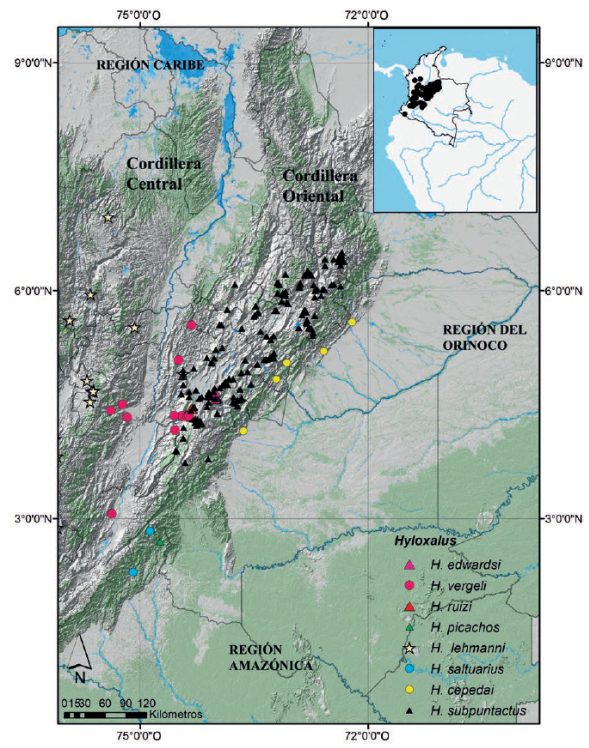
Figura 1 Mapa de distribución de las especies del género Hyloxalus en la cordillera Oriental de Colombia basados en literatura científica (Silverstone, 1971; Lynch, 1982; Ardila-Robayo et al., 1999; Ardila-Robayo y Acosta-Galvis, 2000; Grant y Ardila-Robayo, 2002; Morales 2002, “2000” ; Bernal y Lynch, 2008; Sánchez, 2013; Anganoy, 2013).
En concordancia con las hipótesis filogenéticas propuestas por Grant et al. (2017), sumado a la similitud morfológica identificada con Hyloxalus picachos (y en ausencia de análisis de este taxón terminal en un contexto filogenético), describimos y asignamos esta nueva especie tentativamente al género Hyloxalus (Anexo 1).
Materiales y métodos
Trabajo de campo y colección de referencia. La nueva especie fue registrada en la expedición de campo conducida en la Reserva Natural Privada Bosque La Almenara, municipio de Santamaría (4°53’10.3”N; 73°15’34”O, 1289 m s.n.m.), departamento de Boyacá y localizada en los bosques de niebla de la vertiente Oriental de la cordillera Oriental de los Andes. La localidad está constituida por bosques protegidos con más de 20 años de regeneración y localizada en la ecorregión de Apure-Villavicencio (Dinerstein et al., 1995; Olson y Dinerstein 2002). Las coordenadas geográficas y las elevaciones fueron registradas con un GPS Garmin GPSMAP 60CSx (datum WGS 84). Los especímenes fueron sacrificados empleando una solución de Benzocaína (Chen y Combs, 1999), fijados en una solución de formol al 10 %, preservados en etanol al 70 % y depositados en la colección de anfibios del Instituto de Investigación de Recursos Biológicos Alexander von Humboldt Colombia, Villa de Leyva, Boyacá, Colombia Suramérica. (IAvH-Am).
Morfología de los adultos. Los criterios empleados para la descripción morfológica y los caracteres diagnósticos siguen previas propuestas taxonómicas en este grupo de organismos (Myers et al., 1991; Coloma, 1995; Grant et al., 1997; Kaplan, 1997; Grant y Castro, 1998; Ardila-Robayo et al., 1999; Grant, 2004; Grant et al., 2006, Cisneros-Heredia y Mcdiarmid, 2007; Duellman y Lehr, 2009). Las observaciones morfológicas fueron realizadas mediante un estereoscopio Nikon optical devices SMZ-1B con luz de alta intensidad NI-150 Nikon y App Scope 3xSRA41. Las medidas y proporciones fueron registradas mediante un calibrador digital marca Mitutoyo (precisión ± 0,1 mm) y se siguieron los siguientes parámetros morfométricos: LRC (longitud rostro cloacal), AC (anchura cefálica), LC (longitud cefálica medida desde el borde del proótico hasta el extremo del rostro), DIN (distancia internarinas), DIO (distancia interorbital), DO (diámetro del ojo), DON (distancia ojo-narina), DT (diámetro timpánico), AP (anchura del párpado), LR (distancia entre el margen anterior del ojo hasta el extremo del rostro), AR (anchura rostral), LT (longitud tibial), LF (longitud femoral), LPd (longitud del pie), LM (longitud manual), LAb (longitud del antebrazo), IIIDM (diámetro del disco del tercer dedo manual) y IVDP (diámetro del disco del cuarto dedo pedial). Los promedios de estas medidas morfométricas son reportados junto con la desviación estándar. La madurez sexual fue determinada por la evaluación de rasgos sexuales secundarios. Machos con saco y hendidura vocal fueron identificados como adultos y las hembras fueran identificadas por su coloración del vientre y la ausencia de sacos vocales. Los especímenes in vivo fueron fotografiados con una cámara Canon EOS 70D y los ejemplares preservados con una cámara digital Canon EOS 5D Mark II y una caja de luz Safe-box and LED light que emplea luces de 5500 Kelvin.
Morfología de las larvas. Los especímenes fueron fijados y preservados en formol al 10 %. Una serie de tres lotes de renacuajos en diferentes estadios de desarrollo fueron obtenidos e incluyen renacuajos libres (lote IAvH-Am-14680), larvas de machos nodriza (IAvH-Am-14675, IAvH-Am-14658) y una pequeña serie de especímenes desarrollados in situ para un total de 69 ejemplares estudiados entre los estadios 26-41 (sensuGosner, 1960) (Anexo 2). Los estados de desarrollo, la morfología del disco oral, la formula dentaria y las variables morfométricas empleadas son basadas en previas contribuciones (Gosner, 1960; Altig y McDiarmid, 1999; McDiarmid y Altig, 1999; Lima et al., 2009, 2010; Anganoy-Criollo, 2013). El color in vivo fue descrito a partir de las Fotos y notas de campo. Las medidas estándar registradas para los renacuajos son las siguientes: LT (longitud total desde el extremo del rostro hasta el extremo apical de la región caudal), LC (longitud del cuerpo desde el extremo del rostro hasta la base de la musculatura caudal), LCD ( longitud caudal desde la base de la musculatura caudal hasta el extremo apical de la cola), ACo (mayor altura del cuerpo), AnCo (mayor anchura del cuerpo), ACf (anchura cefálica a la altura de los ojos), Mcd (altura de la musculatura caudal en la base de la cola), Amcd (anchura muscular en la base de la cola) MxAcd (máxima altura de la cola), DR-N (distancia desde el extremo del rostro hasta la porción anterior de la narina), DIN (distancia Internarinas), DIO (distancia interorbital), DO (diámetro del ojo), O-N (distancia ojo-narina), DNR (distancia narina rostro), Ltc (longitud del tubo cloacal), Atc (anchura del tubo cloacal), Ado (anchura disco oral), Hdo (altura del disco oral) y Dae (distancia del rostro a la abertura espiracular). Las medidas morfométricas fueron registradas empleando los mismos equipos presentados en la morfología de los adultos y la morfología del disco oral fue evaluada y fotografiada empleando un estereoscopio digital Leica MC 190-HD.
Vocalizaciones. La vocalización de un ejemplar fue grabado a 1 m de distancia el 30 de abril de 2017 a un ejemplar localizado sobre la hojarasca asociada a bosque natural a las 13:19 horas. Fue registrada mediante una grabadora digital Marantz PMD 671 con un micrófono unidireccional Sennheiser MKH 60 P48. El análisis de la vocalización fue realizado mediante el software Raven 1.4 para Windows (Charif et al., 2010), que incluye vocalizaciones a 44.1 KHz y 16-bits de resolución y para el análisis se empleó un FFT (Fast Fourier Transformation) = 256 y una superposición (Overlap) = 50. Los siguientes parámetros, que incluyen variables espectrales y temporales, siguen diferentes propuestas (Duellman y Pyles, 1983; Cocroft y Ryan, 1995; Coloma, 1995; Lima et al., 2009; Kok, 2010; Lima et al., 2010; Koch et al., 2011; Kok et al., 2013; Köhler et al., 2017) que incluyen: 1. Llamado (definido por la unidad acústica principal en una vocalización; un llamado está separado de otro por silencio), 2. Duración de la llamada (la duración de una sola llamada, independientemente de si está compuesta por una o varias notas), 3. Nota (subunidades más pequeñas, casi siempre separadas por intervalos de silencio, el llamado se suele dividir en notas), 4. Número de notas por llamada (número de señales acústicas reconocibles en una llamada), 5. Duración de una nota (duración de una nota dentro de una llamada; medida desde el principio hasta el final de la nota), 6. Duración de los intervalos entre notas, pulso (ráfagas de sonido dentro de una nota), 7. Número de pulsos por nota, frecuencia dominante (la frecuencia de mayor energía) y número de armónicos (número de armónicos presente en las llamadas). Las grabaciones fueron depositadas en el Banco de Sonidos Ambientales (BSA), del Instituto Humboldt con el número BSA-15986 y las URL con las vocalizaciones están disponibles en http://colecciones.humboldt.org.co/rec/sonidos/BSA-15986/
Resultados
Hyloxalus sanctamariensis sp. nov.
urn:lsid:zoobank.org:act:C06E11C1-FDE2-43FA-8260-717CF7E193FE
Holotipo (Figura 2): macho adulto, IAvH-Am-14658 (número de Campo ARA 7630), colectado por Andrés Acosta, Adrián Pinzón, Nicolás Muñoz y Mariana Pineda el 30 de abril de 2017, y depositado en la colección de anfibios del Instituto de Investigación de Recursos Biológicos Alexander von Humboldt Colombia, Villa de Leyva, Boyacá, Colombia.

Figura 2 Hyloxalus sanctamariensis sp. nov. Holotipo IAvH-Am-14658, macho adulto preservado en etanol 70 %, LRC = 18,0 mm. A. Vista dorsal. B. Vista ventral. C. Vista lateral. Fotografías: Andrés Acosta.
Localidad típica. Reserva Natural Privada Bosque La Almenara (04° 53´ 10,3” N y 73° 15´´3,4” O, 1289 m s.n.m), municipio de Santa María, departamento de Boyacá, (Figura 3, Figura 15).

Figura 3 Panorámica de los hábitats y microhábitats de la localidad típica de Hyloxalus sanctamariensis. A. Panorámica de las áreas intervenidas al interior del bosque en la Reserva la Almenara. B. Microhábitats de las charcas de reproducción formadas por escorrentía del Bosque. C-D. Panorámica al interior del Bosque en la Reserva la Almenara. Fotos: Adrián Pinzón.
Paratipos. (Figura 4): machos adultos IAvH-Am-14673-5 y hembras adultas IAvH-Am-14654-5, IAvH-Am-14659, IAvH-Am-14672 colectados con el holotipo el 30 de Abril de 2017, colectados por Andrés Acosta, Adrián Pinzón, Nicolás Muñoz y Mariana Pineda.

Figura 4 Serie típica in vivo (vista lateral y frontal) de Hyloxalus sanctamariensis sp. nov. A-B. Paratipo, macho adulto IAvH-Am-14675 (LRC = 16,9 mm). C-D. Paratipo, macho adulto IAvH-Am-14674 (LRC = 18,1 mm). E-F. Paratipo, hembra adulta IAvH-Am-14659 (LRC = 17,2 mm). G-H. Vista lateral, frontal y reversa en macho adulto IAvH-Am-14673(LRC = 17,8 mm). I-J. Vista Lateral, frontal y reversa hembra adulta IAvH-Am-14672 (LRC = 17,1mm). K-L. Vista Lateral, frontal y reversa hembra adulta IAvH-Am-14673 (LRC = 17,8 mm). Fotos: Andrés Acosta.
Ejemplares referidos. Ejemplar juvenil IAvH-Am-14647, Quebrada La Cristalina (4° 50´ 53,6” N y 73° 16´´21” O, 869 m s.n.m.), municipio de Santa María, departamento de Boyacá.
Etimología. El epíteto específico hace alusión al municipio de Santa María situado en el sureste de la Provincia de Neira, en el departamento de Boyacá; área geográfica donde fue encontrada la especie.
Definición. Una especie tentativamente asignada al género Hyloxalus y reconocible por la siguiente combinación de caracteres (1) LRC en machos adultos 16,9-18,1 mm (17,7 ± 0,5, n = 4); hembras adultas 17,1-20,1 mm (18,3 ± 1,4,n = 4); (2) Disco del dedo manual III (dedo manual IV sensuGrant et al. 2017) no expandido, la anchura de la falange adyacente equivale al 59,7-90,5 % (Figura 7); (3) dedo manual I (dedo manual II sensu Grant et al., 2017), ligeramente más largo o igual que el II (dedo manual III sensuGrant et al., 2017) (Figura 7); (4) rebordes dérmicos en el margen externo de los dedos manuales y pediales (siendo más evidentes); (5) discos de los dedos pediales moderadamente expandidos, la anchura de la falange adyacente al IV dedo pedial, equivale al 49,3-77,1 % en el disco del dedo IV (Figura 7); (6) rebordes dérmicos en la margen externa de los dedos pediales evidentes (Figura 7); (7) pliegue tarsal externo ausente; tubérculo tarsal interno prominente y elongado a manera de pliegue; (8) palmeadura basal entre los dedos pediales II-III-IV; (9) banda dorsolateral ausente; (10) banda lateral oblicua presente continua que se extiende desde la ingle hasta el extremo del rostro (Figura 6); (11) banda ventrolateral ausente; (12) garganta, pecho y vientre, presentan dimorfismo sexual evidente; en los machos adultos es café violáceo y en las hembras crema a amarillo pálido (Figura 7); (13) III dedo manual (dedo manual IV sensu Grant et al. 2017) no ensanchado en los machos (Figura 5); (14) testículos blancos; (15) tubérculos cloacales ausentes (16) proceso medial lingual ausente (17) la vocalización está definida por una frecuencia dominante entre 4213,3-5828,2 Hz y un duración de cada nota que varía entre 0,062-0,09 s (Figura 9, Figura 10).

Figura 5 Hyloxalus sanctamariensis sp. nov. Paratipo IAvH-Am-14673 macho adulto. A. Vista ventral de la palmeadura manual. B. Vista ventral de la palmeadura pedial, Escala igual = 1 mm. Fotos: Andrés Acosta.

Figura 6 Variación de las superficies lateral y muslo posterior in vivo de Hyloxalus sanctamariensis sp. nov. A-B. Hembra adulta IAvH-Am-14659(LRC = 17,2 mm). C-D. Macho adulto IAvH-Am-14673 (LRC= 17,8 mm). E-F. Hembra adulta, IAvH-Am-14672 (LRC= 17,1 mm). G-H. Macho adulto IAvH-Am-14674(LRC = 18,1 mm). I-J. Macho adulto IAvH-Am-14675(LRC= 16,9 mm). Fotos: Andrés Acosta.

Figura 7 Coloración ventral que indica el dimorfismo sexual de la serie típica de Hyloxalus sanctamariensis sp. nov. A. Macho adulto IAvH-Am-14675 (LRC = 16,9 mm). B. Macho adulto IAvH-Am-14673 (LRC = 17,8 mm). C. Hembra adulta IAvH-Am-14672 (LRC = 17,1 mm). D. Hembra adulta IAvH-Am-14655 (LRC = 18,6 mm). E. Hembra adulta IAvH-Am-14659 (LRC = 17,2 mm). Fotos: Andrés Acosta.
Diagnosis. Ocho especies de Hyloxalus son reportadas en la cordillera Oriental, donde tres tienen sus distribuciones asociadas a las vertientes andinas asociadas a la región cisandina de Colombia (Figura 1). En adición a esta riqueza regional, Hyloxalus sanctamariensis sp. nov. es una rana de tamaño medio que carece de banda ventrolateral (Figura 8D). Este rasgo está presente en Hyloxalus cepedai junto con dos especies de Allobates (A. femoralis [Figura 8B] y A. juanii [Figura 8C]).

Figura 8 Vista lateral de algunas de las especies de Dendrobatoidea presentes en las estribaciones del piedemonte de la cordillera Oriental de Colombia (Anexo 2). A. Hyloxalus cepedai proveniente de Yopal, departamento de Casanare, macho adulto IAvH-Am 10713. B. Ejemplar liberado de Allobates femoralis del Parque Nacional Güeppi-Sekime, provincia de Maynas del departamento de Loreto, Perú. C. Allobates juanii, sitio Pozo Azul, municipio de Villavicencio, departamento del Meta, macho adulto MUJ 3364. D. Hyloxalus sanctamariensis sp. nov. sitio La Almenara, departamento de Boyacá, hembra adulta, IAvH-Am-14672. Fotos: Andrés Acosta.

Figura 9 Llamado (con 5 notas) de un macho adulto de Hyloxalus sanctamariensis BSA-15986, grabado en la localidad típica en La Reserva La Almenara, Santa María, Boyacá. A. Oscilograma. B. Espectrograma muestra entre 5-6 armónicos por nota; http://colecciones.humboldt.org.co/rec/sonidos/BSA-15986/.

Figura 10 Nota individual de Hyloxalus sanctamariensis sp. nov. A. Oscilograma. B. Espectrograma con 6 armónico. C. Espectro de poder. BSA-15986, grabado en la localidad típica en La Reserva La Almenara, Santa María, Boyacá; http://colecciones.humboldt.org.co/rec/sonidos/BSA-15986/.
Hyloxalus sanctamariensis sp. nov también difiere de H. cepedai por la ausencia de una banda dorsolateral (presente en H. cepedai, Figura 8A), la banda lateral oblicua presente (ausente H. cepedai), palmeadura basal entre los dedos pediales II-III-IV (presente en III-IV en H. cepedai), el tercer dedo manual (IV dedo manual sensuGrant et al., 2017) no ensanchado en los machos adultos (ensanchado en H. cepedai), la duración de una nota individual varía entre 0,062-0,09 s (0,029-0,048 s en H. cepedai) mientras que la duración entre notas varía entre 0,281-0,92 s (0,094-0,133s en H. cepedai). Hyloxalus sanctamariensis sp. nov. es muy similar a Hyloxalus picachos dado que comparten una banda lateral oblicua, la ausencia de banda ventrolateral y presentan una palmeadura basal entre los dedos pediales II-III-IV, pero difieren entre sí por la coloración in vivo del iris siendo cobre con retículos negros (amarillo-dorado con retículos gruesos en H. picachos) y la banda lateral oblicua se extiende hasta el rostro (alcanza hasta el tímpano o es ausente en H. picachos).
Al realizar comparaciones con las restantes especies de la cordillera Oriental, Hyloxalus sanctamariensis sp. nov. puede ser distinguida de Hyloxalus lehmanni y H. saltuarius por la ausencia de glándula en el brazo; difiere de H. edwardsi y H. ruizi por la ausencia de un escudo anal (presente en H. edwardsi y H. ruizi), la palmeadura basal entre los dedos pediales II-III-IV (membrana extensiva en H. edwardsi y H. ruizi) y la presencia de hendiduras vocales en los machos adultos (ausentes en H. edwardsi y H. ruizi). Hyloxalus sanctamariensis sp. nov. es fácilmente reconocible de H. vergeli por presentar la palmeadura basal entre los dedos pediales II-III-IV (membrana extensiva en H. vergeli). Finalmente, de Hyloxalus sanctamariensis sp. nov. difiere de H. subpunctatus porque los machos adultos presentan el saco vocal y el pecho pigmentado (crema en los machos adultos de H. subpunctatus) menor tamaño corporal, los machos adultos 16,9-18,1 mm, mientras que las hembras adultas 17,1-20,1 (machos adultos 15,5-23,1 mm, hembras adultas 15,5-27,5 mm en H. subpunctatus), y 124 llamados por minuto (60 llamados por minuto sensuNavas y Biever, 2001).
Descripción y variación de la serie típica (Figura 4, Figura 6). La variación morfométrica es presentada en la Tabla 1. Machos adultos entre 16,9-18,1 mm (n = 4) de longitud rostro cloacal (LRC) con la garganta y pecho oscuros, hembras adultas 17,1-20,1 mm (n = 4) con las superficies ventrales inmaculadas (Figura 7). Piel de las superficies dorsales y laterales en la región cefálica, parpados y la porción anterior del tronco lisas (a nivel de los párpados medialmente un tubérculo aplanado en IAvH-Am-14675), mientras que la porción posterior es granular extendiéndose hasta los miembros posteriores; tubérculos cloacales ausentes.
Anchura cefálica (a nivel de la base mandibular) equivale al 28,8-34,8 % de la longitud rostro cloacal, y el 79,8-92,7 % de la longitud cefálica. La distancia interorbital equivale al 35,5-50,1 % de la anchura cefálica. Rostro corto, redondeado en vista dorsal entre las narinas, en vista lateral inclinado y redondeado. Canthus rostralis bien definido y redondeado. Región loreal casi aplanada con una débil concavidad que se inclina hacia la parte externa del labio superior. Diámetro del ojo equivale al 30,7-37,8 % de la longitud cefálica. Distancia del ojo a la narina equivale al 60,8-75,1 % de la longitud del rostro, y al 80,8-97,7 % del diámetro del ojo. Narinas externas algo protuberantes, ovaladas y orientadas posterodorsalmente. Tres cuartas partes del anillo timpánico visibles en su porción antero-ventral, su diámetro equivale al 43,2-54,0 % del diámetro del ojo. Dientes presentes en el arco maxilar.
Miembros anteriores esbeltos, longitud del antebrazo equivalente al 18,9-22,1 % de la LRC y al 67,8-80,0 % de su longitud manual. La longitud manual equivale al 25,3-28,7 % de su LRC. Discos de los dedos manuales moderadamente expandidos, la anchura de la falange adyacente al dedo III manual (dedo manual IV sensuGrant et al., 2017) equivale al 59,7-90,5 % en el disco del dedo III. Tercer dedo manual (dedo manual IV sensuGrant et al., 2017) no expandido en los machos adultos (levemente en el ejemplar tipo, IAvH-Am-14658). Rebordes dérmicos ausentes en los dedos manuales. Dedo I manual (= dedo manual II sensuGrant et al., 2017) más largo (usualmente) o casi igual que el dedo II (=dedo manual III sensuGrant et al., 2017). El disco del dedo manual II (dedo manual III sensuGrant et al., 2017) entra en contacto con el último tubérculo subarticular del dedo III (dedo manual IV sensuGrant et al., 2017); el disco del dedo manual IV (dedo manual V sensuGrant et al. 2017) no sobrepasa el último tubérculo subarticular del dedo III (dedo manual IV sensuGrant et al., 2017). Longitud relativa de los dedos manuales III>IV≥II>I (IV>V≥III>II sensuGrant et al., 2017). Tubérculos subarticulares 1-1-2-2. Tubérculos supernumerarios ausentes, tubérculos subarticulares redondeados; tubérculo tenar ovoide; tubérculo palmar redondeado y prominente; la relación entre el tubérculo palmar y tenar equivalente en diámetro; pliegues metacarpales ausentes.
Miembros posteriores relativamente robustos, longitud tibial equivale al 46,2-49,7 % de la LRC y la longitud pedial equivalente al 45,7-47,9 % de la LRC. Membrana interdigital pedial basal entre los dedos II-III-IV y rebordes dérmicos en la margen externa de los dedos pediales evidentes. Longitud relativa de los dedos pediales IV>III >V>II>I. Disco del dedo III pedial se extiende más allá de penúltimo tubérculo subarticular del dedo IV. El disco del dedo V entra en contacto con el penúltimo tubérculo subarticular del dedo IV pedial. Discos de los dedos pediales moderadamente expandidos, la anchura de la falange adyacente al IV dedo pedial, equivale al 49,3-77,1 % en el disco del dedo IV. Tubérculos subarticulares pediales 1-1-2-3-2. Tubérculos supernumerarios plantares ausentes (Figura 5); tubérculo metatarsal interno elíptico; tubérculo metatarsal externo subcircular más pequeño que el tubérculo metatarsal interno, el diámetro del tubérculo metatarsal externo equivale al 53,7-93,5 % del tubérculo metatarsal interno; tubérculo tarsal externo ausente; tubérculo tarsal interno prominente y elongado a manera de pliegue, siendo oblicuo al tarso, en algunos ejemplares se extiende en un pliegue delgado y corto orientado al tubérculo metatarsal (en el ejemplar IAvH-Am-14674 el pliegue entra en contacto con el tubérculo metatarsal interno).
Dimensiones del holotipo (en mm). Longitud rostro cloacal 18,0; longitud manual 4,5; longitud tibial 8,3; longitud pedial 8,4; anchura cefálica 5,8; longitud cefálica 6,5; diámetro del ojo 2,1; distancia ojo-narina 2,0; distancia internarinas 2,3; longitud rostral 2,7; distancia interorbital 2,3; diámetro del tímpano 0,9 y longitud del antebrazo 3,6.
Color in vivo (Figura 4, 6 y 7). Basado en las notas de campo y la serie típica fotografiada in situ; Hyloxalus sanctamariesensis sp. nov, presenta en sus superficies dorsales un color café acanelado con pequeñas manchas irregulares y un café más oscuro que se extiende desde el extremo rostral hasta la región urostilar; color de fondo de las superficies dorsales del muslo, tibia y el tarso igual al dorso, con barras transversales de color café oscuro; las superficies de los miembros anteriores café claras con algunas manchas dispersas e irregulares de color café oscuro; región anterior del antebrazo con una banda longitudinal café oscuro. Flanco cefálico y troncal con una banda dorsolateral de color crema que se extiende desde el extremo del rostro hasta la ingle; esta banda dorsolateral en su margen ventral esta bordeada por una banda café oscura que se extiende desde el rostro, cubre la porción superior del tímpano, se ensancha a la altura de las extremidades anteriores y se adelgaza hacia la región inguinal; región labial amarillo pálido con algunas manchas irregulares de color crema en los machos adultos esta región se encuentra pigmentada de color café. Porción anterior del flanco troncal café que se degrada a crema hacia la región ventrolateral con pequeñas manchas irregulares de color blanco mientras que la región inguinal varía de amarillo pálido a café claro. Iris cobre con retículos negros. Muslo anterior varía de amarillo pálido a café claro con una banda longitudinal café. Muslo posterior con color de fondo amarillo pálido a café cubierto de pequeñas reticulaciones y una banda longitudinal irregular de color amarillo pálido. Superficies ventrales con un marcado dimorfismo sexual (Figura 7): en los machos el saco gular de color café violáceo, mientras en las hembras es crema y amarillo pálido; el vientre en los machos es café violáceo y hacia la porción media es crema mientras en las hembras el vientre es crema uniforme. Región palmar y plantar café violáceo.
Color en preservación (etanol 70 %) (Figura 2). La coloración de las superficies dorsales se tornan café con manchas, pequeñas e irregulares café oscuras siendo en algunos ejemplares más densas; los muslos dorsales café claro con barras café oscuro; los miembros anteriores de color crema y algunos ejemplares presentan manchas dispersas de color café oscuro. En vista lateral las superficies del flanco cefálico la banda de la región loreal se torna café oscura y la región supralabial que varía de color crema en las hembras y con finas punteaduras café oscuro en los machos adultos; en la comisura labial unas manchas irregulares de color blanco, pero en algunos ejemplares de la serie estas manchas son visibles en la región infratimpánica e infraocular. La banda lateral oblicua de color crema bordeada en su región ventral por una banda café oscuro que disminuye en anchura hacia la región abdominal del flanco troncal. Región ventrolateral de color café claro con finas punteaduras café oscuro y en algunos ejemplares este patrón forma unas manchas irregulares crema. Superficies ventrales, exhiben un marcado dimorfismo sexual y en los machos la región del saco vocal, pecho y una porción del abdomen superior se tornan café; mientras que en las hembras adultas es crema.
Vocalizaciones. El llamado de Hyloxalus sanctamariensis sp. nov. está compuesto por notas simples emitidas a una tasa constante (Figura 9); con una tasa de vocalización de 124 notas por minuto. La duración de cada nota (Figura 10) varía entre 0,062-0,09 s (0,07 ± 0,006; n = 70) y entre 324-388 (355,7 ± 19,8; n = 44) oscilaciones por cada nota. La duración de los intervalos entre notas varía entre 0,281-0,92 s (0,112 ± 0,40; n = 70). La estructura espectral consiste en 5 armónicos con una frecuencia dominante entre 4213,3-5828,2 Hz (5056,2 ± 704,7; n = 90).
Transporte de las larvas y descripción del renacuajo. Dentro de la serie típica obtenida 2 machos adultos (Figura 11) fueron registrados transportando larvas en su dorso en estadios 26 (sensuGosner, 1960). Cada macho transportaba entre 10 (IAvH-Am-14675) y 6 (Holotipo, IAvH-Am-14658) individuos. Los renacuajos (Anexo 2, Figura 12) son de cuerpo ovoide y deprimido (Figura 12), con elementos condrocraneales visibles (Figura 13); el rostro en vista dorsal y lateral redondeado. Las narinas son pequeñas, subcirculares dirigidas anterodorsalmente. Sus ojos son orientados dorsolateralmente. Espiráculo siniestro, cónico, con la porción distal del tubo es libre, orientada posterolateralmente y conspicua. El tubo cloacal, unido al lado derecho de la aleta ventral y su abertura orientada a la derecha. La musculatura caudal es robusta; los miomeros son más conspicuos y separados entre sí, en la porción distal de la cola. La aleta dorsal, levemente es más ancha que la aleta ventral. El sistema de línea lateral no es visible.

Figura 11 Vista lateral de dos machos nodriza de Hyloxalus sanctamariensis sp. nov. transportando sus renacuajos en el dorso en estadio 26 sensuGosner, (1960). A-B. Vista lateral-reversa IAvH-Am-14675 (LRC = 16,9 mm). C. vista lateral IAvH-Am-14658 (LRC=18,0 mm). Fotos: Andrés Acosta.

Figura 12 Cambio Ontogénico in vivo de Hyloxalus sanctamariensis sp. nov. Lote IAvH-Am-14680; A. Vista lateral, estadio 26 obtenido del dorso del macho. Vida libre: B. Vista lateral estadio 28. C. Vista lateral, Estadio 37. D. Vista ventral, Estadio 37. E. Vista lateral estadio 40. F. Vista dorsal estadio 40. G. Vista lateral estadio 41. H. Vista lateral estadio 42. I. Vista lateral estadio 43. J. Vista lateral estadio 45. K. Vista lateral estadio 46. L. Vista lateral postmetamórfico. Fotos: Andrés Acosta.

Figura 13 Renacuajo de Hyloxalus sanctamariensis sp. nov., exhibiendo los elementos condrocraneales, Lote IAvH-Am-14680. A. Vista dorsal. B. Vista ventral. Fotos: Andrés Acosta.
El disco oral débilmente emarginado, orientado anteroventralmente bordeado por papilas marginales elongadas y de forma piramidal (Figura 14); las papilas marginales están dispuestas entre dos hileras en la región labial anterior y tres hileras en la posterior; picos córneos superior e inferior, pigmentados y aserrados en su borde.
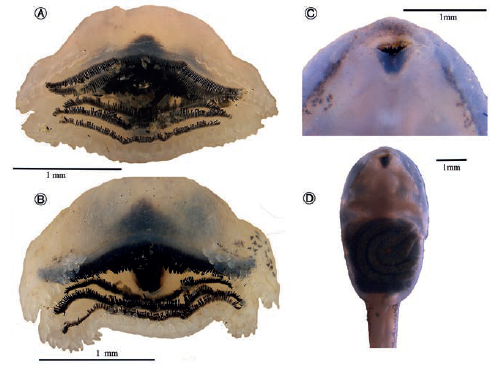
Figura 14 Vista ventral del disco oral de Hyloxalus sanctamariensis sp. nov. A. Estadio 29 (sensuGosner, 1960) exhibiendo la formula dentaria 2/3, papilas marginales y parte del pico córneo, lote IAvH-Am-14680; B) Estadio 41 (sensu Gosner 1960) exhibiendo las hileras P-1 a P-3, papilas marginales y parte del pico córneo anterior, lote IAvH-Am-14680. C-D. Renacuajo proveniente del dorso de parental, Estadio 26 (sensu Gosner, 1960) carente de formula dentaria y papilas marginales, siendo visible el pico córneo, lote IAvH-Am-14680.

Figura 15 Distribución de Hyloxalus sanctamariensis sp. nov. en los bosques subandinos de las estribaciones orientales de la cordillera Oriental; localidad típica (punto rojo).
Formula dental 2/3 (ausentes en algunos de los renacuajos de la espalda), hilera de dientes A-1 es completa, la hilera A-2 es interrumpida medialmente semejando dos hileras separadas por el pico córneo; numerosas papilas submarginales; pico córneo inferior en forma de V, y más angosto que el superior. La hilera de dientes P-1 es completa más angosta que las hileras P-2 y P-3; y P-3 de mayor longitud que P-2.
Color de los renacuajos in vivo (Figura 12). Las superficies dorsales del cuerpo de color café y las de la región caudal café más claro; el flanco cefálico café claro mientras que el flanco corporal café algo translucido con manchas irregulares más claras siendo el corazón e intestinos visibles; musculatura caudal crema con manchas irregulares café siendo más engrosadas en la base de la cola y difusas en la región más distal; aletas dorsal y ventral translucidas con el mismo patrón de la musculatura caudal; iris negro con punteaduras cobre. Superficies ventrales de la región corporal translucidas siendo visibles la región branquial y los intestinos; con algunas manchas irregulares de color blanco. Se evidencia que algunos de estos patrones de coloración cambian parcialmente durante el desarrollo ontogénico: en estadio 26 la superficie del cuerpo es café más oscura con algunas punteaduras crema: en estadio 38 el cuerpo es más claro y son notables las manchas irregulares café sobre la región abdominal y en estadio 40 el cuerpo se torna más homogéneo en coloración.
Color en preservación de los renacuajos (Formol 10 %). La porción anterior de la superficie dorsal en la región cefálica café claro, con elementos condrocraneales visibles. La región abdominal en vista dorsal café oscura. En vista lateral las superficies anteroventrales del rostro translucida y hacia la región infraorbital crema con finas punteaduras café oscuras mientras que la porción abdominal en la región dorsolateral y medial café oscura y la porción ventrolateral translucida siendo evidente la masa abdominal. La musculatura caudal crema, los miomeros visibles mientras que las aletas dorsal y ventral son translucidas con algunas manchas irregulares café, siendo en la porción anterior más concentradas y algunas de ellas forman retículos; mientras que en la porción más distal reducen su tamaño. Las superficies ventrales translucidas siendo evidente el disco oral donde el pico es negro al igual que los dentículos; los elementos condrocraneales son visibles de color crema y la masa intestinal café clara.
Distribución. Allobates sanctamariensis sp. nov. es conocida de dos localidades asociadas a los bosques subandinos pluviales circunscritas al interior del municipio de Santa María en el departamento de Boyacá entre 869-1289 m s.n.m. en las estribaciones orientales de la cordillera Oriental de Colombia (Figura 15).
Historia natural. Hyloxalus sanctamariensis sp. nov. es una especie diurna que habita en los bosques subandinos relictuales con cerca de 40 años de restauración (Figura 3). En estos ecosistemas el régimen de lluvias puntual es monomodal y son áreas con alta pluviosidad de 80,5-89,6 % de humedad relativa media anual y una precipitación promedio de 322 mm anuales. Siendo los meses de menor precipitación diciembre-enero de 58,2 mm y los de mayor mayo-julio con 576 mm, estos valores de precipitación coinciden con la estación reproductiva de la especie. Su actividad biológica es evidente después de lloviznas acompañadas de sol donde los machos adultos vocalizan entre la hojarasca protegiendo pequeños territorios. Durante el trabajo de campo se observaron varios ejemplares desplazándose y vocalizando activamente. Sus abundancias relativas son elevadas, ya que en 3 horas de trabajo se colectaron 8 adultos y se registraron más de 15 ejemplares adicionales junto con un número de renacuajos libres y posmetamórficos en diferentes estadíos de desarrollo en los canales de escorrentía. Los renacuajos son categorizados de tipo exotrófico, loticos (McDiarmid y Altig, 1999) y detritívoros. Hyloxalus sanctamariensis sp. nov. es simpátrica, pero no sintópica con Rheobates palmatus dado que en una de las localidades donde se reportan H. sanctamariensis sp. nov. está asociada a las márgenes y bosque protector de cauce alrededor de pequeñas quebradas de curso lento mientras que R. palmatus se registra al interior de pocetas en el cauce de las quebradas.
Discusión
Respecto a algunos aspectos puntuales de H. sanctamariensis sp. nov. y su similitud con otras especies de la cordillera Oriental, se puede evidenciar que uno de los aspectos comportamentales y a su vez considerada una sinapomorfia propuesta por Grant et al. (2006) es la condición del sexo del ejemplar nodriza; se identifica de esta manera que los machos de H. sanctamariensis sp. nov. transportan sus renacuajos (Figura 11) y este comportamiento considerado primitivo, es compartido con otras especies de la cordillera Oriental como H. subpunctatus de las partes altas en los Andes (Fandiño et al., 1998). Sin embargo, las implicaciones evolutivas de este comportamiento no han sido documentadas en la totalidad de las especies colombianas (Tabla 3), lo que requiere de mayor evidencia para sus análisis (Grant et al., 2006).
Tabla 3 Síntesis del estado de conocimiento de las especies reportadas de los géneros Allobates e Hyloxalus en Colombia, basado en los referentes básicos de su historia natural.

Otro caracter corresponde al patrón de la coloración caudal de las larvas (estados de carácter 87 sensuGrant et al., 2006), que es un rasgo no estudiado en casi todas las descripciones de las especies colombianas (Tabla 3) y por lo tanto requiere mayor evaluación al emplear combinaciones con otros caracteres larvales (Anganoy-Criollo, 2013; Sánchez, 2013). En Hyloxalus sanctamariensis sp. nov. este rasgo es estable durante el desarrollo ontogénico (Figura 12) con un patrón de manchas (melanóforos) irregulares (condición 1, sensuGrant et al., 2006) que a priori es descrito en Hyloxalus pulchellus (sensuColoma, 1995), Hyloxalus bocagei (Páez-Vacas et al., 2010), Hyloxalus edwardsi (sensuLynch, 1982) e Hyloxalus subpunctatus (sensuAnganoy-Criollo, 2013, cuya variación incluye condiciones 1 y 2).
Así mismo, otro rasgo considerado pleisiomórfico entre los dendrobátidos es la presencia de una banda lateral oblicua completa (Myers et al., 1991; Grant et al., 2006; Anganoy-Criollo, 2012) que en Hyloxalus sanctamariensis sp. nov. es compartida con H. picachos y Allobates ranoides de las estribaciones andinas en la cordillera Oriental, siendo un rasgo estable en todos los ejemplares adultos (Figura 6) y es conspicuo en las larvas (Figura 12) a partir de los estadios de desarrollo 41 (sensuGosner, 1960).
Los recientes cambios nomenclaturales propuestos para Hyloxalus picachos y H. cepedai reflejan de forma puntual la problemática y limitaciones de las propuestas previas en la asignación genérica de algunas especies, basados en rasgos morfológicos y su congruencia con las hipótesis filogenéticas basados en datos moleculares; aún si empleamos sinapomorfias optimizadas inequívocamente como la presencia de banda ventrolateral pálida en el género Allobates que está presente en Hyloxalus cepedai (Morales, 2002; Grant et al., 2017) (Figura 8A). Esto conduce a la necesidad de mayor evidencia, ya que si evaluamos como marco de referencia la información biológica disponible de las 22 especies colombianas asignadas al género Hyloxalus, junto con las 12 especies de Allobates (Acosta-Galvis, 2017, http://www.batrachia.com), la información sobre sus estados larvales, secuencias moleculares y vocalizaciones es limitada y heterogénea (Tabla 3). Bajo esta apreciación, uno de los retos en la generación robusta de hipótesis filogenéticas esta cimentada en adecuados métodos de inferencia, junto con la obtención y consolidación de esta evidencia con el objeto de medir los procesos de especiación y sus implicaciones evolutivas.















