Introducción
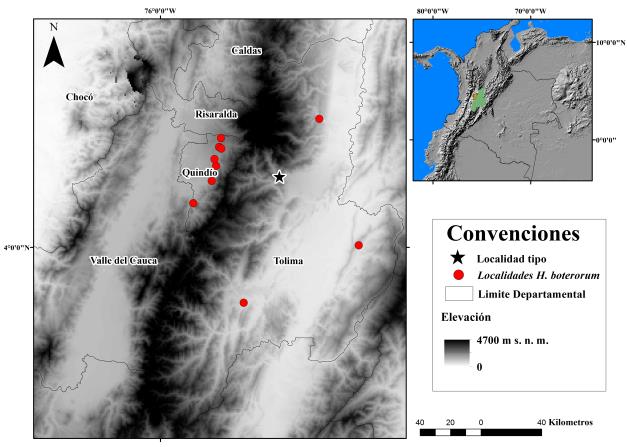
Los Amblypygi son un orden de Arachnidaque se distribuye principalmente en la región tropical. Se caracterizan por presentar un cuerpo dorsoventralmente aplanado, pedipalpos ornamentados con espinas y un primer par de patas largas y delgadas (Weygoldt, 2000).En Colombia se han registrado las familias Charinidae (género Charinus) y Phrynidae (géneros Heterophrynus,Phrynusy Paraphrynus) (Armas et al., 2012; Chiriví & Armas, 2012). La familia Phrynidae se distribuye ampliamente en Colombia, encontrándose especies desde zonas secas hasta bosques húmedos montanos. Sin embargo, pocas especies son simpátricas (Giupponi & Kury, 2013; Víquez et al., 2014; Álvarez-García et al., 2015; Armas et al., 2015). El género Heterophrynus está representado en Colombia por siete especies: H. armiger (Isla Gorgona), H. batesii (Amazonas y Meta), H. caribensis (Sucre), H. cervinus (Putumayo), H. silviae (Valle del Cauca), H. yarigui (Santander), y H. boterorum. Heterophrynus boterorum se distribuye en los Andes de Colombia, entre los departamentos del Quindío y Tolima, entre 900 y 1973 m s.n.m. (Armas et al., 2013; Giupponi & Kury, 2013).
El sistema montañoso de los Andes se originó aproximadamente hace 10 millones de años. Por su altura y extensión, ha dado origen a una gran cantidad de hábitats con condiciones ambientales únicas, favoreciendo procesos de aislamiento y diversificación entre las especies (De-Silva et al.,2017; Díaz et al., 2014; Salgado-Roa et al., 2018). Actualmente, no se tiene certeza sobre el efecto de la cordillera de los Andes en las poblaciones de H. boterorum; sin embargo, podría estar actuando como barrera para el flujo genético (Miller et al., 2008). Se han documentado procesos de aislamiento que dan origen a la diversificación de otros géneros de amblipígidos en sistemas de arenas en el desierto del Kalahari (Damon), y en sistemas de islas y cavernas del Caribe (Phrynus)(Esposito et al., 2015; Futuyma, 1998; Prendini et al., 2005; Punzo & Reeves, 2001; Quintero, 1981; Suzuki, 1974; Torres et al., 2018). Los procesos de aislamiento genético también suelen estar acompañados de procesos de diferenciación morfológica (Hedin & Thomas, 2010). Bajo esta premisa, en este estudio se caracterizó la variación morfológica presente en poblaciones de H. boterorum en diferentes localidades de los Andes de Colombia, utilizando la morfología como indicador de procesos de divergencia interespecífica.
Materiales y métodos
Zona de estudio. Los especímenes fueron categorizados, según su distribución, en regiones correspondientes a la cordillera Central y Oriental de los Andes de Colombia, en la región del Tolima (vertiente oriental de los Andes Centrales y vertiente occidental de los Andes Orientales) y la región del Quindío (vertiente occidental de los Andes Centrales). Las regiones presentan condiciones ambientales contrastantes en temperatura, precipitación y humedad (Gentry, 1982; van der Hammen, 1995; Lobo-Guerrero, 1999; Gómez-Cuervo et al., 2015; Holdridge, 1947, 1967; Duran, 1956), ya que la región del Tolima tiene una mayor temperatura y ambientes más secos, mientras que la región del Quindío presenta mayor precipitación y humedad relativa (IDEAM, 2018).
Material analizado. Se revisó material museológico, y se realizaron algunas recolecciones en campo, de individuos machos y hembras, entre octubre del 2010 y junio del 2015. De la vertiente oriental de la cordillera Central y la vertiente occidental de la cordillera Oriental (Tolima) se obtuvieron 17 individuos, entre los 591 y 1247 m s.n.m., distribuidos en las localidades de Chaparral [n= 7], Cunday [n= 3], Ibagué [n= 2] y Lérida [n= 5]; de la vertiente occidental de la cordillera Central (Quindío) se encontraron 23 individuos entre los 1457 y 1935 m s.n.m., en las localidades de Armenia [n= 5], Calarcá [n=4], Circasia [n=2], Córdoba [n= 5], Filandia [n= 2] y Salento [n= 5] (Figura 1).
El material fue preservado en etanol al 70 %. Los ejemplares se encuentran depositados en la Colección de Insectos de la Universidad del Quindío (CIUQ), Colección de Ictiología Universidad del Quindío (IUQ) y en el Instituto de Ciencias Naturales de la Universidad Nacional de Colombia (ICN), Colección Aracnológica (Anexo 1).
Se incluyeron en el análisis ejemplares machos y hembras, aunque no existen diferencias determinadas por el sexo en las variables morfológicas analizadas. Se compararon machos y hembras en cada característica evaluada, utilizando pruebas T de Student, y Chi cuadrado (p>0.05), dependiendo de si los datos presentaban o no variancias homogéneas; la homogeneidad de varianzas se evaluó utilizando el test de Levene.
La terminología de pedipalpos y patas usada en este trabajo sigue a Quintero (1981), con los cambios correspondientes a la nomenclatura de cada segmento según Shultz (1999). No se sigue la terminología propuesta por Weygoldt (2000), ya que no se presentan todos los segmentos de los pedipalpos. Además, se sigue la numeración de espinas para algunos segmentos propuesta por Weygoldt (2000). Se examinaron solo ejemplares adultos, determinados como tal según el desarrollo gonadal.
Caracteres morfológicos. Se incluyeron medidas corporales reportadas en Weygoldt (1974) y en Giupponi & Kury (2013), como: longitud trocánter derecho e izquierdo (L_tr_de, L_tr_iz), longitud tibia derecha e izquierda (L_Tb_de, L_Tb_iz), ancho y largo del prosoma y opistosoma (A_pro, L_pro,A_op, L_op), longitud borde frontal del prosoma (B_fr), distancia entre el punto medio y los dos grupos de ojos laterales y el margen frontal (DOL), longitud ocular a la línea media (DOM), longitud línea ocular (Lin_O), longitud total del cuerpo (L_to_cu) y longitud del opérculo genital (L_op_ge) (Figura 2). Para todas las mediciones se utilizó un calibrador digital Stanley y la unidad de medida fue el milímetro (mm) (Electronic Digital Calliper, error ± 0.02 mm).
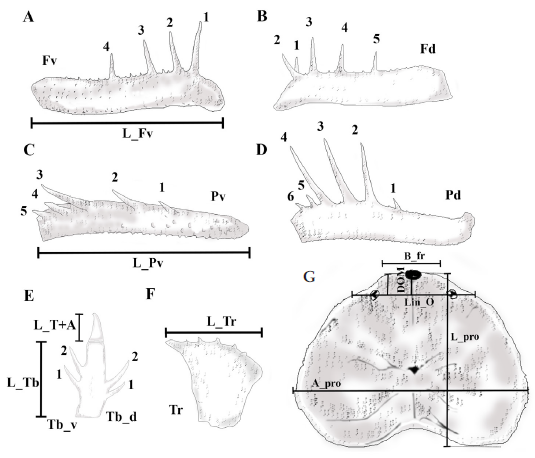
Figura 2 Mediciones realizadas sobre los ejemplares de Heterophrynus boterorum: A, longitud del fémur, vista ventral. B, fémur, vista dorsal. C, longitud de la patela, vista ventral. D, patela, vista dorsal. E, longitud tibia, vista ventral, longitud tarsos más apórtele. F, longitud trocánter, vista ventral. G, dimensiones del prosoma: ancho, largo, longitud línea ocular, longitud borde frontal del prosoma, longitud ocular a la línea media. Se sigue la numeración en espinas de basal a distal, puesto que en otros géneros de Phrynidae se cuenta de esta manera.
Igualmente, se incluyeron caracteres discretos del tipo conteos, como: número de tubérculos ventrales y dorsales en el trocánter derecho e izquierdo (Tr_vde, Tr_viz, Tr_dde, Tr_diz), número de espinas ventrales y dorsales en fémur derecho e izquierdo (Fd_de, Fd_iz, Fv_de, Fv_iz), número de espinas ventrales y dorsales en patela derecha e izquierda (Pd_de, Pd_iz, Pv_de, Pv_iz), número de dentículos en el quelícero móvil (Den_CheMov). Estos caracteres son frecuentemente usados en descripciones de especies, y suelen presentar variación (Quintero, 1981; Weygoldt, 2000; Vasconcelos et al., 2013) (Figura 2 y Anexo 2). Todos los caracteres morfológicos se observaron bajo un estereoscopio Zeiss modelo STEMI DV4 32Z de 4X a 40X.
Análisis de datos
Variabilidad morfológica.
Con la finalidad de explorar la variación en caracteres morfológicos e identificar potenciales patrones fenotípicos por localidad, se realizó un Análisis de Componentes Principales (ACP), evaluando la variación morfológica entre municipios de muestreo (Williams, 2011; Fox, 2016). A partir de este, se tomaron las variables morfológicas que presentaron mayor variación, aplicando análisis de varianza y comparación de medias (ANOVA, t-test) en caso de distribuciones normales y Kruskal-Wallis(Wilcoxon) en casos contrarios (Hollander & Wolfe, 1973; Fox & Weisberg, 2011), para así detectar variaciones morfológicas entre poblaciones (α = 0.05). Todos los datos se analizaron con ayuda del software R, utilizando los paquetes “cmdr, Vegan y ggplot2 (Fox, 2016; Oksanen, 2013; Wickham, 2016); (R Development Core Team, 2015). Para el análisis morfológico no se incluyeron el número de segmentos en el primer par de patas y cerdas en el sternum, ya que es normal que se produzca aumento o disminución considerable cuando se rompe y posteriormente se regenera el exoesqueleto (Igelmund, 1987).
Resultados
En el morfoespacio del ACP, se encontró que entre el primer y segundo componente se acumula el 68.9% de la varianza en los datos morfológicos (Figura 3). En general, se encontraron altas correlaciones entre las variables morfológicas, como longitudes corporales, pero baja correlación de estas con variables discretas, como el número de espinas y tubérculos. Por otra parte, los ejemplares de Lérida (Figura 3) se agruparon en relación a variables del tipo conteos (caracteres discretos).
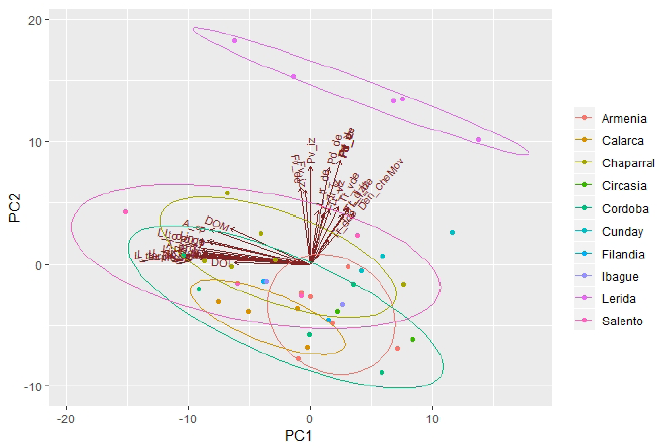
Figura 3 Análisis de componentes principales de variables morfológicas en Heterophrynus boterorum en los Andes de Colombia. Los puntos de colores representan los individuos de cada población (Anexo 2 y Tabla 1).
Las variables morfológicas que tuvieron mayor variación en el CP1y CP2 para H. boterorum fueron: número de tubérculos ventrales y dorsales en el trocánter derecho e izquierdo, longitud fémur derecho e izquierdo, longitud patela derecha e izquierda, largo del opistosoma, ancho del prosoma y longitud total del cuerpo (Tabla 1). Estos caracteres morfológicos fueron importantes en la diferenciación de H. boterorum en Lérida (Figura 3).
Tabla 1 Vectores principales en el ACP que presentaron valores altos para las variables morfológicas en Heterophrynus boterorum en los Andes de Colombia.
| Variables morfológicas | Componente Principal 1 | Componente Principal 2 |
|---|---|---|
| Número de tubérculos trocánter ventrales derecho (Tr_vde) | 0.26488271 | 0.31220694 |
| Número de tubérculos trocánter dorsales derecho (Tr_dde) | 0.60779911 | -0.49484576 |
| Número de tubérculos trocánter ventrales izquierdo (Tr_viz) | 0.18518286 | 0.36493584 |
| Número de tubérculos trocánter dorsales izquierdo (Tr_diz) | 0.64409682 | -0.03877196 |
| Longitud fémur derecho (L_f_de) | 0.20895956 | 0.2111349 |
| Longitud fémur izquierdo (L_f_iz) | 0.20959092 | 0.20156864 |
| Longitud patela derecha (L_P_de) | -0.07269415 | -0.37930208 |
| Longitud patela izquierda (L_P_iz) | -0.07427034 | -0.38269358 |
| Ancho del prosoma (A_pro) | -0.03467562 | -0.11854248 |
| Longitud del opitosoma (L_op) | -0.04032487 | -0.17409056 |
| Longitud total del cuerpo (L_to_cu) | -0.03695075 | -0.23974435 |
En el análisis de varianza o Kruskal-Wallis, se encontraron diferencias significativas (p<0.05) en 15 caracteres morfológicos relacionados con conteos (11 caracteres discretos) y mediciones corporales (cuatro caracteres continuos), al comparar las poblaciones de cada localidad (Tabla 2). Se observó que en el número de espinas en el fémur y patela, la población de Lérida se diferencia del resto, presentando siempre una espina más en estos segmentos en vista dorsal y ventral (Tabla 2). En el caso del número de dentículos en el segmento móvil queliceral, las poblaciones de Cunday, Lérida e Ibagué presentan un dentículo más que la mayoría de los especímenes, diferenciándose de las poblaciones de Calarcá, Circasia y Filandia, pero compartiendo esta misma condición con algunos individuos de poblaciones de Armenia, Chaparral, Córdoba y Salento.
En cuanto a la longitud del trocánter, se encontró que los individuos de Cunday se diferenciaron del resto de individuos en la cordillera Central por su mayor tamaño (Tabla 2). La distancia ocular a la línea media de los individuos de las poblaciones de Armenia, Chaparral, Lérida y Salento fue mayor que la del resto de los individuos analizados. Igualmente, se observó en la distancia entre el punto medio y los dos grupos de ojos laterales y el margen frontal, que los individuos de las poblaciones de Calarcá, Filandia, Ibagué, Lérida y Salento fueron significativamente diferentes del resto de individuos, por presentar longitudes mayores. El número de tubérculos en el trocánter dorsal derecho fue mayor en los individuos de Calarcá, Cunday, Filandia y Salento. Finalmente, el número de tubérculos en el trocánter dorsal izquierdo de los individuos de Armenia, Calarcá, Chaparral, Cunday, Ibagué y Lérida fue mayor que en el resto de poblaciones (Tabla 2).
Tabla 2 Caracteres morfológicos de Heterophrynus boterorum en los Andes de Colombia que presentaron diferencias significativas, por municipio. Arm, Armenia; Cal, Calarcá; Chap, Chaparral; Cir, Circasia; Cor, Córdoba; Cun, Cunday; Fil, Filandia; Iba, Ibagué; Ler, Lérida; Sal, Salento. Est, estadístico.
| Carácter morfológicos | Método | Arm. | Cal. | Chap. | Cir. | Cor. | Cun. | Fil. | Iba. | Ler. | Sal. | Est. | Valor p |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Número de dentículos en el quelícero móvil | Kruskal-Wallis | 5.5 | 5 | 5 | 5 | 5 | 6 | 5.5 | 6 | 6 | 6 | 16.6 | 0.05 |
| Número de espinas dorsales fémur derecho | Kruskal-Wallis | 5 | 5 | 5 | 5 | 5 | 5 | 5 | 5 | 6 | 5 | 39 | 0.00001 |
| Número de espinas dorsales fémur izquierdo | Kruskal-Wallis | 5 | 5 | 5 | 5 | 5 | 5 | 5 | 5 | 6 | 5 | 39 | 0.00001 |
| Número de espinas ventrales fémur derecho | Kruskal-Wallis | 4 | 4 | 5 | 4 | 4 | 4 | 4 | 4 | 5 | 4 | 24 | 0.004 |
| Número de espinas ventrales fémur izquierdo | Kruskal-Wallis | 4 | 4 | 5 | 4 | 4 | 4 | 4 | 4 | 5 | 4 | 30.3 | 0.0003 |
| Número de espinas dorsales patela derecha | Kruskal-Wallis | 6 | 6 | 6 | 6 | 6 | 6 | 6 | 6 | 7 | 6 | 32.4 | 0.0001 |
| Número de espinas dorsales patela izquierda | Kruskal-Wallis | 6 | 6 | 6 | 6 | 6 | 6 | 6 | 6 | 7 | 6 | 39 | 0.00001 |
| Número de espinas ventrales patela izquierda | Kruskal-Wallis | 5 | 5 | 5 | 5 | 5 | 5 | 5 | 5 | 6 | 5 | 39 | 0.00001 |
| Número de espinas ventrales patela derecha | Kruskal-Wallis | 5 | 5 | 5 | 5 | 5 | 5 | 5 | 5 | 6 | 5 | 24.2 | 0.003 |
| Número de tuberculos trocanter dorsal derecho | ANOVA | 26.5 | 15.7 | 25.1 | 19.5 | 21.2 | 51.6 | 33.5 | 36.5 | 27.4 | 29.2 | 10.2 | 0.000000506 |
| Número de tuberculos trocanter dorsal izquierdo | ANOVA | 22 | 19 | 30 | 21 | 25.4 | 50.6 | 20 | 42 | 32.8 | 25.7 | 13.6 | 2.24E-08 |
| Longitud trocánter derecho | ANOVA | 2.9 | 2.4 | 3.9 | 2.3 | 2.9 | 4.9 | 3.2 | 3.1 | 3.4 | 3.8 | 4.3 | 0.00107 |
| Longitud trocánter izquierdo | ANOVA | 2.8 | 2.3 | 3.8 | 2.3 | 2.9 | 4.9 | 3.2 | 3.1 | 3.4 | 3.8 | 6 | 0.000128 |
| Longitud ocular a la línea media | ANOVA | 1.6 | 1.8 | 1.6 | 1.4 | 1.7 | 1.5 | 1.6 | 1.4 | 1.8 | 2.6 | 2.5 | 0.0241 |
| Distancia intraocular | ANOVA | 1.7 | 2.1 | 2.6 | 1.9 | 2.3 | 1.9 | 2.3 | 2 | 1.8 | 1.7 | 4.2 | 0.00121 |
Discusión
Los análisis estadísticos mostraron variaciones morfológicas relacionadas con el número de tubérculos en el trocánter, número de espinas y longitudes en los palpos, indicando que la población de Lérida es un grupo morfológico diferente del resto de poblaciones del análisis. Esta variación está expresada en el aumento en los conteos de espinas del fémur y de la patela, lo que claramente los diferencia del resto de poblaciones. Los individuos de las demás poblaciones se comportaron como un grupo similar morfológicamente, que presenta amplia variabilidad en su tamaño, pero que se solapa morfológicamente entre ellos. En general no se encontraron diferencias entre las cordilleras Central y Oriental de los Andes, ni entre vertientes para las variables analizadas; sin embargo sí se observan diferencias al comparar las poblaciones por municipio donde fueron recolectados.
Hasta el momento se han recolectado pocos individuos de H. boterorum en Colombia. Sin embargo, las diferencias morfológicas encontradas entre localidades son evidentes y probablemente se relacionan con el gradiente altitudinal al que están expuestas las poblaciones localmente (https://colombiasa.com/geografia/geografia.html). Las altas elevaciones en la cordillera Central actúan como barrera para las poblaciones en algunos grupos de animales que se distribuyen en las cordilleras de los Andes (Díaz et al., 2014; Mills et al., 2007; Salgado-Roa et al., 2018), y en el caso de la población de Lérida, su diferenciación morfológica podría estar asociada a que se encuentra ubicada al norte de la vertiente oriental de los Andes Centrales. Es importante resaltar que también las poblaciones de Cunday y Chaparral presentaron diferencias con el resto de poblaciones, que pueden estar relacionadas con las condiciones de aislamiento y distribución que presentan actualmente estas poblaciones, al ser las que presentan mayor distanciamiento geográfico de la localidad tipo en Ibagué, Tolima.
El ACP muestra agrupaciones de variación por localidad, pese a que solo se encontraron dos patrones morfológicos claramente diferenciables. Esto permite pensar que la variación morfológica podría estar influenciada por la variabilidad de ambientes en los cuales se distribuye H. boterorum (Torres et al., 2018), tanto en términos de humedad (muy secos a muy húmedos), como de elevación(500-1900 m s.n.m.) y distanciamiento geográfico (70-100 km).
Hasta el momento no ha sido posible evaluar el aislamiento reproductivo y la estructura genética en H. boterorum, lo cual sería clave en el entendimiento de los procesos de diversificación y especiación del grupo (Futuyma, 1998). Sin embargo, este estudio muestra fuertes indicios de procesos de diferenciación morfológica, principalmente en la población de Lérida, lo cual indica que también pueden estar sufriendo procesos de diferenciación genética. Algunos estudios en Amblypygi han mostrado que los sistemas ecológicos de islas y cavernas promueven la diversificación del grupo, debido al bajo flujo génico que se da entre poblaciones del interior y el exterior de cavernas, y entre islas (Quintero, 1981; Kraus, 2000; Prendini, 2001; Esposito et al., 2015). Por otra parte, se sabe que los Andes de Colombia son fuente de variaciones fenotípicas y actúan como barrera del flujo genético entre poblaciones de algunos grupos de animales (De-Silva et al., 2017; Díaz et al., 2014; Ferretti et al., 2011; Román-Valencia et al, 2009; Ruiz-C et al., 2011; Salgado-Roa et al., 2018), por lo que los resultados encontrados en este trabajo, sugieren que los Andes también promueven procesos de diversificación en los amblipígidos de Colombia.