Introducción
Los dinoflagelados son microorganismos flagelados con movimientos rotatorios, su nombre proviene del griego dino (rotación) y flagellum (látigo). Considerado uno de los grupos más abundante del fitoplancton después de las diatomeas en ambientes costeros, responsables de la producción de energía en las redes tróficas del océano (Lalli & Parsons, 1997). Presentan diversos estilos de vida (libres, parásitos y simbiontes mutualistas), habitan en aguas continentales y marinas en varios niveles tróficos (autótrofos, heterótrofos y mixótrofos) con aproximadamente 40 al 60 % de las especies con capacidad fotosintética (Ojeda-Rodríguez, 1998; Gómez, 2012)
Los dinoflagelados morfológicamente se caracterizan por tener un dinocarionte, es decir, un peculiar núcleo provisto de histonas y cromosomas permanentemente condensados y, un enorme y variable genoma (Lin, 2011). Surgen dos flagelos generalmente del lado de la célula, uno rodea completamente el cuerpo y el otro se proyecta hacia el extremo posterior (Taylor, 1987). Se dividen en dos grupos: los atecados (desnudos) por el poco desarrollo o la ausencia placas celulósicas en el anfiesma y los tecados (cubiertos) por la presencia de estas placas (Larsen, 2002; Balech, 1988). Los tecados son determinados por la disposición, número y relaciones de las distintas placas, cada placa proviene de la región epitecal, cingular, sulcal o hipotecal (Taylor, 1987; Ojeda-Rodríguez, 1998).
Los dinoflagelados marinos pertenecientes al orden Dinophysales presentan una alta diversidad morfoló¬gica, tecadas y móviles, comprimidas lateralmente. Constituye 18 placas: 2 apicales, 4 epitecales, 4 cingu¬lares, 4 hipotecales y 2 sulcales, en algunas especies no se evidencia todas las placas (Kofoid & Skogsberg, 1928; Balech, 1988 ; Ojeda-Rodríguez, 1998). Están representados por 2 familias (Amphisoleniaceae, Dinophysaceae), 16 géneros y 300 especies (Gómez, 2012; Saldarriaga & Taylor, 2017; Guiry & Guiry, 2021). Dentro del orden, han sido analizadas algunas especies y han resultado ser productoras de toxinas o po¬tencialmente toxicas, o bien causantes de florecimientos algales nocivos (Fraga & Barkun, 1993; Reguera, 1993). Según Zingone & Larsen (2020), actualmente se conocen dos géneros productores de toxinas: Dinophysis (10 especies) y Phalacroma (2 especies) y tres géneros: Ornithocercus, Histioneis y Citharistes pre-sentan asociaciones simbióticas con géneros de cianobacterias como Prochlorococcus y Synechococcus respectiva¬mente (Foster et al., 2006).
El género Metadinophysis fue registrado por primera por Nie & Wang (1941) en la bahía de Ghing-Ian, Provincia de Hainan, China y descrito con características morfológicas: cuerpo subovalado en vista lateral y con un contorno reniforme en vista ventral, el lado derecho de la hipoteca uniformemente convexa y el lado izquierdo claramente cóncavo en la región mediana por presentar una hipoteca ovalada. Las placas epitecales no se encuentran dispuestas en el mismo nivel, la derecha inclinada y la izquierda casi recta. Aleta sulcal izquierda robusta con 3 costillas (R1, R2 y R3) y una aleta sulcal derecha reducida o poco visible (Nie & Wang, 1941).
En cuanto a los estudios de los dinoflagelados en la Cuenca Pacífica Colombiana (CPC), estos han sido enfocados en estudios de indicadores biológicos relacionados con el fenómeno de El Niño (Castillo & Vizcaino, 1992; Castillo & Vizcaíno, 1993; Uribe-Palomino, 2003; Ramírez & Giraldo López, 2006; Rojas Higuera & Ortiz, 2007), así como, registros de eventos de florecimientos algales nocivos (García-Hansen et al., 2004; Maldonado, 1978), distribución de especies potencialmente toxicas (Arteaga-Sogamoso & Perdomo-Trujillo, 2016; Galeano-Chavarría & Arteaga-Sogamoso, 2010), detección de especies no nativas provenientes por tráfico marítimo realizado en tres bahías importantes de la CPC (Bahía Solano, Buenaventura y Tumaco) (Osorio-Cardoso, 2019), listado de especies de fitoplancton (Hoyos Acuña et al., 2021); siendo evidente el escaso conocimiento en taxonomía de las especies de dinoflagelados en la CPC.
Colombia como país bioceánico debe incrementar el conocimiento de la biodiversidad, sobre todo, en las zonas costeras que albergan los puertos marítimos soportado en la investigación científica marina, con la finalidad de brindar información como insumo primario para ejercer acciones, planes, programas, estrategias y toma de decisiónes frente a episodios futuros de introducción de especies no nativas, invasoras o productoras de Floraciones Algales Nocivas, a causa del tráfico marítimo internacional. Por esta razón, en función a su relevancia ecológica y los pocos registros a nivel mundial, se registra por primera vez la presencia del dinoflagelado tecado Metadinophysis (Dinophyceae; Dinophysiales) y la relación entre la distribución de la densidad celular con los cambios mareales en las zonas costeras de Colombia, dentro de los límites de la bahía de Buenaventura y el Parque Nacional Natural Uramba (PNN Uramba) en bahía Málaga, en el departamento del Valle del Cauca.
Materiales y métodos
Área de estudio. La bahía de Buenaventura y la bahía de Málaga se encuentran localizadas en el Departamento del Valle del Cauca entre las latitudes 3º 44’ N y 3º 56’N y longitudes 77º 01’ W y 77º 20’ W y entre 3º56´ y 4º05´N y 77° 19´W y 77°21´W respectivamente (Figura 1). La primera presenta una extensión aproximada de 30 Km con forma angosta y alargada, en ella se distinguen dos zonas, una interna donde se presenta la mayor alteración de los ecosistemas costeros por la influencia urbana más grande del pacífico colombiano y otra externa, donde aún hay presencia de extensiones de manglar relativamente bien conservadas y presencia de acantilados (Escobar et al., 2012). La segunda bahía se encuentra dentro de los límites del Parque Nacional Natural Uramba, posee un canal de 18 Km de largo y 7 Km de ancho. Ambas bahías se consideran de ambientes estuarinos debido a la combinación del agua salada del océano Pacífico con el agua dulce de los ríos y esteros que en ellas desembocan (Riascos & Jörg Urban, 2002; Escobar et al., 2012).
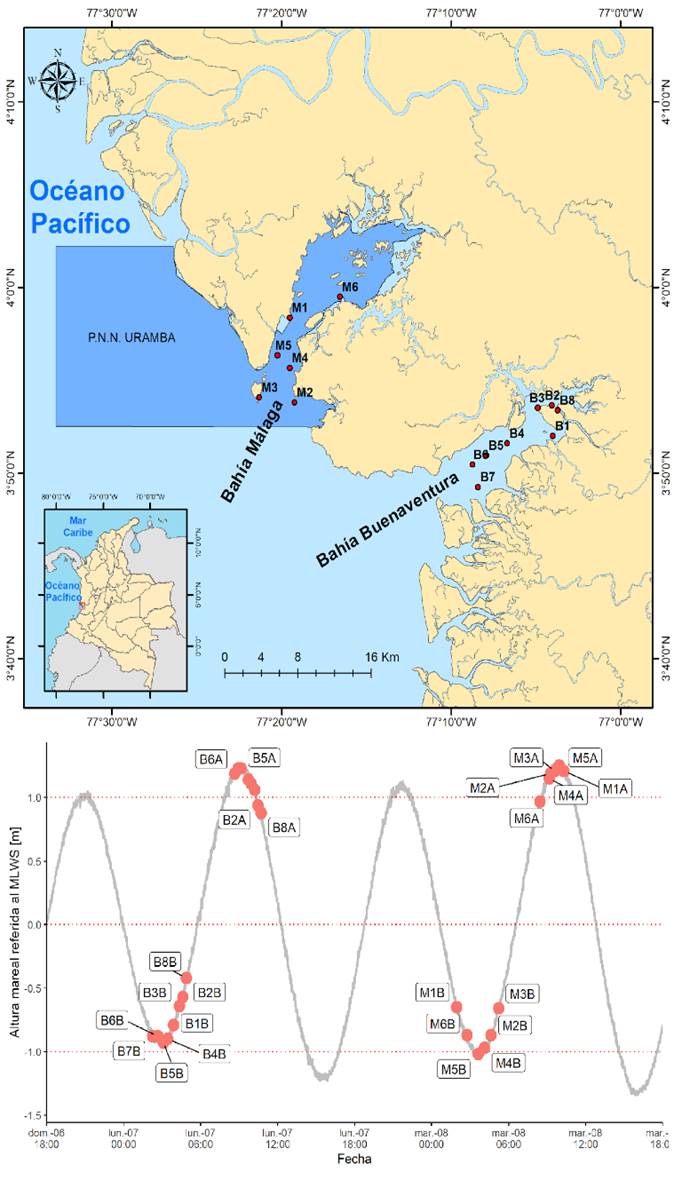
Figura 1 Distribución de las estaciones de muestreo en el Parque Nacional Natural Uramba en Bahía Málaga y la Bahía de Buenaventura en el departamento del Valle del Cauca.Comportamiento de la onda mareal entre los días 6 y 8 de junio del 2021.
Fase de campo
La colecta de las muestras se hizo durante los días 7 y 8 de junio de 2021, empleando una botella Niskin con capacidad de 5 litros a un metro de profundidad, destinando un litro de agua marina en botella ámbar, adicionando solución de Lugol (Throndsen, 1978; Edler & Elbrächter, 2010). Para la bahía de Buenaventura se utilizó un bote pequeño perteneciente a Guardacostas de Buenaventura, mientras que, en Málaga la colecta fue realizada por la embarcación tipo Pilot ARC Isla Tesoro. Por el comportamiento de la onda mareal, se designaron ocho estaciones para la bahía de Buenaventura y seis estaciones para la bahía de Málaga las cuales se visitaron durante la marea alta (pleamar) y la marea baja (bajamar) del mismo día (Figura 1). Los datos de la marea se tomaron del mareógrafo de Isla Palma (Figura suplementaria 1) a través de la Red de Medición de Parámetros Oceanográficos y Meteorología Marina (REDPOMM) de la Dirección General Marítima (DIMAR), esta información suplementaria se encuentra en el repositorio de GitLab que acompaña esta publicación.
Fase de laboratorio
Recuento celular. El recuento de las células fue realizado siguiendo el método de sedimentación por cámara Utermöhl (Utermöhl, 1958), estas muestras fueron sedimentadas por un periodo de tiempo de 24 horas utilizando un tubo de 50 mL de volumen. La observación de las muestras fue realizada en el Laboratorio del CCCP-DIMAR utilizando el microscopio invertido Leica DMi1 a magnificaciones de 100x, 400x y 1000x. Los registros fotográficos se realizaron con la cámara Leica DMC 170 HD y el Software Leica Aplication Suite (LAS) 4.13,
Determinación taxonómica. La determinación taxonómica de Metadinophysis fue realizada tomando como material de referencia, el trabajo original de la descripción del género (Nie & Wang, 1941) y las descripciones hechas en algunos registros a nivel mundial (Omura et al., 2012; Su-Myat et al., 2012; Affe et al., 2019; Nunes et al., 2019).
Análisis estadísticos
Para el análisis estadístico de la densidad, se determinó inicialmente si existía algún tipo de estructura espacial no aleatoria de los datos (autocorrelación espacial) de la densidad en ambas bahías para cada evento mareal. Primeramente, se creó una capa espacial de tipo vectorial de puntos en formato shape y posteriormente se calculó el índice de Moran a través del subpaquete esda (Exploratory Spatial Data Analysis) de la librería PySal (Rey & Anselin, 2007) del lenguaje de programación Python utilizando los datos almacenados en la tabla de atributos de la capa espacial previamente mencionada. Se computó una matriz de pesos de las distancias de los puntos de muestreo y se relacionó con los datos de densidad para generar la prueba estadística sobre el cálculo del índice de Moran para determinar su significancia estadística.
Una vez evaluada la hipótesis estadística de la no diferencia entre la distribución de la densidad con una distribución aleatoria, se procedió a realizar las comparaciones de la densidad de Metadinophysis entre factores tanto temporales (cambios entre la marea alta y la marea baja) como espaciales (cambios entre las bahías). Para la visualización de los datos de densidad entre la combinación de estos dos factores, se construyó un diagrama de cajas con el paquete Seaborn del lenguaje de programación Python (Waskom, 2021). Para evaluar el efecto de los factores analizados en la densidad de Metadinophysis se usó la prueba de Kruskal-Wallis con la prueba de Mann-Whitney para detectar las diferencias pareadas, usando el paquete SciPy del lenguaje de programación Python (Virtanen et al., 2020).
Para efectos de reproducibilidad de los análisis, todos los procedimientos fueron ejecutados y ensamblados en un cuaderno Jupyter basado en Python versión 3 (Van Rossum & Drake, 2009).
Resultados
Análisis taxonómico
Metadinophysis (Nie & Wang, 1941) (Figura 2)
Referencias: (Nie & Wang, 1941), (p. 225, fig 1-18), Omura et al. (2012) (p.64, fig a y b), Su-Myat et al. (2012) (p. fig. 2, j), Affe et al. (2019) (p. 81, fig 2, A-H; fig 3, A-D), Nunes et al. (2019) (p. 956, fig 3c).
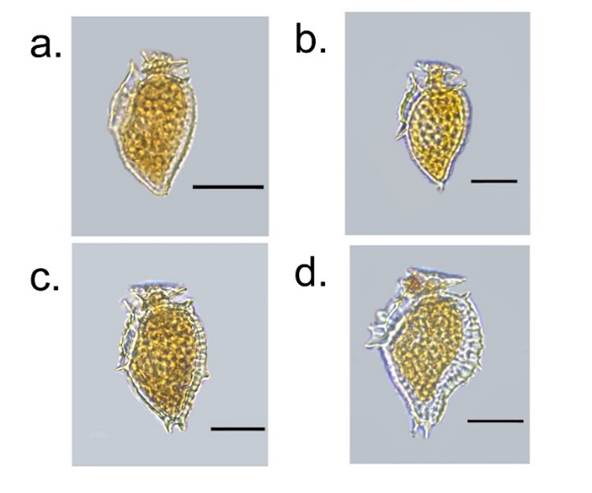
Figura 2 Imágenes de las variaciones morfológicas de Metadinophysis. encontradas en el PNN Uramba en bahía Málaga y bahía de Buenaventura.
Etimología: El género Metadinophysis fue nombrado por Dashu Nie y Chia Chi Wang, zoólogos asiáticos que asignaron el prefijo Meta de origen griego que significa asociado con, cambiado, sustituido por, entre, y en latín significa después o más tarde, también puede interpretarse como post.
Observaciones morfológicas: La mayoría de las células observadas mostraron rasgos morfológicos con cuerpo subtriangular denotando una desviación en la región anterodorsal y comprimido en vista lateral, contorno reniforme con margen liso (Figura 2 a y 2b) o aserrado (Figura 2c y 2d) en vista ventral, el lado derecho de la hipoteca uniformemente convexa y el lado izquierdo claramente cóncavo en la región mediana. Algunos ejemplares en la parte anterior exhibieron una forma convexa en vista lateral, también se puede apreciar un contorno sigmoide. El polo anterior presentaba curvatura hasta llegar a ser ligeramente truncado, mientras que el polo posterior variaba de redondeado a truncado. La epiteca es pequeña, su tamaño representaba cuatro a dos veces menos que la longitud total de la célula, la parte anterior izquierda declinada, aunque en la observación de algunas células se reflejaba una inclinación, la posterior derecha era triangular, a veces convexa, más alta cerca de la región central cuando se observaron en vista lateral derecha. El cíngulo es profundamente cóncavo, formando una espiral descendiente en dirección al lado el derecho, desplazado posteriormente de forma ligera hacia la mitad de la anchura de la intersección entre la parte dorsal y ventral (dorsoventral). La hipoteca mostraba una pronunciada asimetría en forma y tamaño, con el margen dorsal liso a profundamente aserrado; el margen ventral debajo de R3 generalmente recto, aunque en algunas células de tecas robustas presentaba características serradas (figura 2d). La aleta cingular posterior era muy vistosa y prolongada conectando con R1 contrario a la aleta cingular anterior que fue poco visible, incluso ausente. La aleta sulcal izquierda logró evidenciar dos costillas (R1 y R2) en casi la totalidad de las células, mientras que, en unas pocas se encontró bien desarrollada, siendo visible R1, R2 y R3.
La superficie de las tecas presentaba una escultura porosa con retículos poligonales con disposición desigual e irregular. Los promedios de dimensiones y medidas realizadas a Metadinophysis se muestran en la Tabla 1.
Las células observadas de Metadinophysis presentaron una variación en la forma y tamaño del cuerpo distinguiendo cuatro variaciones marcadas. En la primera, se observó una forma sub-triangular, margen dorsal de la hipoteca semidenticulado y borde inferior con ligera proyección obtusa (figura 2a). La segunda variación mostró el mismo contorno de la variación anterior con una leve curvatura en la región media posterior y proyección puntiaguda en el borde dorsal inferior de la hipoteca (Figura 2b). La tercera variación se caracterizó por presentar células levemente robustas y aserradas con dos ligeras proyecciones en el borde inferior de la hipoteca (Figura 2c). Por último, la cuarta variación exhibió un contorno sigmoide con bordes robustos y el margen posterior de la hipoteca es más aserrado que la célula de la figura 2c (figura 2d).
Análisis estadístico de la densidad de Metadinophysis
La densidad de Metadinophysis encontrada en la Bahía de Buenaventura fue de 33000 Cel.L^(-1) en total con un valor máximo de 14333 Cel.L^(-1) en la estación B5 (Figura 3a y 3c) y un valor mínimo de 333 Cel〖.L〗^(-1) en la estación B7 en la marea alta (Figura 3a y 3c). En la marea baja las estaciones B2, B4 y B5 presentaron una densidad muy baja de 333 Cel〖.L〗^(-1), este dato fue igual al dato más bajo captado en marea alta (Figura 3b y 3c).
En la zona del PNN Uramba en Bahía de Málaga el total de la densidad de Metadinophysis fue de 11332 CelL^(-1) y el máximo de densidad se encontró en la estación M6 con una densidad de 3333 CelL^(-1) y un valor mínimo de 1000 CelL^(-1) en la estación M3 y M4, en el ciclo de la marea alta (Figura 3a y 3c). Para la marea baja, la estación M6 también presentó la máxima densidad con 2667 CelL^(-1) y en las estaciones M3 y M1 no se logró detectar presencia de Metadinophysis (Figura 3b y 3c).
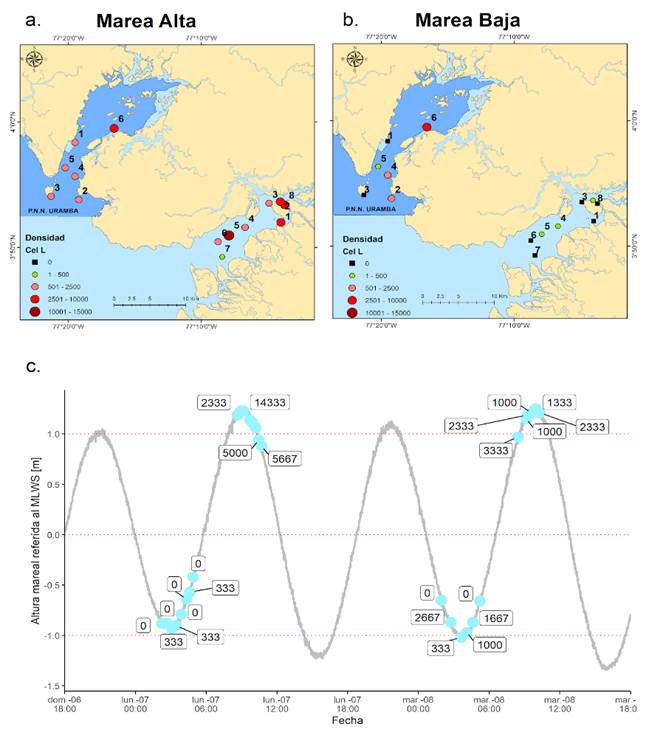
Figura 3 Distribución de la densidad de Metadinophysis entre la a. marea alta y la b. marea baja en el PNN Uramba en bahía Málaga y bahía de Buenaventura. c. Comportamiento de la densidad relacionado con la onda mareal de los días 7 y 8 de junio del 2021.
La densidad en general de Metadinophysis no presentó estructura espacial en ninguna de las dos mareas (marea baja. I de Moran: 0.044 p> 0.05; marea alta. I de Moran: -0.16 p> 0.05; Figura suplementaria 2 y Figura suplementaria 3) pero si presentaron diferencias significativas entre los factores espacio temporales evaluados (mareas y bahías) (Kruskal-Wallis H (7)=15.02, p< 0.05). Al examinar las diferencias de la densidad entre las mareas y las bahías (Figura suplementaria 4) se encontró que la densidad de Metadinophysis registrada en la marea baja de Buenaventura presentó diferencias con la densidad en la marea alta de la bahía de Buenaventura (Mann-Whitney U = 62.5, 𝑛 𝐵/𝑡𝑢𝑟𝑎−𝑎𝑙𝑡𝑎 = 8 𝑛 𝐵/𝑡𝑢𝑟𝑎−𝑏𝑎𝑗𝑎 = 8, p< 0.05 two-tailed) y con la marea alta en bahía Málaga (Mann-Whitney U = 48.0, 𝑛 𝐵/𝑡𝑢𝑟𝑎−𝑏𝑎𝑗𝑎 = 8 𝑛 𝑀á𝑙𝑎𝑔𝑎−𝑎𝑙𝑡𝑎 = 6, p< 0.05 two-tailed). Entre los demás factores no se encontraron diferencias significativas (Mann-Whitney U = 27.0, 𝑛 𝑀á𝑙𝑎𝑔𝑎−𝑎𝑙𝑡𝑎 = 6 𝑛 𝑀á𝑙𝑎𝑔𝑎−𝑏𝑎𝑗𝑎 = 6, p = 0.16; U = 20.0, 𝑛 𝑀á𝑙𝑎𝑔𝑎−𝑎𝑙𝑡𝑎 = 6 ?? 𝐵/𝑡𝑢𝑟𝑎−𝑎𝑙𝑡𝑎 = 8, p= 0.64; U = 35.5, 𝑛 𝐵/𝑡𝑢𝑟𝑎−𝑏𝑎𝑗𝑎 = 8 𝑛 𝑀á𝑙𝑎𝑔𝑎−𝑏𝑎𝑗𝑎 = 6, p = 0.12 two-tailed; U = 37.5, 𝑛 𝐵/𝑡𝑢𝑟𝑎−𝑎𝑙𝑡𝑎 = 8 𝑛 𝑀á𝑙𝑎𝑔𝑎−𝑏𝑎𝑗𝑎 = 6, p= 0.12 two-tailed).
Discusión
A nivel global, el género Metadinophysis ha sido registrado en pocas localidades de la región tropical en las áreas costeras del océano Índico, en Tanintharyi (Gyi et al., 2020) y en el mar de Andaman, Myanmar (Su-Myat et al., 2012); en el océano Atlántico, en el estuario del río Real entre los estados de Bahia y Sergipe (en la bahía de Camamu (Nunes et al., 2019), Morro de São Paulo, Boipeba, Barra Grande y bahía de Todos os Santos en el estado de Bahia, Brasil (Affe et al., 2019, 2021). En el océano Pacífico, Omura et al. (2012) registró el género en las costas occidentales, originalmente en la bahía de Ching-Ian, Isla Hainan en el sureste de China (Nie & Wang, 1941), Lirdwitayaprasit et al. (2010) la registraron en las costas de Tailandia y en las costas del sur de Vietnam (Nguyen, 2016). En este trabajo se registra por primera vez el género Metadinophysis para el océano Pacífico oriental y para Colombia específicamente en las bahías de Buenaventura y Málaga en el PNN Uramba.
Las áreas costeras del Pacífico colombiano están fuertemente influenciadas por deltas de grandes ríos que forman estuarios flanqueados por extensiones de manglares (Escobar et al., 2012; Riascos & Jörg Urban, 2002), estos ambientes coinciden con los registros anteriores del género, concordando con los trabajos de Nie & Wang (1941), Dias-Alves (2017), Gyi et al. (2020), Nunes et al. (2019) y (Affe et al. 2019, 2021).
Las primeras características morfológicas del género fueron descritas por Nie & Wang (1941). Algunas características descritas por estos autores coinciden con lo hallado en este estudio, por ejemplo: la aleta cingular posterior, la epiteca, la aleta sulcal izquierda y la aleta sulcal derecha. Sin embargo, se encontraron diferencias en el contorno del margen dorsal de la hipoteca desde la región media hasta la parte terminal (Figura 2). Este rasgo marca la diferencia morfológica encontrada por Nie & Wang (1941) con lo presentado en este estudio, diferenciando una forma sub-ovalada en Metadinophysis sinensis con una forma sub-triangular en las de Metadinophysis registradas en Buenaventura y el PNN Uramba en bahía Málaga.
Morfológicamente, el primer registro del género realizado por Nie & Wang (1941), indicó que tuvo un promedio de 43 μm de altura con rangos comprendidos entre 41-45 μm. El presente estudio permite evidenciar el promedio de medidas entre 43.1 μm de longitud total con valores máximos de 50.0 μm y mínimo de 33.5 μm (Tabla 1). En la Bahía de Buenaventura se observaron mayores tamaños con respecto a la Bahía de Málaga. Se adicionaron otras dimensiones como: ancho total de 25, 0 μm; longitud celular 35. 6 μm, ancho celular 22.9 μm, ancho de la epiteca 15. 2 μm, longitud aleta cingular posterior 17. 3 μm, longitud aleta sulcal izquierda 21.8 μm, ancho sulcal izquierdo 6.2 μm. Longitud aleta sulcal derecha 10.5 μm y ancho aleta surcal derecha 3.6 μm con el propósito tener aproximaciones al estado biológico del ejemplar (temprano/intermedio/adulto), siendo estos de gran importancia para las futuras comparaciones entre morfoespecies, incluyendo la especie tipo M. sinensis. Los valores de las medidas de las células en este estudio se encuentran dentro del rango de los trabajos de Brasil (Nunes et al., 2019; Affe et al., 2019, 2021) y China (Nie & Wang, 1941) donde el promedio y el rango mayor se da en la bahía de Todos os Santos, Brasil, contrastando con el menor valor que se registró en el PNN Uramba en la bahía de Málaga, Colombia (Tabla 1).
Affe et al. (2019) y Nunes et al. (2019) encontraron variaciones morfológicas en Metadinophysis que difieren de la descripción original de Nie & Wang (1941), estas variaciones coinciden con lo observado en este estudio sobre todo en la forma del contorno del cuerpo, específicamente en el margen dorsal. La figura 3C (pág. 955) de Nunes et al (2019) muestra una forma muy similar a la figura 2b de este trabajo, donde la epiteca presenta unos radios de soporte cortos y una aleta sulcal izquierda visualizando las costillas R1, R2 y R3 y el margen dorsal inferior presenta una pequeña curvatura finalizando en una proyección singular puntiaguda. En Affe et al. (2019), las variaciones morfológicas son más numerosas coincidiendo con las encontradas en el pacífico colombiano, sobre todo entre las registradas en bahía Cumamu en la figura 2 A-C Affe et al. (2019) con las de la figura 2a-c en este caso. La variación registrada en bahía Boipeba en figura 2.D (Affe et al., 2019) concuerda con la encontrada en la figura 2b, donde la proyección inferior se presenta de manera marcada. En la figura 2.E de la bahía de Todo os Santos en Affe et al. (2019) se encontraron variación que corresponden con lo hallado en la figura 2b de este estudio. Nguyen (2016) argumentó una clara separación entre variaciones que encontró de M. sinensis, resaltando como principal diferencia la región dorsal donde existe una sub-ovalada y otra sub-triangular, coincidiendo esta última con lo encontrado en Brasil y ahora en Colombia. Estos resultados indican que las células de Metadinophysis no tienen una gran variación en tamaño y medidas, pero si en su forma y contorno.
La variabilidad morfológica es una característica muy común dentro de los estudios de especies de fitoplancton, siendo diferentes las explicaciones de la ocurrencia de este proceso, por ejemplo: la incidencia de factores ambientales que alteran la forma de la célula (ecotipo) (Reguera & González-Gil, 2001), células teratogénicas (Falasco et al., 2009) y diferentes fases del ciclo de vida (Escalera & Reguera, 2008). En este estudio se encontraron cuatro formas distintas, derivando tres hipótesis: 1) que son diferentes etapas dentro del proceso del crecimiento celular, como lo ocurrido con la especie del dinoflagelado Dinophysis diegensis el cual resultó siendo parte de ciclo de vida de Dinophysis caudata (Reguera et al., 2007), 2) la existencia de variedades de Metadinophysis sinensis o 3) una nueva especie aún por describir.
Hasta el presente trabajo no se han registrado estudios donde expliquen la relación de la densidad celular de Metadinophysis con características hidrográficas o mareales y mucho menos si la distribución de la densidad tiene algún tipo de estructura espacial o no. Solo tres estudios anteriores registran datos de densidad celular, estos son Affe et al. (2019), Gyi et al. (2020) y Lirdwitayaprasit et al. (2010) con densidades que oscilan entre los 170 a los 200 000 CelL^(-1) (Tabla 1, pag. 80), los 50 a los 333 CelL^(-1) (pag. 1204) y los 28 000 CelL^(-1) respectivamente. Se ha registrado una predominancia de las células de este género, posterior a la ocurrencia de un florecimiento de Akashiwo sanguinea en Bahía de Todos os Santos en época de lluvias (Affe et al., 2021).
La densidad celular de Metadinophysis en la bahía de Buenaventura presentó condiciones contrastantes, en la marea alta se obtuvieron los valores de densidad más altos de todo el estudio y a su vez, en la marea baja en esta misma había se obtuvieron valores muy bajos (1-500 CelL^(-1)) o no se detectaron células en algunas estaciones (e.g. estación 1, estación 3, estación 6 estación 7 y estación 8). La bahía de Buenaventura y el PNN Uramba en bahía Málaga son dos cuerpos de agua muy diferentes en cuanto a sus condiciones ambientales, debido a que en el primero hay una fuerte influencia por una de las ciudades más grandes y el puerto con mayor actividad del pacífico colombiano, Por otro lado, en el PNN Uramba en bahía Málaga, se encontró que las densidades entre la marea alta y la marea baja no tienen diferencias significativas y la variación no es tan marcada como en la bahía de Buenaventura (Figura suplementaria 4). Otra principal diferencia entre estas dos bahías, que puede estar influyendo en la densidad de Metadinophysis, es la cobertura vegetal de la costa donde en el PNN Uramba hay mayor presencia de bosque de manglar (Cantera et al., 1999), ambientes que han sido relacionados anteriormente con la presencia de este género (Su-Myat et al., 2012).
Tabla 1 Los promedios de dimensiones del género metadinophysis en micras (𝜇m) en diferentes áreas marítimas. N/ r no se reporta información. N: número de individuos medidos
| N | Longitud Total | Ancho Total | Longitud Celular | Ancho Celular | Ancho Epiteca | Longitud Aleta Cingular Posterior | Longitud Aleta Surcal Izquierda | Ancho Aleta Surcal Izquierda | Longitud Aleta Surcal Derecha | Ancho Aleta Surcal Derecha | R1-R2 | R2-R3 | Localidades | Autores |
| 5 | 43.0 (41.0-45.0) | N/R | N/R | N/R | N/R | N/R | N/R | N/R | N/R | N/R | N/R | N/R | Isla Hainan, China | Nie & Wang (1941) |
| 14 | 45.0 (41.0-47.0) | 25. 0 (21.0-28.0) | 38. 0 (33.0-45.0) | N/R | N/R | N/R | N/R | N/R | N/R | N/R | N/R | N/R | Sur de la Bahía (Morro de San Pablo, Boipeba, Barra Grande y Bahía de Camammu), Brasil | Affe et al. (2019) |
| 20 | 47.0 (40.0-55.0) | 26. 0 (23.0-32.0) | 37.0 (33.0-41.0) | N/R | N/R | N/R | N/R | N/R | N/R | N/R | N/R | N/R | Bahía de Todos los Santos, Brasil | Affe et al. (2019) |
| 3 | 44.27 (48.23-42.23) | 25.91 (29.41-24.11) | 39.84 (45.0-36.46) | 21.29 (24.11 -19.76) | N/R | N/R | N/R | N/R | N/R | N/R | 5.08 (4.38-5.88) | 11.09 (9.76-11.76) | Bahía de Camamu, Brasil | Nunes et al. (2020) |
| 70 | 43.3 (50.8-33.8) | 25.0 (39.3-15.3) | 35.6 (43.8-21.6) | 21.5 (25.1-17.1) | 15.2 (19.4-9.4) | 17.4 (24.0-11.7) | 21.8 (26.9-14.6) | 6,3 (8.2-6.9) | 10.5 (10.8- 10.1) | 3.6 (3.7-3.4) | N/R | N/R | Bahía de Buenaventura, Colombia | Presente estudio |
| 30 | 38. 5 (44.3-33.0) | 21. 3 (26.7-15.3) | 31.2 (33.9-21.9) | 23.4 (24.6-17.6) | 12, 4 (16.7-9.4) | 15.6 (18.4-11.7) | 20.2 (22.9-16. 9) | 5.6 (8.2-2.7) | 10.5 (10.8-10.1) | 3.6 (3.7-3.4) | N/R | N/R | Bahía Málaga, Colombia | Presente estudio |
| 100 | 43.1 (50.8-33.5) | 25, 0 (39.5-15.3) | 35.6 (43.8-21.6) | 22.9 (17.1-25.1) | 15.2 (19.4-9.4) | 17.3 (24.0-11.7) | 21.8 (26.9-14.6) | 6.2 (8.2-2.9) | 10.5 (10.8-10.1) | 3.6 (3.7-3.4) | N/R | N/R | Áreas costeras Pacífico colombiano | Presente estudio |
Conclusiones
Los estudios biológicos y taxonómicos de los dinoflagelados en aguas de la Cuenca Pacífica colombiana (CPC) son escasos, al igual que los registros de los miembros del orden Dinophysales. En cuanto al género de Metadinophysis registrado en las costas del Pacífico colombiano, se evidenció diferencias morfológicas con la descripción original, pues el uso exclusivo de caracteres morfológicos en muchas especies de dinoflagelados presenta muchas limitaciones (Richlen et al., 2008), en especial en un género tan poco estudiado como lo es Metadinophysis; por lo que se hace necesario la implementación de herramientas moleculares y fisiológicas para definir de forma precisa si se habla de variedades de M. sinensis, una especie diferente a esta o varias especies nuevas.
La densidad de Metadinophysis es muy variable y su distribución no responde a un patrón definido, ya que las mareas no afectan su densidad. Asimismo, es necesario estudiar la dinámica trófica de los dinoflagelados en general, con el propósito de mejorar el conocimiento de la diversidad biológica y funcional de las aguas territoriales colombianas y su relación con ecosistemas estratégicos como los bosques de manglar presentes en el PNN Uramba
Recomendaciones
Para futuros estudios del orden Dinophysales, el género Metadinophysis y sus miembros, es muy importante implementar técnicas de avances tecnológicos como la extracción de ADN, pruebas ELISA, prueba rápida para la detección de veneno diarreico en mariscos, extracción de toxinas por ADN, secuenciación de ADN, construcción filogenética y Microscopía Electrónica de Barrido para confirmar la identidad de la especie. De igual forma, apoyarse en investigadores expertos en el conocimiento de los dinoflagelados y las diferentes técnicas enunciadas anteriormente.















