Introducción
La transición entre la selva húmeda tropical y en ambientes de alta montaña, constituye el ecosistema de selva subandina, ubicado entre los 100 y 2400 m s.n.m., con climas húmedos, muy húmedos y pluviales, con coberturas boscosas densas (Rodríguez et al., 2006; Cuatrecasas, 1958). Los bosques de la selva subandina presentan un alto grado de intervención debido a las condiciones ambientales favorables para el establecimiento de áreas de cultivos y pastos, lo que ha resultado en la fragmentación y remoción de la cobertura vegetal nativa alterando la composición, estructura y función original del ecosistema e incrementando la vulnerabilidad de las especies que ahí se sustentan (Rudas et al., 2007; Sarmiento et al., 2002).
La restauración ecológica se presenta como una alternativa potencial en contra de la fragmentación y para mitigar la pérdida de biodiversidad (Chazdon, 2003), permitiendo que los bosques secundarios actúen como proveedores de servicios ambientales, como modelos de rehabilitación en áreas degradadas y como refugios de biodiversidad (Fearnside y Guimarães, 1996). El rápido crecimiento que caracteriza a estos bosques, sumado a la presión que actualmente sufren los bosques primarios, les confiere a los bosques secundarios, un enorme potencial de manejo (Guariguata y Ostertag, 2002).
En Colombia, la mayor tasa de transformación de la cobertura vegetal natural a agroecosistemas se presenta en la región andina, donde también se reúne el mayor número de áreas protegidas, las cuales presentan niveles crecientes de presión por implementación de sistemas productivos (Rudas et al., 2007). Ante esta problemática, en 2006 el Sistema de Parques Nacionales Naturales (SPNN) definió la línea estratégica de manejo Restauración Ecológica Participativa (REP), que comprende el desarrollo de actividades, de manera articulada con las comunidades campesinas, para la recuperación de zonas degradadas en su jurisdicción (Resolución 0247, 2007). Con el objetivo de generar un proceso de REP con las comunidades campesinas que se encuentran dentro del área protegida para dar un manejo efectivo de las áreas ocupadas y/o en uso por la implementación de sistemas productivos establecidos antes y después de la declaración del área protegida el Parque Nacional Natural (PNN) Munchique, presentó el proyecto titulado “Restauración Ecológica Participativa con Familias Campesinas en el Parque Nacional Natural Munchique para la Alianza de la Conservación” (Acevedo y Maya-Girón, 2018).
Por lo anterior, el objetivo del presente estudio es caracterizar la dinámica temporal de la composición y estructura de la comunidad vegetal de una zona en proceso de restauración ecológica en un ecosistema de bosque subandino, partiendo de la información tomada por el PNN Munchique del monitoreo de parcelas de vegetación tipo Gentry, que implementó desde 2013 hasta 2017 y el cual no logró su continuación debido a situaciones de riesgo público y por las limitaciones generadas por pandemia del COVID-19. Las parcelas fueron establecidas con el fin de determinar si las acciones de aislamiento de áreas intervenidas, implementadas por el área protegida para su restauración ecológica, son eficientes para la recuperación de los ecosistemas.
Materiales y métodos
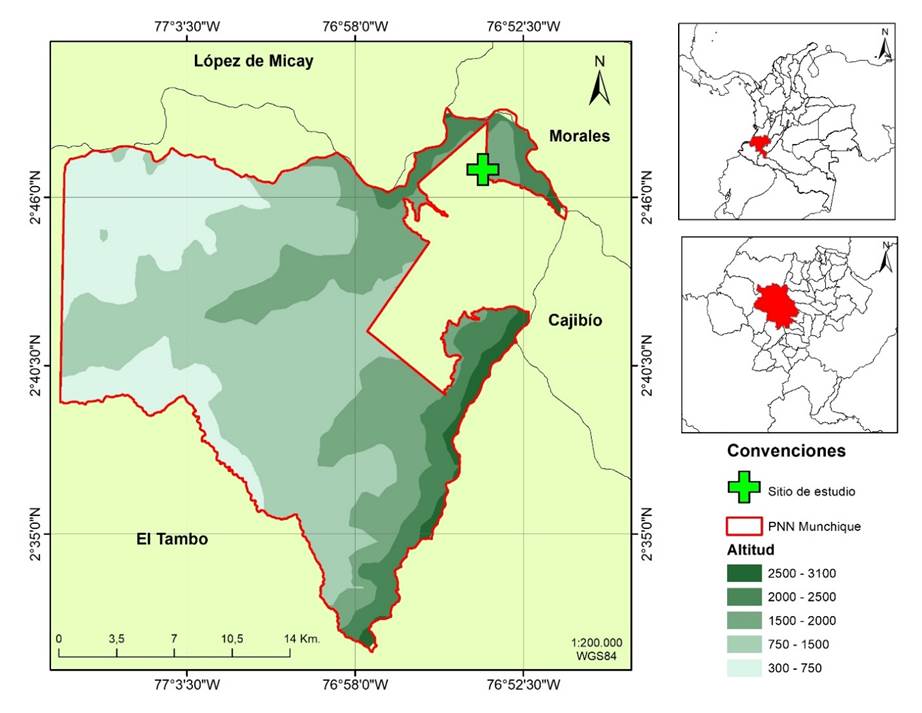
Área de estudio. El área de estudio se ubica en el sector nororiental del Parque Nacional Natural Munchique, en el flanco occidental de la Cordillera Occidental, Municipio de El Tambo, Departamento del Cauca, en las coordenadas 02°47'02"N-76°53'47"O, a 1755 m s.n.m. y 02°46'57"N-76°53'48"O a 1723 m s.n.m. (Figura 1). La zona de vida corresponde a un bosque subandino según Cuatrecasas (1958), que se encuentra en proceso de regeneración natural (Parque Nacional Natural Munchique, 2014).
El sitio de muestreo corresponde a una zona de 143 ha, en la que se ubica la cabaña de funcionarios del sector El Rosal, la cual fue adquirida por el Sistema de Parques Nacionales en 2008 y que previamente era una finca dedicada a la ganadería desde aproximadamente 1980. Este sitio de estudio que corresponde una zona con función amortiguadora del área protegida, colinda con áreas de uso agrícola y pecuario, de comunidades campesinas e indígenas presentes en el territorio desde finales del siglo XIX y principios del siglo XX (Parque Nacional Natural Munchique, 2014).
Evaluación de la vegetación. La información empleada para el presente estudio fue obtenida de monitoreos desarrollados por el Parque Nacional Natural Munchique, enmarcados en la implementación de la estrategia de REP. Estos monitoreos corresponden a la evaluación de la estructura vegetal por medio de transectos tipo Gentry (Gentry, 1982) en dos escenarios de restauración ecológica. En los procesos de restauración pasiva se definió como “restauración avanzada”, un sector que al momento del establecimiento de los transectos en 2013, contaba con un proceso de regeneración natural de 12 años, después de haber sido una zona de potrero con árboles aislados. El segundo escenario llamado “restauración temprana”, fue definido como una zona objetivo de recuperación a partir de la regeneración natural. Esta zona al momento del inicio del monitoreo de los transectos en 2013, contaba con 6 años de aislamiento y previamente también había correspondido a una zona de potrero para la ganadería por cerca de 20 años.
En ambos escenarios fueron ubicados 20 transectos permanentes de vegetación tipo Gentry, distribuyendo diez en cada sitio, con una dimensión de 50 m x 2 m (100 m2) cada uno, para un área total de 0.1 hectáreas por escenario (Figura 2). Los muestreos se realizaron en los años de 2013, 2015 y 2017.

Figura 2 Fotografía del paisaje de los escenarios de restauración temprana y avanzada. La línea amarilla encierra ambos escenarios.
Dentro de cada transecto se censaron todos los individuos vegetales con un diámetro a la altura del pecho (DAP medido a 1.3 metros desde la superficie del suelo) mayor o igual a 1 cm (Villarreal et al., 2006). Cada individuo fue marcado con placas de aluminio y se le registró la altura (m) y circunferencia a la altura del pecho (CAP medido a 1.3 metros de la superficie del suelo). En el caso de individuos ramificados por debajo de 1.3 m, se midió independientemente el perímetro para cada ramificación que registró la medida mínima para que pudiera ser incluida durante el censo (Vallejo-Joyas et al., 2005). Algunas especies fueron identificadas en campo y otras con ayuda de expertos en el herbario CAUP de la Universidad del Cauca. Dinámica estructural. A partir de la información registrada se elaboró una base de datos con la información de DAP, altura y estrato de vegetación para cada individuo censado. Posteriormente se realizaron los cálculos de estructura horizontal (área basal, densidad relativa, frecuencia relativa, dominancia relativa) para el cálculo del índice de valor de importancia de cada especie (IVI) de acuerdo a lo propuesto por Rangel-Ch y Velásquez (1997). Para la estructura vertical (clases de alturas) se evaluó la distribución de individuos por clases de alturas y clases diamétricas (DAP) construyendo intervalos de clase (Rangel-Ch y Velásquez, 1997). También se realizó la clasificación de estratos de la vegetación (hábitos) en general por cada periodo de monitoreo en ambos escenarios siguiendo la propuesta de Rangel-Ch y Lozano-C (1986), con los siguientes tipos: Herbáceo 0.3 - 1.5 m; arbustivo 1.5 - 5 m; sub-arbóreo o de arbolitos 5 - 12 m; arbóreo inferior 12 - 25 m y arbóreo superior > 25 m para cada especie registrada por los años de monitoreo.
Para determinar si el muestreo fue representativo, se realizó el cálculo de las curvas de interpolación y extrapolación a partir de la cobertura de muestra que se refiere a la proporción de la diversidad total que es representada por los datos muestreados (Chao y Jost, 2012). Posteriormente se realizó el cálculo de la diversidad verdadera, para obtener el número de especies efectivas, a partir de lo propuesto por Jost (2006).
Para este trabajo se consideraron tres medidas de diversidad verdadera, siendo la primera la diversidad de orden cero ( q0), cuyo valor equivale a la riqueza de especies ( 0D=S), en donde la fórmula es insensible a la abundancia relativa de las especies; la segunda medida es la diversidad verdadera de orden uno ( q1), en la cual todas las especies son ponderadas proporcionalmente según su abundancia en la comunidad y la tercera medida es la diversidad verdadera de orden dos (q2), en donde las especies dominantes toman mayor relevancia (Jost, 2006; Moreno et al., 2011). Los cálculos de cobertura de muestra y diversidad verdadera se realizaron mediante la versión en línea del paquete iNEXT online. Lo anterior a partir de la serie de números de Hill y graficados con intervalos de confianza del 95% (áreas sombreadas, basadas en un método bootstrap con 100 réplicas) (Chao et al., 2016; http://chao.stat.nthu.edu.tw/wordpress/ software_download/)
Resultados
Se registraron un total de 78 especies de plantas vasculares distribuidas en 29 familias y 45 géneros. Las familias más representativas son Melastomataceae con 11 especies, seguida de Rubiaceae con diez y Lauraceae con siete. Los géneros que registran mayor riqueza de especies fueron Ocotea (siete), Miconia (siete) y Piper (cinco) (Anexo 1).
Para el escenario de restauración avanzada los géneros Ocotea, Palicourea y Elaeagia fueron los mejor representados en cuanto a número de especies y en restauración temprana, los géneros con mayor número de especies fueron Miconia, Piper y Palicourea. En relación al número de individuos, los géneros Elaeagia, Miconia y Cyathea fueron los más abundantes en restauración avanzada y en restauración temprana los géneros Miconia, Meriania y Elaeagia registraron el mayor número de individuos. Se destaca que para ambos escenarios la riqueza registrada aumentó a lo largo de los periodos de muestreo (Tabla 1).
Tabla 1 Riqueza registrada en escenarios de restauración avanzada y restauración temprana para 2013, 2015 y 2017
| Restauración Avanzada | Restauración Temprana | |||||
| 2013 | 2015 | 2017 | 2013 | 2015 | 2017 | |
| Individuos totales | 209 | 290 | 320 | 102 | 245 | 255 |
| Individuos muertos | -- | 4 | 46 | -- | 1 | 41 |
| Individuos nuevos | -- | 85 | 76 | -- | 144 | 51 |
| N° especies | 35 | 39 | 45 | 31 | 44 | 45 |
| N° géneros | 25 | 28 | 30 | 24 | 31 | 30 |
| N° familias | 19 | 22 | 23 | 18 | 2 1 | 21 |
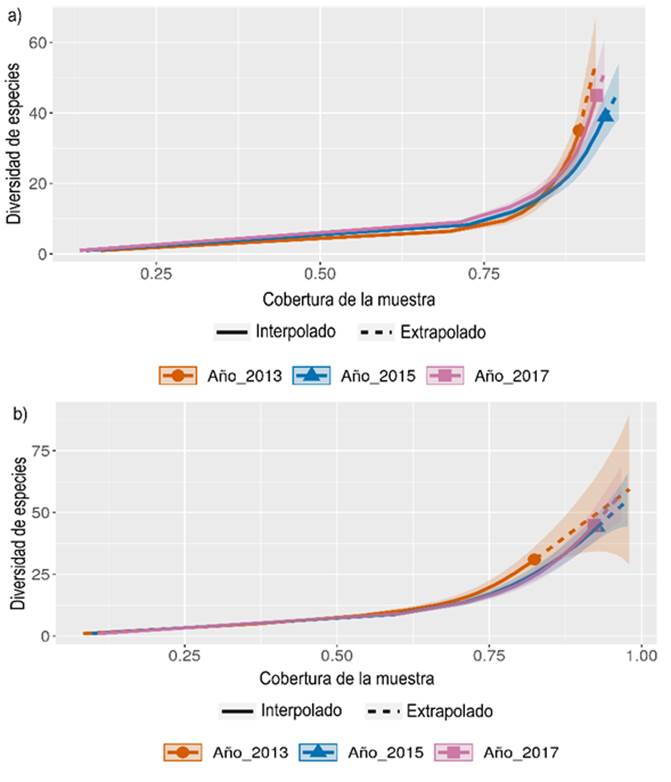
Figura 3 Curvas de rarefacción y extrapolación. a) Escenario de restauración avanzada; b) Escenario de restauración temprana. Basada en la cobertura de la muestra estimada a partir de la riqueza específica (riqueza de especies).
Las curvas de interpolación y extrapolación arrojaron valores de cobertura de la muestra por encima del 75 % a lo largo de los tres periodos de monitoreo, lo que significa que los registros son una muestra repre sentativa de la diversidad de la comunidad vegetal de ambos escenarios (Figura 3).
El índice de valor de importancia de cada especie (IVI) establece que Miconia theizans es la especie más representativa. Esto ocurrió en el escenario de restauración avanzada a lo largo de los tres monitoreos y adicionalmente fue la especie más importante en restauración temprana únicamente en 2013. La segunda especie más sobresaliente en el escenario de restauración avanzada es Elaeagia sp.1, siendo esta misma especie la tercera más importante en el de restauración temprana (Tabla 2).
Tabla 2 Especies con mayor índice de valor de importancia en ambos escenarios en los periodos evaluados
| IVI (%) | ||||||
| Especie | 2013 | 2015 | 2017 | |||
| R. ava | R. tem | R. ava | R. tem | R. ava | R. tem | |
| Miconia theizans | 97.7 | 43.7 | 83.2 | 45.2 | 65.3 | 39.2 |
| Meriania speciosa | 1.7 | 38.8 | 8.1 | 50.2 | 7.9 | 55.3 |
| Elaeagia sp. 1 | 36.6 | 31.4 | 39 | 31.4 | 42.1 | 26.1 |
| Isertia pittieri | 35.8 | 11.8 | 31 | 9.45 | 27.2 | 5.84 |
R. ava.: Escenario Restauración avanzada; R. tem.: Escenario Restauración temprana
R. ava.: Advanced Restoration Site; R. tem.: Early Restoration Site
Meriania speciosa se reporta como la segunda especie más notable en el escenario de restauración temprana, para los tres periodos evaluados. Sin embargo, no registra un valor alto de IVI en el escenario de restauración avanzada (Tabla 2).
Isertia pittieri es la tercera especie más importante para el escenario de restauración avanzada, observando una disminución en su valor del IVI a lo largo de los tres períodos y sin reportar un valor alto en el escenario de restauración temprana (Tabla 2).
En la estructura vertical (clases de alturas) se lograron calcular diez rangos de altura para el escenario de restauración avanzada y nueve rangos para restauración temprana. Para los dos escenarios se observó que la mayor concentración de individuos, durante los tres monitoreos, se registró en los tres primeros rangos (1.5 m - 7.2 m) en el escenario de restauración avanzada y entre el segundo y cuarto rango (3.1 m - 7.3 m) en restauración temprana (Figura 4a y 4b).
En cuanto a la abundancia de especies, en el escenario de restauración avanzada, Cyathea sp. 1 registra mayor número de individuos para el primer rango y a lo largo de los tres monitoreos. Para el segundo y el tercer rango, que comprende alturas entre los 3.4 m y 7.2 m, Elaeagia sp. 1 es la especie más abundante en los tres monitoreos.
Respecto a los rangos de mayor altura, en el escenario de restauración avanzada, Miconia theizans es la especie que registra mayor número de individuos entre los 12.9 m y 20.5 m, mientras que, en el escenario de restauración temprana, donde la mayor altura que se registra es de 14.3 m, se pueden encontrar especies de los géneros Miconia, Cecropia, Meriania y Vismia.
Se identificaron en ambos escenarios los estratos de vegetación herbáceo (0.3 m - 1.5 m), arbustivo (1.5 m - 5 m), sub-arbóreo (5 m - 12 m) y arbóreo inferior (12 m - 25 m). En 2013, restauración avanzada registró la mayor abundancia de individuos para el estrato sub-arbóreo con el 38.8 %, pero en restauración temprana el estrato arbustivo fue el más dominante con el 69.6 % de individuos. Para 2015 se reporta un cambio en el escenario de restauración avanzada, dado que es el estrato arbustivo el más dominante con el 46.6 % del total de individuos. Finalmente, para 2017 se mantiene la tendencia del estrato arbustivo con la mayor abundancia de individuos, tanto en restauración avanzada como en restauración temprana con el 59.4 % y el 65.5 %, respectivamente (Figura 4c y 4d).
En cuanto a la clasificación de hábitos de la vegetación, se encontró que, para el escenario de restauración avanzada, los estratos arbustivo y sub-arbóreo registraron una mayor cantidad de individuos pertenecientes a los géneros Elaeagia, Cyathea y Miconia y la mayoría de los individuos de los estratos arbustivo y sub-arbóreo del escenario de restauración temprana pertenecen a los géneros Miconia y Meriania. En cuanto al estrato arbóreo inferior, los géneros Miconia e Isertia son los más dominantes en restauración avanzada y para restauración temprana son Miconia y Cecropia.

Figura 4 Número de individuos por clase de alturas (estructura vertical) y porcentaje de individuos en estratos de la vegetación (hábitos) para los escenarios de restauración avanzada (a, c) y restauración temprana (b, d) para los periodos evaluados.
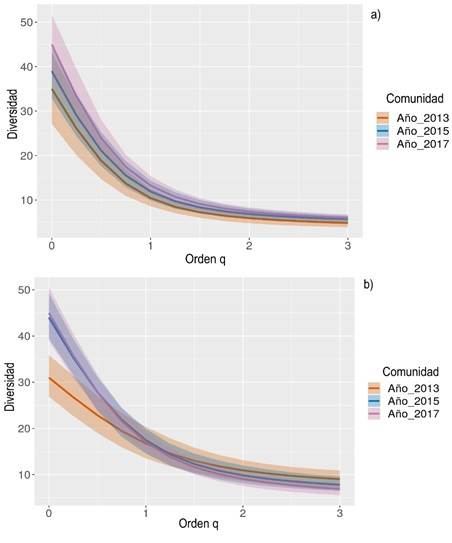
En cuanto a la diversidad verdadera se refleja una dinámica del registro de nuevas especies para los transectos de restauración temprana, en donde el número de individuos en 2015 se duplicó en comparación a 2013, logrando un aumento de 13 especies en la riqueza (q0); en tanto para restauración avanzada en 2015 el aumento fue de cuatro especies (Tabla 3).
Para 2017, los transectos de restauración avanzada son los que reportan un mayor aumento en q0 con 6 especies y en restauración temprana el aumento fue de una sola especie. En cuanto a los valores obtenidos para q1 y q2, se logra establecer que en los transectos de restauración temprana se presenta una comunidad más equitativa y con un mayor número de especies dominantes que en el otro escenario (Tabla 3).
Tabla 3 Valores de diversidad verdadera (q0, q1, q2) obtenidos para cada año de monitoreo en ambos escenarios.
| MONITOREO | Q0 | Q1 | Q2 | |||
| R. ava | R. tem | R. ava | R. tem | R. ava | R. tem | |
| 2013 | 35 | 31 | 10.45 | 16.72 | 5.91 | 10.93 |
| 2015 | 39 | 44 | 11.93 | 17.46 | 6.85 | 9.85 |
| 2017 | 45 | 45 | 13.27 | 17 | 7.39 | 9.06 |
R. ava.: Escenario Restauración avanzada; R. tem.: Escenario Restauración temprana
R. ava.: Advanced Restoration Site; R. tem.: Early Restoration Site.
En los perfiles de diversidad verdadera (Figura 5) para los dos escenarios se determina que la única diferencia significativa al no ver solapamiento en los intervalos de confianza del 95% se da en los valores de orden q0 (riqueza de especies) se presenta en el escenario de restauración temprana entre los años 2013 y 2015.
Discusión
La comunidad de plantas en los escenarios de restauración ecológica evaluados en el PNN Munchique, es una muestra de la vegetación de la zona de selva subandina del área protegida. Al comparar el número de especies registradas en el último periodo de monitoreo de los transectos de restauración temprana, la riqueza es mayor que lo reportado para zonas de selva subandina por Rodríguez et al. (2014) en la Cordillera Oriental, por López et al. (2015) en la meseta de Popayán y por Gómez (2008) en el PNN Munchique debido a que el estado de conservación de esos fragmentos de bosque evaluados se encontraban en un grado de intervención mayor. Sin embargo es un valor menor en comparación a lo presentado por Franco-Rosselli et al. (1997) para una zona de selva subandina en el pacífico nariñense y por Sánchez (2018) para dos zonas de vida del PNN Munchique, debido a que presentaban un mejor estado de conservación. Además, pudo haber influido que el área de estudio y el esfuerzo de muestreo en estos dos trabajos fué mayor.
Al igual que en otros estudios realizados en la zona andina, se encontró que las familias Rubiaceae y Melastomataceae fueron las más representativas en riqueza de especies (Franco-Rosselli et al., 1997; Galindo-T et al., 2003; Rubiano et al., 1994; Sánchez, 2018) y son consideradas como unas de las más relevantes. Así mismo, los géneros Miconia, Ocotea, Piper, Meriania, Elaeagia y Cyathea fueron los más representativos en el presente estudio, tanto como en número de especies como en abundancia y también han sido reportados en otros estudios realizados en zonas de selva subandina de la región y de suramérica (Arellano y Macía, 2014; Bolaños et al., 2010; Franco-Rosselli et al., 1997; García et al., 2010; Gómez, 2008; Rodríguez et al., 2014; Velásquez et al., 2012).
Se presentan algunas diferencias en la composición entre los escenarios muestreados. Esta situación puede estar determinada por la diferencia en tiempo del avance de la regeneración natural de cada uno de los escenarios, estableciendo un mayor grado de conservación en restauración avanzada, ya que de acuerdo con Rangel-Ch y Velásquez (1997) las lauráceas son un tipo de vegetación importante en las selvas subandinas conservadas debido a su contribución en la conformación de la estructura vertical y horizontal, así como el aporte de materia orgnánica y el ofrecimiento de frutos carnosos para la interacción con fauna; también se destaca en las vertientes húmedas la presencia y dominancia de especies de Rubiaceae (Gentry, 1992; Mendoza et al., 2004) y especies de Melastomataceae son típicas de comunidades vegetales en regeneración (Gentry, 1992; Mendoza y Ramírez, 2006).
A nivel de géneros, se nota una diferencia entre la vegetación presente en los escenarios evaluados. Para la zona de restauración avanzada, la mayor riqueza de especies y abundancia la reportan los géneros Ocotea, Elaeagia y Miconia en tanto que los transectos de restauración temprana cuentan con una mayor riqueza y dominancia de los géneros Miconia y Meriania; ratificando el mayor grado de conservación que presenta el escenario de restauración avanzada, puesto que el género Ocotea de la familia Lauraceae es representativo de bosques maduros (Rangel-Ch y Velásquez,1997) y Miconia, es considerado como indicador asociado con áreas de crecimiento secundario (Gentry, 1992).
En lo respectivo a la estructura de la vegetación caracterizada en los transectos de ambos escenarios, se encontraron diferencias en las alturas y DAP de los estratos arbustivo y sub-arbóreo, siendo en restauración avanzada donde se registran valores mayores que en restauración temprana lo que corrobora el estado de desarrollo temprano en que se encuentra este escenario (Bolaños et al., 2010) y ratificando que los transectos del escenario de restauración avanzada se encuentran en un estado más avanzado de regeneración, como respuesta al aislamiento con un periodo de tiempo más prolongado.
Por último, la regeneración natural de la zona logró el aumento de especies vegetales y por lo tanto un aumento en los valores de los parámetros de estructura horizontal y vertical del bosque. Lo anterior se logró evidenciar con las diferencias encontradas en la composición y estructura de la vegetación entre los dos escenarios evaluados, posiblemente debido a la diferencia en el tiempo de aislamiento y a la intensidad de uso que tuvo cada zona. Esto permite validar la liberación de áreas degradadas para la regeneración natural como acción de recuperación de coberturas naturales, significando una importante estrategia de manejo que implementa el PNN Munchique, ya que permite establecer procesos para la reducción de las presiones tanto al interior como en la zona con función amortiguadora del área protegida.