Introducción
Una de las más preocupantes manifestaciones de la pérdida de biodiversidad en el Neotrópico es la fragmentación y pérdida de los bosques andinos. Para los bosques subandinos, las principales amenazas son la tala, la implementación de cultivos agrícolas, incluyendo de usos ilícito, la cacería y el cambio climático (Armenteras et al., 2007). La pérdida de este ecosistema es muy preocupante, tanto por su valor intrínseco, como por los servicios ecosistémicos fundamentales que provee (Calderón-Caro & Benavides, 2022).
La restauración pasiva se presenta como una opción para contrarrestar la fragmentación y la pérdida de ecosistemas de bosque, pues permite reconstruir la conectividad y ayuda a la recuperación de las poblaciones animales a corto, mediano y largo plazo (Chazdon, 2003; Vilches et al., 2008). Para que la regeneración natural ocurra, el papel de la fauna es fundamental al actuar como muy eficientes dispersores de propágulos (polen, semillas) (Domínguez-Domínguez et al., 2006, Dosch et al., 2007), a tal punto que en los bosques tropicales hasta un 90% de las especies arbóreas pueden presentar frutos morfológicamente adaptados para la zoocoria (Andresen, 2005).
El conocimiento sobre el proceso de regeneración del bosque subandino en aspectos como las relaciones e influencia de la fauna están aún pobremente documentadas, pero de otros ecosistemas se tienen evidencias de que los grupos de fauna aparecen en diferentes momentos y sus aportes son distintos. Los murciélagos podrían estar más presentes en los momentos iniciales de la sucesión aportando semillas de plantas pioneras, mientras que las aves podrían hacerlo en etapas avanzadas (de la Peña-Domene et al., 2014). Pero entre las aves también se pueden presentar diferencias, aves pequeñas generalistas podrían ser claves al inicio del proceso (Karubian et al., 2012; Carlo & Morales, 2016), mientras que aves grandes especialistas podrían ser fundamentales en etapas medias y avanzadas (Palacio et al., 2016).
Obtener información más detallada del proceso de sucesión del bosque subandino, en particular de la relación temporal entre especies de plantas y especies de aves es necesario para evaluar el estado de avance del proceso, permitiendo mejorar las estrategias de regeneración de la cobertura vegetal y evitar la extinción de especies vulnerables contribuyendo con el propósito de conservar la biodiversidad. Este estudio aporta información sobre la dinámica temporal de la diversidad de la comunidad de aves frugívoras del bosque subandino, la cual fue monitoreada por parte del equipo del Parque Nacional Natural Munchique entre 2012 y 2017, en una zona en proceso de regeneración natural desde 2006 (Acevedo & Maya-Girón, 2018). La continuación del monitoreo no fue posible debido a situaciones generadas por riesgo público y por la pandemia del COVID-19.
Materiales y métodos
Área de estudio. El área de estudio se ubica en el sector nororiental del Parque Nacional Natural Munchique en el flanco occidental de la cordillera Occidental, municipio de El Tambo, departamento del Cauca, en las coordenadas 02°47'02"N-76°53'47"O, a 1755 m s.n.m. y 02°46'57"N-76°53'48"O a 1723 m s.n.m. (Figura 1). La zona de vida corresponde a un bosque subandino según Cuatrecasas (1958), que se encuentra en proceso de regeneración natural. La zona climática es frío-húmedo, con una precipitación anual entre los 3000 y 4000 mm. El régimen de lluvias es bimodal, con mayores lluvias entre octubre y noviembre y menores entre abril y mayo (Parque Nacional Natural Munchique, 2014).
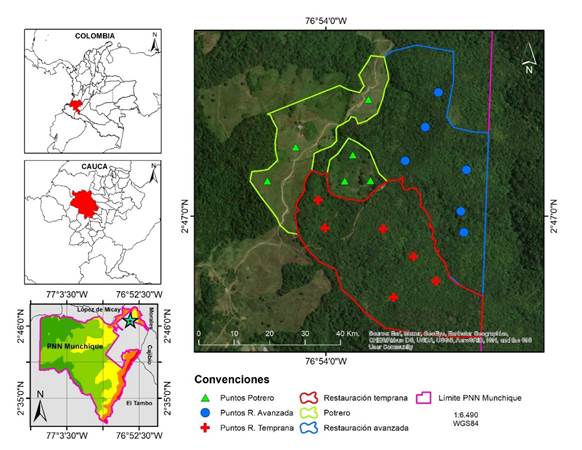
Figura 1 Localización de los escenarios de muestreo en el sitio de estudio y ubicación geográfica del PNN Munchique.
Las zonas de estudio se encuentran ubicadas al interior de un predio de 143 ha, en el que se localizaba la cabaña de funcionarios del sector El Rosal hasta inicios de 2022. Esta fue adquirida por el Sistema de Parques Nacionales en 2008 y previamente era una finca dedicada a la ganadería desde aproximadamente 1980. El sitio de estudio que corresponde a la zona con función amortiguadora del área protegida, colinda con áreas de uso agrícola y pecuario de comunidades campesinas e indígenas presentes en el territorio desde finales del siglo XIX y principios del siglo XX (Parque Nacional Natural Munchique, 2014).
Evaluación de la diversidad de aves. La información empleada para el presente estudio fue obtenida de monitoreos desarrollados por el Parque Nacional Natural Munchique, enmarcados en la implementación de la estrategia de REP. Estos monitoreos corresponden a la evaluación de la diversidad de aves en dos escenarios de restauración ecológica de 0,1 ha cada uno y colindantes entre ellos. El primero se definió como “restauración avanzada”, que al momento del establecimiento de los transectos contaba con 12 años de aislamiento después de haber sido una zona de potrero con árboles aislados. Esta área se caracteriza por la presencia mayoritaria de especies de la familia Lauraceae, Rubiaceae y Melastomataceae, con un estrato arbóreo inferior (12 - 25 m) y sub-arbóreo (5 - 12 m) con una cobertura de dosel discontinua, debido a algunos claros de luz donde posiblemente ocurrió entresaca selectiva. También se destaca el estrato arbustivo (1.5 - 5 m); este último fue aumentando su dominancia a lo largo de los periodos de muestreo y donde se registran la mayor cantidad de epífitas (obs. per.) (Figura 2a). El segundo escenario llamado “restauración temprana”, fue definido como una zona objetivo de recuperación a partir de la regeneración natural. Esta zona al momento del inicio del monitoreo de los transectos, contaba con 6 años de aislamiento y previamente también había correspondido a una zona de potrero para la ganadería por cerca de 20 años. En este escenario se registraron los estratos arbustivo (1.5 - 5 m) y sub-arbóreo (5 - 12 m) con un dosel discontinuo y evidenciandose un aumento de individuos a lo largo del monitoreo (obs. pers.). Las especies vegetales más comunes pertenecían a las familias Melastomataceae, Piperaceae y Rubiaceae (Figura 2b).
Adicionalmente, se evaluó un tercer escenario de 0,1 ha denominado “potrero” que fue definido por el área protegida con el objetivo de identificar las especies de aves tolerantes a sitios perturbados, como también la movilidad de las especies entre el interior de bosque, borde de bosque y el potrero ubicado de manera adyacente al bosque, Los parches de bosque que rodean el tercer escenario presentan conectividad entre ellos. El “potrero” se caracteriza por estar dominado de la especie Brachiaria sp. y tener algunos árboles aislados de Psidium guajava.
En los escenarios fueron ubicados un total de 18 puntos fijos de observación de aves (Ralph et al., 1996), 6 puntos por cada escenario. Cada punto contó con un radio de 20 metros y una distancia de 100 metros entre ellos. Los muestreos se realizaron entre 2012 y 2017, dos por cada año de manera semestral, un día para cada escenario, con un total de seis días al año. Para el análisis los datos fueron agrupados en tres períodos de tiempo: El primero (I) consta de los registros obtenidos entre 2012 y 2013, el segundo (II) comprende los datos entre 2014 y 2015 y el tercero (III) representa los datos de 2016 y 2017; sin embargo, el área de estudio está excluida de perturbación desde el año 2006.
Se efectuaron observaciones directas y registro de vocalizaciones en cada uno de los seis puntos establecidos en los escenarios de muestreo por un periodo de 10 minutos en cada uno, desde las 06:00 am hasta las 08:00 am y desde las 4:00 pm hasta las 6:00 pm. Para las observaciones directas fueron empleados binoculares Nikon Monarch-7 8x42 y para la identificación de especies fueron implementadas la Guía de las Aves de Colombia (Hilty & Brown, 2001) y la Guía de campo de las Aves de Colombia (McMullan & Donegan, 2014); en los resultados se sigue la propuesta taxonómica de Remsen et al. (2022). En este estudio las aves se consideraron frugívoras todas aquellas cuya dieta consiste principalmente de frutos, incluyendo desde generalistas (se alimentan de una variedad amplia de frutos) hasta especialistas (solo usan frutos con características muy particulares), con base en la revisión de la información secundaria al respecto (Kattan et al., 1994, Hilty & Brown ,2001, Casas, 2006, Palacio, 2014, Angulo, 2016).
Dinámica temporal de la riqueza de aves. Se obtuvo la riqueza de especies por órdenes y familias en cada uno de los escenarios muestreados. Para determinar si el muestreo fue representativo se realizó el cálculo de las curvas de rarefacción y extrapolación a partir de la cobertura de muestra, que se refiere a la proporción de la diversidad total que es representada por la muestra (Chao & Jost, 2012). Posteriormente, se realizó el cálculo de la diversidad verdadera, para obtener el número de especies efectivas, a partir de lo propuesto por Jost (2006). Lo anterior, debido a que es una forma sencilla de interpretar y comparar la diversidad de varias comunidades. Para este trabajo se consideraron tres medidas de diversidad verdadera, siendo la primera la diversidad de orden cero (q0), cuyo valor equivale a la riqueza de especies, en donde la fórmula es insensible a la abundancia relativa de las especies. La segunda medida es la diversidad verdadera de orden uno (q1), en la cual todas las especies son ponderadas proporcionalmente según la frecuencia en la comunidad, y la tercera medida es la diversidad verdadera de orden dos (q2), en donde las especies dominantes toman mayor relevancia (Jost, 2006; Moreno et al., 2011). Los cálculos de cobertura de muestra y diversidad verdadera se realizaron mediante la versión en línea del paquete iNEXT (Chao et al., 2016; http://chao.stat.nthu.edu.tw/wordpress/software_download/).
Resultados
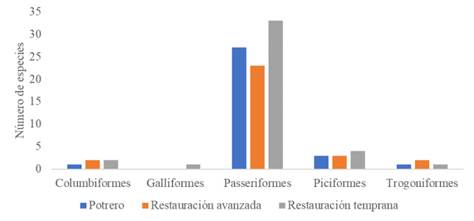
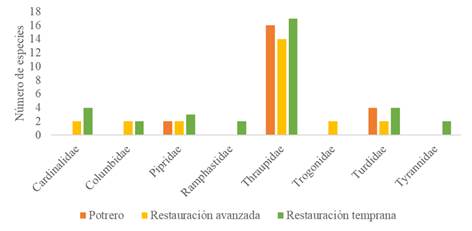
De las observaciones realizadas en los puntos fijos de muestreo en los tres escenarios de monitoreo en el PNN Munchique, se registraron 50 especies de aves frugívoras que corresponden a 31 géneros, 15 familias y 5 órdenes (Anexo 1). La comunidad de aves frugívoras de la zona de estudio está compuesta de un 82 % por Passeriformes y en un 18 % por otros órdenes (Figura 3). La familia con mejor representación es Thraupidae con 22 especies, seguida de Turdidae, Cardinalidae y Pipridae con cinco, cuatro y tres especies respectivamente. Las familias restantes se encuentran representadas por una o dos especies (Figura 4).
La representatividad del muestreo, calculada a partir de curvas de interpolación y extrapolación, estuvo entre 85% y 93% para los tres escenarios y a lo largo de los tres periodos de monitoreo, lo que implica que la comunidad muestreada fue representativa de la diversidad total presente en el ecosistema (Villarreal et al., 2006) (Figura 5).
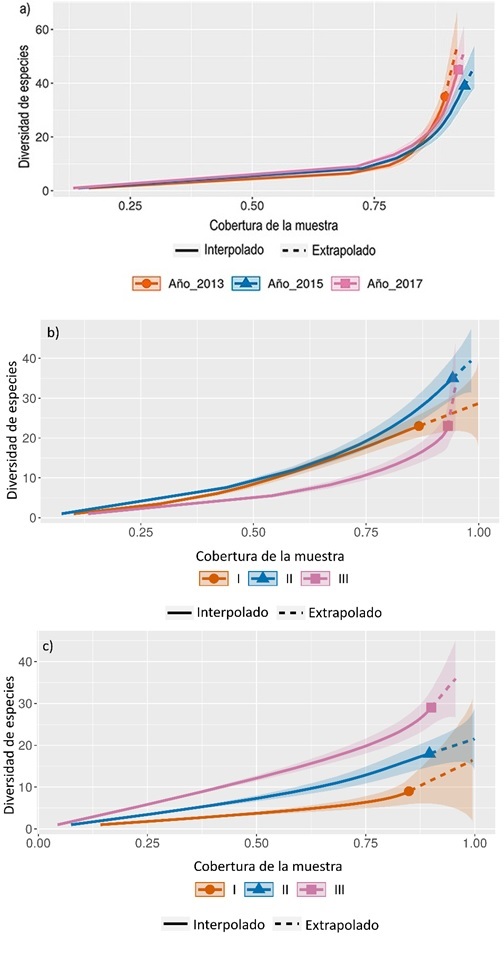
Figura 5. Curva de rarefacción basada en la diversidad observada (curvas sólidas) y extrapolación basada en la diversidad esperada (curvas discontinuas) indicando la cobertura de muestra para los periodos muestreados en los tres escenarios en el PNN Munchique a partir de la serie de números de Hill y representada por la riqueza específica (número efectivo de especies) con intervalos de confianza del 95% (áreas sombreadas, basadas en un método bootstrap con 100 réplicas) a) Escenario restauración avanzada, b) Escenario restauración temprana, c) Escenario potrero.
En el periodo I (2012-2013), la comunidad de aves frugívoras en el escenario de restauración avanzada registró un total de 12 especies; el escenario de restauración temprana reportó un total de 23 especies y para el escenario de potrero fueron registradas 9 especies. En el periodo II (2014-2015) se observa un aumento en la riqueza de especies para los tres escenarios con 22, 35 y 18 para restauración avanzada, temprana y potrero respectivamente. Finalmente, para el periodo III (2016-2017) y en comparación con el periodo II, se registra una disminución en la riqueza de las aves frugívoras en los escenarios de restauración avanzada y temprana, con 20 y 23 respectivamente, excepto en el escenario de potrero donde se registró un aumento de nueve especies al comparar con la riqueza del periodo II.
Se destaca que las tres especies más frecuentes en el periodo I (2012-2013) para el escenario de restauración avanzada fueron Semnornis ramphastinus, Myadestes ralloides y Eubucco bourcierii; en restauración temprana fueron Myadestes ralloides, Patagioenas plumbea y Masius chrysopterus y para el escenario de potrero fueron Myadestes ralloides, Semnornis ramphastinus y Thraupis episcopus. Durante el segundo periodo de monitoreo (2014-2015) en el escenario de restauración avanzada las especies Myadestes ralloides, Tangara arthus y Habia cristata eran las más frecuentes; para el escenario de restauración temprana se destacaron Myadestes ralloides, Patagioenas fasciata y Tangara arthus y en potrero Tangara gyrola, Ramphocelus flammigerus y Chalcothraupis ruficervix. En el tercer periodo de monitoreo (2016-2017), en el escenario de potrero se registró la mayor riqueza, siendo Chalcothraupis ruficervix, Semnornis ramphastinus y Turdus ignobilis las tres especies más frecuentes para esta zona. En restauración temprana Myadestes ralloides, Patagioenas fasciata y Masius chrysopterus fueron las más frecuentes y para restauración avanzada fueron Patagioenas fasciata, Myadestes ralloides y Tangara arthus.
De la lista de especies de aves frugívoras obtenida a lo largo del monitoreo en el PNN Munchique, el género Tangara se destaca como el más diverso con nueve especies registradas y el cual también, presentó diferencias notorias en el registro de sus especies entre los sitios de muestreo y periodos de monitoreo. Tangara arthus fue la especie más frecuente del género en el escenario de restauración temprana durante el periodo II; T. gyrola y S. vitriolina eran frecuentes para la zona de potrero durante el segundo y tercer periodo respectivamente. Otras especies como Tangara nigroviridis reporta presencia en los tres sitios. Las especies que se registraron en un único sitio de muestreo fueron T. xantocephala y S. henei, la primera se observó solamente en restauración avanzada en los periodos II y III y la segunda en potrero, únicamente en el tercer periodo de monitoreo.
Por otro lado, se logró registrar que la comunidad de aves frugívoras presente en el escenario de restauración temprana fue más diversa que la de restauración avanzada y potrero, dado que presenta una mayor riqueza (q0), mayor equitatividad (q1) y menor dominancia (q2) al ser comparada con la de los dos escenarios restantes y a lo largo de los tres periodos de monitoreo (Tabla 1). Se observa también que, tanto en restauración avanzada como en restauración temprana, la comunidad registrada en el periodo II es más diversa al compararla con la reportada en los periodos I y III. En el periodo III se registró casi el doble de individuos que en el periodo I, y este último presenta una comunidad más equitativa al reportar valores mayores en q1 y q2 (Tabla 1). El escenario de potrero presenta diferencia de los valores de diversidad verdadera en contraste con los dos escenarios restantes. Para este sitio se registra una comunidad poco diversa para los periodos I y II, al compararlas con los otros dos escenarios; sin embargo, se observa que para el periodo III, sus valores de diversidad verdadera son mayores que los otros sitios mencionados.
Ante lo anterior, los resultados obtenidos de los índices de diversidad verdadera en los tres escenarios presentan una tendencia al aumento en sus valores; aunque, se observa que, para el último periodo, en potrero es en el único escenario en el que se mantiene este aumento (Tabla 1).
Tabla 1 Valores de diversidad verdadera donde q0 es la riqueza de especies, q1 las especies más equitativas y q2 las especies más dominantes obtenidas para los períodos I, II y III de monitoreo de aves en los tres escenarios evaluados.
| rowspan="2">PERIODO MONITOREO | Q0 | Q1 | Q2 | ||||||
| R. ava | R. tem | Pot | R. ava | R. tem | Pot | R. ava | R. tem | Pot | |
| I | 12 | 23 | 9 | 7.6 | 14.6 | 6.9 | 5.6 | 8.7 | 5.7 |
| II | 22 | 35 | 18 | 14.3 | 19.9 | 13.5 | 10.2 | 12.6 | 10.9 |
| III | 20 | 23 | 29 | 10.7 | 11.6 | 22.3 | 6.8 | 7.1 | 18.7 |
R. ava.: Escenario Restauración avanzada; R. tem.: Escenario Restauración temprana; Pot: Escenario Potrero
R. ava.: Advanced Restoration Scenario; R. tem.: Early Restoration Scenario; Pot: Paddock
Lo anterior se puede corroborar en los perfiles de diversidad donde se observa un aumento en la riqueza de especies para el periodo II y III. Se destaca un aumento significativo en la diversidad para el escenario de restauración temprana al comparar los periodos I y II. Así mismo, se logra apreciar como estos dos períodos tienen un comportamiento similar, pero donde se refleja un aumento en el número de especies frecuentes y dominantes es para el periodo II. Por último, para el periodo III se registró un aumento en la diversidad de los tres escenarios; sin embargo, en potrero es donde se nota el mayor registro de especies dominantes en comparación con los otros dos escenarios (Figura 6).
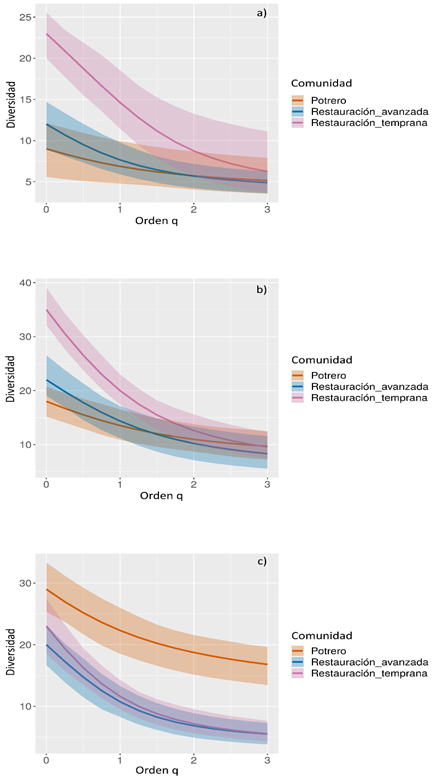
Figura 6 Perfiles de diversidad verdadera para la comunidad de aves frugívoras de los períodos I, II y III de los escenarios evaluados en el PNN Munchique. a) Periodo I; b) Periodo II; c) Periodo III. El orden de diversidad q0 es la riqueza de especies, q1 las especies más equitativas y q2 las especies más dominantes. Se proyectan los intervalos de confianza del 95% (áreas sombreadas, basadas en un método bootstrap con 100 réplicas)
Discusión
El conocimiento publicado sobre la relación entre la sucesión natural del bosque Andino al suroccidente de Colombia y la riqueza y rol de las aves frugívoras está muy poco documentado En este estudio se pudo establecer que hay diferencias en la riqueza, abundancia y frecuencia entre las diferentes especies de aves, pero concuerdan con los patrones reportados para otras zonas de los Andes colombianos. Las especies de aves frugívoras registradas a lo largo del monitoreo son comunmente reportadas para el flanco occidental de la cordillera Occidental y para el PNN Munchique (Negret, 1994; Ayerbe-Quiñones et al., 2008; López-Ordoñez et al., 2013, Fierro-Calderón et al., 2016). Esta comunidad conforma un grupo funcional representativo del ecosistema de selva subandina, al presentar similitud en la riqueza de especies con la avifauna estudiada por Renjifo (1999);2001), Lentijo & Kattan (2005) y Sanabria-Mejía (2018) en zonas de bosque subandino de las cordilleras Central y Occidental, en los cuales también se observa que la familia Thraupidae es una de las más representativas en cuanto a especies y el género Tangara registra la mayor riqueza.
La composición de especies fue diferente en cada uno de los tres escenarios monitoreados: restauración temprana, avanzada y potrero. En restauración temprana y avanzada Myadestes ralloides y Patagioenas fasciata fueron las más frecuentes. Esto concuerda con lo reportado por Renjifo (2001), quien observo que Myadestes ralloides con mayor abundancia en la zona de bosque continuo y Patagioenas fasciata con mayor abundancia en la zona de fragmento de bosque rodeado por pastizal.
En el escenario de potrero las mayores frecuencias de aves se obtuvieron para especies como Tangara gyrola, S. heinei, S. vitriolina, S. cyanicollis, Ramphocelus flammigerus, Thraupis episcopus y Tachyphonus rufus de la familia Thraupidae, y Turdus ignobilis y Mimus gilvus de la familia Turdidae que a pesar de observarse frecuentemente en áreas intervenidas (obs. pers.) y de ser abundantes en este tipo de hábitats (Renjifo, 1999), son especies frugívoras de tamaño mediano (50-140 g) y pequeño (<50 g) que presentan una mayor tolerancia a áreas con disturbios intermedios y severos. Estas aves al transitar entre zonas degradadas y parches de bosque, pueden dispersar las semillas de los frutos que consumen (Gomes et al., 2008) aportando significativamente al banco de semillas de las áreas degradadas y fortaleciendo el proceso de regeneración natural.
En los escenarios de restauración temprana y avanzada se registró a Miconia theizans que se caracteriza por una abundante producción de frutos pequeños de manera asincrónica durante todo el año, significando una oferta alimenticia constante para diferentes tipos de aves frugívoras especialistas y generalistas (Snow, 1981). Angulo (2016) y Palacio (2014) registraron especies del género Miconia como las especies más importantes para la alimentación de las aves frugívoras, debido a que corresponden a las especies con mayor número de interacciones en redes de interacción entre aves frugívoras y plantas.
La disposición espacial de los escenarios de monitoreo también podría explicar la variación en los valores de riqueza de aves a lo largo de los periodos de muestreo. Para el periodo I, la comunidad de frugívoros presentó una riqueza similar entre los escenarios de restauración avanzada y potrero, lo que podría explicarse por el tránsito constante de especies como Pharomachrus auriceps, Rupicola peruvianus y Semnornis ramphastinus en árboles aislados de Psidium guajava y Ficus sp. en la zona de potrero. Renjifo (1999) y Wilms & Kappelle (2006) plantean que los árboles aislados funcionan como sitios de percha, puntos de forrajeo o escalones para aves frugívoras que incursionan a los claros y pastizales, traduciéndose en una eficiencia en la dispersión de semillas para esta área degradada y en una efectiva restauración pasiva de la zona.
En cuanto al escenario de restauración avanzada se puede deducir un mayor grado de conservación al registrar con mayor frecuencia, en comparación con los otros escenarios, especies como Rupicola peruvianus y Habia cristata, las cuales son consideradas como indicadoras de buen estado de conservación de un bosque (Renjifo, 1999)
También, se observa que el estrato arbóreo inferior, el cual fue más representativo en el escenario de restauración avanzada (obs. pers.), pudo haber influenciado la presencia de Patagioenas fasciata, ya que esta ave forrajea en alturas de dosel (Hilty & Brown, 2001) y adicionalmente Renjifo (2001) y Gomes et al. (2008) la reportan como una especie en la que su abundancia no es afectada por la fragmentación del bosque y presenta cierta tolerancia a los ambientes intervenidos, por lo cual se logra explicar su registro frecuente en restauración temprana. De manera contraria se observó que Semnornis ramphastinus, especie que Restrepo & Mondragón (1998) describen con una dieta mayoritaria de especies de estrato arbustivo y epífitas, no registró una mayor abundancia en el escenario de restauración temprana, donde el estrato arbustivo es dominante. Cabe mencionar que Kattan et al., (1994) reporta la desaparición de esta especie, en su rango de distribución, para una zona de bosque subandino en la cordillera Occidental, relacionándolo directamente con la fragmentación del hábitat y con la presión de cacería para el comercio de S. ramphastinus como ave de jaula.
Por otro lado, se espera que los cambios asociados a la estructura forestal durante el proceso de sucesión hacia un estado de mayor conservación, aumente la diversidad de frugívoros especialistas, por ejemplo aves grandes de dosel (> 140 g) (Gomes et al., 2008). Esto considerando lo planteado por Gómez et al. (2021) quienes encontraron una relación entre la evaluación histórica y la perdida de riqueza funcional representada en la desaparición de aves especialistas de gran tamaño, posiblemente por factores como la reducción de sus hábitats. Sin embargo, su presencia y abundancia a lo largo del monitoreo en el PNN Munchique no fue significativa, lo que sugiere que no hay suficientes individuos en la zona para la colonización, probablemente debido a la deforestación que se presenta en el área circundante a los escenarios de restauración. Kattan et al. (1994) y Renjifo (1999) afirman que los frugívoros grandes son más propensos a desaparecer debido a la fragmentación de los ecosistemas.
Por último, se espera que, al aumentar el tiempo de sucesión vegetal en las parcelas de regeneración natural del PNN Munchique, haya un aumento en la complejidad de la red de interacción entre las aves frugívoras y las especies forestales. Cuando la regeneración tenga la composición y estructura de los bosques maduros es probable que la comunidad de aves frugívoras cuente con la presencia especies especialistas y, por lo tanto, haya un mayor número de interacciones específicas entre ave y planta aumentando así la diversidad funcional del ecosistema (Casas et al., 2016; Salas-Correa & Mancera-Rodríguez, 2018, 2020).