Introducción
La polinización representa la posibilidad de reproducción para un sin número de especies vegetales en los bosques secos tropicales (BsT) (Holdridge, 1978). En Colombia, se conserva aproximadamente el 8% de las coberturas originales de BsT, además, representa uno de los ecosistemas menos estudiados en el país, por lo cual las especies nativas, las relaciones entre éstas y los servicios ecosistémicos se encuentran en riesgo (Pizano & García, 2014). La fauna y la flora del BsT se encuentra relacionada a través de una gran variedad de interacciones, donde la polinización adquiere relevancia y es crucial para entender los procesos ecológicos que mantienen la biodiversidad, la estructura y la composición de un ecosistema tan amenazado como el bosque seco (Peres-Coelho et al., 2013).
El deterioro del BsT se debe principalmente a acciones humanas que ponen en riesgo al ecosistema y que han incrementado en los últimos años, sin embargo, es importante reconocer que se considera que estos ecosistemas secos en el valle geográfico del río Cauca han presentado presiones por actividades humanas desde hace aproximadamente 2300 años (Castaño-Salazar, 2009; Scolozzi et al., 2012; Ruiz et al., 2013; Ramos-Pérez & Silverstone-Sopkins, 2018). El BsT se encuentra en el Valle del Cauca con un poco más del 9 % de la cobertura total del ecosistema en Colombia (Alvarado-Solano & Otero-Ospina, 2015), sin embargo a nivel regional, presenta de igual modo un alto grado de deterioro; Se encuentra distribuido en pocos parches dispersos que oscilan entre 1 a 330 ha, con vegetación leñosa, arbustos y pasturas que presentan un único estrato de coronas de árboles, registrándose una pérdida de aproximadamente el 50 % desde 1984, ocasionado principalmente por las áreas de cultivo extensivas (Arcila-Cardona et al., 2012; Alvarado-Solano & Otero-Ospina, 2015).
Algunos de los trabajos realizados en el BsT resaltan la gran diversidad que alberga este ecosistema (Arcila- Cardona et al., 2012; Vargas, 2012) y reconocen que proporciona una serie de beneficios a las comunidades humanas, es decir, servicios ecosistémicos. Sin embargo, una de las amenazas que enfrentan estos bosques en Colombia es la fuerte degradación, por lo tanto, este tipo de estudios cobran gran importancia ya que permiten conocer las relaciones ecológicas asociadas a los servicios ecosistémicos, en este caso, para la polinización (Cárdenas-Camacho et al., 2021). La incorporación de este concepto en los estudios de conservación visibiliza de una forma explícita la interdependencia del bienestar humano y el mantenimiento del adecuado funcionamiento de los ecosistemas, además, resalta la importancia de las interacciones de fauna y flora en la naturaleza (Balvanera, 2012).
Entre los servicios ecosistémicos y/o interacciones se resalta la polinización (Millenium Ecosystem Assessment, 2005), el proceso de reproducción básico de las plantas angiospermas que favorece el flujo y variabilidad genética (Peres-Coelho et al., 2013). En Colombia se reconoce la polinización como un servicio ecosistémico estratégico en relación con el papel que desempeña para la conservación de la diversidad biológica, el mantenimiento de la estructura y función de los ecosistemas, la producción de alimentos y la economía. Este proceso, para muchas especies vegetales, debe llevarse a cabo por polinizadores, entre los cuales se destacan insectos, algunas especies de aves, mamíferos no voladores y murciélagos (Cárdenas- Cajamarca, 2017; Moreno-Villamil et al., 2018).
Muchos murciélagos exhiben características morfológicas que les confieren un papel crucial en la polinización. El vuelo les permite visitar una gran cantidad de flores cada noche, ubicadas en un amplio rango geográfico, y especies nectarívoras e incluso omnívoras poseen largas lenguas para alcanzar el néctar de las flores y posteriormente polinizarlas debido a la adhesión y transporte del polen en su pelaje (Moreno-Villamil et al., 2018). Estas dinámicas entre animales y plantas también son importantes para entender los procesos ecológicos que generan y mantienen la biodiversidad, la estructura y composición, así como, especies claves para los ecosistemas.
El análisis de las relaciones entre los murciélagos y las plantas que polinizan es posible por medio de redes complejas, las cuales evidencian la acumulación de las interacciones entre los diferentes actores, en diferentes niveles y grados de asociación en el tiempo y el espacio (Jordano et al., 2009). Las denominadas redes de interacción mutualistas se describen mediante nodos que muestran las especies o actores y enlaces, los cuales pueden estar relacionados con la presencia, fuerza o dirección del vínculo. De este modo, la forma en la que se organizan los enlaces o topología de las redes es un reflejo de las dinámicas que ocurren dentro de los ecosistemas, así como de los roles que cumplen las especies en el entorno (Bascompte & Jordano, 2007; Bascompte & Jordano, 2008) y han sido evaluados de acuerdo a diferentes índices y métricas, entre ellas las configuraciones modular y anidada (Fortuna et al., 2010; Pinheiro et al., 2019) en redes de interacción mutualistas, incluyendo las relaciones quiróptero-planta (González-Gutiérrez et al., 2022). En las redes de interacción, la estructuración anidada se caracteriza porque los enlaces se organizan de forma asimétrica y jerárquica donde subgrupos de especies con pocas interacciones interactúan o son incluidas en subconjuntos de especies cada vez más conectadas (cada vez menos especialistas) (Mariani et al., 2019). Mientras que la estructura modular se caracteriza porque muestra las particiones que presenta la red de acuerdo a la frecuencia de interacción de las especies, formando módulos o subgrupos, donde las especies se conectan con socios dentro de su mismo módulo o con especies de otros módulos, lo cual puede reflejar selección diferencial, dinámicas coevolutivas, agrupamiento entre especies cercanamente relacionadas, heterogeneidad de hábitat o los roles que pueden estar cumpliendo las especies dentro de la red y del ecosistema (Lewinsohn et al., 2006; Olesen et al., 2007; Pinheiro et al., 2019). Además, la estructura de la red, la interacción de las especies y su rol dentro de la comunidad, puede ser una medida de la dinámica y robustez del ecosistema (Bascompte & Jordano, 2007). La métrica de robustez, debido a procesos de co-extinciones secundarias (Memmott et al., 2004), permite conocer la tolerancia de una red frente a la pérdida de especies (Hagen et al., 2012; Oliveira et al., 2019) una medida especialmente relevante en ecosistemas amenazados por acciones antrópicas, tal como el BsT del Valle del Cauca.
Con el fin de aportar a la conservación del BsT del Valle del Cauca se hace necesario el desarrollo de estudios que permitan evidenciar las relaciones que soportan la biodiversidad en el ecosistema, en especial, relaciones poco estudiadas entre plantas y polinizadores que ocurren en los fragmentos de BsT. De este modo, el objetivo del presente trabajo fue identificar las redes de interacción entre murciélagos nectarívoros y plantas en diez remanentes de BsT en el Valle del Cauca, por medio de la identificación de las especies de polen encontradas en el pelaje y heces de murciélagos nectarívoros y polinívoros. Se espera que la información recolectada provea lineamientos para la determinación de especies claves en el ecosistema y contribuya al direccionamiento de los esfuerzos de conservación.
Materiales y métodos
Fase de campo. La investigación se llevó a cabo entre diciembre del 2019 y septiembre del 2021 en diez remanentes de bosque seco tropical del centro y norte del Valle del Cauca, Colombia, los cuales se encontraban dentro de una franja altitudinal de 970-1200 m s.n.m. Los remanentes muestreados corresponden a relictos de bosques dentro de haciendas o áreas protegidas de distinta índole (Figura 1), los cuales fueron asociados a letras para facilitar su reconocimiento: Parque Natural Regional (PNR) Mateguadua (A), Reserva Forestal Protectora Nacional (RFPN) Valenzuela (B), Hacienda (Hda) El Volcán (C), Hacienda La Venta (D), Bosque La Gitana (E), Reserva Natural (RN) Chimbilaco (F), PNR El Vínculo (G), Bosque Comunitario (BC) Higueroncito (H), Hacienda El Medio (I) y Hacienda Verdún (J). Cada localidad fue visitada en dos ocasiones con cuatro días/noches de muestreo efectivas para cada visita, los muestreos trataron de abarcar un periodo de lluvia y uno de sequía, sin embargo, por temas logísticos se distribuyeron de la siguiente forma: Primera visita: diciembre 2019 (A, B, C y D); julio - agosto 2020 (E, F, G); noviembre 2020 (H, I, J). Segunda visita: marzo, abril y mayo 2021 (A, B, C, D, E, F, G, H, I) y septiembre 2021 (J). El tiempo total efectivo de muestreo para cada remanente fue de 8 días/noches.
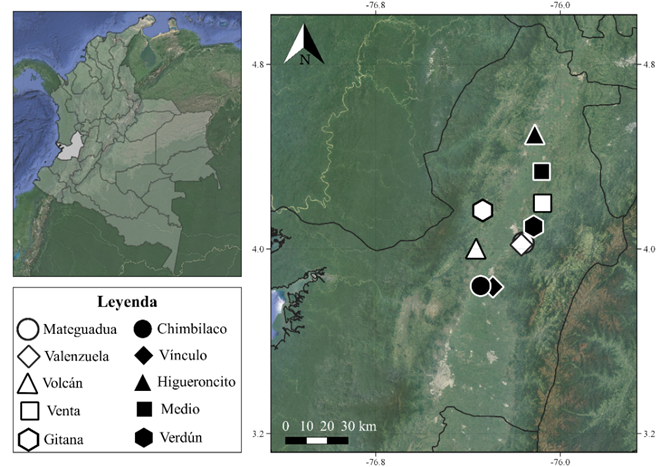
Figura 1 Localidades muestreadas durante el estudio en el centro y norte del departamento del Valle del Cauca, Colombia con el fin de conocer la interacción de polinización plantas-murciélagos en el Bosque seco Tropical del Valle.
Durante la primera visita a los diez remanentes se realizó una colección de referencia de polen (Medina et al., 2021), esto con el fin de contar con una base para la identificación de cargas polínicas. Para esto, se realizaron recorridos diurnos y nocturnos en el interior y borde de los bosques en búsqueda de plantas en floración, las plantas fueron colectadas y depositadas en el Herbario TULV del INCIVA y en el Herbario de la Universidad del Valle (CUVC). Las flores fueron disectadas para extraer el polen directamente de las anteras por medio de pinzas estériles, a continuación, se realizó el montaje de las placas de polen por medio del método de tacto con gelatina glicerinada coloreada, la cual fue preparada siguiendo la metodología de Fonnegra(1989) con modificaciones propuestas por Thomas(1998). La gelatina con el polen se dispuso sobre una lámina portaobjetos, fue cubierta con una lámina cubreobjetos y fijada con calor. La colección de polen de referencia con 123 muestras fue depositada en el Herbario TULV del INCIVA.
Con el fin de registrar la interacción entre plantas y murciélagos se realizó la captura de quirópteros entre las 18:00 y 24:00 h, para esto se emplearon diez redes de niebla (111 metros lineales) para un esfuerzo total de 4800 h/red. Los murciélagos capturados que presentaron una marcada preferencia alimenticia por néctar o polen fueron seleccionados para la toma de cargas polínicas debido a su potencial como polinizadores, cada murciélago fue depositado individualmente en una bolsa de tela debidamente aseada para evitar contaminación de la carga polínica, a cada uno le fue asignado un código y se realizó la respectiva identificación taxonómica. Posteriormente, se realizó la toma de muestras de polen del pelaje tanto de la zona dorsal como ventral de la cabeza de cada individuo, esto por medio del método de tacto con la gelatina glicerinada coloreada y el montaje y fijación de las placas para la posterior identificación del polen en el laboratorio. Adicionalmente, se revisó la bolsa de tela donde se encontraba cada murciélago en busca de excretas. Las heces fueron colectadas en bolsas de papel con el fin de realizar el montaje de placas de polen ingerido y excretado por los murciélagos.
Los murciélagos fueron marcados y liberados después del procedimiento de la toma de muestras. Cuando fue necesaria la identificación taxonómica por medio de caracteres craneales se procedió a la colecta del individuo. Los especímenes recolectados bajo el permiso de CVC, resolución 0100 N° 1122 del 2018, fueron depositados en la Colección de Mamíferos de la Universidad del Valle (UV) y en la Colección de Referencia de INCIVA (IMCN).
Fase de laboratorio. Se revisaron las placas de polen de pelaje y heces por medio de un microscopio óptico Olympus CX21 examinando cada placa en su totalidad en busca de granos de polen. Cada grano fue identificado al menor nivel taxonómico posible a través de su descripción, medidas, fotografías y comparación con el polen de la colección de referencia y guías polínicas disponibles en la Red de Catálogos Polínicos online (RCPol, 2021). En el caso de no lograr identificar el grano de polen, le fue asignado un número al morfotipo. Las interacciones de la red se definieron como la presencia de un morfotipo de polen en cada murciélago capturado, esto independiente del número de granos de cada morfotipo encontrado en los quirópteros (Souza et al., 2021) puesto que las diferentes especies de plantas pueden variar en la cantidad de polen producido (de Manincor et al., 2020). La Frecuencia de Interacción se consideró como la cantidad de interacciones reportadas para cada individuo animal y en sumatoria, para cada especie.
Análisis de datos. Con base en la frecuencia de interacción, se construyó una matriz cuantitativa y una red de interacción total para los diez remanentes de bosque seco muestreados. Para evaluar la estructuración de la red, se calcularon distintos índices a nivel de red: 1) Grado de especialización complementaria, a través del índice H2' (Blüthgen et al., 2006): mide la segregación de especies, donde valores cercanos a uno sugieren una alta partición de nicho y alta especialización a nivel de comunidad, y valores cercanos a cero sugieren que los niveles de especialización son bajos, 2) Anidamiento, representado por el índice WNODF (Weighted NODF) (Martínez et al., 2019; Ulrich, 2011) y valor ponderado del índice NODF (Overlap and Decreasing Fill): relaciona la especialización de la red con la asimetría de los enlaces, y determina de manera jerárquica como subgrupos de especies poco conectadas (especialistas) son incluidas o vinculadas en subgrupos cada vez más conectados (generalistas) (Almeida-Neto et al., 2008; Britton et al., 2016); González-Gutiérrez et al., 2022), y 3) Modularidad: evalúa la formación de subgrupos dentro de la red debido a la prevalencia de interacciones, y fue calculada a partir del algoritmo DIRT_LPAwb+ con la función computeModules (Beckett, 2016). La significancia de los valores tanto WNODF como DIRT_LPAwb+ fue evaluada con el modelo nulo "r2dtable" de la función nullmodell, (Dormann et al., 2008) con 1000 repeticiones del software R (R Core Team, 2022) y los índices a nivel de especie, por medio de la función networklevel, del paquete Bipartite (Dormann et al., 2019).
Como índices a nivel de especie se tuvieron en cuenta: A) Grado: demuestra el número de socios con los que interactúa cada especie, B) Conectancia: permite identificar la selectividad de las especies en relación al número total de socios disponibles, donde valores más altos indican mayor especialización, y C) Asimetría de la especialización (d'): permite identificar la selectividad de las especies en relación al número total de socios disponibles, valores más altos indican mayor especialización (Blüthgen et al., 2006).
Por otro lado, se evaluó la robustez de la red, siguiendo la metodología propuesta en Memmott et al. (2004) y Mello et al. (2011), donde por medio de modelos de eliminación según la "extinción primaria" de especies de una de las comunidades, se observa el comportamiento de la comunidad contraria ("extinción secundaria"). Estos modelos pueden ser al azar o dirigidos según el grado de importancia de las especies (desde especies con menos vinculaciones, hasta las más conectadas o viceversa). De este modo, se obtienen curvas de extinción secundaria que muestran el grado de decrecimiento tanto de la comunidad de plantas como de murciélagos de acuerdo con la perdida (co-extinciones) de especies especialistas o generalistas de comunidad contraria (Oliveira et al., 2019). Este análisis fue realizado por medio de la función second.extinct del paquete Bipartite (Dormann et al., 2019), de modo que los valores obtenidos pueden ubicarse entre cero y uno, siendo cercanos a 1 aquellos con un mayor porcentaje de robustez, y gráficamente, aquellos con menor pendiente. Finalmente, se comparó el número de especies tanto de plantas como de murciélagos, así como el número de enlaces e interacciones entre los diez fragmentos de bosque muestreados. Los análisis se realizaron con el lenguaje de programación R 4.2.1 (R Core Team, 2022).
Resultados
De un total de 1142 quirópteros capturados con representatividad de todos los gremios tróficos, 223 fueron nectarívoros/polinívoros, representados en seis especies de la siguiente manera: 197 individuos fueron de la especie Glossophaga soricina, 14 de Phyllostomus hastatus, siete de Glossophaga commissarisi, tres de Choeroniscus godmani, uno de Choeroniscus minor y uno de Phyllostomus discolor. Las especies de murciélagos nectarívoros/polinívoros interactuaron con 7 especies (o morfoespecies) de plantas (Figura 2), donde 12 representaron casi el 60% de las interacciones, principalmente las especies Inga cf. edulis (51; 7.41%), Maclura tinctoria (44; 6.40%), Ceiba pentandra (40, 5.81%), Inga_cf._punctata (40; 5,81), Poaceae_sp2 (32; 4,65), Inga_cf._vera (26; 3,78), Ficus_sp2 (25; 3,63), Vismia_sp. (25; 3,63), Ficus_sp1 (24; 3,49), Mucuna_mollis (22; 3,20), Ochroma_pyramidale (19; 2,76), Trichanthera_gigantea (19; 2,76), Crescentia_cujete (17; 2,47) y Solanum_sp1 (16; 2,33) (Anexo 2).

Figura 2 Murciélagos y plantas que interactúan en el bosque seco tropical del Valle del Cauca, A). Glossophaga soricina interactuando con Trichanthera gigantea, B). Murciélago nectarívoro Choeroniscus godmani, C). Grano de polen de Ochroma pyramidale (escala 20 µm), D). Grano de polen de T. gigantea (escala 25 µm), E). Flor de Pseudobombax septenatum, F). Flor de Crescentia cujete, G). Floración de Ceiba pentandra.
Figure 2. Bats and plants that interact in the tropical dry forest of Valle del Cauca. A). Glossophaga soricina interacting with Trichanthera gigantea, B). Nectar-feeding bat Choeroniscus godmani, C). Pollen grain of Ochroma pyramidale (20 qm scale), D). Pollen grain of T. gigantea (25 qm scale), E). Flower of Pseudobombax septenatum, F). Flower of Crescentia cujete, G). Ceiba pentandra flowers.
De las 462 (6 murciélagos x 77 plantas) interacciones posibles, se registraron un total de 125, representadas en 688 vínculos. La especie de murciélago G. soricina exhibió 73 interacciones, P. hastatus 21, G. commissarisi 17, C. minor 7, C. godmani 6 y P. discolor 1, recayendo casi el 80% de la interacciones animal-planta en G. soricina y P. hastatus. Por el contrario, las especies de plantas que más variación presentaron en sus interacciones fueron C. pentandra y C. cujete, que se relacionaron con 4 especies de murciélagos cada una, mientras que casi el 54.5% de las plantas (42 especies) presentaron interacción con una única especie de murciélago (Figura 3; Anexo 2).
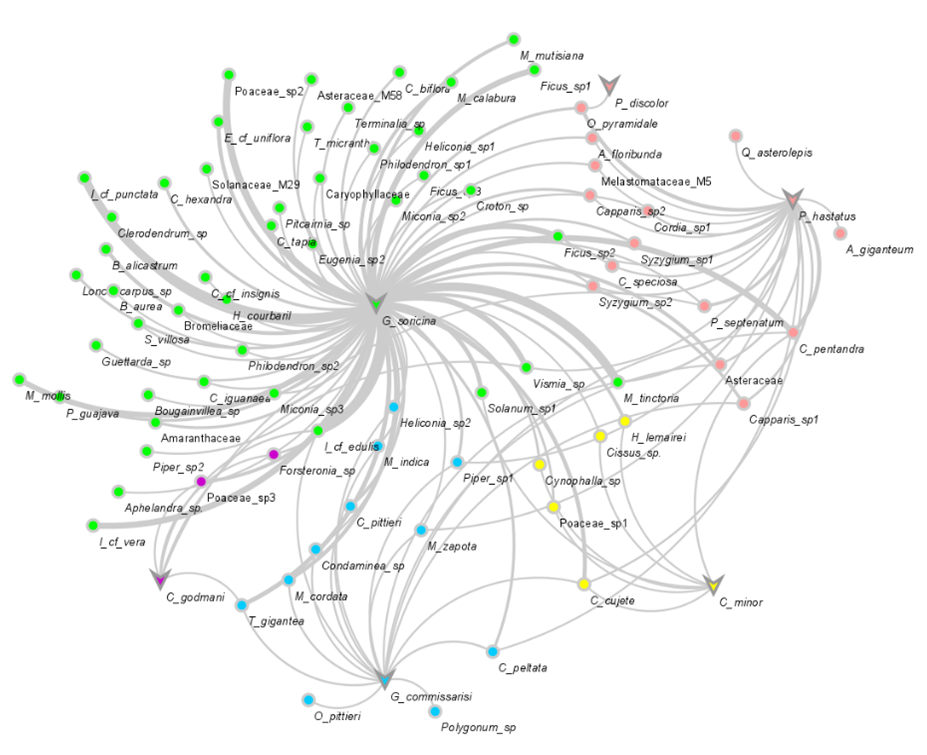
Figura 3. Representación gráfica de la red de interacción cuantitativa entre murciélagos nectarívoros/polinívoros y plantas en diez remanentes de bosque seco tropical del Valle del Cauca, Colombia. Circulo: especies de plantas; Triangulo invertido: especies de murciélagos. Cada color representa un módulo de la red.
Al estimar los atributos estructurales de la red de interacción resultante, se encontraron características de modularidad, puesto que el valor del índice se ubicó por encima del intervalo de confianza (Q0.025 = 0.079, Q0.975 = 0.104; Qobs = 0.16; Anexo 1). Además, gráficamente fueron diferenciados cinco módulos (Figura 3), donde las especies de murciélagos G. soricina, G. commissarisi, C. minor y C. godmani fueron único actor
polinizador en cada uno de sus respectivos módulos, mientras que P. hastatus y P. discolor compartieron la formación de un mismo módulo. En el caso de las plantas, la mayoría se incluyeron en el módulo de G. soricina (especies: 45 - 57.7%; enlaces: 588 - 85.47%), seguido del módulo de las especies del género Phyllostomus (especies: 15 - 19.2%; enlaces: 64 - 9.30%), el módulo de G. commissarisi (especies: 11 - 14.1%; enlaces: 21 - 3.05%), C. minor (especies: 5 - 6.4%; enlaces: 8 - 1.16%) y por último C. godmani (especies: 2 - 2.6%; enlaces: 7 - 1.02%).
Por otro lado, la red no presentó una estructuración anidada, dado que el valor del índice weighted NODF se ubicó por debajo del intervalo de confianza (InuHü.025 = 42.26, InulWs = 52.24; wNODF = 34.13; Anexo 1). Sin embargo, se encontró un valor relativamente bajo de especialización (H2' = 0.38; Anexo 1). En cuanto a los índices de estructuración de especie, se obtuvieron valores bajos de conectancia (0.27) y grado (1.5 enlaces por especie), mientras que la asimetría de la especialización fue relativamente alta (d' = 0.65).
Por otra parte, el índice de robustez permitió ver que la red en general es altamente robusta frente a la pérdida de nodos poco conectados o especialistas (RLbat = 0.93, RLplant = 0.96; Figura 4 C-D ), puesto que la pendiente fue menor y el valor de robustez fue mayor al obtenido si las extinciones ocurriesen completamente al azar (Rnullbat = 0.61, Rnullplant = 0.85; Figura 4 A-B). Adicionalmente, se observó mayor fragilidad frente a la pérdida de nodos generalistas, donde ambas comunidades presentaron valores bajos de robustez. Sin embargo, en la comunidad de murciélagos se presentó una curva con un decrecimiento más marcado (RHbat = 0.22; Figura 4 F ) en comparación con la comunidad de plantas (RHplant = 0.53; Figura 4 E ).
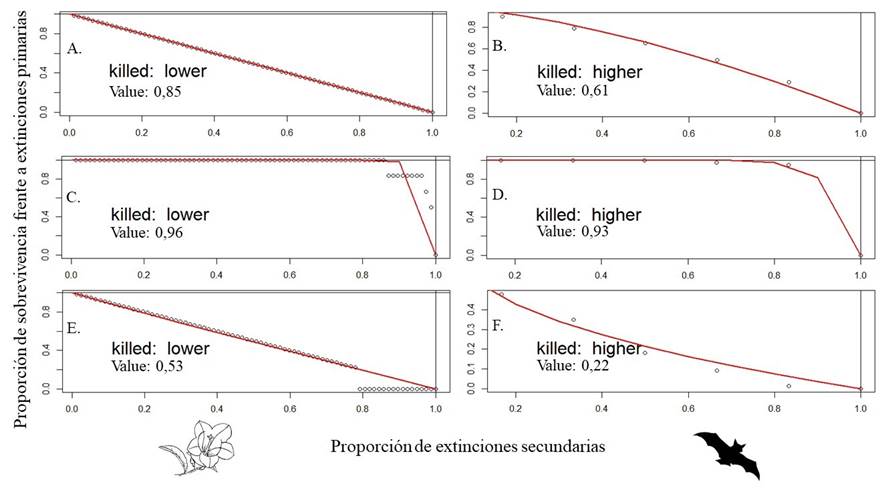
Figura 4 Robustez a partir del área bajo la curva de extinciones secundarias de las especies vinculadas en la red de interacción de polinización murciélago-planta en remanentes de bosque seco tropical del Valle del Cauca, Colombia. Según los modelos de extinción aleatoria (A, B) y selectiva para especies de menor a mayor abundancia (C, D) y de mayor a menor abundancia (E, F). A la izquierda la comunidad de plantas (A, C, E) y a la derecha la comunidad de murciélagos (B, D, F).
Finalmente, en cuanto a la comparación entre remanentes, se observó que los Parques Naturales Regionales de Mateguadua y Vínculo presentaron el mayor número de interacciones (47 y 42 respectivamente), coincidiendo con el mayor número de especies de plantas o morfoespecies observadas (40 y 30 respectivamente), mientras que el bosque de la Hacienda El Medio presentó la menor cantidad de interacciones (14) y de morfoespecies vegetales (12). Por otro lado, en el fragmento de bosque perteneciente a la Hacienda Verdún se encontró la mayor diversidad de especies de murciélagos nectarívoros/polinívoros (4) aunque menos de la mitad de morfoespecies vegetales (14) que en los PNR Mateguadua o Vínculo.
Tabla 1 Número de especies de plantas y murciélagos relacionado con la cantidad de enlaces e interacciones encontradas en diez remanentes de bosque seco tropical del Valle del Cauca, Colombia. Ícono de flor representa plantas, ícono de murciélagos representa a los quirópteros. PNR: Parque Natural Regional, RFPN: Reserba Forestal Protectora Nacional, RN: Reserva Natural, BC: Bosque Comunitario, Hda: Hacienda.
Discusión
En este estudio se observaron las características topológicas de la red de interacción planta-murciélago nectarívoro / polinívoro en diez fragmentos de BsT del centro y norte del Valle del Cauca. En general, la red presentó una alta especialización (d'=0.65), donde poco más del 54% de las especies de plantas presentaron una sola interacción (grado=1.5), lo que conlleva a una baja conectancia (0.27). Según Fortuna et al. (2010), de forma teórica, las redes de polinización con estas características muestran cierta relación entre los patrones de anidamiento y modularidad, sin embargo, en las comunidades naturales, las redes generalmente se organizan de forma no aleatoria y la estructuración puede verse influenciada por muchos factores, incluyendo condiciones ambientales y composición de especies (Olesen et al., 2007; Pinheiro et al., 2019), por lo cual las redes pueden variar en el tiempo y en el espacio (Chacoff et al., 2012; Pinheiro et al., 2019). En el caso de la red del presente estudio no se encontró relación entre ambos tipos de estructuras, puesto que aunque fue marcadamente modular, no presentó características de anidamiento, contrario a lo que se espera en redes bipartitas de polinización (Fortuna et al., 2010; González-Gutiérrez et al., 2022). Sin embargo, teniendo en cuenta el anidamiento como una organización jerárquica donde el conjunto de socios de un nodo es un subconjunto o superconjunto de otros grupos de socios de menor (o mayor) grado, Mariani et al. (2019) expone que este tipo de organización puede verse modificado de acuerdo a las propiedades básicas de la red, como el tamaño de la red, la densidad y la distribución de grados.
Por otra parte, Staniczenko et al., (2013) proponen la aparición de redes no anidadas de acuerdo a la abundancia de especies y la diferencia entre la relación generalistas-especialistas en la red. De acuerdo a lo anterior, se sugiere que, aunque este estudio presenta una red de polinización, la organización no anidada resultante podría deberse tanto a la marcada diferencia en la abundancia entre la comunidad de plantas (77 especies) y polinizadores (6 especies), como a la disimilitud entre el número de especies que se pueden considerar como especialistas (<2 interacciones; Plantas: 37%, Murciélagos: 17%) y generalistas (>3; Plantas: 63%; Murciélagos: 83%). Sin embargo, en este último caso, dentro de las especies generalistas, sólo un subgrupo de pocas especies fueron las que abarcaron la mayoría de las interacciones, como son las especies de quirópteros G. soricina y P. hastatus (94,6% de las interacciones), que se caracterizan porque gran parte de su dieta está basada en polen y néctar, entre otos recursos (Sánchez-Casas & Alvarez, 2000; Calonge, 2009; Teixeira, 2010; Cocucci & Johnson, 2017), y según González-Gutierrez et al. (2022), son las especies que más aparecen en redes de polinización del neotrópico y que generalmente se ubican como generalistas o centros de conexión, abarcando la mayoría de interacciones. Por su parte el subgrupo de especies con más vínculos en la comunidad de plantas (54,2% de las interacciones), estuvo comprendido por Inga cf. edulis, Madura tinctoria, Ceiba pentandra, Inga_cf._punctata, Poaceae_sp2, Inga_cf._vera, Ficus_sp2, Vismia_sp., Ficus_sp1, Mucuna_mollis, Ochroma_pyramidale, Trichanthera_gigantea y Crescentia_cujete, plantas caracterizadas en varias redes de polinización como parte de la dieta esencial de las especies de murciélagos nectarívoros/polinívoros (González-Gutiérrez et al., 2022), además de ser especies comunes en remanentes de bosque seco en el Valle del Cauca, por lo que se encuentran tanto dentro de los bosques, como en potreros arbolados y cercas vivas, lo que facilita la oferta de polen por parte de estas especies (Medina et al, 2021).
Por otro lado, la organización en la estructura modular se basa en los nodos (especies) y los bordes (interacciones entre las especies), sin embargo, la división en subgrupos viene dada principalmente por la frecuencia de interacción, puesto que la partición de la red y el posicionamiento de cada especie dentro de los bloques va a depender de la cantidad de interacciones y si estas se organizan principalmente con especies dentro de su mismo subgrupo (especialistas) o con especies de otros subgrupos (generalistas o conectoras) (Grilli et al., 2016). En el caso de la red para el Valle del Cauca, los subgrupos se dividieron principalmente de acuerdo a la especie de polinizador y estuvieron diferenciados por las especies de plantas polinizadas únicamente (especialistas) por cada especie de murciélago. Así los subgrupos centrados en G. soricina (vinculado con 45 especies de plantas) y P. hastatus - P. discolor (vinculados con 14 especies de plantas), fueron los más grandes en número de especies (nodos). Sin embargo, por parte de las plantas, las especies C. pentandra y C. cujete, fueron las que más vinculaciones presentaron (interacción con 4 especies de murciélagos), por lo que pueden estar funcionando como generalistas o conectoras de modulo.
Además de las funciones de las especies en el ecosistema, la estructura modular puede brindar información acerca de la estabilidad de las comunidades (Olesen et al., 2007; Grilli et al., 2016). De hecho, según Stouffer & Bascompte (2011) y Grilli et al. (2016), la estructura en bloques o módulos puede indicar redes resistentes a las perturbaciones, puesto que la perdida de una especie, dependiendo de los nexos establecidos por la misma, puede afectar sólo su propio subgrupo y la red general permanecer estable.
Otra forma de evaluar la robustez de las redes de interacción es mediante los modelos de co-extinciones secundarias, de acuerdo a extinciones primarias en la comunidad contraria (Memmott et al., 2004; Mello et al., 2011). De acuerdo a este análisis, el índice de robustez demostró que la red presenta una alta estabilidad frente a la perdida de nodos especialistas, tanto de la comunidad de plantas (0.96) como de la comunidad de murciélagos (0.93) (Figura 4C-D), puesto que los valores del índice fueron mayores a lo esperado por azar (Figura 4A-B) y la pendiente de la curva fue menos pronunciada en comparación con lo esperado por azar, indicando que la posibilidad de pérdida de nodos poco vinculados (especies especialistas) puede ser alta, antes de que el sistema completo o red se vean severamente afectados. Según Memmott et al. (2004); Dormann (2011) y Grilli et al. (2016), entre otros autores, el comportamiento que exhibe la curva depende del número de vinculaciones que tenga cada especie, de modo que si una especie posee muchas interacciones, esta no se verá enormemente afectada por la pérdida de uno o algunos pocos enlaces, y en retroalimentación, los enlaces socios pueden sobrevivir. Caso contrario ocurre si la eliminación de nodos inicia por las especies más generalistas, puesto que al extraer una especie super-vinculada del sistema, los socios, que en su mayoría pueden ser menos generalistas o incluso especialistas, no puedan mantenerse en el tiempo, lo que puede causar que la red decaiga más rápidamente (Memmott et al., 2004; Mello et al., 2011; Bascompte & Olesen, 2015). Lo anterior se ve reflejado en la red del presente estudio, donde la comunidad de plantas con un índice de robustez de 0.53 mostró más fragilidad de lo esperado por azar (Figura. 4E), pero más robustez que la comunidad de murciélagos (0.22), la cual decayó rápidamente en el modelo (Figura 4F), probablemente debido a que es la comunidad con menor número de especies.
De los distintos fragmentos de BsT visitados, los PNR Mategudua y El Vínculo presentaron la mayor cantidad de interacciones, debido probablemente a la influencia de varios factores actuando simultaneamente, entre ellos, una mayor cantidad de morfoespecies de plantas observadas en los individuos polinizadores, especies de murciélagos capturados previamentereportados como generalistas/facultativos (Sánchez-Casas & Alvarez, 2000; Calonge, 2009; Teixeira, 2010; Lumbreras- Ramos, 2012; González-Gutiérrez et al., 2022), y tambien que estas dos áreas protegidas presentan gran tamaño, siendo reconocidas como remanentes importantes de Bs-T del Valle del Cauca (https://runap.parquesnacionales.gov.co). En este caso particular, los esfuerzos de conservación a nivel regional pueden estar juando un papel clave, ya que estos bosques están categorizados como Reservas Naturales Regionales lo cual puede estar influyendo en la diversidad que albergan y el espacio para las interacciones entre las distintas especies.
En contraste, la Hacienda El Medio presentó la menor cantidad de interacciones y enlaces, lo cual puede estar relacionado con la poca cantidad de morfoespecies vegetales encontradas en los murciélagos y el aislamiento del bosque, inmerso en grandes matrices de monocultivo y ganaderia. Adicionalmente, en este fragmento la toma de datos se vió impactada por la lluvia, lo que pudo influir en la colecta de muestra polínica, esto debido a la disminución en la efectividad del medio utilizado para la captura de los granos de polen y/o la cantidad de carga polínica depositada en el pelaje de los murciélagos que no fue lavada por la lluvia. Aunque el bosque de la Hacienda Verdún se encuentra también inmerso en una matriz ganadera, se registró la mayor riqueza de quirópteros nectarívoros/polinívoros (cuatro especies), probablemente por la influencia de un conjunto de caracteristicas de conectividad y fuentes de agua al interior del bosque. Aunque el remanente se encuentra rodeado por una matriz ganadera, se encuentran árboles dispersos al rededor del bosque, en los pastizales, que pueden funcionar como pasaderas (stepping stones), creando conectividad con bosques aledaños como aquellos de la cordillera central (Saura et al., 2013; Frey-Ehrenbold et al., 2013). Los resultados aquí obtenidos son un gran avance al conocimiento del Bs-T colombiano, sin embargo, son necesarios más estudios en este ecosistema tan amenazado para seguir guiando y priorizando las acciones de conservación.
Conclusiones
Las comunidades de plantas y murciélagos del BsT del Valle del Cauca demostraron baja robustez frente a la pérdida de especies generalistas, dónde debido a extinciones secundarias, los quirópteros resultan siendo la comunidad más afectada frente a la pérdida de especies vegetales, y por ende, de coberturas boscosas. De esta manera, la conservación de especies de plantas con vínculos generalistas podría ofrecer estabilidad en las interacciones de polinización por murciélagos en el BsT del norte y centro del Valle. Por otro lado, la poca cantidad de plantas que abarcan la mayoria de interacciones evidencia la susceptibilidad de esta red murciélago-planta, donde el peso de la polinización recae en las pocas especies vegetales hipervinculadas, por lo cual, bajo un escenario en el que estas desaparezcan, la integridad de la red de polinización podria verse amenazada. Es así como se torna escencial el desarrollo de más estudios que permitan ampliar el conocimiento de las dinámicas que ocurren en el ecosistema de Bs-T, así como el fortalecimiento de las áreas protegidas y conectividad entre los fragmentos de bosque, para garantizar las interacciones planta- animal que ocurren en los ambientes naturales y el mantenimiento de los servicios ecosistémicos.
















