Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Universidad y Salud
versão impressa ISSN 0124-7107versão On-line ISSN 2389-7066
Univ. Salud vol.12 no.1 Pasto jan./dez. 2010
CARACTERIZACIÓN MORFOMÉTRICA Y MICROBIOLÓGICA DE ABSCESOS HEPÁTICOS DE VACAS PROVENIENTES DEL FRIGORÍFICO DE SAN JUAN DE PASTO, NARIÑO
MORPHOMETRIC AND MICROBIOLOGICAL CHARACTERIZATION OF LIVER ABSCESSES IN FRIDGE COWS FROM PASTO CITY, NARINO
Dario Cedeño1, María Morales2, Jennifer Quenán3
1 Profesor asociado, Esp. MSc. Profesor Facultad de Ciencias Pecuarias, Universidad de Nariño. Colombia. e-mail: dcedeno@udenar.edu.co
2 Médico Veterinario. Universidad de Nariño, Colombia. e-mail: victoria8587@hotmail.com
3 Médico Veterinario. Universidad de Nariño, Colombia. e-mail: jenniferquenan@yahoo.com
Fecha recepción: Marzo 05 - 2010 / Fecha de aceptación: Agosto 06 - 2010
RESUMEN
El objetivo del trabajo fue identificar las características de los abscesos hepáticos de vacas procedentes del frigorífico de San Juan de Pasto. Se realizó el aislamiento del agente etiológico bacteriano, medición y determinación de la localización de los abscesos, así como la asociación entre las variables (tamaño, localización, microorganismo) a partir de un total de 65 hígados decomisados en el mes de abril de 2010. Los datos se analizaron con la ayuda del paquete estadístico Stat graphics plus 5.0. La estadística descriptiva indicó que el microorganismo de mayor presentación fue el Staphylococcus no aureus con un 36.92% del total de las muestras, seguido de E.coli con un 32.31% y siendo el de porcentaje mínimo Klebsiella sp con un 1.54%. Con respecto a la localización, se determinó que los abscesos hepáticos se localizaron a nivel de la cara parietal de los hígados con un 74%, mientras que en la posición visceral un 26%. Mediante medidas de tendencia central, dispersión y estableciendo intervalos de confianza del 95%, se caracterizó el tamaño de los abscesos donde se estableció que el más pequeño presentó un tamaño de 1 cm, el de mayor tamaño de 20 cm, y la media fue equivalente a 6.01 cm. Para determinar la relación entre las variables, se realizó el análisis de varianza que reveló que es el microorganismo, el factor que tiene un valor estadísticamente significativo sobre tamaño. Aplicando el método de contrastes múltiples rangos para tamaño según microorganismo, se realizó la clasificación de los tamaños donde encontramos un tamaño pequeño (2.53 – 3.46 cm) correspondiente a los microorganismos Klebsiella sp, y E. coli, los de tamaño mediano (6 – 6.61 cm) para Proteus sp. y Staphylococcus no aureus, y los de tamaño grande (8.62 – 9.73 cm) correspondiente a los microorganismos Actinomyces sp y no crecimiento.
Palabras clave: Absceso hepático, salud pública.
ABSTRACT
The purpose of the study was to identify the characteristics of liver abscesses of cattle from the refrigerator of San Juan de Pasto by isolating from bacterial agent, measuring and determining the location of the abscesses, as well as the association among variables (size, localization, and microorganism) from a total of 65 livers seized in April de 2010. The data was analyzed with the help of the statistical software Stat graphics Plus 5.0. The descriptive statistics indicated that the microorganism with higher presentation was Staphylococcus non aureus with a 36.92% of total samples, followed by E.coli with a 32.31% of total samples, and Klebsiella sp with a 1.54%, being the lowest percentage. Regarding the location, it was determined that liver abscesses were located predominantly at the level of the parietal side of the livers in a 74% of total samples, while there was a 26% in the visceral anatomical position. The size of the abscesses was characterized by measures of central tendency, dispersion and by establishing confidence intervals of a 95%. It was also established their size and it was found that the smallest one was 1 cm, the largest one was 20 cm, and the average was equivalent to 6.01 cm. An analysis of variance was performed to determine the relationship between variables. It revealed that the microorganism is the factor that has a statistically significant value on size. The classification of sizes was made by applying the method of contrasts multiple ranges for size according to microorganism where the small-sized (2.53 - 3.46 cm) for microorganisms Klebsiella sp, and E. coli, the medium-sized (6 - 6.61 cm) for Proteus sp. Staphylococcus non aureus, and the large-sized (8.62 - 9.73 cm) for microorganisms Actinomyces sp and not growth were found.
Key words: Hepatic abscess, public health.
INTRODUCCIÓN
Los abscesos son una causa importante de decomiso a nivel hepático y representan un gran problema de salud pública, ya que muchos de los agentes causales son de carácter zoonótico, poniendo en riesgo la salud del consumidor. Según la FAO,1 la higiene de los alimentos se define como todas las condiciones y medidas necesarias para asegurar la inocuidad e idoneidad de los alimentos en todos los pasos de la cadena productiva del alimento. La higiene de la carne es una ciencia demandante y tiene que tratar con diferentes clases de riesgos. Por muchos años, la inspección de la carne se enfocó hacia formas de contaminación microbiológica causantes de lesiones macroscópicas. Anteriormente tenían especial atención la tuberculosis, ántrax, salmonelosis en cerdos yásitos como Cysticercos. Ahora que estas formas de contaminación están bajo control en la mayoría de los países, mejores monitoreos y vigilancia hacen posible enfrentar otros patógenos microbiológicos cuya importancia radica en que pueden ser detectados sólo con técnicas de laboratorio. La FAO, tén menciona que estudios recientes sobre el riesgo zoonótico de estos patógenos, revelan que la dosis infecciosa media para los diferentes patógenos de origen cárnico puede variar desde algunélulas, por ejemplo, E. coli O157:H7, hasta muchos millones de células, como en el caso de la Salmonella spp. El tipo y prevalencia de estos patógenos cambia radicalmente con el control de las prácticas de producción, procesamiento y manejo de los alimentos en los diferentes países.
Para Nagaraja y Lechtenberg2 los microorganismos determinados como causantes de abscesos hepáticosán Fusobacterium Necrophorum, Actinomyces pyogenes, E.coli, estreptococos betahemolíticos, estafilococos, Bacteroides spp, enterobacterias y otras.
Bacha3 considera que el absceso hepático es un trastorno de importancia en el ganado de engorde en el que ocurre en forma secundaria a ruminitis. En estos animales se registrérdidas considerables, en virtud de que en los mataderos se decomisan los hígados. Se ha observado una incidencia del 22% en bovinos alimentados con cebada en el Reino Unido, y alrededor de 5% de los bovinos que viven en Estados Unidos son rechazados por padecer abscesos hepáticos. Los microbios causales de abscesos pueden llegar al hígado por vía traumática,ática énica según Dirksen.4 Pueden pasar de un foco peritonítico superficial a la profundidad del hígado, o penetran en el mismo con un cuerpo extraño perforante desde la redecilla. Con mucha mayor frecuencia llegan a través de la vena umbilical (onfaloflebitis), pero especialmente a és de la vena porta. En este ultimo caso la patología suele iniciarse en una retículo ruminitis (complejo ruminitis – hígado – abscedación).
Los casos de absceso hepático en el ganado de engorde no presentan signos clínicos según estudios realizados por Radostits,5 a menos que el absceso sea muy voluminoso y pueda causar una enfermedad aguda o crónica. En los casos agudos se produce fiebre, anorexia, depresión, descenso de la producción de leche y debilidad. El dolor abdominal se pone de manifiesto a la percusión en las costillas posteriores sobre el flanco derecho, los animales enfermos muestran arqueo de los lomos y resistencia a desplazarse o a echarse. El volumen del hígado puede estar tan aumentado que fácilmente se palpa este órgano por detrás del arco costal. El dolor abdominal puede ser lo suficientemente intenso para provocar un gruñido con cada respiración.
Los abscesos macroscópicos son los fagocitos predominantes en lesiones de 8 horas o menos y los macrófagos en las lesiones de 12 horas o más. Se postula que la leucotoxina es la que permite a la bacteria soportar la respuesta celular fagocitaria permitiendo así que la infección persista. Si la invasión hepática es masiva se produce toxemia a partir de la infección bacteriana, lo que causa enfermedad aguda o crónica. Se ha aislado un lipopolisacárido endotóxico de F. necrophorum, el cual probablemente contribuya a la toxemia. Sin embargo en la mayor parte de los casos las lesiones son demasiado pequeñas para producir signos clínicos. La diseminación hematógena a partir de lesiones hepáticas incluye rotura en la vena cava caudal que puede provocar lesiones múltiples en muchos órganos y un desenlace mortal.6
Las lesiones necróticas iníciales, si el animal sobrevive, evolucionan a abscesos en semanas, por licuefacción y encapsulamiento. Los abscesos son lesiones delimitadas residuales, de naturaleza crónica. Normalmente, el número de abscesos presentes en un hígado es elevado, pero en algunos casos, puede darse en un número reducido. En estos casos, al tratarse de lesiones focales, delimitadas, producidas por agentes no considerados zoonóticos, el expurgo de la lesión puede ser aceptable, siempre y cuando se realice sin contaminar el resto del órgano.7
Los abscesos maduros varían entre el tamaño de una arveja y la cabeza de un niño, pueden ser solitarios o múltiples (hasta cientos); en este último caso su tamaño suele ser uniforme, lo que habla a favor de una génesis hematógena. Los abscesos solitarios suelen encontrarse en la profundidad del órgano cuya superficie diafragmática y/o visceral se encuentra hundida en el sitio. Todo absceso tiene uápsula blanquecina, mas o menos gruesa de tejido conectivo firme anclado fuertemente enénquima hepático, cuya superficie interior es irregular y mate (membrana piógena). El contenido es pus gris pardo o gris amarillento, denso y generalmente inodoro.8
Según el estudio realizado por Martínez y Cilima,9 en el 2009, se encontró que durante el periodo de estudio realizado en el municipio de San Juan de Pasto en el matadero FRIGOVITO se decomisaron un total de 7.795 órganos de los cuales 5.424 fueron hígados, 2.241 pulmones y 130 corazones. La causa de decomiso mas importante en hígado fue la Distomatosis hepática con un 31.09% seguido de abscesos áticos con un 14.42%, fibrosis y adherencias 3.16% y telangectasia con un 2.11%. El matadero FRIGOVITO, es la entidad encargada de la recepción, sacrificio y distribución de las canales de bovinos y porcinos para su posterior consumo; por lo cual se convierte en la empresa responsable de asegurar la calidad de los productos que emergen de esta. Mediante el presente trabajo se buscó evaluar cuáles son las características morfométricas y microbiológicas de los abscesos hepáticos decomisados en la planta, con el fin de determinar los microorganismos causales y analizar si existe relación de estos con el tamaño y la localización de los abscesos hepáticos. El aislamiento e identificación de los agentes etiológicos servirán para estableceáles son los microorganismos a tener en cuenta al momento del decomiso para establecer medidas de control por ser patógenos para el humano.
El hígado con abscesos es una fuente de contaminación microbiológica al igual que la carne siendo un riesgo zoonótico. La dosis infecciosa media para los diferentes patógenos de origen cárnico puede variar desde algunaélulas, por ejemplo, E. coli O157:H7, hasta muchos milloélulas, como en el caso de la Salmonella spp, Según Dirksen: La musculatura de bovinos de faena que tienen focos necróticos o abscesos en el hígado no rara vez presentan gérmenes, por lo que ante la presencia de estas lesiones siempre debe hacerse un análisis bacteriológico de la carne.10 Por ello el INVIMA en su ARTICULO 285 (decreto 2278)11 regula el decomisa de vísceras rojas. En caso de abscesos hepáticos la planta de sacrificio decomisa:
• Abscesos embólicos asociados con infecciones umbilicales recientes y con abscesos traumáticos del bazo, seá el decomiso total de la canal y las vísceras.
• Abscesos encapsulados; se permite la aprobación de la canal y las vísceras y se hará el decomiso parcial de los órganos afectados.
MATERIALES Y MÉTODOS
El estudio se llevó a cabo en el frigorífico Jongovito S.A del municipio de Pasto, Nariño, ubicado en la vereda Jongovito km 5 vía Niza. Para el presente estudio se tuvo en cuenta el total de decomisos por absceso hepático en el mes de abril de 2010 el cual fue de 65.
Se utilizó la siguiente fórmula para establecer la confiabilidad y margen de error del estudio:
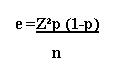
Z = 1.64 (con una seguridad del 90%)
p = proporción esperada (en este caso 5% = 0.05)
e = error esperado (9%)
n = número de abscesos muestreados
e = 1.642 (0.369)(0.63)/65
e = 0.009
La inspección de los hígados con absceso se realizó inmediatamente después de extraído el órgano del bovino. La muestra se obtuvo del absceso que después de la medición presentó mayor tamaño en cada hígado y después se determinó la localización visceral o parietal del absceso. Se tomaron las muestras realizando limpieza y desinfección del área a incidir, posteriormente mediante hoja de bisturí estéril se realizó incisión en el absceso para obtener el contenido a través de escobillonesériles. Una vez obtenida la muestra se almacenó en medio de transporte (Oxoid transport system) debidamente rotulados, que fueron llevados hasta el laboratorio de la Universidad de Nariño, para posteriormente procesarlos. Todos estos procedimientos se realizaron teniendo en cuenta las normas de bioseguridad.
Cada muestra fue sembrada en el medio de cultivo agar sangre, esperando su crecimiento 24 a 48 horas en aerobiosis a una incubación de 37°C. Al finalizar este periodo de tiempo se observó si hubo crecimiento bacteriano, y en caso de no lograr desarrollo del microorganismo se sembró nuevamente en anaerobiosis (mediante BBL CampyPak – Microaerophilic System Envelopes) y aerobiosis. Al no obtener colonias por ninguno de estos dos métodos se reportó como no crecimiento. A las bacterias que crecieron, se les realizó tinción de gram con el fin de clasificarlas como gram negativas o gram positivas y se observó el tipo de morfología que presentan, para elegir el protocolo adecuado según sean bacilos o cocos. A todas las bacterias se les hizo la prueba de catalasa, la cual fue positiva o negativa según el microorganismo.
Según el manual de procedimientos de microbiología del laboratorio médico veterinario de la Universidad de Nariño se manejaron los siguientes protocolos:
• Cocos Gram positivos – catalasa (+): Fueron sembradas en el medio de cultivo sal manitol.
• Bacilos Gram positivos- catalasa (-): Estos microorganismos se clasificaron por análisis de su morfología.
• Bacilos Gram negativos - catalasa (+): Fueron sembrados en medio de cultivos EMB, y MacConkey. A los patógenos que se identificaron como MacConkey positivos y EMB negativos, se les realizaron baterías bioquímicas (Citrato Simmons, LIA, SIM, TSI, urea, caldo MRVP).
RESULTADOS Y DISCUSIÓN
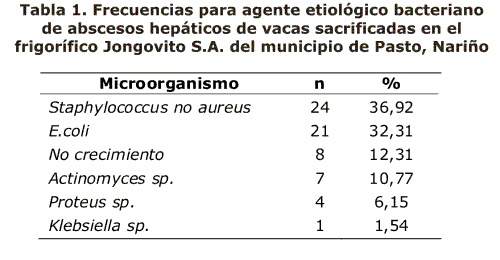
En la Tabla 1 se relacionan los microorganismos aislados a partir de las 65 muestras recogidas de los abscesos hepáticos encontrando que el microorganismo de mayor presentación fue el Staphylococcus no aureus con un 36.92% del total de las muestras seguido de E.coli con un 32.31% y siendo el de porcentaje mínimo Klebsiella sp con un 1.54%.
Esto se puede relacionar con lo descrito por Dirksen12 afirma que con mayor frecuencia esta patologia se asocia a microorganismos que llegan al hígado a partir de una onfaloflebitis, en donde se encuentran como agentes causales a E. coli, especies de Proteus, especies de Staphylococcus y Actinomyces pyogenes, que pueden provocar grandes abscesos en el trayecto de la vena umbilical, que pueden llegar a alcanzar el hígado produciendo un gran absceso hepático.
En un estudio bacteriológico realizado por Kanoe,13 se determinó a Staphylococcus como especies causantes de absceso hepático. Encontró que en nueve de los cultivos se aislaron especies de Staphylococcus y 3 especies de enterobacterias de un total de 66 cultivos.
Adicionalmente Doré et al,14 en su investigacion también encontró a Staphylococcus, Actinomyces spp., y E.coli como agentes etiológicos de absceso hepático en bovinos.
En contraste con estos resultados, Nagaraja y Lechtenberg15 afirman que es el Fusobacterium Necrophorum el primer agente causal y Actinomyes pyogenes es el segundo patógeno más frecuentemente aislado de abscesosáticos.
Según Dirksen,16 los abscesos hepáticos causados por Fusobacterium necrophorum pueden iniciarse a partir de una reticulo rumintis con lactoacidosis asociada. El áciáctico es el suás importante para Fusobacterium necrophorum, y encuentra en las mucosas dañadas la capacidad de fijarse y diseminarse por via hemática.
Respecto al grupo de no crecimiento, se puede relacionar a lo descrito por Lotfollazadeh17 en su estudio bacteriológico de abscesos hepáticos donde a partir de 33 muestras, se determinó que el 9% se clasificó como no crecimiento. Adicionalmente Doré et al,18 reportan un caso de no crecimiento en su investigación.
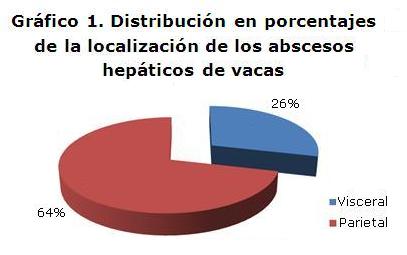
En el Gráfico 1 se puede apreciar que del total de las muestras recolectadas (65) los abscesos áticos se localizaron predominantemente a nivel de la cara parietal de los hígados con un 74% mientras que en la posición anatómica visceral con un 26%.
Para Dirksen,19 el cuadro clínico y curso de los abcesos hepáticos es muy variable dependiendo entre otras cosas de la localización que en concecuencia, puede llegar a causar complicaciones. Un absceso ubicado cercano al diafragma (cara parietal), irrumpe en el parenquima pulmonar; con ello puede desarrollarse una fístula biliobronquial. Abscesos hepáticos voluminosos frecuentemente causan adherencias con los preeestómagos y trastornos del pasaje de la ingesta (cara visceral).
En cuanto al tamaño de los abscesos descritos en centímetros el mas pequeño presenta un tamaño de 1 cm, el de mayor tamaño es de 20 cm, y la media equivale a 6.01 cm. Esto coincide con lo descrito por Nagaraja y Chengappa,20 que afirman que el tamaño de los abscesos puede variar de 1 centímetro hasta más de 15 cm deámetro. Langwoth,21 coincide en que se pueden encontrar múltiples abscesos de tamaño diverso que incluso pueden llegar a medir hasta 20 cm de diámetro.
La Tabla 2 describe la clasificación de los tamaños en pequeño, mediano y grande. Los de tamaño pequeño (2.53 – 3.46 cm) corresponde a los microorganismos Klebsiella sp, y E. coli, los de tamaño mediano (6 – 6.61 cm) para Proteus sp. y Staphylococcus no aureus, y los de tamaño grande (8.62 – 9.73 cm) correspondiente a los microorganismos Actinomyces sp. y No crecimiento.
Correlacionando con lo descrito por Itabisashi,22 en su estudio realizado mediante ultrasonografía identificó como abscesos hepáticos de tamaño pequeño a aquellos que midieron de 1-2 cm de diámetro, tamaño mediano a los de 5 cm y un tamaño grande de 13 cm. En contraste Brink,23 clasifica los tamaños de los abscesos con respecto al número en que se presentan en el hígado. Así calificó como 0 a hígados sin absceso, A (-) de uno a dos abscesos pequeños (menos de 2.5 cm), A= de dos a cuatro abscesos pequeños (menos de 2.5 cm), A (+)= uno o más abscesos grandes (mas de 2.5). A pesar de los estudios citados anteriormente no se encontró estudios que determinen clasificación de los tamaños en base a existencia de relación entre agente etiológico y diámetro de los abscesos hepáticos.
En el análisis de varianza para tamaño vs. microorganismo y localización de abscesos hepáticos de vacas sacrificadas en el frigorífico Jongovito S.A del municipio de Pasto, se encontró que el microorganismo es el factor que tiene un valor estadísticamente significativo sobre tamaño. La localización no es un factor que determina el tamaño de los abscesos hepáticos.
CONCLUSIONES
De los aislamientos realizados el microorganismo de mayor presentación fue el Staphylococcus no aureus con un 36.92% del total de las muestras seguido de E.coli con un 32.31% y siendo el de porcentaje mínimo Klebsiella sp. con un 1.54%.
Los abscesos hepáticos se localizaron predominantemente a nivel de la cara parietal de los hígados con un 74% mientras que en la posición anatómica visceral se presentó un 26%.
Con respecto al tamaño de los abscesos se encontró que el más pequeño presenta un tamaño de 1 cm, el de mayor tamaño es de 20 cm, y la media equivale a 6.01 cm. Al relacionar las variables se determinó que el microorganismo es un factor que influye sobre el tamaño de los abscesos. La localización no es un factor que incide sobre el tamaño de los abscesos hepáticos para el presente estudio.
El microorganismo que presentó menor tamaño fue E. coli con 2.53 cm, y los de mayor tamaño fueron Actinomyces sp. de 8.62 cm, y el grupo identificado como No crecimiento con abscesos de 9.73 cm de diámetro. Los abscesos se clasificaron en pequeño (2.53 – 3.46 cm) correspondiente a los microorganismos Klebsiella sp., y E. coli, los de tamaño mediano (6 – 6.61 cm) para Proteus sp. y Staphylococcus no aureus, y los de tamaño grande (8.62 – 9.73 cm) correspondiente a los microorganismos Actinomyces sp. y No crecimiento.
REFERENCIAS
1. FAO. Buenas Prácticas para la industria de la Carne. Manual FAO Salud y producción animal. Roma 2007. [ Links ]
2. Nagaraja TG, Lechtenberg KF. Liver Abscesses in feedlot cattle. Vet Clin North Am Food Anim Pract. 2007; 23(2): 351– 369. [ Links ]
3. Bacha F. Nutrición, patología digestiva y salud intestinal rumiantes en cebo. aspectos prácticos. XVIII Curso de Especialización FEDNA, Barcelona Coopiensos – NACOOP S.A. 2002;143-159. [ Links ]
4. Dirksen G, Dieter H, Stober M. Medicina interna y cirugía del bovino. Volumen 1. 4ª ed Bogotá: Intermedica Editorial. 2003; 574. [ Links ]
5. Radostits O, Blood D. Medicina veterinaria. Volumen 1. 7°ed. Bogotá: Mc Graw Hill. 1992; 799-800. [ Links ]
6. Checkley SL, Janzen ED, Campbell JR, McKinnon JJ. Efficacy of vaccination against fusobacterium necrophorum infection for control of liver abscesses and footrot in feedlot cattle in western Canada. Can Vet J. 2005; 46(11):1002-1007. [ Links ]
7. Nagaraja TG, Narayanan SK, Stewart GC, Chengappa MM. Fusobacterium necrophorum infections in animals: Pathogenesis and pathogenic mechanisms. Anaerobe. 2005; 11(4): 239–246. [ Links ]
8. Tadepalli S, Narayanan SK, Stewart GC, Chengappa MM, Nagaraja TG. Fusobacterium necrophorum: A ruminal bacterium that invades liver to cause abscesses in cattle. Anaerobe 2009; 15: 36–43. [ Links ]
9. Martínez G, Cilima R. Principales causas de decomiso de vísceras rojas en el frigorífico del municipio de Pasto. en el año 2008 (Tesis Pregrado) Pasto: Universidad de Nariño. Facultad de ciencias pecuarias; 2009. [ Links ]
10. Dirksen G, Dieter H, Stober M. Medicina interna y cirugía del bovino. Volumen 1. 4ª ed Bogotá: Intermedica Editorial. 2003; 574. [ Links ]
11. República de Colombia. Invima. Decreto 2278 de 1982, artículo 285. [ Links ]
12. Dirksen G, Dieter H, Stober M. . Medicina interna y cirugía del bovino. Volumen 1. 4ª ed Bogotá: Intermedica Editorial. 2003; 574. [ Links ]
13. Kanoe M, Imagawa H, Toda M, Sato A, Inoue M. Bacteriology of bovine hepatic abscesses. Nihon Juigaku Zasshi. 1976; 38(3):263-268. [ Links ]
14. Dore E, Fecteau G, Hélie P, Francoz D. Liver Abscess in Holstein dairy cattle: 18 (1992-2003) cases. J Vet Intern Med. 2007; 21(4):853-856. [ Links ]
15. Nagaraja TG, Lechtenberg KF. Liver abscesses in feedlot cattle. Vet Clin Food Anim 2007; 23(2): 351–369. [ Links ]
16. Dirksen G, Dieter H, Stober M. Medicina interna y cirugia del bovino. Volumen 1. 4ª ed Bogotá: Intermedica Editorial. 2003; 574. [ Links ]
17. Lotfollazadeh S, Aadboli A, et al. The Bacteriologic study of hepatic abscess in slaughtered cattle in shahrekord abattoir. Faculty of veterinary medicine, Azad university of Garmsar. International Society for Animal Hygiene, Saint Malo. 2004. [ Links ]
18. Dore E, Fecteau G, Hélie P, Francoz D. Liver abscess in holstein dairy cattle: 18 (1992-2003) cases. J Vet Intern Med. 2007; 21(4):853-856. [ Links ]
19. Dirksen G, Dieter H, Stober M. Medicina interna y cirugia del bovino. Volumen 1. 4ª ed Bogotá: Intermedica Editorial. 2003; 574. [ Links ]
20. Nagaraja TG, Chengappa MM. Liver abscess in feedlot cattle: a review. J Anim Sci. 1998; 76(1):287-298. [ Links ]
21. Langworth B. Fusobacterium necrophorum: Its characteristics and role as an animal pathogen. Bacteriol Rev. 1977; 41(2): 373–390. [ Links ]
22. Itabisashi T, Yamamoto R, Satoh M. Ultrasonogram of hepatic abscess in cattle inoculated with fusobacterium necrophorum. Nihon Juigaku Zasshi. 1987; 49(4):585-92. [ Links ]
23. Brink D, Lowry S, Stock R, Parrott J. Severity of liver abscess and efficiency of feed utilization of feedlot cattle. J Anim Sci. 1990; 68(5):1201-1207. [ Links ]