Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Universidad y Salud
Print version ISSN 0124-7107On-line version ISSN 2389-7066
Univ. Salud vol.14 no.1 Pasto Jan./June 2012
CARACTERIZACIÓN DE LA MICROBIOTA LÁCTICA GÁSTRICA ASOCIADA A GASTRITIS CRÓNICA
CHARACTERIZATION OF THE GASTRIC MICROBIOTA LACTIC ASSOCIATED WITH CHRONIC GASTRITIS
Alvaro J. Pazos1, Luis Eduardo Bravo2, Andrés M. Betancourt3, Myriam Astudillo4
1 Ph.D Ciencias Biomédicas. Profesor Asistente, Departamento de Biología, Universidad de Nariño, Pasto, Colombia. e-mail: alpazmo@yahoo.com
2 M.Sc. Epidemiología. Profesor Titular, Departamento de Patología, Universidad del Valle, Cali, Colombia. e-mail: bravo.luiseduardo@gmail.com
3 B.Sc. Ingeniero Agroindustrial, Asistente de Investigación, Laboratorio de Microbiología, Universidad de Nariño, Pasto, Colombia. e-mail: andres.mbj@udenar.edu.co
4 M.Sc. Microbiología. Profesora Titular, Departamento de Microbiología, Universidad del Valle, Cali, Colombia. e-mail: myrastud@yahoo.com
Fecha de recepción: Febrero 21 - 2012 / Fecha de aceptación: Junio 29 - 2012
RESUMEN
Introducción: El papel de las bacterias ácido lácticas (BAL) en el ambiente gástrico humano es importante, así como la interacción con Helicobacter pylori, microorganismo asociado con gastritis y cáncer gástrico, influye en la colonización y en el tipo de respuesta inflamatoria del hospedero. Las BAL son microbiota del estómago humano y como probiótico podrían modular la infección por H. pylori. Objetivo: Determinar la distribución de BAL según el tipo de gastritis en sujetos procedentes de regiones con contraste de riesgo de cáncer gástrico: La Florida-Nariño (alto riesgo) y Tumaco-Nariño (bajo riesgo). Metodología: Se incluyeron 113 pacientes adultos con diagnóstico de gastritis, 65 de La Florida y 48 de Tumaco. Se obtuvieron biopsias de mucosa gástrica por endoscopia, para análisis histológicos y aislamiento de H. pylori y BAL. Resultados: La prevalencia de la colonización por bacterias lácticas gástricas fue mayor en los pacientes de La Florida (35%) que en los de Tumaco (25%). El 68% de las BAL se encontraron en individuos con gastritis no atrófica. Conclusiones: La distribución de la microbiota láctica gástrica varió según la procedencia y el tipo de gastritis. La especie más frecuente aislada de pacientes de ambas regiones fue L. paracasei ssp paracasei 1. La prevalencia de H. pylori fue similar en los pacientes de La Florida (88%) y Tumaco (85%). Sin embargo, la proporción de pacientes con gastritis atrófica fue significativamente mucho mayor en la Florida (43%). Sin embargo, la proporción de pacientes con gastritis atrófica fue significativamente mucho más alta en La Florida (43%) que en Tumaco (25%), p< 0,05. Probablemente, otros factores como la variabilidad genética de H. pylori la dieta, y los polimorfismos humanos de acogida podrían explicar estas diferencias geográficas.
Palabras clave: Gastritis crónica; microbiota láctica; cáncer gástrico; Helicobacter pylori.
ABSTRACT
Introduction: The role of lactic acid bacteria (LAB) in the human gastric environment is important, as well as the interaction with Helicobacter pylori, a microorganism associated with gastritis and gastric cancer, influences the colonization and the type of host inflammatory response. The LAB are part of the microbiota of human stomach, and used as probiotic, it could modulate H. pylori infection. Objetive: To determine the distribution of LAB according to the type of gastritis in patients from two regions with contrasting risk for gastric cancer: La Florida-Nariño (high risk) and Tumaco-Nariño (low risk). Methods: 113 adult patients diagnosed for gastritis were enrolled: 65 from La Florida and 48 from Tumaco. Mucous biopsies and gastric juices were obtained by endoscopies and were used for histology, isolation of H. pylory and LAB. Results: The prevalence of LAB colonization was higher in patients from La Florida (35%) than in those from Tumaco (25%). 68% of the LAB were found in patients with non-atrophic gastritis. Conclusions: Lactic gastric microbiota varied with the region of origin and the type of gastritis. Lactobacillus paracasei ssp paracasei 1 was the most frequently isolated species in both regions. The prevalence of H. pylori infection was similar both in the patients from La Florida (88%) as in those from Tumaco (85%). However, the proportion of patients with atrophic gastritis was significatively much higher in La Florida (43%) than in Tumaco (25%), p< 0.05. Probably, other factors such as H. pylori genetic variability, diet and human host polymorphisms could explain these geographical differences.
Key words: Chronic gastritis; lactic microbiota; gastric cancer; Helicobacter pylori.
INTRODUCCIÓN
Helicobacter pylori es un patógeno gástrico que infecta crónicamente a más de la mitad de la población mundial, con una prevalencia del 30% en países desarrollados y cerca del 90% en países en desarrollo. La infección por H. pylori se asocia con la patogénesis de la gastritis, la úlcera péptica y el cáncer gástrico.1
En la zona andina de Nariño, donde la tasa de incidencia de gastritis crónica es una de las más altas del mundo: 150/100000 habitantes,2 también la infección por H. pylori tiene las características de una hiperendemia.
La prevalencia en niños de dos años de edad es de 52%; 80% a los nueve años de edad y 93% en adultos.3,4 Aunque existen múltiples terapias de erradicación, el tratamiento es polimicrobiano con altas tasas de fracaso terapéutico, que oscilan entre el 20% para la triple terapia con antibióticos e inhibidores de la bomba de protones,5 a 90% en la terapia con bismuto y metronidazol.6,7 Ante estas dificultades es importante explorar otras alternativas que puedan complementar el manejo terapéutico.8
Son alentadores los estudios que exploran el posible uso de los probióticos en la patología gastroduodenal,9-11 pues tanto en adultos como en niños describen los efectos benéficos de las BAL como complemento de las terapias convencionales de erradicación anti-H. pylori.12,16 El término probiótico se refiere a suplementos alimenticios con microorganismos vivos los cuales inducen en el hospedero beneficios en su salud.17-22 Las BAL, junto con otras bacterias, son integrantes de la microbiota propia del estómago humano,23 colonizan los sitios donde generalmente realizan una acción positiva, sobreviven a la acción de enzimas líticas presentes en la boca, a las condiciones de pH bajo en el estómago, a las sales biliares intestinales y modulan la infección por H. pylori.24-26 Algunos autores consideran que se necesitan BAL viables para lograr el efecto inhibitorio sobre H. pylori, sugiriendo que el mecanismo de acción es mediado por metabolitos parcialmente identificados y no por aumento en las concentraciones de ácido láctico.27-29 Entre los mecanismos de acción propuestos, está la inhibición de los receptores glucoproteicos que sirven de unión entre el H. pylori y el hospedero.30 Es prometedor que las investigaciones del uso de BAL se orientan a la población humana,31-35 algunos estudios en niños36,37 y adultos describen el efecto benéfico de BAL como complemento de las terapias de erradicación convencionales.38-44 El efecto probiótico directo es evaluado en estudios recientes45-48 y la eficacia del L. gasseri y L. acidophilus como complemento de la terapia de erradicación fue documentada en sujetos infectados con H. pylori.49-53
El propósito de este trabajo fue caracterizar la microbiota láctica gástrica y estudiar las posibles asociaciones con la presencia de H. pylori y el tipo de lesiones presentes en mucosa gástrica en pacientes provenientes de dos regiones con contraste de riesgo de cáncer gástrico: La Florida-Nariño (alto riesgo) y Tumaco-Nariño (bajo riesgo).
MATERIALES Y MÉTODOS
Estudio descriptivo que incluyó 113 pacientes adultos mayores de 17 años con síntomas de dispepsia remitidos de consulta externa por sus médicos tratantes al servicio de gastroenterología de los hospitales San Andrés de Tumaco y La Florida del departamento de Nariño, para la realización de una endoscopia digestiva. Se caracterizó la microbiota láctica gástrica en 65 personas procedentes de La Florida y 48 de Tumaco.
No fueron elegibles los pacientes que estaban recibiendo terapia específica contra H. pylori o medicamentos inhibidores de la bomba de protones y/o bismuto. Tampoco las mujeres embarazadas y quienes rehusaron firmar el consentimiento escrito. El estudio fue aprobado por el Comité de Ética en Investigación de la Universidad de Nariño y por la Junta de Revisión Institucional del Comité de Ética de la Universidad del Valle.
Procedimiento de endoscopia
Al inicio del procedimiento se recolectaron 25ml. de jugo gástrico en una trampa estéril que se acopló al aparato de succión, para determinación de pH y cultivo bacteriano. Se obtuvieron ocho muestras de mucosa gástrica de acuerdo al siguiente protocolo: Dos biopsias de cuerpo y dos de antro, que se incluyeron en parafina para estudios de histología; dos muestras de antro-curvatura menor, cerca de incisura, para cultivo bacteriano y dos biopsias de antro para preservación en nitrógeno líquido.
Procedimientos microbiológicos
Para el aislamiento de BAL y H. pylori se sembraron los 2 fragmentos de mucosa gástrica en agar De Man, Rogosa y Sharpe (MRS) (Oxoid®) y en agar Columbia (Merck®) enriquecido con sangre de cordero al 10% más suplemento Dent (Oxoid®) respectivamente. Las BAL se incubaron en aerobiosis a 37 °C durante 24 a 48 hrs. H. pylori se incubó en una incubadora de CO2 (Shel Lab®) a 37 oC; con atmósfera de CO2 al 10% y 90% de humedad durante 3 a 10 días en ambiente microaerofílico. Se tomaron 2 alícuotas de 10 ml. de jugo gástrico, la primera para determinar el pH y la segunda se centrifugó a 4000 rpm por 10 min. El sedimento se inoculó en los mismos medios de cultivo y bajo iguales condiciones de incubación descritas previamente.54-57 A las colonias compatibles con BAL y H. pylori se les realizó coloración de Gram.58 Se tamizaron los aislados de BAL catalasa negativos para identificarlos mediante pruebas de asimilación de carbohidratos (API CH 50-Biomeurx®) y pruebas de oxidasa, de catalasa y de ureasa (Host Test), para H. pylori. Los aislados de H. pylori se conservaron en caldo tioglicolato (BBL®), al 20% de glicerol (Merck®) y los de BAL en caldo MRS glucosa 5 g/l, al 20% de glicerol59 en nitrógeno líquido.60
Procedimientos de histopatología
Con las cuatro muestras de mucosa gástrica incluidas en parafina se obtuvieron secciones histológicas cortadas a 6µ las cuales se colorearon con hematoxilina y eosina. La evaluación histopatológica fue realizada por un único patólogo experimentado, a ciegas sobre la identidad de los sujetos y todas las otras variables del estudio. Para el diagnóstico histológico de la presencia de H. pylori se usó la tinción de Giemsa modificada y para la clasificación de los diferentes tipos de gastritis crónica se utilizó la escala visual análoga descrita por Dixon.61
Plan de análisis
El manejo de la información se realizó en un sistema de base de datos relacional que contenía tablas con información individualizada para cada conjunto de datos: Información demográfica, siembra, purificación, aislamiento e identificación de bacterias lácticas y diagnóstico histopatológico. A cada paciente se le asignó un código de identificación para el estudio que sirvió como clave para construir las diferentes tablas en la base de datos.
Se realizó la descripción de las variables continuas y categóricas como promedios y proporciones respectivamente. Los contrastes se evaluaron con ANOVA y Mann-Whitney. La significancia se estimó con la prueba de X 2 o t dependiendo del tipo de distribución. Los datos se analizaron con el programa STATA versión 10.0.
RESULTADOS
De los 113 pacientes incluidos en el estudio, 57,5% eran procedentes de la Florida y del total 63,7% fueron mujeres. En la tabla 1 se muestran las características demográficas y microbiológicas de los pacientes según el tipo de gastritis y la relación con la microbiota láctica gástrica. Se observa que la proporción de gastritis crónica atrófica fue más alta en los pacientes procedentes de La Florida (43%) que en los de Tumaco (25%), p< 0.05. El riesgo de gastritis atrófica fue 1,8 veces más alto en pacientes infectados con H. pylori que en los libres de la infección (IC 95%, 0.5-5.9). Se encontró que la proporción de colonización por BAL gástricas fue mayor en pacientes procedentes de La Florida (35%) que en los de Tumaco (25%) p=0,042. Aunque se encontraron varias diferencias en cuanto a la colonización por BAL y el género, la colonización por BAL y el pH del jugo gástrico, presencia de BAL y la edad, la coexistencia de H pylori y BAL, estas diferencias no fueron significativas. Se observó que el tipo de gastritis es independiente del género y la presencia de BAL.
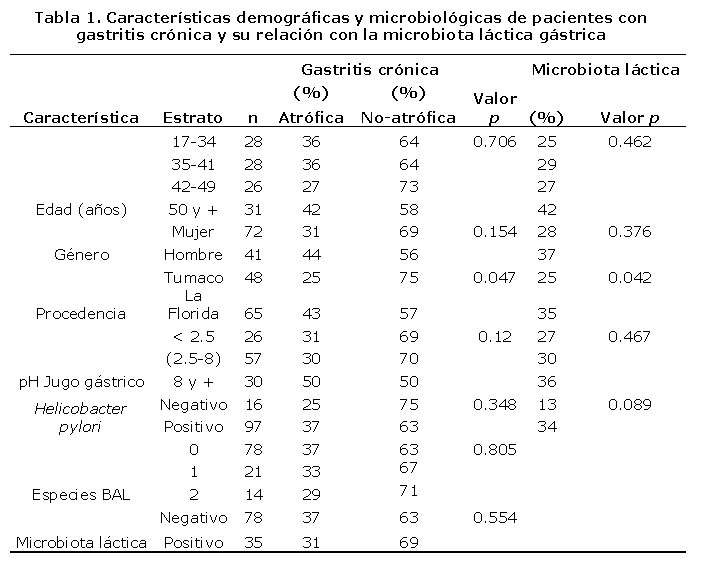
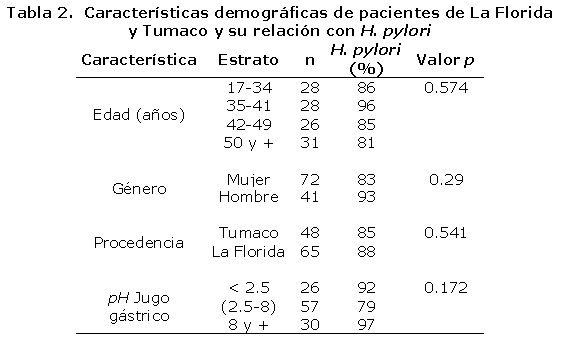
En la tabla 2, se describen las características demográficas de pacientes de La Florida y Tumaco y su relación con la infección por H. pylori. La infección por H. pylori fue más frecuente en hombres (93%) que en mujeres (83%), independientemente de la edad. La prevalencia de la infección por H. pylori fue alta y similar en los pacientes de La Florida (88%) y Tumaco (85%), sin embargo, la proporción de pacientes con gastritis atrófica fue significativamente mas alta en pacientes de La Florida (43%) en comparación con los de Tumaco (25%), p < 0.05, concordante con hallazgos previos.62
Patrón de composición de la microbiota láctica gástrica asociada a gastritis
En la tabla 3 se observa, que el patrón de composición de la microbiota láctica gástrica de pacientes con gastritis de los municipios de Tumaco y La Florida es diferente. Se destaca que las especies que con más frecuencia se aislaron para estas poblaciones fueron: Lactobacillus pentosus, Lactobacillus paracasei ssp paracasei 1 y Lactobacillus acidophilus 1. De las 12 especies encontradas en las dos poblaciones sólo fueron comunes seis, pues las restantes fueron propias para cada región. De estas Lactobacillus paracasei ssp paracasei 1 fue la especie más frecuente en las dos poblaciones. El género Lactobacillus fue el más común de mucosa y jugo gástrico, seguido de los géneros Lactococcus y Streptococcus, hallazgo comparable con lo reportado por Vilaichone y col.63 Cats y col.64 y otros estudios.65-67

Caracterización de la microbiota láctica gástrica según tipo de gastritis
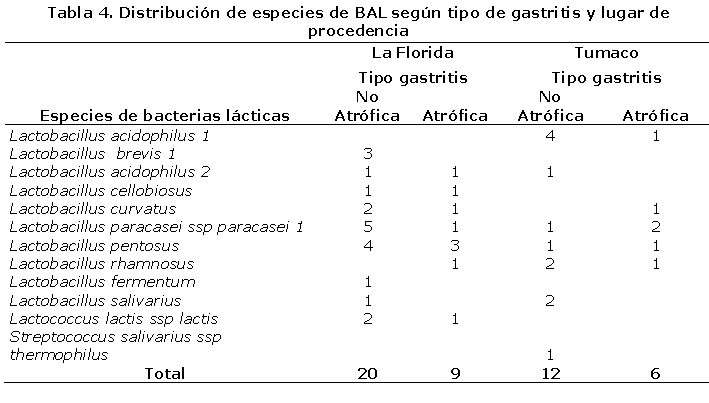
En la tabla 4 se observa que las especies que conforman la microbiota láctica gástrica de pacientes con gastritis del municipio de La Florida es heterogénea, sin embargo pertenecen en su mayoría al género Lactobacillus. De 65 pacientes de La Florida, se obtuvieron 31 aislamientos de BAL, de los cuales, 2 provenían de individuos con mucosa gástrica normal, 20 (68%), fueron obtenidos de pacientes con gastritis no atrófica (gastritis crónica superficial y antral difusa) y 9 pertenecían a pacientes con gastritis atrófica activa con metaplasia. Este hallazgo indica una tendencia a que las bacterias lácticas colonizan preferiblemente el ambiente intragástrico de pacientes con gastritis no atrófica. La especie más frecuente en esta población fue Lactobacillus pentosus, seguido de Lactobacillus paracasei ssp paracasei 1, en su mayoría de pacientes con gastritis no atrófica, sin observarse en los pacientes con mucosa gástrica normal, lo que sugiere que el patrón de composición de la microbiota láctica gástrica es diferente para cada tipo de gastritis y para sujetos normales.
El patrón de composición de la microbiota láctica gástrica de pacientes con gastritis del municipio de Tumaco es heterogéneo, sin embargo las especies encontradas pertenecen en su gran mayoría al género Lactobacillus. La especie de BAL más frecuente para Tumaco fue Lactobacillus acidophilus 1. De 48 pacientes de Tumaco, se obtuvieron 18 aislados de BAL, de los cuales 12 (66,7%) fueron obtenidos de pacientes con gastritis no atrófica (gastritis crónica superficial y antral difusa), en comparación con 6 (33,3%) aislados de pacientes con gastritis atrófica.
DISCUSIÓN
La infección por H. pylori causa una serie de desórdenes en el tracto gastrointestinal superior de humanos. Muchos de los cambios fisiopatológicos pueden ser revertidos al eliminar la bacteria, lo cual se puede lograr con la administración de una combinación de agentes antimicrobiales y antiácidos.68 Desafortunadamente la terapia de erradicación no siempre es exitosa y puede inducir efectos colaterales como la alteración del equilibrio ecológico del microambiente gastrointestinal o la generación de resistencia antibiótica.69-71
La incidencia de resistencia a los antibióticos por H. pylori se ha aumentado en los últimos años.72,73 La combinación de probióticos con L. gasseri OLL2716 y la terapia de erradicación de la convencional, se aplica para el control de las cepas resistentes.74 Los organismos probióticos pueden estabilizar o restaurar la microbiota gastrointestinal endógena, como consecuencia de su acción bactericida y/o bacteriostática, competencia por nutrientes, o inhibición de receptores glucoprotéicos que sirven de unión entre H. pylori y las células epiteliales75-77 o por la secreción de sustancias antibacteriales, como el ácido láctico, bacteriocinas o autolisinas.78-81
Estudios de evaluación de los mecanismos probióticos de Lactobacillus sobre H. pylori demostraron una reducción de la adhesión de H. pylori a líneas celulares epiteliales en la presencia de especies del género Lactobacillus y de la especie Bifidobacterium bifidum en modelo murino.82,83 Otros estudios sugieren que la inhibición puede ser debida a la producción de ácido láctico, o a la consecuente baja del pH.84-87 Las especies de L. salivarius, L. casei subsp. rhamnosus, L. acidophilus y Lactobacillus GG, se utilizan como suplemento en la terapia de erradicación de H. pylori; los resultados son prometedores porque la proporción de erradicación fue significativamente superior en comparación al grupo de pacientes control que no recibieron suplemento de BAL.88,89 El efecto directo ha sido probado con las especies L. acidophilus, L. johnsonii La1 y L. paracasei ST11, como moduladores de la colonización de H. pylori en niños y adultos.90-93
Una condición para considerar un aislado con potencial probiótico es que sea capaz de colonizar el sitio donde posiblemente realizará su función benéfica.94,95 Desde esta perspectiva, es conveniente aislar el microorganismo del mismo lugar que se pretende colonizar y seguidamente desarrollar su capacidad probiótica. Los probióticos son beneficiosos en la reducción de los efectos adversos y el aumento de la tolerabilidad de los regímenes de erradicación de H. pylori.96-99 Las BAL son especialmente útiles en pacientes con infecciones recurrentes por H. pylori y en el control de efectos adversos gastrointestinales inducidos por antibióticos.100 El interés actual en los probióticos como agentes terapéuticos contra H. pylori no sólo se debe a su uso en diferentes enfermedades gastrointestinales, sino también por considerarse una alternativa ante la creciente resistencia de bacterias patógenas a los antibióticos.101
Los estudios in vitro demuestran actividad inhibitoria cepa específica de los probióticos sobre el crecimiento de H. pylori. Estudios en humanos indican que los probióticos mejoran la tasa de erradicación de H. pylori102 y son útiles en la disminución de la carga bacteriana y de los síntomas dispépticos.103,104 La aplicación clínica de las BAL mejor documentada es la reducción de los efectos secundarios asociados a los antibióticos de primera línea en el tratamiento de la infección por H. pylori.105-107 Bajo este enfoque, este estudio determinó la distribución de la microbióta láctica gástrica de pacientes con gastritis y provenientes de regiones con contraste de riesgo de cáncer gástrico: La Florida (alto riesgo) y Tumaco (bajo riesgo). Las especies que con mas frecuencia se aislaron de pacientes de estas dos regiones fueron: L pentosus, L paracasei ssp paracasei 1, L. acidophilus 1 y L. rhamnosus. Estas tres últimas especies se utilizan en países de Europa, EE UU y Japón como suplementos dietéticos, entre otros, por su efecto modulador de la infección por H. pylori.108-110 La composición de la microbiota láctica gástrica fue diferente según la procedencia y tipo de gastritis, siendo comunes para pacientes de las dos regiones, seis especies de las 12 encontradas, las seis especies restantes fueron propias para cada lugar de procedencia, (tabla 3). Los aislamientos de BAL se obtuvieron en su mayoría de pacientes con gastritis no atrófica, observándose especies diferentes en los individuos con mucosa gástrica normal y con gastritis atrófica, lo que sugiere que el patrón de composición de la microbiota láctica gástrica es diferente para cada tipo de gastritis y para sujetos normales.
La diversidad de especies de BAL aisladas en este estudio, de pacientes con gastritis atrófica y no atrófica, en relación con los aislamientos de individuos normales requiere de estudios complementarios para determinar si existe una pérdida del equilibrio microbial gástrico inducido por la gastritis crónica, la úlcera péptica, el cáncer gástrico, la infección por H pylori, la terapia antimicrobial, o bien por factores dietarios o microambientales. El género Lactobacillus fue el más común de mucosa y jugo gástrico, seguido del género Lactococcus y Streptococcus, hecho concordante con lo reportado por Vilaichone y col.;111 Cats y col.112 Es posible que la microbiota normal de la mucosa gástrica humana, además de formarse por una alta diversidad de especies de BAL, como las descritas en este estudio, esté acompañada de bacterias de los géneros Bacillus, Bifidobacterium y otras especies como lo describe Pinchuk y col.;113 Duc y col.;114 Varbanova y col.115 y Khani y col.116 La coexistencia de la microbiota láctica gástrica con H. pylori se observó en 34% de los pacientes y sólo 13% estuvieron colonizados únicamente con microbiota láctica. Esto sugiere que las bacterias lácticas, como parte de la comunidad bacteriana autóctona del estómago humano, se adaptan y permanecen colonizando la mucosa de pacientes con gastritis, pudiendo en una buena medida compartir el ambiente intragástrico con H. pylori, coincidente con un estudio reciente.117 El riesgo de gastritis atrófica fue 1,8 veces más alto en pacientes infectados con H. pylori que en los libres de la infección, lo que concuerda con reportes previos.118,119 La prevalencia de la infección por H. pylori fue alta y similar en los pacientes de La Florida (88%) y Tumaco (85%), sin embargo, la proporción de pacientes con gastritis atrófica fue significativamente más alta en La Florida (43%) en comparación con Tumaco (25%), estos hallazgos concuerdan con otras investigaciones.120 En estudios realizados en la costa pacífica colombiana se ha encontrado alta prevalencia de infección por H. pylori, sin embargo la incidencia de gastritis atrófica y de lesiones precursoras de cáncer gástrico es baja, esto puede ser explicado probablemente, por factores como la variabilidad genética de las bacterias, la dieta y los polimorfismos humanos.121
Se puede concluir que la composición de la microbiota láctica gástrica varió según la procedencia y tipo de gastritis, siendo comunes para pacientes de las dos regiones estudiadas, seis especies de las 12 encontradas, de estas, en mayor proporción fueron aisladas de individuos con gastritis no-atrófica. Es posible que esta variación se explique, en parte, por el hábito de consumo de lácteos y sus derivados observado en individuos procedentes de la región de alto riesgo de cáncer gástrico, o por la alteración del pH del jugo gástrico inducido por la atrofia glandular significativamente más alta en los pacientes procedentes de La Florida que en los de Tumaco. Se encontró que la proporción de colonización por BAL gástricas fue mayor en pacientes procedentes de La Florida que en los de Tumaco (25%), sin embargo, el papel y las implicaciones de la presencia BAL en mayor proporción en pacientes con gastritis no atrófica necesitan estudiarse en investigaciones futuras. La especie más frecuentemente aislada de pacientes de las dos regiones fue Lactobacillus paracasei ssp paracasei 1.
AGRADECIMIENTOS
Al Sistema de Investigaciones de la Universidad de Nariño, por patrocinar este trabajo. Al grupo de investigación Registro Poblacional de Cáncer de la Universidad del Valle. A todos los investigadores de la Universidad de Nariño y de la Universidad del Valle que participaron en el trabajo.
REFERENCIAS
1. Correa P, Piazuelo MB. Natural history of Helicobacter pylori infection. Digestive and Liver Disease. 2008 Jul; 40(7):490–6. [ Links ]
2. Oliveros R. Tratamiento quirúrgico del cáncer gástrico. Rev Colomb Gastroenterol. 2003; 32:82-5. [ Links ]
3. Goodman KJ, Correa P. The transmisión of Helicobacter pylori. A critical review of the evidence. Int J Epidemiol. 1995 Oct; 24(5):875-87. [ Links ]
4. Goodman KJ, Correa P, Tengana hj, delany jp, Collazos T. Nutritional factors and Helicobacter pylori infection in Colombian children. J Pedriatr Gastroenterol Nutr. 1997 Nov; 25(5):507-15. [ Links ]
5. Gisbert JP, Gonzales L, Calver X, Roque M, Gabriel R, Pajares JM. Helicobacter pylori eradication: proton pump inhibitor versus raditidine bismuth citrate plus two antibiotics for 1 week: a metaanalysis of efficacy. Aliment Pharmacol Ther. 2000 Sep;14(9):1141-50. [ Links ]
6. O'morain C, Borody T, Farley A, De Boer WA, Dallaire C, Schuman R, et al. Efficacy and safety of single-trile capsules of bismuth biskalcitrate, metronidazole and tetracicline, given with omeprazole, for the eradication of Helicobacter pylori: an international multicentre study. Aliment Pharmacol Ther. 2003 Feb; 17(3):415-20. [ Links ]
7. Suerbaum S, Michetti P. Helicobacter pylori infection. N Engl J Med. 2002 Oct 10; 347(15):1175-86. [ Links ]
8. Ozdil K, Calhan T, Sahin A, Senates E, Kahraman R, Yüzbasioglu B, et al. Levofloxacin based sequential and triple therapy compared with standard plus probiotic combination for Helicobacter pylori eradication. Hepatogastroenterology. 2011 Jul-Aug; 58(109):1148-52. [ Links ]
9. Ozdil K, Calhan T, Sahin A, Senates E, Kahraman R, Yüzbasioglu B, et al. Levofloxacin based sequential and triple therapy compared with standard plus probiotic combination for Helicobacter pylori eradication. Hepatogastroenterology. 2011 Jul-Aug; 58(109):1148-52. [ Links ]
10. Varbanova M, Schult C, Malferthiner P. Helicobacter pylori and other gastric bacteria. Dig Dis. 2011 Dec 12; 29(6):562-9. [ Links ]
11. Wilhelm SM, Johnson JL, Kale PB. Treating bugs with bugs: the role of probiotics as adjunctive therapy for Helicobacter pylori. Ann Pharmacother. 2011 Jul 21; 45(7-8):960-6. [ Links ]
12. Ozdil K, Calhan T, Sahin A, Senates E, Kahraman R, Yüzbasioglu B, et al. Levofloxacin based sequential and triple therapy compared with standard plus probiotic combination for Helicobacter pylori eradication. Hepatogastroenterology. 2011 Jul-Aug; 58(109):1148-52. [ Links ]
13. Wilhelm SM, Johnson JL, Kale PB. Treating bugs with bugs: the role of probiotics as adjunctive therapy for Helicobacter pylori. Ann Pharmacother. 2011 Jul 21; 45(7-8):960-6. [ Links ]
14. Sakamoto I, Igarashi M, Kimura K, Takagi A, Miwa T, Koga Y. Suppressive effect of lactobacillus gasseri OLL 2716 (LG21) on Helicobacter pylori infection in humans. Journal Antimicrob Chemoter. 2001 May; 47(5):709-10. [ Links ]
15. de Vrese M, Kristen H, Rautenberg P, Laue C, Schrezenmeir J. Probiotic lactobacilli and bifidobacteria in a fermented milk product with added fruit preparation reduce antibiotic associated diarrhea and Helicobacter pylori activity. J Dairy Res. 2011 Nov; 78(4):396- 403. Epub 2011 Aug 26. [ Links ]
16. Lionetti E, Indrio F, Pavone L, Borrelli G, Cavallo L, Francavilla R. Role of probiotics in pediatric patients with Helicobacter pylori infection: a comprehensive review of the literature. Helicobacter. 2010 Apr; 15(2):79-87. [ Links ]
17. Varbanova M, Schult C, Malferthiner P. Helicobacter pylori and other gastric bacteria. Dig Dis. 2011 Dec 12; 29(6):562-9. [ Links ]
18. Lionetti E, Indrio F, Pavone L, Borrelli G, Cavallo L, Francavilla R. Role of probiotics in pediatric patients with Helicobacter pylori infection: a comprehensive review of the literature. Helicobacter. 2010 Apr; 15(2):79-87. [ Links ]
19. Gibson GR, Probert HM, Loo JV, Rastall RA, Roberfroid MB. Dietary modulation of the human colonic microbiota: updating the concept of prebiotics. Nutr Res Rev. 2004 Dec; 17(2):259-75. [ Links ]
20. Guarner F, Khan AG, Garisch J, Eliakim R, Gangl A, Thomson A, et al. World gastroenterology organization global guidelines: probiotics and prebiotics october 2011. J Clin Gastroenterol. 2012 Jul; 46(6):468-81. [ Links ]
21. Khani S, Hosseini HM, Taheri M, Nourani MR, Fooladi A. Probiotics as an alternative strategy for prevention and treatment of human diseases: A review. Inflamma Allergy Drug Targets. 2012 Apr; 11(2):79-89. [ Links ]
22. Lionetti E, Principi M, Scaccianoce G, Maurogiovanni G, La Rosa M, Ierardi E. Probiotics and Helicobacter pylori. European Gastroenterology & Hepatology Review. 2011 May; 7(2):121–8. [ Links ]
23. Varbanova M, Schult C, Malferthiner P. Helicobacter pylori and other gastric bacteria. Dig Dis. 2011 Dec 12; 29(6):562-9. [ Links ]
24. Gibson GR, Probert HM, Loo JV, Rastall RA, Roberfroid MB. Dietary modulation of the human colonic microbiota: updating the concept of prebiotics. Nutr Res Rev. 2004 Dec; 17(2):259-75. [ Links ]
25. Guarner F, Khan AG, Garisch J, Eliakim R, Gangl A, Thomson A, et al. World gastroenterology organization global guidelines: probiotics and prebiotics october 2011. J Clin Gastroenterol. 2012 Jul; 46(6):468-81. [ Links ]
26. Khani S, Hosseini HM, Taheri M, Nourani MR, Fooladi A. Probiotics as an alternative strategy for prevention and treatment of human diseases: A review. Inflamma Allergy Drug Targets. 2012 Apr; 11(2):79-89. [ Links ]
27. Wilhelm SM, Johnson JL, Kale PB. Treating bugs with bugs: the role of probiotics as adjunctive therapy for Helicobacter pylori. Ann Pharmacother. 2011 Jul 21; 45(7-8):960-6. [ Links ]
28. Sakamoto I, Igarashi M, Kimura K, Takagi A, Miwa T, Koga Y. Suppressive effect of lactobacillus gasseri OLL 2716 (LG21) on Helicobacter pylori infection in humans. Journal Antimicrob Chemoter. 2001 May; 47(5):709-10. [ Links ]
29. Khani S, Hosseini HM, Taheri M, Nourani MR, Fooladi A. Probiotics as an alternative strategy for prevention and treatment of human diseases: A review. Inflamma Allergy Drug Targets. 2012 Apr; 11(2):79-89. [ Links ]
30. Mukai T, Asasaka T, Sato E, Mori K, Matsumoto M, Ohori H. Inhibition of binding of Helicobacter pylori to the glycolipid receptors by probiotic Lactobacillus reuteri. Inmunol Med Microbiol. 2002 Jan 14; 32(2):105-10. [ Links ]
31. Wilhelm SM, Johnson JL, Kale PB. Treating bugs with bugs: the role of probiotics as adjunctive therapy for Helicobacter pylori. Ann Pharmacother. 2011 Jul 21; 45(7-8):960-6. [ Links ]
32. Sakamoto I, Igarashi M, Kimura K, Takagi A, Miwa T, Koga Y. Suppressive effect of lactobacillus gasseri OLL 2716 (LG21) on Helicobacter pylori infection in humans. Journal Antimicrob Chemoter. 2001 May; 47(5):709-10. [ Links ]
33. de Vrese M, Kristen H, Rautenberg P, Laue C, Schrezenmeir J. Probiotic lactobacilli and bifidobacteria in a fermented milk product with added fruit preparation reduce antibiotic associated diarrhea and Helicobacter pylori activity. J Dairy Res. 2011 Nov; 78(4):396- 403. Epub 2011 Aug 26. [ Links ]
34. Mukai T, Asasaka T, Sato E, Mori K, Matsumoto M, Ohori H. Inhibition of binding of Helicobacter pylori to the glycolipid receptors by probiotic Lactobacillus reuteri. Inmunol Med Microbiol. 2002 Jan 14; 32(2):105-10. [ Links ]
35. Cats A, Kuipers EJ, Bosschaert MA, Pot RG, Vandenbroucke CM, Kusters JG. Effect of frequent consumption of a Lactobacillus caseicontaining milk drink in Helicobacter pyloricolonized subjects. Aliment Pharmacol. 2003 Feb; 17(3):429-35. [ Links ]
36. Lionetti E, Indrio F, Pavone L, Borrelli G, Cavallo L, Francavilla R. Role of probiotics in pediatric patients with Helicobacter pylori infection: a comprehensive review of the literature. Helicobacter. 2010 Apr; 15(2):79-87. [ Links ]
37. Shimizu T, Haruna H, Hisada K, Yamachiro Y. Effects of Lactobacillus gasseri OLL 2716 (LG21) on Helicobacter pylori infection in children. Journal Antimicrob chemother. 2002 Oct; 50(4):617-8. [ Links ]
38. Wilhelm SM, Johnson JL, Kale PB. Treating bugs with bugs: the role of probiotics as adjunctive therapy for Helicobacter pylori. Ann Pharmacother. 2011 Jul 21; 45(7-8):960-6. [ Links ]
39. Sheu BS, Cheng HC, Kao AW, Wang ST, Yang YJ, Yang HB, et al. Pretreatment with Lactobacillus and Bifidobacterium containing yogurt can improve the efficacy of quadruple therapy in eradicating residual Helicobacter pylori infection after failed triple therapy. Am J Clin Nutr. 2006 Apr; 83(4):864-9. [ Links ]
40. Heczko PB, Strus M, Kochan P. Critical evaluation of probiotic activity of lactic acid bacteria and their effects. J Physiol Pharmacol. 2006 Nov; 57 Suppl 9:5-12. [ Links ]
41. Armuzzi A, Cremonini F, Bartolozzi F. Bartolozzi F, Canducci F, Candelli M, et al. Effect of Lactobacillus GG supplementation on antibioticassociated gastrointestinal side effects during Helicobacter pylori eradication therapy: a pilot study. Digestion. 2001; 63(1):1-7. [ Links ]
42. De Francesco V, Stoppino V, Sgarro C, Faleo D. Lactobacillus acidophilus administration added to omeprazole/amoxycillin-based double therapy in Helicobacter pylori eraradication. Dig Liver Dis. 2000 Nov; 32(8):746-7. [ Links ]
43. Canducci F, Armuzzi A, Cremonini F, Cammarota G, Bartolozzi F, Pola P, et al. A lyophilized and inactivated culture of Lactobacillus acidophilus increases Helicobacter pylori eradication rates. Aliment Pharmacol. 2000 Dec; 14(12):1625-9. [ Links ]
44. Varbanova M, Schult C, Malferthiner P. Helicobacter pylori and other gastric bacteria. Dig Dis. 2011 Dec 12; 29(6):562-9. [ Links ]
45. Varbanova M, Schult C, Malferthiner P. Helicobacter pylori and other gastric bacteria. Dig Dis. 2011 Dec 12; 29(6):562-9. [ Links ]
46. Wilhelm SM, Johnson JL, Kale PB. Treating bugs with bugs: the role of probiotics as adjunctive therapy for Helicobacter pylori. Ann Pharmacother. 2011 Jul 21; 45(7-8):960-6. [ Links ]
47. Lionetti E, Indrio F, Pavone L, Borrelli G, Cavallo L, Francavilla R. Role of probiotics in pediatric patients with Helicobacter pylori infection: a comprehensive review of the literature. Helicobacter. 2010 Apr; 15(2):79-87. [ Links ]
48. Guarner F, Khan AG, Garisch J, Eliakim R, Gangl A, Thomson A, et al. World gastroenterology organization global guidelines: probiotics and prebiotics october 2011. J Clin Gastroenterol. 2012 Jul; 46(6):468-81. [ Links ]
49. Wilhelm SM, Johnson JL, Kale PB. Treating bugs with bugs: the role of probiotics as adjunctive therapy for Helicobacter pylori. Ann Pharmacother. 2011 Jul 21;45(7-8):960-6. [ Links ]
50. Sakamoto I, Igarashi M, Kimura K, Takagi A, Miwa T, Koga Y. Suppressive effect of lactobacillus gasseri OLL 2716 (LG21) on Helicobacter pylori infection in humans. Journal Antimicrob Chemoter. 2001 May; 47(5):709-10. [ Links ]
51. de Vrese M, Kristen H, Rautenberg P, Laue C, Schrezenmeir J. Probiotic lactobacilli and bifidobacteria in a fermented milk product with added fruit preparation reduce antibiotic associated diarrhea and Helicobacter pylori activity. J Dairy Res. 2011 Nov; 78(4):396- 403. Epub 2011 Aug 26. [ Links ]
52. Chen X, Liu XM, Tian F, Zhang Q, Zhang HP, Zhang H Antagonistic activities of lactobacilli against Helicobacter pylori growth and infection in human gastric epithelial cells. J Food Sci. 2012 Jan; 77(1):M9-14. [ Links ]
53. Medeiros JA, Gonçalves TM, Boyanova L, Pereira MI, de Carvalho JN, Pereira AM, et al. Evaluation of Helicobacter pylori eradication by triple therapy plus Lactobacillus acidophilus compared to triple therapy alone. Eur J Clin Microbiol Infect Dis. 2011 Apr; 30(4):555-9. [ Links ]
54. Lanara L. Métodos microbiológicos. 3ªed Brasilia: Ministerio de Agricultura; 1981. [ Links ]
55. Raimbault M. Manual de procedimientos del laboratorio de Bioconversiones. Universidad del Valle. Cali: Oficina de comunicaciones; 1994. [ Links ]
56. Pruszkowski J, Ziolkowski G, Gonciarz Z, Besser P. Isolation of Helicobacter pylori from gastric mucosa depending on the growth medium used. Med Dosw Mikrobiol. 1994; 46(4):305-11. [ Links ]
57. Azevedo NF, Pacheco AP, Keevil CW, Vieira1 MJ. Nutrient shock and incubation atmosphere influence recovery of culturable Helicobacter pylori from water. Applied and Environmental Microbiology. 2004 Jan; 70(1):490–3. [ Links ]
58. Lanara L. Métodos microbiológicos. 3ª ed Brasilia: Ministerio de Agricultura; 1981. [ Links ]
59. Raimbault M. Manual de procedimientos del laboratorio de Bioconversiones. Universidad del Valle. Cali: Oficina de comunicaciones; 1994. [ Links ]
60. Pruszkowski J, Ziolkowski G, Gonciarz Z, Besser P. Isolation of Helicobacter pylori from gastric mucosa depending on the growth medium used. Med Dosw Mikrobiol. 1994; 46(4):305-11. [ Links ]
61. Dixon MF, Yardley JH, Correa P. Classification and grading of gastritis. The updated sydney system. The American Journal of Surgical Pathology 1996; Oct; 20(10):1161-81. [ Links ]
62. Bravo LE, Doorn LJ, Realpe JL, Correa P. Virulence- Associated genotypes of Helicobacter pylori: Do they explain the african enigma? The American J of Gastroenterol. 2002 Jun 11; 97 (11):2839-42. [ Links ]
63. Vilaichone RK, Mahachai V, Tumwasorn S, Nunthapisud P, Kullavanijaya P. Inhibitory effect of Lactobacillus acidophilus on Helicobacter pylori in peptic ulcer patients: In vitro study. Med Assoc Thai. 2002 Jun; 85 Suppl 1:S79-84. [ Links ]
64. Cats A, Kuipers EJ, Bosschaert MA, Pot RG, Vandenbroucke CM, Kusters JG. Effect of frequent consumption of a Lactobacillus caseicontaining milk drink in Helicobacter pyloricolonized subjects. Aliment Pharmacol. 2003 Feb; 17(3):429-35. [ Links ]
65. Varbanova M, Schult C, Malferthiner P. Helicobacter pylori and other gastric bacteria. Dig Dis. 2011 Dec 12; 29(6):562-9. [ Links ]
66. Guarner F, Khan AG, Garisch J, Eliakim R, Gangl A, Thomson A, et al. World gastroenterology organisation global guidelines: probiotics and prebiotics october 2011. J Clin Gastroenterol. 2012 Jul; 46(6):468-81. [ Links ]
67. Fujimura Sh, Watanabe A, Kimura K, Kaji M. Probiotic Mechanism of Lactobacillus gasseri OLL2716 Strain against Helicobacter pylori. Journal of Clinical Microbiology. 2012 March; 50(3):1134–6. [ Links ]
68. Ozdil K, Calhan T, Sahin A, Senates E, Kahraman R, Yüzbasioglu B, et al. Levofloxacin based sequential and triple therapy compared with standard plus probiotic combination for Helicobacter pylori eradication. Hepatogastroenterology. 2011 Jul-Aug; 58(109):1148-52. [ Links ]
69. Cats A, Kuipers EJ, Bosschaert MA, Pot RG, Vandenbroucke CM, Kusters JG. Effect of frequent consumption of a Lactobacillus caseicontaining milk drink in Helicobacter pyloricolonized subjects. Aliment Pharmacol. 2003 Feb; 17(3):429-35. [ Links ]
70. Fujimura Sh, Watanabe A, Kimura K, Kaji M. Probiotic Mechanism of Lactobacillus gasseri OLL2716 Strain against Helicobacter pylori. Journal of Clinical Microbiology. 2012 March; 50(3):1134–6. [ Links ]
71. Bühling A, Radun D, Müller WA, Malfertheiner P. Influence of anti-Helicobacter tripletherapy with metronidazole, omeprazole and clarithromycin on intestinal microflora. Aliment Pharmacol. 2001 Sep; 15(9):1445-52. [ Links ]
72. Ozdil K, Calhan T, Sahin A, Senates E, Kahraman R, Yüzbasioglu B, et al. Levofloxacin based sequential and triple therapy compared with standard plus probiotic combination for Helicobacter pylori eradication. Hepatogastroenterology. 2011 Jul-Aug; 58(109):1148-52. [ Links ]
73. Fujimura Sh, Watanabe A, Kimura K, Kaji M. Probiotic Mechanism of Lactobacillus gasseri OLL2716 Strain against Helicobacter pylori. Journal of Clinical Microbiology. 2012 March; 50(3):1134–6. [ Links ]
74. Ibíd. [ Links ]
75. Lionetti E, Indrio F, Pavone L, Borrelli G, Cavallo L, Francavilla R. Role of probiotics in pediatric patients with Helicobacter pylori infection: a comprehensive review of the literature. Helicobacter. 2010 Apr; 15(2):79-87. [ Links ]
76. Guarner F, Khan AG, Garisch J, Eliakim R, Gangl A, Thomson A, et al. World gastroenterology organisation global guidelines: probiotics and prebiotics october 2011. J Clin Gastroenterol. 2012 Jul; 46(6):468-81. [ Links ]
77. Mukai T, Asasaka T, Sato E, Mori K, Matsumoto M, Ohori H. Inhibition of binding of Helicobacter pylori to the glycolipid receptors by probiotic Lactobacillus reuteri. Inmunol Med Microbiol. 2002 Jan 14; 32(2):105-10. [ Links ]
78. Fujimura Sh, Watanabe A, Kimura K, Kaji M. Probiotic Mechanism of Lactobacillus gasseri OLL2716 Strain against Helicobacter pylori. Journal of Clinical Microbiology. 2012 March; 50(3):1134–6. [ Links ]
79. Tsimmerman L, Subbotina LV, Neschisliaev VA. Microbial antagonism and rationale for the use of probiotics in combined therapy of Helicobacter pylori-related diseases. Klin Med. 2010; 88(4):35-42. [ Links ]
80. Lorca Gl, Wadstrom T, Font GF, Ljungh A. Lactobacillus acidophilus autolysins inhibit Helicobacter pylori in vitro. Curr Microbiol. 2001 Jun; 42 (1):39-44. [ Links ]
81. Ljungh A, Wadström T. Lactic acid bacteria as probiotics. Curr Issues Intest Microbiol. 2006 Sep; 7(2):73-89. [ Links ]
82. Chenoll E, Casinos B, Bataller E, Astals P, Echevarría J, Iglesias JR, et al. Novel probiotic Bifidobacterium bifidum CECT 7366 strain active against the pathogenic bacterium Helicobacter pylori. Appl Environ Microbiol. 2011 Feb; 77(4):1335-43. [ Links ]
83. Sheu BS, Yang HB, Yeh YC, Wu JJ. Helicobacter pylori colonization of the human gastric epithelium: a bug's first step is a novel target for us. J Gastroenterol Hepatol. 2010 Jan; 25(1):26-32. [ Links ]
84. Wilhelm SM, Johnson JL, Kale PB. Treating bugs with bugs: the role of probiotics as adjunctive therapy for Helicobacter pylori. Ann Pharmacother. 2011 Jul 21; 45(7-8):960-6. [ Links ]
85. Guarner F, Khan AG, Garisch J, Eliakim R, Gangl A, Thomson A, et al. World gastroenterology organisation global guidelines: probiotics and prebiotics october 2011. J Clin Gastroenterol. 2012 Jul; 46(6):468-81. [ Links ]
86. Fujimura Sh, Watanabe A, Kimura K, Kaji M. Probiotic mechanism of Lactobacillus gasseri OLL2716 Strain against Helicobacter pylori. Journal of Clinical Microbiology. 2012 March; 50(3):1134–6. [ Links ]
87. Chenoll E, Casinos B, Bataller E, Astals P, Echevarría J, Iglesias JR, et al. Novel probiotic Bifidobacterium bifidum CECT 7366 strain active against the pathogenic bacterium Helicobacter pylori. Appl Environ Microbiol. 2011 Feb; 77(4):1335-43. [ Links ]
88. Armuzzi A, Cremonini F, Bartolozzi F. Bartolozzi F, Canducci F, Candelli M, et al. Effect of Lactobacillus GG supplementation on antibioticassociated gastrointestinal side effects during Helicobacter pylori eradication therapy: a pilot study. Digestion. 2001; 63(1):1-7. [ Links ]
89. Canducci F, Cremonini F, Armuzzi A, Di Caro S, Gabrielli M, Nista E, et al. Probiotics and Helicobacter pylori erradicación. Dig Liver Dis. 2002 Sep; 34 Suppl 2:S81-3. [ Links ]
90. Wilhelm SM, Johnson JL, Kale PB. Treating bugs with bugs: the role of probiotics as adjunctive therapy for Helicobacter pylori. Ann Pharmacother. 2011 Jul 21; 45(7-8):960-6. [ Links ]
91. Lionetti E, Indrio F, Pavone L, Borrelli G, Cavallo L, Francavilla R. Role of probiotics in pediatric patients with Helicobacter pylori infection: a comprehensive review of the literature. Helicobacter. 2010 Apr; 15(2):79-87. [ Links ]
92. Canducci F, Cremonini F, Armuzzi A, Di Caro S, Gabrielli M, Nista E, et al. Probiotics and Helicobacter pylori erradicación. Dig Liver Dis. 2002 Sep; 34 Suppl 2:S81-3. [ Links ]
93. Cruchet S, Obregón MC, Salazar G, Diaz E, Gotteland M. Effect of the ingestion of dietary product containing Lactobacillus johnsonii La1 on Helicobacter pylori colonization in children. Applied Nutritional Investigation. 2003 Sep; 19(9):716-21. [ Links ]
94. Guarner F, Khan AG, Garisch J, Eliakim R, Gangl A, Thomson A, et al. World gastroenterology organisation global guidelines: probiotics and prebiotics october 2011. J Clin Gastroenterol. 2012 Jul; 46(6):468-81. [ Links ]
95. Ibíd. [ Links ]
96. Wilhelm SM, Johnson JL, Kale PB. Treating bugs with bugs: the role of probiotics as adjunctive therapy for Helicobacter pylori. Ann Pharmacother. 2011 Jul 21; 45(7-8):960-6. [ Links ]
97. Lionetti E, Indrio F, Pavone L, Borrelli G, Cavallo L, Francavilla R. Role of probiotics in pediatric patients with Helicobacter pylori infection: a comprehensive review of the literature. Helicobacter. 2010 Apr; 15(2):79-87. [ Links ]
98. Heczko PB, Strus M, Kochan P. Critical evaluation of probiotic activity of lactic acid bacteria and their effects. J Physiol Pharmacol. 2006 Nov; 57 Suppl 9:5-12. [ Links ]
99. Ljungh A, Wadström T. Lactic acid bacteria as probiotics. Curr Issues Intest Microbiol. 2006 Sep; 7(2):73-89. [ Links ]
100. Wilhelm SM, Johnson JL, Kale PB. Treating bugs with bugs: the role of probiotics as adjunctive therapy for Helicobacter pylori. Ann Pharmacother. 2011 Jul 21; 45(7-8):960-6. [ Links ]
101. Lionetti E, Principi M, Scaccianoce G, Maurogiovanni G, La Rosa M, Ierardi E. Probiotics and Helicobacter pylori. European Gastroenterology & Hepatology Review. 2011 May; 7(2):121–8. [ Links ]
102. Lionetti E, Indrio F, Pavone L, Borrelli G, Cavallo L, Francavilla R. Role of probiotics in pediatric patients with Helicobacter pylori infection: a comprehensive review of the literature. Helicobacter. 2010 Apr; 15(2):79-87. [ Links ]
103. Ibíd. [ Links ]
104. Lionetti E, Principi M, Scaccianoce G, Maurogiovanni G, La Rosa M, Ierardi E. Probiotics and Helicobacter pylori. European Gastroenterology & Hepatology Review. 2011 May; 7(2):121–8. [ Links ]
105. Guarner F, Khan AG, Garisch J, Eliakim R, Gangl A, Thomson A, et al. World gastroenterology organisation global guidelines: probiotics and prebiotics october 2011. J Clin Gastroenterol. 2012 Jul; 46(6):468-81. [ Links ]
106. Lionetti E, Principi M, Scaccianoce G, Maurogiovanni G, La Rosa M, Ierardi E. Probiotics and Helicobacter pylori. European Gastroenterology & Hepatology Review. 2011 May; 7(2):121–8. [ Links ]
107. Ljungh A, Wadström T. Lactic acid bacteria as probiotics. Curr Issues Intest Microbiol. 2006 Sep; 7(2):73-89. [ Links ]
108. Vilaichone RK, Mahachai V, Tumwasorn S, Nunthapisud P, Kullavanijaya P. Inhibitory effect of Lactobacillus acidophilus on Helicobacter pylori in peptic ulcer patients: In vitro study. Med Assoc Thai. 2002 Jun; 85 Suppl 1:S79-84. [ Links ]
109. Canducci F, Cremonini F, Armuzzi A, Di Caro S, Gabrielli M, Nista E, et al. Probiotics and Helicobacter pylori erradicación. Dig Liver Dis. 2002 Sep; 34 Suppl 2:S81-3. [ Links ]
110. Cruchet S, Obregón MC, Salazar G, Diaz E, Gotteland M. Effect of the ingestion of dietary product containing Lactobacillus johnsonii La1 on Helicobacter pylori colonization in children. Applied Nutritional Investigation. 2003 Sep; 19(9):716-21. [ Links ]
111. Vilaichone RK, Mahachai V, Tumwasorn S, Nunthapisud P, Kullavanijaya P. Inhibitory effect of Lactobacillus acidophilus on Helicobacter pylori in peptic ulcer patients: In vitro study. Med Assoc Thai. 2002 Jun; 85 Suppl 1:S79-84. [ Links ]
112. Cats A, Kuipers EJ, Bosschaert MA, Pot RG, Vandenbroucke CM, Kusters JG. Effect of frequent consumption of a Lactobacillus caseicontaining milk drink in Helicobacter pyloricolonized subjects. Aliment Pharmacol. 2003 Feb; 17(3):429-35. [ Links ]
113. Pinchuk IV, Bressollier P, Verneuil B, Fenet B, Sorokulova IB, Megraud F, et al. In vitro anti- Helicobacter pylori activity of the probiotic strain Bacillus subtilis 3 is due to secretion of antibiotics. Antimicrobial Agents and Chemotherapy. 2001 Nov;45(11):3156-61. [ Links ]
114. Duc LH, Hong HA, Barbosa TM, Henriques AO, Cutting SM. Characterization of Bacillus probiotics available for human use. Applied and environmental microbiology. 2004 Apr; 70(4):2161-71. [ Links ]
115. Varbanova M, Schult C, Malferthiner P. Helicobacter pylori and other gastric bacteria. Dig Dis. 2011 Dec 12; 29(6):562-9. [ Links ]
116. Khani S, Hosseini HM, Taheri M, Nourani MR, Fooladi A. Probiotics as an alternative strategy for prevention and treatment of human diseases: A review. Inflamma Allergy Drug Targets. 2012 Apr; 11(2):79-89. [ Links ]
117. Varbanova M, Schult C, Malferthiner P. Helicobacter pylori and other gastric bacteria. Dig Dis. 2011 Dec 12; 29(6):562-9. [ Links ]
118. Correa P, Piazuelo MB. Natural history of Helicobacter pylori infection. Digestive and Liver Disease. 2008 Jul; 40(7):490–6. [ Links ]
119. Goodman KJ, Correa P, Tengana hj, delany jp, Collazos T. Nutritional factors and Helicobacter pylori infection in Colombian children. J Pedriatr Gastroenterol Nutr. 1997 Nov; 25(5):507-15. [ Links ]
120. Bravo LE, Doorn LJ, Realpe JL, Correa P. Virulence- Associated genotypes of Helicobacter pylori: Do they explain the african enigma? The American J of Gastroenterol. 2002 Jun 11; 97 (11):2839-42. [ Links ]
121. Bravo LE, Doorn LJ, Realpe JL, Correa P. Virulence- Associated genotypes of Helicobacter pylori: Do they explain the african enigma? The American J of Gastroenterol. 2002 Jun 11; 97 (11):2839-42. [ Links ]













