Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Universidad y Salud
Print version ISSN 0124-7107On-line version ISSN 2389-7066
Univ. Salud vol.15 no.1 Pasto Jan./June 2013
Infección por VPH en mujeres del municipio de Pasto (Colombia) con resultados de citología normal
HPV infection in women from Pasto (Colombia) with normal results citology
Sánchez-Ortega Claudia1, Suárez-Narváez Karen2, Yépez-Chamorro Maria3, Guerrero-Flórez Milena4
1 Bióloga. Departamento de Biología. Centro de Estudios en Salud CESUN, Universidad de Nariño, Pasto, Nariño, Colombia. e-mail: claudita.so0414@gmail.com
2 Bióloga. Departamento de Biología. Centro de Estudios en Salud CESUN, Universidad de Nariño, Pasto, Nariño, Colombia. e-mail: karen.suarezn@gmail.com
3 Directora Centro de Estudios en Salud CESUN. Grupo de Investigación Salud Pública. Universidad de Nariño, Pasto, Nariño, Colombia. e-mail:mcych@udenar.edu.co
4 Profesora Departamento de Biología. Grupo de Investigación Salud Pública. Centro de Estudios en Salud CESUN, Universidad de Nariño, Pasto, Nariño, Colombia. e-mail:milenague@udenar.edu.co
Fecha de recepción: Febrero 2 - 2013 / Fecha de aceptación: Junio 7 – 2013
RESUMEN
Introducción. El cáncer de cuello uterino (CCU) asociado a la infección por VPH se considera un importante problema de salud pública a nivel mundial. En Colombia, es la segunda causa de muerte por cáncer en mujeres. En el municipio de Pasto (N) ubicado al suroccidente de Colombia, la tasa de incidencia es de 27,3/100.000 habitantes. Profundizar en la historia natural de la infección por VPH permitiría mejorar las estrategias de control y diagnóstico temprano para evitar la progresión de este tipo de cáncer. Métodos. Se realizó la detección y tipificación del VPH, mediante Reverse line blot - GP5+/GP6+, en muestras de cepillado cervical tomadas de 145 mujeres que acudieron a toma de citología en 7 Instituciones Prestadoras de Salud del municipio de Pasto. Los resultados obtenidos se analizaron junto con algunas variables poblacionales. Resultados. Se detectó VPH en 6,9% de las pacientes, los genotipos encontrados fueron VPH 11, 45, 53, 54, 55, 56, 70 y 84, los tipos virales de alto riesgo representaron el 54,6%. El 10% de las mujeres VPH positivas, presentaron infección múltiple. La edad, la infección por otros microorganismos, el número de gestas, el uso de anticonceptivos y los cambios celulares reactivos asociados a inflamación no constituyeron factores determinantes para adquirir o explicar la infección por el VPH en mujeres con citología normal. Conclusión: La infección por VPH fue más frecuente en mujeres < 37 años, con al menos una gesta previa y con algún grado de inflamación en el cérvix.
Palabras clave: Virus de papiloma humano, cáncer de cuello uterino, reverse line blot hybridization, infección. (DeCS-Bireme)
ABSTRACT
Introduction. Human Papillomavirus is sexually-transmitted well known for being the main cause of cervical cancer, which constitutes a major problem of public health worldwide. In Colombia, cervical cancer is the second cause of women mortality, and Pasto shows one of the highest incidence rates (27.39 per 100,000 inhabitants). Further in-depth research about natural history of HPV infection, would enable to improve the early-diagnosis and control strategies of the viral infection avoiding the progression to cancer. Methods. In the present study was performed the HPV-detection and typing by Reverse line blot - GP5+/6+, in cervical cell samples taken from 145 women who attended the cytologys taking in 7 IPS (health provider institutions) of Pasto city (Colombia). Such results were analyzed together with some population variables. Results. The HPV was detected in 6.9 % of the patients studied; meanwhile, the genotypes found were: HPV 11, 45, 53, 54, 55, 56, 70 and 84, the high-risk HPV types represented 54.6%. Among women HPV positive, 90% had a single HPV infection and 10% of patients had a multiple HPV infection. Age, infection with other microorganisms, the number of pregnancies, the use of contraceptives and reactive cellular changes associated with inflammation were found to be not decisive factors for acquiring or explain HPV-infection into the group of women with normal cytology. Conclusion. The HPV infection was more often for women under 37 years having at least one previous pregnancy together with some degree of cervix inflammation.
Key words: Human papillomavirus, cervical cancer, reverse line blot hybridization, infection. (Source: MeSH, NLM)
INTRODUCCIÓN
El cáncer de cuello uterino (CCU) es un problema de salud pública a nivel mundial, es la segunda neoplasia maligna más frecuente en mujeres y la quinta causa de muerte por cáncer.1-3 En Colombia, la incidencia estimada por edad para el periodo 2002-2006 de CCU fue de 28,2 por 100.000 habitantes y la tasa de mortalidad observada por edad para el mismo periodo fue de 10 por 100.000 habitantes.4 En el municipio de Pasto, la incidencia de CCU para el periodo 2003-2007 fue de 27,3 por 100.000 habitantes y la tasa de mortalidad ajustada por edad fue de 6,6 por 100.000 personas/año. Según el registro poblacional de cáncer del municipio de Pasto para el periodo mencionado, la tasa de incidencia ajustada por edad, de neoplasia in situ de cuello uterino fue de 30,3 por 100.000 habitantes.5
El VPH es considerado como el principal agente causal de las lesiones intraepiteliales y del CCU, especialmente los tipos de alto riesgo oncogénico, sin embargo, la presencia del VPH no es suficiente para la progresión a cáncer, varios autores sugieren que hay otros factores relacionados con las células hospederas, hábitos del hospedero y su medio ambiente que predisponen a la neoplasia cervical maligna.6,7
En la actualidad, la citología cervical es el método preventivo más empleado en la detección de alteraciones celulares causadas por VPH. Una evaluación citológica anual de manera óptima permitiría prevenir hasta un 70% de las neoplasias cervicales. A pesar de todas las ventajas de la citología, su evaluación está basada en parámetros subjetivos y requiere una alta experticia por el personal de salud encargado de la toma de la muestra y su lectura, que genera una proporción importante de falsos positivos o negativos.8,9 Es por ello, que hoy en día, se ha propuesto complementar los métodos convencionales con el uso de técnicas moleculares sensibles y específicas, que permitan la detección, genotipaje y evaluación de la carga viral del VPH, como nuevas estrategias de prevención y manejo de la infección viral, destinadas hacia una intervención oportuna en aquellas mujeres con alto riesgo de desarrollar CCU, aun cuando la infección sea asintomática.10,11
En este estudio se realizó la detección y tipificación de VPH a partir de muestras de cepillado cervical en mujeres con resultado de citología normal, mediante el sistema Reverse Line Blot (RLB). La genotipificación se realizó con el fin de obtener información acerca de la infección viral, los genotipos circundantes y la influencia de otros factores poblacionales que podrían permitir un mejor entendimiento de la dinámica de la infección por VPH en mujeres del Municipio de Pasto.
MATERIALES Y MÉTODOS
Población de estudio. Se incorporaron al estudio 160 mujeres que acudieron a la toma de citología, en 7 Instituciones Prestadoras de Servicios de Salud (IPS), pertenecientes a la Empresa Social del Estado de Pasto, distribuidas en las zonas norte, oriente, occidente y sur del municipio. Los criterios para la inclusión en este estudio fueron, mujeres entre 18 y 60 años de edad, pertenecientes al régimen subsidiado de salud y carnetizadas en los estratos 1, 2 y 3, que aceptaron participar de forma voluntaria a través de la firma de un consentimiento informado. No se incluyeron pacientes histerectomizadas y/o que hayan recibido tratamiento para neoplasia cervical y/o infección por VPH. El estudio fue aprobado por el comité de ética de la Universidad de Nariño y se desarrolló de acuerdo con los aspectos éticos y legales de la investigación en seres humanos, contemplados en la Resolución Nº 008430 de 1993 del Ministerio de Salud de la República de Colombia.
Muestras y recolección de información. Para la recolección de las muestras, la información poblacional y la firma de los consentimientos informados, se contó con la colaboración de personal de Pasto Salud E.S.E. A cada paciente se le tomó una muestra de cepillado cervical mediante procedimientos estándar. La muestra se utilizó para realizar la citología convencional, que fue leída y clasificada según el sistema Bethesda 2001 y el remanente de la muestra de cepillado cervical se utilizó en la detección y tipificación molecular de VPH.12
Detección y tipificación de VPH. Para todas las reacciones de amplificación por PCR, se partió de un lisado celular. Las muestras se resuspendieron en 750µl de buffer fosfato salino 1X y timerosal al 0,05%, luego se homogenizaron y se llevaron a 90°C en plancha de calentamiento durante 10 minutos. Para su conservación se llevaron primero a 4°C y luego a -20°C, hasta el posterior uso.
Análisis de calidad del ADN. Para evaluar la integridad y la calidad del ADN de las muestras recolectadas y excluir aquellas con ADN degradado o no detectable, se realizó la amplificación de un fragmento de 110 pb del gen constitutivo de ß-globina (HHB), con los iniciadores PCO3 (sentido) 5'ACACAACTGTGTTCACTAGC3' y PCO4 (antisentido) 5'CAACTTCATCCACCTTCACC3', según la metodología descrita por García y cols. Para hacer uso de estos iniciadores se realizó una confirmación bioinformática de la región de anillamiento en el gen de la ß-globina humana, usando la herramienta Blastn/Megablast del National Center for Information Biotechnology (NCBI). La reacción de PCR se realizó en un volumen final de 25µl que contenía 2,5µl buffer de PCR 1X, 3,5mM de MgCl2, 200µM de cada dNTP, 1µM de cada iniciador, 1,25U de GoTaq flexi (Promega BioSciences, San Luis Obispo, CA, USA), 5µl de lisado celular y para completar el volumen de reacción se utilizó agua ultrapura. Los ciclos de amplificación se llevaron a cabo en un termociclador My CyclerTM (Biorad Laboratories LTDA, Hertfordshire, U.K) bajo la siguiente programación: 4 minutos a 94°C, 40 ciclos de amplificación de 94°C durante 30 segundos, 52 °C por 30 segundos y 72 °C durante 1 minuto. Y una extensión final a 72°C por 4 minutos. Los productos de amplificación fueron verificados mediante electroforesis en gel de agarosa al 2% teñidos con Syber safe (1µl/ml). La corrida electroforética se llevó a cabo en el equipo Biorad Power PAC 3000, con buffer TBE 1X, durante una hora a 80V, 50A y 100mA. La visualización del gel se realizó con luz UV en un fotodigitalizador de geles con el software Quantity One de Biorad. Las muestras se consideraron positivas para el gen de ß-globina cuando se observó una banda del tamaño esperado, compatible con el marcador de peso molecular GeneRuler Ultra Low Range DNA Ladder (10-300bp) y el resultado de la muestra fue interpretado como negativo en ausencia de banda de tamaño esperado, como blanco se utilizó agua destilada estéril.
Tipificación de VPH mediante Reverse Line Blot – RLB. La detección y tipificación de VPH se realizó usando los amplificados por PCR GP5+/bio-GP6+ y la técnica RLB, de acuerdo con la metodología descrita por Van den Brule y cols Se realizó la amplificación de un fragmento de 150 pb de la región L1 del genoma VPH a partir de las muestras positivas para el gen de ß-globina (HHB) utilizando los iniciadores GP5+ (sentido) 5'TTTGTTACTGTGGTAGATACTA3' y GP6+ marcado con biotina (antisentido) 5'GAAAAATAAACTGTAAATCATA3'.13 La reacción de PCR se realizó en un volumen final de 25µl que contenía 2,5µl buffer de PCR 1X, 1,5µM de MgCl2, 200µM de cada dNTP, 1µM de cada iniciador, 1,25U de GoTaq flexi (Promega), 5µl de lisado celular y agua ultrapura para completar el volumen de reacción. Los ciclos de amplificación se llevaron a cabo en un termociclador My CyclerTM (Biorad) bajo la siguiente programación: 4 minutos a 94°C, 40 ciclos de amplificación de 94°C durante 1 minuto, 40°C por 2 minutos, 72°C durante 30 segundos y una extensión final a 72°C por 4 minutos.
Los productos de PCR GP5+/bio-GP6+ fueron sometidos a hibridación no radiactiva con diferentes sondas de oligonucleótidos, utilizando el sistema Minibloter 45 Immunetics, Inc (Drydock Boston, MA, USA). Las oligosondas acopladas detectan 37 tipos de VPH: HPV 6, 11, 16, 18, 26, 31, 33, 34, 35, 39, 40, 42, 43, 44, 45, 51, 52, 53, 54, 55, 56, 57, 58, 59, 61, 66, 68, 70, 72, 73, 82, 83, 84, 71, 81 y CP6108.14,15
La membrana Biodyne C fue activada usando 16% (p/v) de EDAC [1-ethyl-3-(3-dimethylaminopropyl) carbodiimide; Sigma, St. Louis, Mo.] y posteriormente ubicada en el sistema miniblotter (MN 45; Immunetics), donde se depositaron en líneas paralelas las 37 oligosondas. Para llevar a cabo la hibridación, los productos obtenidos en la PCR GP5+/Bio-GP6+ fueron denaturados a 99°C. La hibridación se realizó a 42°C durante 1 hora, se incubó con el conjugado estreptividina peroxidasa (Roche, Bogotá, Colombia) por 45 minutos a 42°C, se lavó en SSPE 2x, SDS 0,5% y se incubó con ECLTM líquido (GE Healthcare UK, AmershamTM) para la posterior detección y revelado mediante autoradiografía. El revelado se llevó a cabo en el equipo Medical Film Procesador modelo SRX-100 A Konica Minolta Medical y Graphic, Inc. Como control positivo de RLB se utilizaron plásmidos de VPH 16 y 18. Una muestra se consideró positiva para un tipo determinado de VPH, cuando se observó en la película, un punto de hibridación definido (Spot) entre las sondas para cada tipo viral y el producto de PCR y una muestra se consideró positiva para una infección múltiple por VPH, cuando se observó en la película dos o más puntos de hibridación.
Análisis de Resultados. Se construyó una base de datos en el programa Microsoft Excel® edición 2010, con la información de cada una de las pacientes incluidas en el estudio. Los datos registrados fueron recolectados a partir de la anamnesis, formatos de resultados de citología, amplificación del gen de ß-Globina y tipificación de VPH mediante RLB.
La unidad de análisis la constituyó cada una de las mujeres ingresadas al estudio, con la información sobre: edad, datos clínicos, gineco-obstétricos y los resultados de tipificación de VPH. Se realizó un análisis descriptivo, univariado.
Para determinar la asociación entre la presencia de VPH y las variables del estudio, se realizó un análisis bivariado con el estadístico Chi – cuadrado (X2) en el programa SPSS 15.0 para Windows, con un nivel de confianza del 95%.
RESULTADOS
Población de estudio. De las 160 muestras de cepillados cervicales colectadas, 4 muestras tuvieron que ser excluidas por presentar un resultado de citología con anormalidad en las células epiteliales y 11 más, debido a que no revelaron una banda clara y bien definida en la PCR para el gen control de ß-globina, quedando un total de 145 muestras de mujeres con citología normal para los análisis de tipificación de VPH mediante RLB.
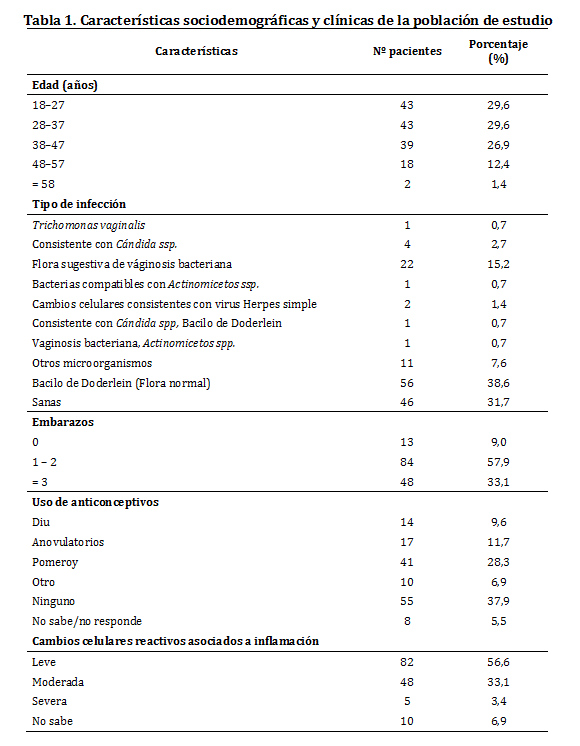
Las características sociodemográficas y clínicas de la población de estudio se describen en la tabla 1.
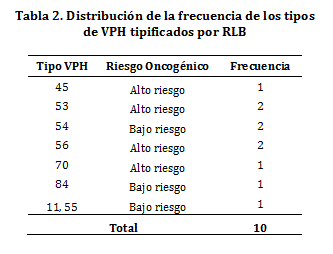
Detección y tipificación de VPH. La prevalencia de la infección por VPH en mujeres con citología normal fue de 6,9% (10/145). En el análisis de PCR GP5+/BioGP6+ y posterior RLB, se identificaron 8 genotipos diferentes: VPH 11, 45, 53, 54, 55, 56, 70 y 84. De los tipos virales encontrados, los tipos de VPH de bajo riesgo representaron el 45,4% (4/10) de las muestras positivas y los tipos virales de alto riesgo representaron el 54,6% (6/10). Entre las mujeres tipificadas como VPH positivas, se evidenció un caso de infección múltiple con los tipos virales 11 y 55. En la tabla 2 se presenta la frecuencia de los tipos de VPH detectados y su potencial oncogénico.
Asociación entre algunas variables poblacionales y la infección por VPH. A partir del análisis bivariado realizado con la información poblacional y los resultados de la detección molecular de VPH, se determinó que no hay interacciones estadísticamente significativas entre la presencia de VPH y variables como la edad, infección por otros microorganismos, el número de embarazos, uso de anticonceptivos y cambios celulares reactivos asociados a inflamación (p-valor > 0,05), ver tabla 3.
En el grupo de mujeres con citología normal para CCU, en quienes se detectó algún tipo de VPH las características que se observaron fueron: Con respecto a la edad, 9 casos ocurrieron en las mujeres de 18 - 37 años y un caso ocurrió en el grupo de mujeres de 48 - 57 años. Respecto a la infección por otros microorganismos, en una paciente VPH positiva se encontró coinfección con flora sugestiva de vaginosis bacteriana, en otra paciente se encontró coinfección con otro microorganismo que no fue posible identificarlo morfológicamente en la citología y en 4 pacientes VPH positivas se identificó la presencia del bacilo de Doderlein.
La asociación entre la infección por VPH y las características clínicas de las mujeres, se muestra en la tabla 3.
DISCUSIÓN
A nivel mundial se han realizado una gran variedad de estudios relacionados con el rol de la infección por el VPH en el CCU; a nivel local la información con respecto a la infección viral en las mujeres del municipio de Pasto aun es escasa, siendo esta investigación el primer estudio que ha permitido conocer en forma preliminar la frecuencia de la infección por VPH en mujeres de la región con citología normal y la asociación de la infección con algunas variables clínicas y poblacionales.
En la tipificación molecular, el porcentaje de muestras positivas para VPH en mujeres con citología normal fue de 6,9%, cifra menor a las reportadas para otras poblaciones de Colombia, con una prevalencia de 18,2% y de 21,6%.16,17
Respecto a la frecuencia, los tipos de VPH 11, 45, 53, 54, 55, 56, 70 y 84, no presentaron diferencias significativas entre sí.
Algunos de los tipos virales encontrados, han sido reportados en estudios realizados en diferentes regiones de Colombia, la frecuencia de cada tipo viral ha sido variable, es el caso de dos estudios realizados en Bogotá - Colombia en donde los tipos de VPH más frecuentes en un estudio fueron 16, 58, 31 y 18 y en el otro VPH 56, 58 y 81.18,19 En otro estudio realizado en Barranquilla - Colombia los tipos virales más prevalentes fueron VPH 16, 18, 45 y 58, información que se debe tener en cuenta, para el potencial desarrollo de vacunas.20-22
Las variaciones en la frecuencia de los tipos de VPH detectados entre diferentes regiones geográficas pueden explicarse por una parte, al comportamiento endémico del VPH en poblaciones específicas y por otra, pueden estar relacionadas con los hábitos comportamentales de cada población, su exposición a los factores de riesgo y las condiciones genéticas de los hospederos.23 También se debe tener cuenta algunas consideraciones metodológicas como la técnica de detección y tipificación molecular empleada y/o el número de pacientes incluidos en cada estudio.
Respecto al riesgo oncogénico de los tipos de VPH detectados, el porcentaje de infección con los tipos virales de alto riesgo fue superior al de los tipos de bajo riesgo (55% vs 45%). De los tipos de VPH de bajo riesgo, VPH 11 es uno de los más documentados, ya que ha sido detectado en el 90% de las verrugas genitales o condilomas, consideradas como la enfermedad de trasmisión sexual viral más propagada en el mundo.24,25 De los tipos de VPH de alto riesgo, se destaca la importancia de VPH 56 reportado como uno de los más frecuentes tanto en mujeres colombianas con citología negativa y mujeres con lesión intraepitelial de alto grado (LEIAG); el VPH 45 es uno de los principales agentes etiológicos del CCU en mujeres jóvenes, filogenéticamente relacionado con VPH 18 y a su vez asociado con el desarrollo de adenocarcinomas.26,27
Es importante mencionar que, la detección temprana de los tipos de VPH de alto riesgo es de gran utilidad para la prevención de CCU, no solo en la región de estudio, sino en otras regiones donde la distribución del virus y las características poblacionales tienen comportamientos similares, más aún si se tiene en cuenta que, las mujeres que presentan infecciones con VPH de alto riesgo, tienen aproximadamente 100 veces más probabilidades de desarrollar CCU en comparación con mujeres no infectadas.28
El porcentaje de infecciones múltiples -varios tipos de VPH- encontrado 1/10 (10%) fue similar al obtenido en un estudio realizado por Segovia y Mendoza (2009) en el cual observaron 1/14 (7%) muestras positivas para infección por más de un tipo viral y difiere de otros estudios en los que se ha documentado porcentajes más altos, como el de García y cols, que reportó 29,5% (23/79) de infecciones múltiples.29,30 Las variaciones encontradas en la frecuencia de éste tipo de infecciones por VPH puede ser consecuencia de la sensibilidad y especificidad de las técnicas de detección y tipificación viral; la prevalencia de los tipos virales circulantes en una población; factores de riesgo involucrados en la transmisión y persistencia de la infección por VPH propios de cada población.31-33 Es decir, la presencia de infecciones múltiples se explica por la presencia de varios tipos de VPH que comparten la misma vía de trasmisión simultáneamente, o, la infección por un tipo viral facilita la adquisición de otro. Sobre éstas teorías, aún no existe claridad respecto al mecanismo biológico involucrado en la presencia de estas infecciones múltiples.34
Las implicaciones clínicas de la infección por más de un tipo viral tampoco están bien definidas, algunos estudios sugieren que las mujeres que presentan infecciones múltiples por VPH, tienen mayor riesgo de desarrollar lesiones escamosas intraepiteliales que se explican por los patrones de susceptibilidad del hospedero y reflejan una mayor tolerancia inmunológica a la infección por VPH, a la interacción entre los virus o a la probabilidad de progresión independiente de cada tipo viral.35,36
Algunos estudios sobre evolución del virus consideran que, en la infección por más de un tipo de VPH debe existir una competencia mediada por la selección de ciertos genotipos y la regulación de la carga viral; selección basada en la adaptación al ambiente o la habilidad de producir progenie. Por ésta razón se cree que, si dos o más genotipos de VPH están presentes es posible que uno de los tipos virales prevalezca más que los otros, en especial los tipos de alto riesgo oncogénico y por tanto los tipos virales que se encuentren con un menor número de copias no puedan ser detectados, existiendo variaciones en los reportes correspondientes con la prevalencia de las infecciones múltiples a nivel mundial.37
En el presente estudio, la detección de VPH en pacientes con resultado de citología negativo, al igual que en otros estudios puede atribuirse a infecciones subclínicas, cuando ocurre la incubación del virus y sin desarrollo de cambios morfológicos relacionados con el tipo viral adquirido.38-40 Las mujeres que presentan infecciones asintomáticas constituyen importantes reservorios del virus por periodos variables de tiempo y pueden transmitirlo, aun sin saberlo a otros individuos.41
Desde el punto de vista biológico, un resultado de citología, donde hay ausencia de cambios morfológicos se puede atribuir a que el VPH se encuentra en fase latente, es decir, no hay replicación viral, un número de copias virales reducido (30-50 copias por célula infectada), el virus se encuentra en forma extracromosomal y se distribuye en grandes zonas del epitelio sin que ocurran manifestaciones clínicas, ni histológicas y la respuesta inmune es pobre o nula.42 Por otra parte, también puede estar relacionada con algunas limitaciones de la citología; en un reciente meta-análisis se demostró que la sensibilidad promedio de la citología cervicouterina para detectar una neoplasia intraepitelial cervical NIC o CCU es de 51% y su especificidad promedio de 98%.43 Los resultados falsos negativos de la citología son atribuibles a errores en la interpretación de los frotis, una inadecuada toma de muestra o preparación de la misma; el empleo de métodos moleculares permite incrementar la sensibilidad de la detección y en particular, en el presente estudio, la técnica empleada RLB ha sido reportada como un método con una alta sensibilidad y reproducibilidad.44-46
Es así como para realizar un mejor análisis de los cambios morfológicos de las lesiones preinvasoras, infecciones subclínicas y el estudio del potencial oncogénico de los tipos de VPH en la población, es recomendable utilizar técnicas de biología molecular para la detección y tipificación de VPH junto con las clásicas de exploración ginecológica.
Las variables incluidas en el estudio, no constituyeron factores determinantes para explicar o predecir la infección por VPH. No obstante, varios estudios han mostrado que una vez adquirida la infección por VPH, factores como la edad, la coinfección con otros microorganismos, el número de embarazos, el uso de anticonceptivos y la inflamación, pueden incrementar el riesgo de desarrollar LIEAG y CCU.47-49
En cuanto a la edad, en el presente estudio la infección por VPH en mujeres jóvenes del rango de 28-37 años, se puede explicar por el mecanismo de contagio, la tendencia a tener mayor número de compañeros sexuales sin protección, como también por los cambios activos en la zona de transición o transformación que son predominantes en etapas tempranas de la vida.50-52 En las mujeres de 38 a 47 años, no se detectó infección por VPH, posiblemente debido a una baja exposición al virus relacionado con un comportamiento sexual más estable o a la adquisición de inmunidad por infecciones previas.53,54
En países como Chile, Colombia, Costa Rica y México se ha observado un segundo pico en la infección por VPH en mujeres peri y postmenopausicas, sin embargo, la edad correspondiente a esta etapa puede variar para cada mujer, en Colombia se ha observado en mujeres mayores de 50 años.55-57 En el presente estudio la frecuencia de infecciones por VPH en el grupo de mujeres de 48 a 57 años fue del 10%. El ligero incremento de infecciones por VPH en mujeres alrededor de los 50 años, puede explicarse por la reactivación de infecciones por VPH latentes, a una mayor susceptibilidad a adquirir nuevas infecciones debida a la disminución de la respuesta inmune, también a los cambios hormonales relacionados con la disminución de la función ovárica generada en la menopausia y/o por la susceptibilidad que presenta el cuello uterino para que una infección por VPH alcance el tejido basal y persista y así el tejido escamocolumnar puede sufrir metaplasia durante la menarquía.58
En relación con la infección por otros microorganismos, se debe tener en cuenta que la frecuencia de las infecciones detectadas a través del estudio citológico podrían ser superiores a las reportadas, principalmente por la sensibilidad de la técnica utilizada en el estudio. La citología no detecta otras infecciones de trasmisión sexual que podrían presentar algún tipo de asociación con la infección por VPH, como por ejemplo el virus de inmunodeficiencia humana-VIH, Chlamydia trachomatis y la sífilis.59,60 En el presente estudio se obtuvo que 10% de las pacientes positivas para VPH presentaban coinfección con flora sugestiva de vaginosis bacteriana, Watts y cols reportaron la asociación entre la vaginosis bacteriana y la prevalencia e incidencia de la infección por VPH, pero no con la persistencia de la infección viral y progresión de las lesiones escamosas intraepiteliales.61
Las mujeres con vaginosis pueden ser más susceptibles a la adquisición de nuevas infecciones por VPH o su reactivación, debido a un aumento en la producción de sialidasas, cambios en la barrera mucosa cervical, disminución de la producción de H2O2 causada por una disminución de los lactobacilos y cambios en la producción de citosinas. Las mujeres que presentan infección por VPH pueden favorecer cambios en el ambiente vaginal que facilitan la infección por flora sugestiva de vaginosis bacteriana.62,63
En mujeres VPH positivas se identificó además, la presencia del bacilo de Doderlein, resultado considerado normal por ser parte de la microbiota habitual del tracto vaginal y su detección en el examen citológico es frecuente. En este estudio, no se cuenta con información correspondiente a la cantidad de bacilos de Doderlein presentes, que en caso de ser mayor a lo establecido en los rangos normales, se podría correlacionar con la respuesta inmune del hospedero frente a la infección por agentes extraños como el VPH, más si se tiene en cuenta que uno de los mecanismos de defensa naturales contra agresiones externas existentes en el cérvix es el mantenimiento del equilibrio de la microbiota normal, proceso en el cual está involucrado el bacilo de Doderlein.64
En relación con la paridad, existen estudios con resultados similares, en los que no se ha encontrado una asociación estadísticamente significativa, entre el número de embarazos y la infección por VPH, sugiriendo la posibilidad de que la asociación observada entre la infección por VPH y la multiparidad sea consecuencia del azar y no refleje eventos biológicos.65 Las razones fisiológicas que expliquen la asociación entre la paridad elevada, la infección por VPH y la progresión a lesiones pre-neoplásicas y neoplásicas, aún no están claras, algunos investigadores indican que no es el número de partos el responsable de incrementar el riesgo de aparición de neoplasias intraepiteliales, sino más bien, los cambios nutricionales-hormonales, depresión de la respuesta inmune y la presencia de microtraumas que ocurren durante el embarazo.66,67
Los cambios hormonales inducidos por el embarazo involucran un incremento de los niveles de estrógenos y progesterona y pueden modular la respuesta inmune al VPH e incrementan el riesgo de persistencia o progresión de la infección.68,69 Se ha comprobado que durante la gestación ocurre una disminución de los niveles de folatos en la sangre los cuales junto con la vitamina B6, la vitamina B12 y la metionina se han asociado con los procesos de metilación del ADN; en estudios in vitro estos eventos se han relacionado con la perdida de la transcripción viral en los procesos de carcinogénesis.70
Otro aspecto importante en relación con la infección por VPH en mujeres con al menos un embarazo, son aquellas mujeres menores de 16 años y embarazadas, en quienes el riesgo de adquirir una infección viral es mayor, debido a que tanto la adolescencia como el embarazo son algunas de las etapas en las que se encuentra más activa la fase de transición en el epitelio, haciéndolo más vulnerable a las lesiones. En mujeres adultas en cambio, la probabilidad de traumas en la zona de transformación en el periodo postparto no es frecuente y la influencia de la multiparidad es cuestionable.71
En la población de estudio, ninguna mujer usa anticonceptivos orales y es VPH positiva; los reportes de literatura señalan que, el uso de anticonceptivos orales como un importante cofactor para el desarrollo de CCU en mujeres VPH positivas, más no con la adquisición de la infección viral.72 De acuerdo con los resultados obtenidos en estudios multicéntricos, el uso de anticonceptivos orales por menos de cuatro años no presenta relación con el desarrollo de CCU en mujeres VPH positivas, pero, un uso prolongado por más de cinco años incrementa cuatro veces el riesgo de progresión a cáncer invasivo.73 En la presente investigación no se cuenta con información correspondiente al tiempo de consumo de los anticonceptivos orales y por lo tanto, no fue posible realizar un análisis más profundo de su asociación con la infección por VPH.
En la presente investigación, no se encontró una relación de dependencia estadísticamente significativa entre la gravedad de la inflamación y la detección de VPH, sugiriendo que tal alteración no permite predecir infecciones por VPH, no obstante es de gran relevancia que todas las mujeres VPH positivas hayan presentado algún grado de inflamación; en estudios previos se ha reportado que las mujeres con inflamaciones cervicales y VPH positivas tienen una tendencia significativamente positiva de presentar infecciones persistentes y tienen dos veces más riesgo de progresar a LIEAG.74
La relación entre las lesiones intraepiteliales y la presencia de inflamaciones puede atribuirse a la inflamación que puede actuar como un factor de riesgo que favorece las condiciones para que la infección por VPH progrese a lesiones malignas y contribuir al incremento de especies reactivas de oxígeno y a una consecuente disminución de la respuesta inmune.75
En conclusión, la presente investigación confirma la presencia de VPH de alto y bajo riesgo oncogénico, en mujeres del municipio de Pasto con resultados de citología normal, lo cual sugiere la necesidad de implementar métodos de diagnóstico y detección molecular en la población, que complementen los programas convencionales de tamizaje del CCU y en conjunto garanticen una detección temprana y eficiente de la infección por VPH. Además, aunque los datos obtenidos en nuestro estudio son preliminares, constituyen un marco de referencia para el conocimiento del rol del VPH a nivel local y para estudios futuros.
Agradecimientos
A Pasto Salud E.S.E por su apoyo en la toma de muestra e inclusión de pacientes. A los Doctores Fabio Aristizabal y Adriana García de la Universidad Nacional de Colombia, por sus importantes aportes en la metodología de tipificación molecular.
REFERENCIAS
1. García A, Schmitt M, Arregui A, Castillo M, Briceño I, Aristizábal F. Genotipificación del Virus del Papiloma Humano (VPH) en muestras de cepillados cervicales de pacientes de diferentes hospitales de Bogotá y evaluación de la concordancia de dos métodos basados en PCR. Rev Colomb Obstet Ginecol. 2010;61(4):310-318. [ Links ]
2. Two N, Yen M, Lau H, Chen Y, Yu B, Lin C. Type-specific human papillomavirus DNA testing with the genotyping array: a comparison of cervical and vaginal sampling. Eur J Obstet Gyn R B. 2011;156(1):96-100. [ Links ]
3. Zur Hausen H. Papillomaviruses in the causation of human cancers - a brief historical account. J Clin Virol. 2009;384(2):260-265. [ Links ]
4. Pardo C, Cendales R. Incidencia estimada y mortalidad por cáncer en Colombia, 2002 – 2006. Bogotá: INC; 2010. [ Links ]
5. Yépez M, Bravo L, Hidalgo A, Jurado D, Bravo L. Incidencia y Mortalidad por Cáncer, Municipio de Pasto 2003-2007. Pasto: Editorial Universitaria - Universidad de Nariño; 2012. [ Links ]
6. Molijn A, Kleter B, Quint W, Doorn L. Molecular diagnosis of human papillomavirus (HPV) infections, Review. J Clin Virol. 2005; 32 Supl 1:43-51. [ Links ]
7. Hoory T, Monie A, Gravit P. Molecular Epidemiology of Human Papillomavirus. J Formos Med Assoc. 2008;107(3):198-217. [ Links ]
8. Molijn A, Kleter B, Quint W, Doorn L. Molecular diagnosis of human papillomavirus (HPV) infections, Review. J Clin Virol. 2005; 32 Supl 1:43-51. [ Links ]
9. Melo A, Roa I, Montenegro S, Capurro I, Roa J. Estudio comparativo de detección del virus papiloma humano (VPH) en muestras citológicas y biopsias de cuello uterino. Rev Méd Chil. 2005;133(6):639-644. [ Links ]
10. Geraets D, Heideman D, Koning M, Snijders P, Meijer C, Van Doorn L, y cols. High genotyping concordance between the digene HPV Genotyping RH Test and the Reverse Line Blot genotyping assay on GP5+/6+-PCR products. J Clin Virol. 2009;46 Supl 3:16-20. [ Links ]
11. Castellsagué X. Natural history and epidemiology of HPV and cervical cancer. J Gynecol Oncol. 2008;110(3):4-7. [ Links ]
12. Solomon D, Davey D, Kurman R, Moriaty A, OConnor D, Prey M. The Bethesda System. Terminology for reporting results of cervical cytology. JAMA. 2002;267(16):2114-19. [ Links ]
13. Van den Brule A, Pol R, Fransen N, Schouls L, Meijer C, Snijders P. GP5+/6+ PCR followed by Reverse Line Blot Analysis Enables Rapid and High-Throughput Identification of Human Papillomavirus Genotypes. J Clin Microbiol. 2002;40(3):779-787. [ Links ]
14. Ibíd. [ Links ]
15. García A, Briceño I, Castillo M, Aristizábal F. Detection of gene amplification in MYCN, C-MYC, MYCL1, ERBB2, EGFR, AKT2, and human papilloma virus in samples from cervical smear normal cytology, intraepithelial cervical neoplasia (CIN I, II, III) and cervical cancer. Colomb Med. 2011;42(2):144-53. [ Links ]
16. Molano M, Posso H, Weiderpass E, Van den Brule AJC, Ronderos M, Franceschi S, y cols. Prevalence and determinants of HPV infection among Colombian women with normal cytology. Br J Cancer. 2002;87(3):324-333. [ Links ]
17. Farfán Y, García A, Arias Y, Morales O, Isaza M, Aristizábal F. Genotipificación del virus de papiloma humano en mujeres con hallazgo citológico de lesión escamosa intraepitelial de bajo grado (LSIL) o de significado indeterminado (ASC-US) en Bogotá, Colombia. Rev Colomb Cienc Quím Farm. 2010;39(1):42-54. [ Links ]
18. García A, Briceño I, Castillo M, Aristizábal F. Detection of gene amplification in MYCN, C-MYC, MYCL1, ERBB2, EGFR, AKT2, and human papilloma virus in samples from cervical smear normal cytology, intraepithelial cervical neoplasia (CIN I, II, III) and cervical cancer. Colomb Med. 2011;42(2):144-53. [ Links ]
19. Muñoz N, Méndez F, Posso H, Molano M, Van den Brule A, Ronderos M, y cols. Incidence, Duration, and Determinants of Cervical Human Papillomavirus Infection in a Cohort of Colombian Women with Normal Cytological Results. J Infect Dis. 2004; 190(2): 2077-87. [ Links ]
20. Ibíd. [ Links ]
21. Arias Y, Carrillo E, Aristizabal F. Human papillomavirus (HPV) detected in restored plasma DNA from women diagnosed with pre-invasive lesions and invasive cervical cancer. Colomb Med. 2010;41(2):148-54. [ Links ]
22. Murillo R, Molano M, Martínez G, Mejía J, Gamboa O. HPV prevalence in Colombian women with cervical cancer: Implications for vaccination in a developing country. Infect Dis Obstet Gynecol. 2009: 137-148. [ Links ]
23. Orozco A, Carrillo A, Méndez A, Ponde S, Mohar A, Maldonado R, y cols. Geographical variation in human papillomavirus prevalence in Mexican woman with normal cytology. Int J Infect Dis. 2010;14(12):1082-1087. [ Links ]
24. Castellsagué X, Muñoz N. Cofactors in human papillomavirus carcinogenesis – Role of parity, oral contraceptives, and tobacco smoking. J Natl Cancer Inst Monogr. 2003; 31: 20-28. [ Links ]
25. Segovia E, Mendoza L. Tipificación del virus del papiloma humano en muestras cervicales de 15 mujeres atendidas en el Instituto Nacional del Cáncer, Año 2007. Mem Inst Investig Cienc Salud. 2009;5(1):46-53 [ Links ]
26. Arias Y, Carrillo E, Aristizabal F. Human papillomavirus (HPV) detected in restored plasma DNA from women diagnosed with pre-invasive lesions and invasive cervical cancer. Colomb Med. 2010;41(2):148-54. [ Links ]
27. Murillo R, Molano M, Martínez G, Mejía J, Gamboa O. HPV prevalence in Colombian women with cervical cancer: Implications for vaccination in a developing country. Infect Dis Obstet Gynecol. 2009: 137-148. [ Links ]
28. Molano M, Posso H, Weiderpass E, Van den Brule AJC, Ronderos M, Franceschi S, y cols. Prevalence and determinants of HPV infection among Colombian women with normal cytology. Br J Cancer. 2002;87(3):324-333. [ Links ]
29. García A, Briceño I, Castillo M, Aristizábal F. Detection of gene amplification in MYCN, C-MYC, MYCL1, ERBB2, EGFR, AKT2, and human papilloma virus in samples from cervical smear normal cytology, intraepithelial cervical neoplasia (CIN I, II, III) and cervical cancer. Colomb Med. 2011;42(2):144-53. [ Links ]
30. Segovia E, Mendoza L. Tipificación del virus del papiloma humano en muestras cervicales de 15 mujeres atendidas en el Instituto Nacional del Cáncer, Año 2007. Mem Inst Investig Cienc Salud. 2009;5(1):46-53. [ Links ]
31. García A, Schmitt M, Arregui A, Castillo M, Briceño I, Aristizábal F. Genotipificación del Virus del Papiloma Humano (VPH) en muestras de cepillados cervicales de pacientes de diferentes hospitales de Bogotá y evaluación de la concordancia de dos métodos basados en PCR. Rev Colomb Obstet Ginecol. 2010;61(4):310-318. [ Links ]
32. Molano M, Posso H, Weiderpass E, Van den Brule AJC, Ronderos M, Franceschi S, y cols. Prevalence and determinants of HPV infection among Colombian women with normal cytology. Br J Cancer. 2002;87(3):324-333. [ Links ]
33. Murillo R, Molano M, Martínez G, Mejía J, Gamboa O. HPV prevalence in Colombian women with cervical cancer: Implications for vaccination in a developing country. Infect Dis Obstet Gynecol. 2009: 137-148. [ Links ]
34. Segovia E, Mendoza L. Tipificación del virus del papiloma humano en muestras cervicales de 15 mujeres atendidas en el Instituto Nacional del Cáncer, Año 2007. Mem Inst Investig Cienc Salud. 2009;5(1):46-53. [ Links ]
35. Murillo R, Molano M, Martínez G, Mejía J, Gamboa O. HPV prevalence in Colombian women with cervical cancer: Implications for vaccination in a developing country. Infect Dis Obstet Gynecol. 2009: 137-148. [ Links ]
36. López J, Aristizábal F. Integración viral y cáncer de cuello uterino. Rev Col Cienc Quím Farm. 2006;35(1):5-32. [ Links ]
37. Mas A, López C, Cacho I, Gómez J, Martinez M. Unfinished stories on viral quasispecies and Darwinian views of evolution. J Mol Biol. 2010;397(4):865-877. [ Links ]
38. Castellsagué X. Natural history and epidemiology of HPV and cervical cancer. J Gynecol Oncol. 2008;110(3):4-7. [ Links ]
39. López J, Aristizábal F. Integración viral y cáncer de cuello uterino. Rev Col Cienc Quím Farm. 2006;35(1):5-32. [ Links ]
40. Reigosa A, Alvarez M, De Vasconcelo M, Cristina R, Salas W, Rebolledo V, y cols. Diagnóstico del Virus Papiloma Humano en cuello uterino de mujeres que acuden a su consulta anual citológica. Revista de la Facultad de Ciencias de la Salud, Universidad de Carabobo. 2004;8(1):26-31. [ Links ]
41. Alonso P, Lazcano E, Hernández M. Cáncer cervicouterino: Diagnóstico, prevención y control. 2da ed. México: Editorial Médica Panamericana; 2005. [ Links ]
42. Doorbar J. The papillomavirus life cycle, Review. J Clin Virol. 2005 Suppl 1; 32: 7-15. [ Links ]
43. Alonso P, Lazcano E, Hernández M. Cáncer cervicouterino: Diagnóstico, prevención y control. 2da ed. México: Editorial Médica Panamericana; 2005. [ Links ]
44. Hoory T, Monie A, Gravit P. Molecular Epidemiology of Human Papillomavirus. J Formos Med Assoc. 2008;107(3):198-217. [ Links ]
45. García A, Schmitt M, Arregui A, Castillo M, Briceño I, Aristizábal F. Genotipificación del Virus del Papiloma Humano (VPH) en muestras de cepillados cervicales de pacientes de diferentes hospitales de Bogotá y evaluación de la concordancia de dos métodos basados en PCR. Rev Colomb Obstet Ginecol. 2010;61(4):310-318. [ Links ]
46. Geraets D, Heideman D, Koning M, Snijders P, Meijer C, Van Doorn L, y cols. High genotyping concordance between the digene HPV Genotyping RH Test and the Reverse Line Blot genotyping assay on GP5+/6+-PCR products. J Clin Virol. 2009;46 Supl 3:16-20. [ Links ]
47. García A, Schmitt M, Arregui A, Castillo M, Briceño I, Aristizábal F. Genotipificación del Virus del Papiloma Humano (VPH) en muestras de cepillados cervicales de pacientes de diferentes hospitales de Bogotá y evaluación de la concordancia de dos métodos basados en PCR. Rev Colomb Obstet Ginecol. 2010;61(4):310-318. [ Links ]
48. Castellsagué X. Natural history and epidemiology of HPV and cervical cancer. J Gynecol Oncol. 2008;110(3):4-7. [ Links ]
49. Segovia E, Mendoza L. Tipificación del virus del papiloma humano en muestras cervicales de 15 mujeres atendidas en el Instituto Nacional del Cáncer, Año 2007. Mem Inst Investig Cienc Salud. 2009;5(1):46-53. [ Links ]
50. Sánchez Y, Barrios M, Acosta R, Polo H. Relación citohistológica en mujeres con diagnóstico de papiloma virus humano. Archivo médico de Camaguey. 2008;12(6):1-8. [ Links ]
51. León G, Bosques O. Infección por el virus del papiloma humano y factores relacionados con la actividad sexual en la génesis del cáncer de cuello uterino. Rev Cubana Obstet Ginecol. 2005;31(1):1-8. [ Links ]
52. Sideri M, Igidbashian S, Boveri S, Radice D, Casadio C, Spolti N, y cols. Age distribution of HPV genotypes in cervical intraepitelial neoplasia. J Gynecol Oncol. 2011; 121(3):510-513. [ Links ]
53. Muñoz N, Méndez F, Posso H, Molano M, Van den Brule A, Ronderos M, y cols. Incidence, Duration, and Determinants of Cervical Human Papillomavirus Infection in a Cohort of Colombian Women with Normal Cytological Results. J Infect Dis. 2004; 190(2): 2077-87. [ Links ]
54. Reigosa A, Alvarez M, De Vasconcelo M, Cristina R, Salas W, Rebolledo V, y cols. Diagnóstico del Virus Papiloma Humano en cuello uterino de mujeres que acuden a su consulta anual citológica. Revista de la Facultad de Ciencias de la Salud, Universidad de Carabobo. 2004;8(1):26-31. [ Links ]
55. Murillo R, Molano M, Martínez G, Mejía J, Gamboa O. HPV prevalence in Colombian women with cervical cancer: Implications for vaccination in a developing country. Infect Dis Obstet Gynecol. 2009: 137-148. [ Links ]
56. Muñoz N, Méndez F, Posso H, Molano M, Van den Brule A, Ronderos M, y cols. Incidence, Duration, and Determinants of Cervical Human Papillomavirus Infection in a Cohort of Colombian Women with Normal Cytological Results. J Infect Dis. 2004; 190(2): 2077-87. [ Links ]
57. Alonso P, Lazcano E, Hernández M. Cáncer cervicouterino: Diagnóstico, prevención y control. 2da ed. México: Editorial Médica Panamericana; 2005. [ Links ]
58. Muñoz N, Méndez F, Posso H, Molano M, Van den Brule A, Ronderos M, y cols. Incidence, Duration, and Determinants of Cervical Human Papillomavirus Infection in a Cohort of Colombian Women with Normal Cytological Results. J Infect Dis. 2004; 190(2): 2077-87. [ Links ]
59. Alonso P, Lazcano E, Hernández M. Cáncer cervicouterino: Diagnóstico, prevención y control. 2da ed. México: Editorial Médica Panamericana; 2005. [ Links ]
60. Watts H, Fazarri M, Minkoff H, Hillier S, Sha B, Glesby M, y cols. Effects of bacterial vaginosis and other genital infections on the natural history of human papillomavirus infection in HIV-1-infected and high-risk HIV-1-uninfected woman. J Infect Dis. 2005;191(7):1129-39. [ Links ]
61. Ibíd. [ Links ]
62. León G, Bosques O. Infección por el virus del papiloma humano y factores relacionados con la actividad sexual en la génesis del cáncer de cuello uterino. Rev Cubana Obstet Ginecol. 2005;31(1):1-8. [ Links ]
63. Watts H, Fazarri M, Minkoff H, Hillier S, Sha B, Glesby M, y cols. Effects of bacterial vaginosis and other genital infections on the natural history of human papillomavirus infection in HIV-1-infected and high-risk HIV-1-uninfected woman. J Infect Dis. 2005;191(7):1129-39. [ Links ]
64. Sánchez Y, Barrios M, Acosta R, Polo H. Relación citohistológica en mujeres con diagnóstico de papiloma virus humano. Archivo médico de Camaguey. 2008;12(6):1-8. [ Links ]
65. Muñoz N, Méndez F, Posso H, Molano M, Van den Brule A, Ronderos M, y cols. Incidence, Duration, and Determinants of Cervical Human Papillomavirus Infection in a Cohort of Colombian Women with Normal Cytological Results. J Infect Dis. 2004; 190(2): 2077-87. [ Links ]
66. Reigosa A, Alvarez M, De Vasconcelo M, Cristina R, Salas W, Rebolledo V, y cols. Diagnóstico del Virus Papiloma Humano en cuello uterino de mujeres que acuden a su consulta anual citológica. Revista de la Facultad de Ciencias de la Salud, Universidad de Carabobo. 2004;8(1):26-31. [ Links ]
67. Castellsagué X, Muñoz N. Cofactors in human papillomavirus carcinogenesis – Role of parity, oral contraceptives, and tobacco smoking. J Natl Cancer Inst Monogr. 2003; 31: 20-28. [ Links ]
68. Reigosa A, Alvarez M, De Vasconcelo M, Cristina R, Salas W, Rebolledo V, y cols. Diagnóstico del Virus Papiloma Humano en cuello uterino de mujeres que acuden a su consulta anual citológica. Revista de la Facultad de Ciencias de la Salud, Universidad de Carabobo. 2004;8(1):26-31. [ Links ]
69. Castellsagué X, Muñoz N. Cofactors in human papillomavirus carcinogenesis – Role of parity, oral contraceptives, and tobacco smoking. J Natl Cancer Inst Monogr. 2003; 31: 20-28. [ Links ]
70. Sarduy M. Neoplasia intraepitelial cervical. Preámbulo del cáncer cérvicouterino. Rev Cubana Obstet Ginecol. 2008;34(2):1-9. [ Links ]
71. León G, Bosques O. Infección por el virus del papiloma humano y factores relacionados con la actividad sexual en la génesis del cáncer de cuello uterino. Rev Cubana Obstet Ginecol. 2005;31(1):1-8. [ Links ]
72. Moreno V, Bosch X, Muñoz N, Meijer C, Shah K, Walboomers J, y cols. Effect of oral contraceptives on risk of cervical cancer in women with human papillomavirus infection: the IARC multicentric case-control study. The Lancet. 2002;359:1085-192. [ Links ]
73. Castellsagué X, Muñoz N. Cofactors in human papillomavirus carcinogenesis – Role of parity, oral contraceptives, and tobacco smoking. J Natl Cancer Inst Monogr. 2003; 31: 20-28. [ Links ]
74. Castle P, Hillier S, Rabe L, Hildesheim A, Herrero R, Bratti M, y cols. An association of cervical inflammation with High-Grade Cervical neoplasia in women infected with oncogenic human papillomavirus (VPH). Cancer Epidemiol Biomarkers Prev. 2001;10(10):1021-1027. [ Links ]
75. Castle P, Giuliano A. Genital tract infections, cervical inflammation, y antioxidant nutrients – Assessing their roles as human papillomavirus cofactors. J Natl Cancer Inst Monogr. 2003;31:29-34. [ Links ]