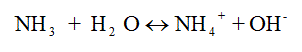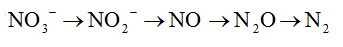Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Universidad y Salud
Print version ISSN 0124-7107On-line version ISSN 2389-7066
Univ. Salud vol.15 no.1 Pasto Jan./June 2013
Nitrógeno en aguas residuales: orígenes, efectos y mecanismos de remoción para preservar el ambiente y la salud pública
Nitrogen in wastewater: origins, effects and removal mechanisms to preserve the environment and public health
Gloria Lucia Cárdenas Calvachi1, Iván Andrés Sánchez Ortiz2
1 Ingeniera Química. Candidata a Magister en Ingeniería Ambiental. Profesora Asistente Departamento de Ingeniería Ambiental, Facultad de Ingeniería, Universidad Mariana, Pasto, Colombia. e-mail: glucardenas@gmail.com.co
2 Ingeniero Civil. M.Sc. en Ingeniería Ambiental y Recursos Hídricos. Profesor Asistente Departamento de Recursos Hidrobiológicos, Facultad de Ciencias Pecuarias, Universidad de Nariño. e-mail: iaso@udenar.edu.co
Fecha de recepción: Octubre 6 - 2012 / Fecha de aceptación: Junio 7 - 2013
RESUMEN
El tratamiento de aguas residuales (AR), centrado tradicionalmente en la remoción de sólidos, patógenos y materia orgánica, ha puesto especial interés en la remoción de nutrientes, principalmente del nitrógeno debido a las consecuencias ambientales y sanitarias de su presencia en el recurso hídrico como aumento de la acidez, eutrofización y toxicidad de los ecosistemas acuáticos, que afectan sobrevivencia, crecimiento y capacidad reproductiva de algunos animales. Ciertas formas de nitrógeno en el agua establecen riesgos para el hombre por su ingesta o por contacto directo con compuestos como toxinas, liberadas por floraciones de cianobacterias en ambientes eutrofizados. La presente revisión, trata sobre los tipos de compuestos nitrogenados en el agua; sus orígenes e impactos sobre el recurso hídrico, algunas especies hidrobiológicas y la salud humana; describe brevemente las opciones tradicionales para transformación o remoción de compuestos nitrogenados en AR, enfatizando en las relativas a la eliminación biológica, pues pueden remover completamente el contaminante y no lo traslada hacia otros sistemas. La información presentada es de gran importancia para la selecciónde sistemas de tratamiento y remoción del nitrógeno de AR para reducir sus impactos sobre los cuerpos de agua y preservar la salud pública.
Palabras clave: Aguas residuales, contaminación, remoción, salud pública, tratamiento biológico.
ABSTRACT
The wastewater treatment, traditionally based on removal of solids, pathogens and organic matter, have focused specially on nutrient removal, mainly of nitrogen due to the environmental and sanitary consequences of its presence on water resources such increased acidity, eutrophication and toxicity of aquatic ecosystems, that affect the survival, growing and reproductive capacity of some animals. Certain forms of nitrogen on water establish risks for humans through its ingestion or direct contact with compounds as toxins released by cyanobacteria blooms on eutrophic environments. This review deals with the forms of nitrogen compounds on water; their origins and impacts on water resources, some hydro biological species and public health. It also briefly describes the conventional options for nitrogen compounds transformation or removal in wastewater. The biological elimination alternatives are emphasized because they can completely remove the contaminant and not transfer it to other systems. The presented information is important for the selection of wastewater treatment systems and nitrogen removal of wastewater in order to reduce their impacts on water bodies and preserve the public health.
Key words: Wastewater, contamination, removal, public health, biological treatment.
INTRODUCCIÓN
Las actividades antrópicas generan niveles cada vez mayores de contaminación del recurso hídrico. Los contaminantes que con mayor frecuencia se ha pretendido remover del agua son: los sólidos por su rápido efecto sobre la apariencia del líquido, la materia orgánica (MO) por el alto consumo de oxígeno necesario para su estabilización y los microorganismos por la posible transmisión de enfermedades por agentes patógenos. Sin embargo, no menos importantes que los anteriores, nutrientes como el nitrógeno (N) y el fósforo generan importantes impactos sobre los cuerpos de agua ya que pueden incidir en la estabilidad de los ecosistemas acuáticos, la eutrofización y la incorporación de niveles tóxicos que pueden afectar a las comunidades biológicas y a la salud humana, inclusive en muy bajas concentraciones.
Por tal razón, es fundamental la transformación y preferiblemente la eliminación del N del agua a sus formas menos tóxicas a través de la aplicación de las tecnologías encaminadas al mejoramiento de la calidad del agua, que involucran la acción de fuerzas físicas, procesos químicos, procesos biológicos o la combinación de ellos.
El tema adquiere relevancia porque pese a numerosos descubrimientos de la afectación negativa de los nutrientes sobre los cuerpos de agua, muchos sistemas de tratamiento de aguas residuales (AR)handejado en un segundo plano los procesos de disminución o eliminación de los compuestos nitrogenados y fosforados que muchas veces son vertidos a las fuentes de agua con escaso o nulo tratamiento, generando los impactos antes comentados.
Este artículo presenta un acercamiento inicial a la presencia de compuestos nitrogenados (CN) en AR y la importancia de su remoción para reducir los efectos negativos en el ambiente y la salud humana; posteriormente se describen aspectos fundamentales para los procesos de remoción de N, los factores que influyen en tales procesos y los avances más significativos en sus aplicaciones en el tratamiento de AR, temática que cobra utilidad en estudios, investigaciones o proyectos relacionados con la descontaminación y/o el reuso de AR y sirve como apoyo en la selección de la tecnología más apropiada para remoción o transformación de algunas de las formas de N en las aguas servidas.
1. Compuestos nitrogenados en el agua, orígenes y formas comunes
En el agua los nutrientes son sustancias esenciales para el metabolismo de todo organismo vivo ya que forman parte de él, son determinantes en el inicio de la cadena alimenticia acuática porque estimulan el crecimiento del fitoplancton y posteriormente el desarrollo de peces y crustáceos.1-3Sin embargo, cuando se presentan en exceso ocasionan problemas de contaminación acuática.4-6
Los CN cobran relevancia, no solo porque el N es un elemento esencial en las funciones metabólicas de los seres vivos, sino por su abundancia en aire, suelo y agua dada la compleja química del N, que puede tomar siete diferentes estados de oxidación (desde -3 a +5) y por tanto formar parte de una gran diversidad de compuestos, siendo los más comunes -3 para NH3 y NH4+, 0 para N2, +3para N2O3 y +5 para N2O5 y HNO3.7,8
En el agua,la presencia de CN se debe a causas naturales como la disolución atmosférica o de depósitos geológicos ricos en estos materiales, escorrentías superficiales y subterráneas, fijación de organismos procariotas y descomposición de MO; y a causas antropogénicasprovenientes de usos domésticos e industriales así como a la deposición atmosférica fruto de la contaminación del aire.9-13
En la naturaleza la transformación natural entre las distintas formas de N está regulada por un ciclo14 que abarca seis procesos:15
• Fijación del N• Reducción desasimilativa de nitrato a amonio
• Amonificación
• Oxidación anaerobia a amonio
• Nitrificación
• Desnitrificación
Sin embargo, el normal funcionamiento del ciclo del nitrógeno ha sido afectado por distintas actividades humanas como la utilización de combustibles fósiles y la fabricación de fertilizantes nitrogenados, suplementos alimenticios animales, adhesivos, tintas, cosméticos y papel, entre otros,16que han aumentado casi al doble la concentración de N fijado anualmente en la biósfera.17
Como resultado de la excreción de organismos acuáticos, el N puede encontrarse en compuestos como urea, amoniaco, aminoácidos, oxidoaminos, creatina, creatinina y ácido úrico; por fertilización se pueden encontrar urea, nitrato y sulfato de amonio, nitrato de sodio, potasio o calcio.La transformación de estos CN se hace naturalmente a través de procesos biológicos como la asimilación de las algas, la amonificación y la nitrificación. El amonio es asimilado e inmovilizado por algas, principalmente por cianobacterias; cuando ellas mueren, sus restos se descomponen en el fondo de cuerpos hídricos, trasladando el amonio a los sedimentos; a ello se le suma la amonificación del material celular nitrogenado que también pasa el amonio a los sedimentos, que se acumula bajo condiciones anóxicas y puede oxidarse a nitratos en ambientes oxigenados.18
Por lo anterior, en el agua, los CN inorgánicos más comunes son amonio, nitrito y nitrato; de ellos el principal es el amonio que se origina por la descomposición de materiales proteicos. Sin embargo, en algunos casos cuando la contaminación es producida por fertilizantes inorgánicos o por algún proceso industrial, pueden encontrarse cantidades significativas de nitritos y nitratos.19
El amonio total es la suma del amonio no ionizado o amoniaco (NH3)y el amonio ionizado (NH4+), que en solución acuosa establecen un equilibrio mediante la reacción:
Este equilibrio depende de la temperatura, el pH y la salinidad. Bajo condiciones normales de 25°C y un pH de 7, el amonio no ionizado representa el 0,6% del amonio total, mientras que a pH de 9,5 y una temperatura de 30°C este porcentaje puede subir a 72%.20
La forma no ionizada, es extremadamente tóxica debido a su capacidad de movilizarse a través de las membranas celulares, su concentración se incrementa cuando disminuye el OD, aumenta la temperatura y hasta 10 veces por cada grado de aumento en el pH del agua.21-23 El amonio está presente en el agua como resultado de la descomposición de MO de plantas y animales, diversas actividades industriales, la desaminación microbiana de las proteínas en un proceso denominado amonificación y por ser el principal producto de excreción de los organismos debido a la necesidad de una alimentación con alta concentración proteica.24
2. Problemas ambientales por compuestos nitrogenados en el agua
Las consecuencias de la presencia de CN en el agua son diversas y hacen que su posterior uso se vea restringido.Los CN presentes en AR no solo comprometen la calidad de líquido en la zona de vertimiento sino a toda su cuenca hidrográfica y la región estuarina donde vierte sus aguas.25
Los tres principales problemas ambientales generados por la presencia de compuestos de N en el sistema acuático son: el aumento de la acidez, el desarrollo de eutroficación y el aumento de las concentraciones hasta niveles tóxicos tanto en aguas superficiales como subterráneas que limitan su uso principalmente como fuentes de agua para consumo humano o en acuacultura, donde la acumulación de N orgánico suele impedir la operación exitosa de sistemas de reuso.26-30
3. Toxicidad de las formas de nitrógeno y efectos en la salud humana>
3.1 Toxicidad para especies acuáticas
Los CN pueden alcanzar en el agua niveles tóxicos que alteren la capacidad de los animales para sobrevivir, crecer y reproducirse, en algunos casos su presencia se debe a vertimiento directo de contaminantes o sustancias, aunque también puede darse por deposición atmosférica.31 Estos niveles pueden presentarse tanto en fuentes naturales muy contaminadas como ríos, lagos y embalses o en sistemas de cultivo intensivo de organismos acuáticos, donde la calidad del agua se convierte enun factor limitante, dada la acumulación de sustancias tóxicas principalmente debido a alimentos no consumidos y heces, La suma de amonio ionizado y no ionizado, el nitrito y el nitrato se denomina nitrógeno inorgánico y su presencia, especialmente del amonio y del nitrito, tiene reconocidos efectos tóxicos sobre especies acuáticas. 32,33
La forma no ionizada NH3 es más tóxica para los organismos acuáticos debido a varios factores: las membranas branquiales de los peces son relativamente permeables al NH3 mas no al NH4+,tiene una elevada solubilidad en lípidos lo que facilita su paso a través de las membranas biológicas causando daños en las superficies respiratorias.34-35 Diversos autores han realizado estudios para identificar los efectos producidos en peces por diferentes concentraciones de NH3 y formular recomendaciones sobre concentraciones máximas de nitrógeno amoniacal total para diversas especies en exposiciones de corta y larga duración con el fin de evitar los efectos producidos por la toxicidad del amoniaco.36,37
El nitrito se encuentra presente como ión nitrito (NO2–) o como ácido nitroso (HNO2); la concentración de cada uno de ellos, depende del pH del agua de manera directa para el ión y de manera inversa para el ácido; ambos compuestos son extremadamente tóxicos, pero en la naturaleza el ión es más común. La toxicidad puede ser reducida con la adición de cloruros y de otras sustancias menos efectivas como el bicarbonato y el calcio.38 Los efectos toxicológicos en exposiciones prolongadas disminuyen la respuesta inmunológica de los organismos acuáticos induciendo a patologías que pueden conducir a la muerte de las especies, en organismos marinos reduce la habilidad de osmoregulación manifestándose en inhibición de los ciclos reproductivos.39,40
El nitrato (NO3–) es el producto final de la nitrificación, muy nocivo en los humanos y relativamente inofensivo para los peces y otros organismos acuáticos cultivados, debido principalmente a su limitada absorción a través de las branquias.41
3.2 Efectos en la salud humana
El panorama de toxicidad de CN no es exclusivo de organismos acuáticos, para el ser humano la ingesta principalmente de nitritos y nitratos, puede inducir efectos adversos en la salud. Se ha comprobado que bebés menores de cuatro meses que consuman agua rica en nitratos pueden llegar a contraer la enfermedad denominada metahemoglobinemia, manifestando los síntomas típicos de cianosis, taquicardia, convulsiones, asfixia, y por último término la muerte.42Algunasevidencias científicas sugieren además que la ingestión prolongada de nitratos y nitritos podría contribuir al desarrollo de linfomas y cánceres, enfermedades coronarias, infecciones del tracto respiratorio, y malformaciones en los recién nacidos. El cáncer gástrico se da por la formación de nitrosaminasque se producen por la presencia de nitrito de sodio, que se ve favorecida gracias al bajo pHdel estómago, a dicho compuesto también se le atribuye la dilatación y adelgazamiento de los vasos coronarios intramusculares; las neoplasias malignas están asociadas entre otros a dietas ricas en contenido de nitritos y nitratos; altas concentraciones de nitratos en agua potable se han relacionado al incremento de abortos espontáneos, nacimientos prematuros y retardo en el crecimiento intrauterino.43-46
Además se pueden presentar efectos adversos sobre la salud humana por causas indirectas, por ejemplo la proliferación de algas tóxicas que pueden ocasionar desde trastornos fisiológicos e intoxicación hasta la muerte de la persona afectada por su ingestao por contacto de tipo recreacional.47,48 La eutroficación puede favorecer el desarrollo de organismos patógenos y vectores y por ende la transmisión de enfermedades como el Cólera; igualmente, las adiciones de N en los ambientes acuáticos genera cambios ecológicos que incluyen la dinámica de algunas enfermedades humanas producto de la alteración de la abundancia y distribución de importantes vectores como los mosquitos que transmiten la malaria.49,50
Para prevenir efectos adversos sobre la salud humana se han establecido concentraciones máximas de nitritos y nitratos en agua potable: la WHO ha definido como valores límite 3 mg/L de ión nitrito y 50 mg/L de ión nitrato (11 mg/L de nitrato-N y 0,9 mg/L de nitrito-N respectivamente); la USEPA ha recomendado valores de 1 mgNO2-N/L y 10-11 mgNO3-N/L; en Brasil, la Portaria 518 recomienda 1 mgNO2-N/L y 10 mgNO3-N/L; y en Colombia los valores máximosson de 0,1 mgNO2-N/L y 10mgNO3-N/L.51-54
Dada las bajas concentracionesde CN recomendadas con relación a las que habitualmente se encuentran en muchos cuerpos de agua, es de esperar un mayor compromiso de los actores ambientales, en el sentido de evitar o reducir drásticamente las emisiones de N al medio, especialmente considerando las condiciones ambientales producidas por el cambio climático en curso, que agudizan los procesos de toxicidad como resultado de una menor dilución en las zonas de menos pluviosidad, además de una mayor ocurrencia de procesos de eutrofización y mayor abundancia de algas tóxicas.55
Los efectos antes comentados sobre la presencia del N y sus diversos compuestos en el agua hacen que sea de fundamental importancia la adopción de sistemas de tratamiento que disminuyan eficientemente sus concentraciones o eliminen su presencia en las AR antes de ser vertidas a los cuerpos hídricos.
4. Procesos de remoción de compuestos nitrogenados en aguas residuales
La remoción de compuestos nitrogenados en AR incluye la utilización de métodos de tratamiento de tipo físico, químico, biológico o la combinación de uno o varios de ellos. Dependiendo del tipo de AR, del flujo, de la intermitencia del mismo, de la temperatura del sitio, de los costos y de muchas otras variables, el sistema de tratamiento también puede ser continuo o discontinuo. A continuación se describen algunos de los tratamientos reportados por la literatura.
4.1 Procesos físicos
Los CN, especialmente los nitratos pueden sereliminados del AR por procesos físicos fundamentalmente por medio deósmosis inversa, proceso que se basa en el paso de un solvente a través de una membrana impermeable a un soluto, donde se necesita el uso de membranas especializadas por contaminante. Sin embargo,presenta el inconveniente que las membranas utilizadas no tienen una gran selectividad por el nitrato.56
4.2 Procesos químicos
Uno de los procesos químicos avanzados de tratamiento de AR es el intercambio iónico, que consiste en hacer pasar el agua a través de un lecho de resina que permite el reemplazo de un ión por otro; sin embargo, suinconveniente es que no existen resinas con una alta y exclusiva selectividad por el nitrato, así como la dificultad para regenerar y sustituir las resinas utilizadas en el proceso.57,58
La toxicidad de los nitritos se puede reducir o bloquear mediante iones cloruro; por ellose recomienda aplicar la oxidación química con cloro en ocasiones muy particulares como altísimas concentraciones de amonio o nitrato en AR de pequeño caudal.59
4.3 Procesos biológicos
Se considera que los procesos biológicos son más efectivos, porque no trasladan el contaminante de un medio a otro como en el caso de los procesos físicos y químicos, sino que lo eliminan transformándolo en condiciones óptimas a productos finales no contaminadores como CO2 y N2. Además, se considera que son económicamente viables para tratar AR industriales, agrícolas y domésticas.60
Avnimelech, Mozes, Diab y Kochba, determinaron las constantes de velocidad de degradación de carbono y N orgánicos en estanques de cultivo y concluyeron que la degradación biológica de CN es más lenta que la degradación de los compuestos carbónicos puesto que solo una parte del N orgánico puede mineralizarse o convertirse a N inorgánico y el resto se usa para producir proteínas bacterianas.61
Los procesos biológicos cobran importancia porque los tratamientos fisicoquímicos no logran obtener por sí solos efluentes con niveles aceptables de N, sobre todo cuando hay presencia de urea, debido a que las bacterias Klebsiellapneumoniae y Proteusmirabilis, generadoras de enzimas de tipo ureasa son eficientes enla eliminación de N orgánico proveniente de urea de efluentes petroquímicos.62
A continuación se presentarán las principales vías para remoción biológica de CN inorgánico; adicionalmente, el Gráfico 1 esquematiza la transformación de formas de N en procesos biológicos.
4.3.1 Asimilación. Es la utilización del N como nutriente incorporando el nitrógeno amoniacal (NA) en la masa molecular, especialmente de las proteínas, necesarias para el desarrollo de las nuevas bacterias en un proceso que no consume oxígeno. La conversión biológica se basa en que los CN constituyen nutrimentos clave para el crecimiento de los seres vivos, así que el N puede eliminarse del agua si es asimilado por microorganismos.65 La asimilación permite el crecimiento de nuevas células bacterianas, lo que ocasiona un complicado manejo de la biomasa producida, esto hace que los procesos biológicos no asimilativos como la nitrificación y la desnitrificación se constituyan en una alternativa efectiva, sostenible y económicamente factible de eliminación de nitrógeno de las AR.
4.3.2 Nitrificación y desnitrificación. La nitrificación – desnitrificación son las reacciones que permiten una conversión biológica desde NA a nitratos y posteriormente los nitratos a nitrógeno molecular; estas reacciones son realizadas mediante la acción metabólica de microorganismos, unos aerobios y los otros anóxicos.Los dos procesos pueden hacerse en reactores separados en serie o con fracciones diferenciadas donde dependiendo de las características del AR, una fracción del afluente es nitrificada y la otra es tratada con desnitrificación, también es posible realizar los dos procesos en un mismo reactor. En este último grupo se encuentran los biofiltros con biomasa en suspensión o conbiopelícula adherida a un lecho fijo, donde hay formación de dos capas diferenciadas de organismos: unos predominantemente heterotróficos que realizan desnitrificación en la zona externa y los otros autotróficos y nitrificantes en la parte interna.66
4.3.2.1 Nitrificación. Es la conversión aerobia de NA a nitrato, utilizando bacterias quimioautótrofas que toman la energía de la oxidación de compuestos inorgánicos, se presenta principalmente por la acción de nitrosomonas y nitrobacterias, que transforman el amonio a nitrito y el nitrito a nitrato respectivamente, conforme las reaccionespresentadas en el Gráfico 1.
La nitrificación puede darse como un proceso natural de oxidación en los cuerpos de agua, generando consumo de oxígeno, que podría evitarse mediante un sistema de tratamiento que realice la nitrificación de las AR con amonio antes de su descarga a las fuentes hídricas.67
Se considera que la velocidad de crecimiento de las Nitrobacter es mayor que el de las Nitrosomonas, por ello la conversión de amonio a nitrito se considera el paso limitante del proceso de nitrificación. Debido a esto,autores como Zhu y Chen recomiendan los sistemas de tratamiento de crecimiento fijo a los de lecho suspendido ya que en los primeros es posible mantener un mayor tiempo de retención celular y asegurar el crecimiento bacteriano en un reactor de flujo continuo.68
Las reacciones de oxidación de NH4+ (nitrificación) son una potencial fuente de acidez en sistemas acuáticos. Cuando la oxidación es incompleta, se presenta una acumulación de nitrito que también es necesario eliminar, dada su alta toxicidad para peces y otros organismos acuáticos.
4.3.2.2 Desnitrificación: Para una eliminación completa del N se necesita que el nitrato pase al estado elemental del N, ello se presenta en condiciones anóxicas con la acción de una población de bacterias heterotróficas desnitrificantes que usan los productos de degradación orgánica como fuentes de carbono y energía, y el nitrato como un aceptor de electrones, convirtiendo el nitrato por la vía nitrito- óxido nítrico y óxido nitroso a N gaseoso elemental, el cual sale del medio acuático a la atmósfera, siendo así finalmente removido.69El proceso de desnitrificación se hace en cuatro etapas o fases:
Esta secuencia se logra principalmente gracias a la presencia de bacterias Pseudomonas y Alcaligenes, pero también de géneros como Azospirillum, Rhizobium, Rhodopseudomonas y Propionibacterium bajo determinadas condiciones. Estos microorganismos poseen enzimas especializadas en cada una de las etapas de la desnitrificación, y cada una tiene una velocidad específica por lo que puede presentarse acumulación de intermediarios. La presencia o ausencia de productos intermediarios depende del pH; a pHs bajos (5,5) la desnitrificación sigue la secuencia: Nitrato-Nitrito-N2O-N2, mientras que a pHs altos (8,5) el Nitrato pasa a N2 sin formación de intermediarios.70
La desnitrificación se da al mismo tiempo que se oxida la MO, la cual puede tomarse de los sustratos de carbono del AR cruda (fuente endógena) cuando la relación DQO/N es alta, o ser añadida al proceso utilizando una fuente externa (fuente exógena) cuando la relación DQO/N es baja.
Entre los compuestos químicos de carbono que pueden ser usados como fuentes exógenas se encuentran los almidones, azucares y alcoholes; de estos los que han obtenido mayor velocidad de desnitrificación son el ácido acético, el metanol, y el etanol. Los ácidos grasos volátiles, como el ácido acético y el ácido propiónico, son una fuente alternativa atractiva, ya que pueden ser producidos in situ a través de la fase ácida de la digestión anaerobia o por hidrolisis térmica del lodo, lo que puede reducir costos y problemas de manejo y almacenamiento.71-75
4.3.3 Nitrificación parcial o vía nitrito
La nitrificación parcial se basa en el hecho de que el nitrito está presente como intermediario de los procesos de nitrificación y desnitrificación, ello se puede aprovechar para llevar a cabo la nitrificación hasta nitrito y a partir de allí realizar la desnitrificación, por ello se le denomina remoción vía nitrito y es posible efectuarla en un solo reactor. Este proceso permite reducir la producción de lodos, los requerimientos de aireación durante la nitrificación y la cantidad de MO requerida para la desnitrificación.76
4.3.4 Oxidación anaerobia de amonio (ANAMOX) Despuésde encontrar tasas de eliminación de N en unidades de nitrificación y desnitrificación en sistemas con bajos niveles de oxígeno y carbono orgánico, Mulder, Van de Graaf, Robertson y Kuenenconfirmaron experimentalmente que era posible una oxidación anaerobia de amoniaco (Anammox), gracias a la presencia de bacterias que usan el nitrito como un receptor de electrones y anaeróbicamente convierten el nitrito y el amonio directamente a N2 gaseoso, en un proceso autotrófico, donde los microorganismos usan bicarbonato como fuente de carbono.77,78
Cuando se utilizan dos reactores, el primero lleva a cabo la nitrificación parcial y el segundo el proceso de oxidación anaerobia; para ello se requiere que el efluente de la primera etapa tenga concentraciones similares de amonio y nitrito.79
4.3.5 Cultivos hidropónicos y humedales Existen opciones de tratamiento que unen un sistema de remoción mecánica de solidos y nitrificación, con la asimilación de nutrientes por plantas, macroalgas y/o moluscos, mediante la conversión de los nutrientes en plantas y otra biomasa que puede ser extraída y que frecuentemente tiene un buen valor. La implementación de humedales para el tratamiento de AR se caracteriza por tener moderados costos de construcción, bajo consumo de energía y mantenimiento y los beneficios de una amplia gama de micro y macro fauna que puede aumentar la eficiencia del tratamiento.80
Los humedales tanto naturales como artificiales, remueven el N del agua debido a la formación de una biopelícula similar a la de los bioreactores, que está adherida a las partículas del suelo y la superficie radicular de las plantas que conforman el humedal. Esta biopelícula permite en su interior la realización de procesos aerobios y anaerobios que propician la degradación de nutrientes como los CN, además se ha comprobado que son eficientes en la disminución de patógenos, sólidos suspendidos, MO y elementos de traza.81
La remoción del Nen los humedales se lleva a cabo por diferentes vías como: traslado a la biomasa de las plantas, incorporación a la MO del suelo, volatilización de amonio, nitrificación y desnitrificación bacteriana, entre otras. Los resultados de la remoción de N con humedales son muy dispersos ya que la eficiencia del sistema depende de muchos factores como la temperatura ambiental, las características de la composición del suelo, la distribución y la forma de las partículas, el flujo hidráulico y el oxígeno de entrada, por ello es considerado un campo prometedor de investigación a futuro en la remoción de este nutriente.82
5. Factores que influyen en la remoción de nitrógeno Entre los principales factores que inciden en la eficiencia de remoción del N en las AR se encuentra el pH, la alcalinidad, la temperatura, la concentración de oxígeno disuelto, la relación entre las cantidades de materia orgánica y nitrogenada.
Usualmente para los procesos de nitrificación se recomiendan valores de pH que superen la neutralidad; por tratarse de un proceso que consume alcalinidad es necesario monitorear este parámetro y compensar su disminución para evitar reducciones en su eficiencia. La nitrificación y la desnitrificación también son influenciadas por la temperatura ya que afecta directamente las tasas de crecimiento bacteriano; en términos generales se recomienda que su valor nunca esté por debajo de 5ºC porque cesa toda actividad de las bacterias nitrificantes. El impacto de la concentración de OD se vuelve más significativo a medida que aumenta la carga orgánica del reactor, puesto que el medio permite un crecimiento de bacterias heterótrofas que compiten con las autótrofas o nitrificantes por el limitado oxígeno.83 Como complemento a lo anterior, la relación DQO/N en el AR es un parámetro clave en la definición de la velocidad de nitrificación, ya que determina la competencia de crecimiento de microorganismos autótrofos y heterótrofos.84 En la tabla 1 se presentan valores recomendables para los más importantes parámetros citados.
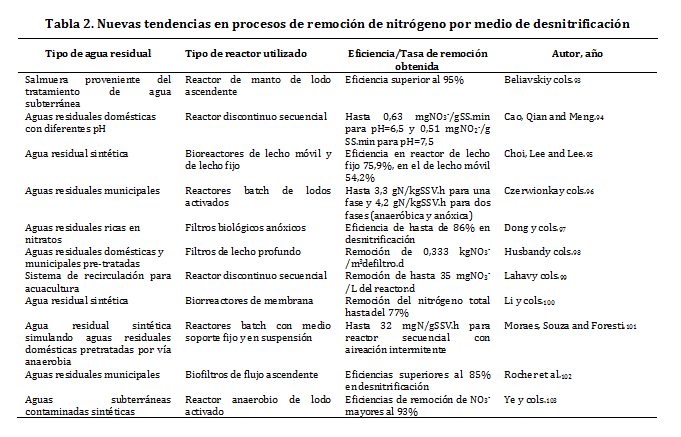
6. Nuevas tendencias y tecnologías Entre las diferentes opciones de remoción de N del agua, tal vez la tendencia que mayor desarrollo ha presentado en términos de la generación de nuevas tecnologías sea el uso de diversos tipos de reactores biológicos,principalmente para realizar desnitrificación en AR donde con acumulación de nitratos, algunos de los reportes más recientes sobre nuevas tecnologías se indica a continuación en la tabla 2.
CONCLUSIONES
El origen de las diferentes formas de nitrógeno en el agua obedece a múltiples causas naturales; sin embargo, su presencia se ha incrementado por diversas actividades antrópicas, que también han alterado el normal funcionamiento del ciclo del nitrógeno.
Los compuestos nitrogenados pueden alcanzar en el agua niveles tóxicos que alteren la capacidad de los animales para sobrevivir, crecer y reproducirse, de ellos el más tóxico para los organismos acuáticos es el amonio no ionizado.
La ingesta principalmente de nitritos y nitratos puede producir efectos adversos en la salud humana que en múltiples casos pueden culminar con la muerte de la persona afectada, lo que justifica la intervención de diversas legislaciones internacionales para el control de sus cantidades en el agua potable.
Con base en los efectos que los compuestos nitrogenados ejercen sobre el ambiente y la salud humana se han desarrollado grandes avances en la transformación y eliminación del nitrógeno de las aguas residuales apoyados en principios de disminución del contaminante por vías físicas, químicas o biológicas.
Los sistemas de tratamiento biológicos se basan en procesos de microorganismos dentro del ciclo del nitrógeno, algunos de dichos sistemas se han considerado los más convenientes en la remoción de este nutrienteporque son capaces de eliminarlo completamente del agua y no lo trasladan a otros sistemas.
Las nuevas tecnologías de tratamiento biológico de aguas residuales tendientes a la remoción del nitrógeno apuntan a la consolidación de los procesos de desnitrificación, con alternativas que superan el 90% de remoción de los nitratos acumulados en el líquido.
REFERENCIAS
1. Atlas R, Bartha R. Ecología microbiana y Microbiología ambiental. Madrid: Pearson Educación S.A; 2002. [ Links ]
2. Hagopian DS, Riley JG. A closer look at the bacteriology of nitrification. Aquacultural Engineering. 1998; 18(4):223-44. [ Links ]
3. Boyd CE, Massaut L. Risks associated with the use of chemicals in pond aquaculture. Aquacultural Engineering. 1999; 20:113-32. [ Links ]
4. Timmons M, Ebeling J, Wheaton F, Summerfelt S, Vinci B. Sistemas de recirculación para la acuacultura. Santiago de Chile: Fundación Chile; 2002. [ Links ]
5. Roldán G, Ramirez J. Fundamentos de Limnología Neotropical. 2ª Ed. Medellín: Universidad de Antioquia; 2008. [ Links ]
6. Diaz RJ, Nestlerode J, Diaz M. A Global perspective on the effects of eutrophication and hypoxia on aquatic biota. In: Rupp G, White M (Eds.), Seventh International Symposium: Fish Physiology, Toxicology, and Water Quality - Tallinn, Estonia. 2003: 1-34. [ Links ]
7. Brown T, LeMay H, Bursten B, Burdge J. Química, la ciencia central. Ciudad de México: Pearson Educación; 2004. [ Links ]
8. Sawyer C, McCarty P, Parkin G. Química para Ingeniería Ambiental. 4ª Ed. Ariza E, Ed, Arteaga L, Traductor. Santafé de Bogotá: McGraw Hill; 2001. [ Links ]
9. Camargo J, Alonso A. Contaminación por nitrógeno inorgánico en los ecosistemas acuáticos: problemas medioambientales, criterios de calidad del agua, e implicaciones del cambio climático. Revista Ecosistemas [internet]. 2007[citado 2012]; 16(2). Disponible en: thhp://www.revistaecosistemas.net. [ Links ]
10. Ecological Society of America. Excess Nitrogen in the U.S. Environment: Trends, Risks, and Solutions. Issues in ecology, Report number fifteen. Washington DC: The Society; 2012. [ Links ]
11. Camargo J, Alonso A. Ecological and toxicological effects of inorganic nitrogen pollution in aquatic ecosystems: A global assessment. Environment international. 2006; 32(6): 831-49. [ Links ]
12. United States Environmental Protection Agency USEPA. Frequently asked questions about atmospheric deposition, a handbook for watershed managers. Washington DC: The Agency; 2001. [ Links ]
13. Fields S. Global nitrogen: Cycling out of control. Environmental Health Perspectives. 2004; 112(10): A556-63. [ Links ]
14. Lema JM. Eliminación biolóxica de nitróxeno en aguas residuais. Revista Galegado Ensino. 1998; 19: 49-73. [ Links ]
15. Beristain R, Texier AC, Razo-Flores E, Mendez R, Gomez J. Biotransformation of aromatic compounds from wastewaters containing N and/or S, by nitrification/denitrification?: a review. Environmental Science Biotechnology. 2009; 8(4): 325-42. [ Links ]
16. Cervantes FJ, editor. Environmental Technologies to Treat Nitrogen Pollution. Principles and Engineering. London, UK: IWA Publishing; 2009. [ Links ]
17. Cervantes F, Pérez J, Gómez J. Avances en la Eliminación Biológica del Nitrógeno de las Aguas Residuales. Revista Latinoamericana de Microbiología. 2000; 42: 73-82. [ Links ]
18. Van Rijn J. The potential for integrated biological treatment systems in recirculating fish culture-A review. Aquaculture. 1996; 139(3-4): 181-201. [ Links ]
19. Singer A, Parnes S, Gross A, Sagi A, Brenner A. A novel approach to denitrification processes in a zero-discharge recirculating system for small-scale urban aquaculture. Aquacultural Engineering. 2008; 39(2-3):72-77. [ Links ]
20. Paredes D, Kuschk P, Mbwette T, Stange F, Müller R, Köser H. New Aspects of Microbial Nitrogen Transformations in the Context of Wastewater Treatment – A Review. Eng. Life Sci. 2007; 7(1): 13-25. [ Links ]
21. Masser MP, Rakocy J, Losordo TM. Recirculating Aquaculture Tank Production Systems- Management of Recirculating Systems. Southern Regional Aquaculture Center. 1992; 452: 1-12. [ Links ]
22. Twarowska JG, Westerman PW, Losordo, TM. Water treatment and waste characterization evaluation of an intensive recirculating fish production system. Aquacultural Engineering. 1997; 16(3): 133-47. [ Links ]
23. Colt J. Water quality requirements for reuse systems. Aquacultural Engineering. 2006; 34(3): 143-56. [ Links ]
24. Avnimelech Y. Carbon/nitrogen ratio as a control element in aquaculture systems. Aquaculture. 1999; 176(3-4): 227-235. [ Links ]
25. Nóbrega C, Pacheco A. Modelagem matemática para avaliação dos efeitos de despejos orgânicos nas condições sanitárias de águas ambientais. Cad. Saúde Pública, Rio de Janeiro. 2006; 22(8): 1715-1725. [ Links ]
26. Choudhury ATMA, Kennedy IR. Nitrogen Fertilizer Losses from Rice Soils and Control of Environmental Pollution Problems. Communications in Soil Science and Plant Analysis. 2005; 36: 1625–39. [ Links ]
27. European Commission Directorate-General XI. Position paper on air quality: Nitrogen dioxide. The commission. 1997. 76p. [ Links ]
28. Alaburda J, Nishihara L. Presença de compostos de nitrogênio em águas de poços. Rev. Saúde Pública. 1998; 32(2): 160-5. [ Links ]
29. United Nations Environmental Programme UNEP, The Woods Hole Research Center WHRC. Reactive Nitrogen in the environment, too much or too little of a good thing. Paris: UNEP & WHRC. 2007. 51p. [ Links ]
30. Arbiv R, Van Rijn J. Performance of a Treatment System for Inorganic Nitrogen Removal in Intensive Aquaculture Systems. Aquacultural Engineering. 1995; 14(2): 189-203. [ Links ]
31. United States Environmental Protection Agency USEPA. Nitrogen: Multiple and regional impacts. USEPA clean air market programs. Washington, DC: The Agency. 2002. 38 p. [ Links ]
32. Van Rijn J, Fonarev N, Berkowitz B. Anaerobic treatment of intensive fish culture effluents: digestion of fish feed and release of volatile fatty acids. Aquaculture. 1995; 133(1): 9-20. [ Links ]
33. Avnimelech Y. Bio-filters: The need for a new comprehensive approach. Aquacultural Engineering. 2006; 34(3): 172-178. [ Links ]
34. Timmons M, Ebeling J. Recirculating Aquaculture. New York: Northeastern Regional Aquaculture Center. 2010. [ Links ]
35. Alonso A. Valoración del efecto de la degradación ambiental sobre los macroinvertebrados bentónicos en la cabecera del río Henares. Ecosistemas. 2006; 15(2): 101-105. [ Links ]
36. Camargo J, Alonso A, Salamanca A. Nitrate toxicity to aquatic animals: a review with new data for freshwater invertebrates. Chemosphere. 2005; 58(9): 1255-1267. [ Links ]
37. Thorarensen H, Farrell AP. The biological requirements for post-smolt Atlantic salmon in closed-containment systems. Aquaculture. 2011; 312(1): 1-14. [ Links ]
38. Lewis W, Morris D. Toxicity of Nitrite to Fish: A review. Transactions of the American Fisheries Society. 1986; 115: 183-95. [ Links ]
39. Timmons M, Ebeling J. Recirculating Aquaculture. New York: Northeastern Regional Aquaculture Center. 2010. [ Links ]
40. Shimura R, Ijiri K, Mizuno R, Nagaoka S, Co ES. Aquatic Animal Research in Space Station and its issues -Focus on support Technology on Nitrate Toxicity. Advances in Space Research. 2002; 30(4): 803-808. [ Links ]
41. Boley A, Mülleru W, Haider G. Biodegradable polymers as solid substrate and biofilm carrier for denitrification in recirculated aquaculture systems. Aquacultural Engineering. 2000; 22(1-2): 75-85. [ Links ]
42. Fewtrell L. Drinking-Water Nitrate, Methemoglobinemia, and Global Burden of Disease: A Discussion. Environmental Health Perspectives. 2004; 112(14): 1371-1374. [ Links ]
43. Vieira AM, Dos Santos SA, Do Valle CNT, Da Silva JA. Educação Alimentar: Uma Proposta de Redução do Consumo de Aditivos Alimentares. Química nova na escola. 2012; 34(2): 51-57. [ Links ]
44. Manahan S. Environmental Chemistry. 9ª Ed. London: CRC Press. 2010. [ Links ]
45. Mensinga TT, Speijers GJA, Meulenbelt J. Health Implications of Exposure to Environmental Nitrogenous Compounds. Toxicol Rev. 2003; 22(1): 41-51. [ Links ]
46. Teixeira PML, Peres F. Consumo de aditivos alimentares e efeitos à saúde: desafios para a saúde pública brasileira. Cad. Saúde Pública, Rio de Janeiro. 2009; 25(8): 1653-1666. [ Links ]
47. Busse LB, Venrick EL, Antrobus R, Miller PE, Vigilant V, Silver MW, Mengelt C, et al. Domoic acid in phytoplankton and fish in San Diego, CA, USA. Harmful Algae. 2006; 5(1): 91-101. [ Links ]
48. Stewart I, Webb PM, Schluter PJ, Shaw GR. Recreational and occupational field exposure to freshwater cyanobacteria – a review of anecdotal and case reports, epidemiological studies and the challenges for epidemiologic assessment. Environmental Health. A Global Access Science Source. 2006; 5(6):1-13. [ Links ]
49. Johnson P, Carpenter S. Influence of eutrophication on disease in aquatic ecosystems: patterns, processes and predictions. En: R. Ostfeld, F. Keesing, & V. Eviner, Infectious Disease Ecology: the effects of ecosystems on disease and of disease on ecosystems. New Jersey, USA: Princeton University Press. 2008. 71-99p. [ Links ]
50. Townsend AR, Howarth RW, Bazzaz FA, Booth MS, Cleveland CC, et al. Human health effects of a changing global nitrogen cycle. Front Ecol Environ. 2003; 1(5): 240–246. [ Links ]
51. World Health Organization. Nitrate and nitrite in drinking-water. Background document for development of WHO Guidelines for Drinking-water Quality. Geneva, Switzerland: WHO Press. 2011. [ Links ]
52. United States Environmental Protection Agency USEPA. National Recommended Water Quality Criteria. EPA; 2012. [citado dic 2012] Disponible en: http://water.epa.gov/scitech/swguidance/standards/current/index.cfm"target="_blank">http://water. [ Links ]epa.gov/scitech/swguidance/standards/current/index.cfm
53. Brasil. Ministério da Saúde. Portaria no. 518, de 25 de março de 2004: estabelece os procedimentos e responsabilidades relativos ao controle e vigilância da qualidade da água para consumo humano e seu padrão de potabilidade. Brasília: Diário Oficial da União. 2004; 59: 266-70. [ Links ]
54. Colombia. Ministerios de Protección Social y de Ambiente, Vivienda y Desarrollo Territorial. Resolución Número 2115 del 22 de junio del 2007. 2012 [citado abril 2012], disponible en thhp://www.minproteccionsocial.gov.co/Normatividad/RESOLUCIÓN%202115%20DE%202007.pdf [ Links ]
55. Smith VH, Joye SB, Howarth RW. Eutrophication of freshwater and marine ecosystems. Limnology and Oceanography. 2006; 51(1-2): 351-355. [ Links ]
56. Carrera J. Eliminación biológica de nitrógeno en un efluente con alta carga. Estudio de los parámetros del proceso y diseño de una depuradora industrial. Barcelona: Universidad Autónoma de Barcelona. 2001. [ Links ]
57. Kiely G. Ingeniería Ambiental: Fundamentos, entornos, tecnologías y sistemas de gestión. Veza JM, Trad. Madrid: McGraw Hill. 1999. [ Links ]
58. Carrera J. Eliminación biológica de nitrógeno en un efluente con alta carga. Estudio de los parámetros del proceso y diseño de una depuradora industrial. Barcelona: Universidad Autónoma de Barcelona. 2001. [ Links ]
59. Lema JM. Eliminación biolóxica de nitróxeno en aguas residuais. Revista Galegado Ensino. 1998; 19: 49-73. [ Links ]
60. Metcalf E, Inc. Ingeniería de aguas residuales: tratamiento, vertido y reutilización. 3ª. Ed. Madrid, España: Mc Graw-Hill. 1995. [ Links ]
61. Avnimelech Y, Mozes N, Diab S, Kochba M. Rates of organic carbon and nitrogen degradation in intensive fish ponds. Aquaculture. 1995; 134: 211-216. [ Links ]
62. Perez S, Niño Z, Hernández V, Hernández C. Uso de Enzimas de Tipo Ureasa en el Tratamiento de Aguas Residuales con Alto Contenido en Nitrógeno Orgánico. Información tecnológica. 2007; 18(5): 41-48. [ Links ]
63. Crites R, Tchobanoglous G. Small and Decentralized Wastewater Management Systems. New York: McGraw-Hill. 1998. [ Links ]
64. Chen S, Ling J, Blancheton JP. Nitrification kinetics of biofilm as affected by water quality factors. Aquacultural Engineering. 2006; 34(3): 179-197. [ Links ]
65. Cárdenas C, Perruolo T, Ojeda M, Chirinos M, Yabroudi S, et al. Evaluación del proceso de nitrificación y desnitrificación en el tratamiento de aguas residuales utilizando un reactor por carga. Ciencia. 2006; 14(1):75-87. [ Links ]
66. Van Loosdrecht M, Van Benthum W, Heijnen J. Integration of nitrification and denitrification in biofilm airlift suspension reactors. Water Science and Technology. 1998; 41(4-5): 97-103. [ Links ]
67. Perez J, Menéndez C. Variantes de procesos de nitrificación- desnitrificación para un sistema de biomasa en suspensión para el tratamiento de aguas residuales. Ingeniería Hidráulica y Ambiental. 2007; 28(3): 57-64. [ Links ]
68. Zhu S, Chen S. The impact of temperature on nitrification rate in fixed film biofilters. Aquacultural Engineering. 2002; 26(4): 221-237. [ Links ]
69. Perez S, Niño Z, Hernández V, Hernández C. Uso de Enzimas de Tipo Ureasa en el Tratamiento de Aguas Residuales con Alto Contenido en Nitrógeno Orgánico. Información tecnológica. 2007; 18(5): 41-8. [ Links ]
70. Thomsen JK, Geest T, Cox RP. Mass Spectrometric Studies of the Effect of pH on the Accumulation of Intermediates in Denitrification by Paracoccusdenitrificans. Applied and Environmental Microbiology. 1994; 60(2): 536-541. [ Links ]
71. Hamlin HJ, Michaels JT, Beaulaton CM, Graham WF, Dutt W, et al. Comparing denitrification rates and carbon sources in commercial scale upflowdenitrification biological filters in aquaculture. Aquacultural Engineering. 2008; 38: 79-92. [ Links ]
72. Akunna JC, Bizeau C, Moletta R. Nitrate and nitrite reductions with anaerobic sludge using various carbon sources: Glucose, glycerol, acetic acid, lactic acid and methanol. Water Research. 1993; 27(8): 1303-12. [ Links ]
73. Lee SI, Park JH, Ko KB, Koopman B. Effect of fermented swine wastes on biological nutrient removal in Sequencing Batch Reactors. Water Research. 1997; 31(7): 1807-1812. [ Links ]
74. Peng YZ, Ma Y, Wang SY. Denitrification potential enhancement by addition of external carbon sources in a pre-denitrification process. Journal of environmental sciences (China). 2007; 19(3): 284-289. [ Links ]
75. Elefsiniotis P, Li D. The effect of temperature and carbon source on denitrification using volatile fatty acids. Biochemical Engineering Journal. 2006; 28(2): 148-55. [ Links ]
76. Ciudad G, Rubilar O, Vergara C, Ruiz G, Chamy R, Jeison D. Desnitrificación de aguas residuales con alto contenido de nitrito como parte de una estrategia de nitrificación - desnitrificación vía nitrito. XV Congreso de Ingeniería Sanitaria y Ambiental. Concepción: AIDIS; 2003. [ Links ]
77. Mulder A, Van de Graaf AA, Robertson LA, Kuenen JG. Anaerobic ammonium oxidation discovered in a denitrifying fluidized bed reactor. FEMS Microbiology Ecology. 1995; 16: 177-84. [ Links ]
78. Strous M, Van Gerven E, Zheng P, Kuenen G, Jetten M. Ammonium removal from concentrated waste streams with the Anaerobic Ammonium Oxidation (ANAMMOX) process in different reactor configurations. Water Research. 1997; 31(8): 1955-62. [ Links ]
79. Paredes D, Kuschk P, Mbwette T, Stange F, Müller R, Köser H. New Aspects of Microbial Nitrogen Transformations in the Context of Wastewater Treatment – A Review. Eng. Life Sci. 2007; 7(1): 13-25. [ Links ]
80. Lin YF, Jing SR, Lee DY, Wang TW. Nutrient removal from aquaculture wastewater using a constructed wetlands system. Aquaculture. 2002; 209(1-4): 169-84. [ Links ]
81. Ciudad G, Rubilar O, Vergara C, Ruiz G, Chamy R, Jeison D. Desnitrificación de aguas residuales con alto contenido de nitrito como parte de una estrategia de nitrificación - desnitrificación vía nitrito. XV Congreso de Ingeniería Sanitaria y Ambiental. Concepción: AIDIS; 2003. [ Links ]
82. Paredes D, Kuschk P, Mbwette T, Stange F, Müller R, Köser H. New Aspects of Microbial Nitrogen Transformations in the Context of Wastewater Treatment – A Review. Eng. Life Sci. 2007; 7(1): 13-25. [ Links ]
83. Ling J, Chen S. Impact of organic carbon on nitrification performance of different biofilters. Aquacultural Engineering. 2005; 33(2): 150-62. [ Links ]
84. Carrera J. Eliminación biológica de nitrógeno en un efluente con alta carga. Estudio de los parámetros del proceso y diseño de una depuradora industrial. Barcelona: Universidad Autónoma de Barcelona. 2001. [ Links ]
85. Timmons M, Ebeling J. Recirculating Aquaculture. New York: Northeastern Regional Aquaculture Center. 2010. [ Links ]
86. Crites R, Tchobanoglous G. Small and Decentralized Wastewater Management Systems. New York: McGraw-Hill. 1998. [ Links ]
87. Cárdenas C, Perruolo T, Ojeda M, Chirinos M, Yabroudi S, et al. Evaluación del proceso de nitrificación y desnitrificación en el tratamiento de aguas residuales utilizando un reactor por carga. Ciencia. 2006; 14(1): 75-87. [ Links ]
88. Lema JM. Eliminación biolóxica de nitróxeno en aguas residuais. Revista Galegado Ensino. 1998; 19: 49-73. [ Links ]
89. Timmons M, Ebeling J. Recirculating Aquaculture. New York: Northeastern Regional Aquaculture Center. 2010. [ Links ]
90. Chen S, Ling J, Blancheton JP. Nitrification kinetics of biofilm as affected by water quality factors. Aquacultural Engineering. 2006; 34(3): 179-197. [ Links ]
91. Ye Z, Wang F, Bi H, Wang Z, Liu G. Denitrification of nitrate-contaminated groundwater using a simple immobilized activated sludge bioreactor. Water Science & Technology. 2012; 66 (3): 517-524. [ Links ]
92. Van Rijn J, Tal Y, Schreier HJ. Denitrification in recirculating systems: Theory and applications. Aquacultural Engineering. 2006; 34(3): 364–376. [ Links ]
93. Beliavski M, Meerovich I, Tarre S, Green M. Biological denitrification of brines from membrane treatment processes using an upflow sludge blanket (USB) reactor. Water Science & Technology. 2010; 61(4): 911-917. [ Links ]
94. Cao X, Qian D, Meng X. Effects of pH on nitrite accumulation during wastewater denitrification. Environmental Technology. 2013; 34(1): 45–51. [ Links ]
95. Choi HJ, Lee HA and Lee SM. Comparison between a moving bed bioreactor and a fixed bed bioreactor for biological phosphate removal and denitrification. Water Science & Technology. 2012; 65(10): 1834-1838. [ Links ]
96. Czerwionka K, Makinia J, Kaszubowska M, Majtacz J, Angowski M. Distillery wastes as external carbon sources for denitrification in municipal wastewater treatment plants. Water Science & Technology. 2012; 65(9): 1583-1590. [ Links ]
97. Dong W, Zhang X, Wang H, Sun F, Liu T. Enhanced denitrification with external carbon sources in a biological anoxic filter. Water Science & Technology. 2012; 66(10): 2243-2250. [ Links ]
98. Husband JA, Slattery L, Garrett J, Corsoro F, Smithers C, Phipps S. Full-scale operating experience of deep bed denitrification filter achieving minor 3 mg/l total nitrogen and minor O.18 mg/l total phosphorus. Water Science & Technology. 2012; 65(3): 519-524. [ Links ]
99. Lahav O, Massada IB, Yackoubov D, Zelikson R, Mozes N, Tal Y, Tarre. Quantification of anammox activity in a denitrification reactor for a recirculating aquaculture system. Aquaculture. 2009; 288 (1-2): 76–82. [ Links ]
100. Li J, Yang F, Ohandja DG, Wong FS. Integration of nitrification and denitrification by combining anoxic and aerobic conditions in a membrane bioreactor. Water Science & Technology. 2010; 62(11): 2590-2598. [ Links ]
101. Moraes BS, Souza TSO, Foresti E. Characterization and kinetics of sulfide-oxidizing autotrophic denitrification in batch reactors containing suspended and immobilized cells. Water Science & Technology. 2011; 64(3): 731-738. [ Links ]
102. Rocher V, Paffoni C, Gonçalves A, Guérin S, Azimi S, Gasperi J, Moilleron R, Pauss A. Municipal wastewater treatment by biofiltration: comparisons of various treatment layouts. Part 1: assessment of carbon and nitrogen removal. Water Science & Technology. 2012; 65(9): 1705-1712. [ Links ]
103. Ye Z, Wang F, Bi H, Wang Z, Liu G. Denitrification of nitrate-contaminated groundwater using a simple immobilized activated sludge bioreactor. Water Science & Technology. 2012; 66(3): 517-524. [ Links ]