Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Universidad y Salud
Print version ISSN 0124-7107On-line version ISSN 2389-7066
Univ. Salud vol.17 no.1 Pasto Jan./June 2015
Resistencia antimicrobiana de bacterias aisladas de clínicas veterinarias de la ciudad de Ibagué, Colombia
Antimicrobial resistance of bacteria isolated from veterinary clinics in the city of Ibague, Colombia
María del Pilar Sánchez1, Norma Patricia Gutiérrez2, Mónica Yamile Padilla3, Leidy Lorena Suárez4
1 Mg. Microbiología. Profesora Facultad de Medicina Veterinaria y Zootecnia. Grupo de investigación IMPRONTA Universidad Cooperativa de Colombia, sede Ibagué. Ibagué, Colombia. e-mail: maria.sanchez@campusucc.edu.co
2 Mg. Administración de empresas con énfasis en sistemas integrados de gestión. Profesora Facultad de Medicina Veterinaria y Zootecnia. Grupo de investigación IMPRONTA. Universidad Cooperativa de Colombia, sede Ibagué. Ibagué, Colombia. e-mail: norma.gutierrez@campusucc.edu.co
3 MVZ. Facultad de Medicina Veterinaria y Zootecnia. Universidad Cooperativa de Colombia, sede Ibagué. Ibagué, Colombia. e-mail: mpadilla03@unisalle.edu.co
4 MVZ. Facultad de Medicina Veterinaria y Zootecnia. Universidad Cooperativa de Colombia, sede Ibagué. Ibagué, Colombia. e-mail: bichololis7@gmail.com
Fecha de recepción: Marzo 26 - 2014 / Fecha de aceptación: Mayo 26 - 2015
Resumen
Objetivo: Aislar bacterias que circulan en clínicas veterinarias de la ciudad de Ibagué, conocer su perfil de resistencia a antimicrobianos y en algunas, su capacidad de transferir dicha resistencia a bacterias sensibles. Métodos: Se tomaron muestras de 10 clínicas a las que se les realizó cultivo bacteriológico, identificación bioquímica, antibiograma y pruebas de conjugación bacteriana para transmitir dicha resistencia. El diseño metodológico fue de tipo cuasi-experimental, el análisis de los resultados se hizo mediante estadística descriptiva. Resultados: En todas las áreas de las 10 clínicas se encontraron bacterias potencialmente patógenas multirresistentes que pertenecían a 8 de 16 especies aisladas. Los microorganismos que aparecieron con mayor frecuencia en los diferentes sitios de las clínicas fueron: Staphylococcus intermedius, Acinetobacter baumannii, Pantoea agglomerans, Klebsiella pneumoniae y Burkhordelia cepacia. Los lugares donde se aislaron microorganismos multirresistentes con más frecuencia fueron el piso de consulta externa y la mesa de examen clínico. La resistencia se presentó principalmente a amoxicilina y cloranfenicol. El estudio muestra la presencia de patógenos potenciales de causar infecciones nosocomiales, que se constituyen en reservorio de genes de resistencia a los antibióticos para las bacterias patógenas no resistentes.
Palabras clave: Resistencia a antibióticos, clínicas veterinarias, conjugación bacteriana, nosocomial. (Fuente: DeCS, Bireme).
Abstract
Objective: To isolate bacteria circulating in veterinary clinics in the city of Ibague for knowing its antimicrobial resistance profile and in some cases, its ability to transfer this resistance to susceptible bacteria. Methods: Samples of 10 clinics that underwent bacterial culture, biochemical identification, antimicrobial susceptibility testing and bacterial conjugation to transfer this resistance were taken. The methodological design was quasi-experimental and the analysis of the results was made using descriptive statistics. Results: In all areas of the 10 clinical multiresistant potentially pathogenic bacteria which belonged to 8 of 16 species isolated were found. The microorganisms that occurred more frequently in different clinical places were: Staphylococcus intermedius, Acinetobacter baumannii, Pantoea agglomerans, Klebsiella pneumoniae and Burkhordelia cepacia. The places where multiresistant microorganisms were most frequently isolated were the outpatients floor and the clinical examination table. The resistance occurred mainly to amoxicillin and chloramphenicol. The study shows the presence of potential pathogens causing nosocomial infections, which constitute a reservoir of resistance genes to antibiotics for non-resistant pathogenic bacteria.
Keywords: Antibiotic resistance, veterinary clinics, bacterial conjugation, nosocomial. (Source: DeCS, Bireme).
Introducción
El 17 de noviembre de 2011, bajo el concepto de "una sola salud", se reunieron representantes de la Organización Mundial de la Salud, la FAO, la Organización Mundial de la Salud Animal (OIE) y expertos internacionales de salud pública, sanidad animal y medio ambiente y declararon la resistencia de bacterias a los antibióticos, junto con la rabia y la influenza de origen animal, como las tres principales amenazas mundiales emergentes.1
Desde los años setenta, la resistencia bacteriana viene acompañada de la aparición de enfermedades nuevas u ocultas que se caracterizan por su carácter zoonótico y pandémico. Este fenómeno adquiere mayores dimensiones en el ambiente hospitalario, debido a la presión ejercida por el uso de los antimicrobianos, promoviendo la selección y acumulación de genes de resistencia entre las poblaciones bacterianas residentes.
Esta situación ha hecho que la resistencia a los antibióticos haya pasado a ser considerada por algunos países y por los organismos internacionales antes mencionados, un desafío mundial por dos motivos: a) la capacidad de las bacterias de transmitir información genética y b) la globalización que facilita enormemente la posibilidad de difundir esa resistencia en cortos períodos.2
Prueba de la existencia de un problema serio para la sanidad global (humana y animal) son los resultados de una encuesta realizada por la OIE que ha evidenciado que el 64 % de los países encuestados reconocen tener resistencia a los antibióticos en bacterias que pueden compartirse entre humanos y animales.3
En los hospitales esta resistencia tiene un alto impacto sobre las tasas de morbilidad y mortalidad, limita las opciones terapéuticas e incrementa los costos por concepto de terapia alternativa y estadía hospitalaria. Se considera que las infecciones intrahospitalarias conllevan un costo de US$ 28.4 a 33.8 billones en Estados Unidos y que el 70% de ellas son causadas por microorganismos resistentes, en un momento donde las enfermedades infecciosas constituyen la principal causa de mortalidad en países de ingresos bajos, tanto en humanos como en animales.4
Frente a la problemática de la resistencia bacteriana a los antibióticos, la medicina humana encendió las alarmas en los años ochenta y noventa del pasado siglo. Solo terminado el siglo XX y a inicios del presente, comienza en los países desarrollados la preocupación por la resistencia microbiana a nivel veterinario y la relación entre antibióticos de uso animal y el impacto en la salud pública. La OIE publicó en el 2003 los estándares internacionales sobre resistencia antimicrobiana, en donde ofrece una guía para la vigilancia de la resistencia y el establecimiento de programas de control.5
En el año 2002, el Dr Jhonson del Belle City Veterinary Hospital, realiza una publicación de la "Infección nosocomial" que afecta del 5 al 10% de todos los pacientes humanos hospitalizados de Norteamérica, causando un significativo incremento en la morbilidad, mortalidad y costos hospitalarios. La incidencia de la infección nosocomial no había sido establecida hasta ese momento en veterinaria, haciendo un llamado a los colegas a aprovechar la oportunidad de aprender de la experiencia de la profesión médica humana para prevenir la escalada de las infecciones nosocomiales y su impacto en veterinaria.6
En el 2008 un estudio realizado a 31 hospitales de enseñanza veterinaria de los Estados Unidos acreditados por la AVMA (American Veterinary Medical Association), reporta que el 82% de estos hospitales ha presentado brotes de infección nosocomial durante los 5 años anteriores.7
Un estudio en Alemania muestra un incremento en la prevalencia de Acinetobacter baumani multirresistente en animales hospitalizados en la clínica veterinaria de la Universidad Justus-Liebig de Giessen y en otras clínicas de la ciudad durante un período de 9 años, donde registros del 2000 al 2008 del departamento de microbiología de la facultad de Veterinaria de esta universidad muestran que de 137 animales de diferente especie hospitalizados, 56 adquirieron infecciones por Acinetobacter spp, identificados y diferenciados por combinación de métodos genotípicos y susceptibilidad a los antimicrobianos. De estos, 52 aislados correspondieron a A. baumani, 3 a A. pittii y 1 con un perfil AFLP (Amplified fragment length polymorphism) no descrito, por lo tanto no fue clasificado.
El estudio concluye que A. baumani multirresistente ha sobrevivido en el ambiente hospitalario y se ha propagado tanto en el hospital y en otras clínicas por años, indicando una ocurrencia endémica del organismo en estas salas. En cuanto a la cadena de propagación ponen en consideración: la transferencia persistente de paciente a paciente, el traslado de animales de una clínica a otra, posible transmisión por manos de veterinarios, estudiantes y ganaderos, transporte de animales entre salas de exámenes y contaminación de los equipos.8
Del 2008 al 2010, 24 aislados de K. penumoniae (clon CTX-M-15 productora de ß-lactamasas resistente a ciprofloxacina), fueron recolectados de muestras de orina en perros no relacionados y gatos; 17 en el mismo hospital de referencia especializado en cirugías en la ciudad de París Francia, los otros 7 de clínicas regulares de suburbios de la ciudad. Se realizan pruebas de susceptibilidad a 32 antimicrobianos por el método de difusión en agar. Todos los aislados fueron resistentes a ß-lactámicos con pruebas de producción de ß-lactamasas y resistentes a ciprofloxacina.
El gen blac CTX-M-15, fue identificado en los 24 aislados de K. pneumoiae. De los 24 aislados, 17 procedían de mascotas sometidas a cistotomía o uretrostomía perineal para disolución de urolitos en el mismo hospital de referencia; los otros 3 aislados de clínicas regulares, dos por cirugías del mismo tipo y unos por cistitis crónica. De 4 aislados no se obtuvieron datos epidemiológicos.
El estudio sugiere la propagación del clon a través de seguimiento posoperatorio. A 9 aislados escogidos al azar se les realizaron pruebas de clonación y se detectaron plásmidos tipo InCR portadores del gen blc CYX-M-15. Este es el primer estudio donde se reporta el gen blac CTX-M-15 en un plásmido InCR, recientemente reportado en humanos, por esta razón, el estudio abre la hipótesis de la transmisión del humano a la mascota. Como el gen CTX-M-15, se ha reportado en E. coli, aislado de animales domésticos, la transferencia del gen a través deplásmidos entre bacterias también es plausible.9
Staphylococcus aureus resistente a meticilina (SARM) y Staphylococcus pseudointermedius resistente a meticilina (SPRM) son un problema emergente en la medicina veterinaria. Unidades de cuidados intensivos pueden estar particularmente en riesgo de brotes periódicos por la colonización y la enfermedad. SARM fue aislado del tubo de traqueostomía de un Golden Retriever macho en la unidad de cuidados intensivos UCI, del Colegio Veterinario de Ontario, esto llevó a una investigación de la colonización por SARM en otros animales en la UCI. SARM, se aisló de 6 de 26 (23%) animales durante el período del brote (4/22 2/4 perros y gatos). No se presentaron signos clínicos de infección por SARM en estos animales.
Todos los aislamientos fueron indistinguibles entre sí. En la UCI, se implementaron medidas de control de infecciones, incluyendo la vigilancia activa de todos los animales, las precauciones de barrera, y la higiene de manos para controlar el brote aparente. El brote de este informe pone de relieve el potencial de transmisión clínicamente inaparente de SARM dentro de una instalación y las medidas de control de infecciones que podrían facilitar su erradicación del entorno de las unidades de cuidados intensivos en las clínicas veterinarias.10
Las fuentes de infecciones asociadas a los hospitales pueden incluir el personal médico, la propia flora del paciente y objetos inanimados, a este respecto un estudio en Canadá en el colegio veterinario de Ontario (CVO), determina la prevalencia de contaminación de celulares portados por el personal del centro de ciencias de la salud del CVO con SPRM y SARM, donde el 1,6 % (2/123) correspondió a SPRM y el 0,8% (1/123) a SARM. Solo 21,9% (27/123) participantes en el estudio indicaron que limpiaban rutinariamente su teléfono celular.
El estudio concluye que los teléfonos celulares pueden albergar SPRM y SARM, dos oportunistas patógenos de gran importancia en infecciones intrahospitalarias a nivel humano y animal y que aunque la tasa de contaminación fue baja, los teléfonos podrían representar una potencial fuente de infección, para pacientes, personal hospitalario y otras personas que pueden tener contacto con ellos.
Independientemente de la incidencia de contaminación de teléfonos celulares encontrados en el estudio, esta investigación sugiere que debería instaurarse un protocolo de desinfección en teléfonos celulares personales y de hospitales, para reducir el potencial de contaminación cruzada.11
El papel del medio ambiente en la infección adquirida en hospitales (IAH), es en gran parte desconocido. La publicación de un estudio del colegio veterinario de Ontario en el 2010, plantea el control de la infección basado en la clínica, como un campo emergente en medicina veterinaria, y a los hospitales veterinarios como una intersección de la interacción humano y animal. El estudio se inició para determinar la recuperación de E. coli y de algunos patógenos veterinarios y zoonóticos del ambiente de 101 comunidades hospitalarias veterinarias. 90 fueron clínicas de animales de compañía, 10 de animales mezclados y 1 hospital para animales exóticos.
La proporción de hospitales con hisopos ambientales positivos fue para E. coli 92%, aislado principalmente de los pisos de las clínicas, Clostridium difficile 58% aislado principalmente en salas de aislamiento, SARM 9%, E. coli productora de CMY-2 9%, SPRM 7% y Salmonella sp 2%. El estudio además buscaba la presencia de Enteroccoccus sp resistente a vancomicina, parvovirus felino y calicivirus canino, pero estos no fueron aislados. La prevalencia de la resistencia a los antimicrobianos en cepas de E. coli fue baja, pero en todos los aislados se presentó resistencia al menos a 1 de los 15 antimicrobianos probados.
Importantes patógenos potenciales de animales y humanos fueron recuperados, incluyendo la cepa epidémica canadiense SARM-2, SARM-5 y el ribotipo 027 de C. difficile. El estudio concluye que la alta frecuencia de patógenos potenciales recuperados, combinado con las inadecuadas políticas de control, provee una oportunidad para el establecimiento de infecciones adquiridas en comunidades hospitalarias veterinarias.12
Una publicación del 2014 revela la preocupación por la falta de investigación en esta área en el continente africano. El estudio buscaba investigar la prevalencia y susceptibilidad antimicrobiana de SA (Staphylococcus aureus) y SP (Staphylococcus pseudointermedius) de animales de compañía y del ambiente, en el único hospital veterinario de la república de Zambia. Un total de 11 SA y 48 SP, fueron recolectados entre 101 muestras de animales de compañía (n=59) y del ambiente (n=42).
Las muestras de los animales provenían de oído izquierdo y derecho, piel y heridas. Las del ambiente, de manijas de puertas, mesas de exámenes, puertas de refrigeradores, superficies de bandejas, escritorios, escaleras, pisos, dispositivos médicos y objetos que frecuentemente estuvieran en contacto con el personal médico.
La prevalencia de SP y SA en animales y ambiente fue de 13,6% y 7,1% respectivamente. El estudio mostró el predominio de SP colonizando el 69,5% de animales de compañía y 16,7% aislado del ambiente. Ninguno de los SA aislado fue multirresistente, mientras que 5 aislados de SP (10,5%) mostraron multirresistencia.13
En Europa, la Comisión Europea pidió a la EMA (European Medicines Agency), desde el 2009, desarrollar un enfoque armonizado y coordinar la recogida de datos en una base anual sobre las ventas nacionales totales, de los agentes antimicrobianos veterinarios y su consumo, por parte de las principales especies productoras de alimentos (aves de corral, cerdos, carne de ternera, otros rumiantes, animales domésticos y peces).
Para el desarrollo de este proyecto se creó ESVAC (European Surveillance of Veterinary Antimicrobials), quien trabaja junto con el ECDC (the European Centre for Disease Control), la EFSA (the European Food Safety Authority) y la EURL-AMR (the European Reference Laboratory for Antimicrobial Resistance).
Este es el primer proyecto liderado por los países europeos que se basa en desarrollar políticas nacionales para reducir al mínimo los riesgos para la salud animal y humana que pueden derivarse del uso de antimicrobianos en la medicina veterinaria.14
En la conferencia mundial de la Organización Mundial de la Salud Animal OIE en el 2013 sobre el "uso responsable y prudente de los agentes antimicrobianos en los animales", se muestra la falta de un sistema de colección cuantitativo de datos de la resistencia bacteriana en el paciente animal y en las clínicas veterinarias de América Latina. En las américas solo USA y Canadá aportan el 4% de información por parte del continente a los sistemas mundiales de control y vigilancia de uso de los antimicrobianos.3
En Colombia no se han conformado grupos de investigación en resistencia bacteriana en animales; salvo los estudios para la vigilancia de la resistencia antimicrobiana de la cadena avícola y los realizados por el Instituto de Investigaciones Biológicas del Trópico de la Universidad de Córdoba.15,16 Tampoco grupos de vigilancia en infección nosocomial en los hospitales veterinarios del país.
Por estas razones, el objetivo de este estudio fue aislar microorganismos que circulan en el ambiente hospitalario de clínicas veterinarias de la ciudad de Ibagué, conocer su susceptibilidad frente a los antibióticos y determinar en algunos de los aislados mediante pruebas de conjugación bacteriana la capacidad de transferir la resistencia a los antimicrobianos a cepas sensibles.
Materiales y métodos
Diseño metodológico y análisis estadístico
Se utilizó un diseño metodológico cuasi experimental al no asegurar las condiciones de estabilidad ambiental que requiere un diseño experimental puro, ya que los ambientes de cultivo fueron controladas, no así la recolección de la muestra.
La investigación no pretendió medir la relacióncausa efecto; sino la presentación de resistencia a antimicrobianos que pueden tener las bacterias y la capacidad de transferencia de la misma, esta circunstancia representó para la escogencia de la muestra una cuidadosa y controlada elección de casos con ciertas características específicas para este estudio. El estudio se llevó a cabo en 3 fases.
En la primera, se realizó la toma de la muestra y el aislamiento microbiológico; en la segunda la realización de los antibiogramas y en la tercera, fueron escogidas dos especies bacterianas multirresistentes para la realización de pruebas de transferencia de la resistencia, mediante ensayos de conjugación bacteriana. Las variables fueron: el tipo de bacteria, el perfil de resistencia a antimicrobianos y la capacidad de transferir resistencia. El análisis estadístico fue realizado con el software estadístico SPSS versión 17.0. Se utilizó estadística descriptiva para la determinación de frecuencias y proporciones.
Delimitación de la población y de la muestra
De las clínicas veterinarias de animales de compañía de la ciudad de Ibagué Colombia, se tomaron 10 establecimientos a conveniencia, por ser los más antiguos y reconocidos en la ciudad. La población correspondió a las bacterias encontradas en los espacios nosocomiales veterinarios de la ciudad de Ibagué.
Un total de 5 muestras fueron tomadas por clínica, tres correspondían a áreas del ambiente: mesa, quirófano y piso, las otras dos a procedimientos de contacto directo entre médico y paciente: fonendoscopio y manos del veterinario.
Aspectos éticos
Los propietarios de las clínicas fueron informados sobre los objetivos y procedimientos del estudio, dejando claro que la toma de las muestras se realizaría sin previo aviso, para lo cual se solicitó una firma de consentimiento informado. No se practicaron procedimientos experimentales, por esta razón no se solicitó aval de un Comité de ética.
Aislamiento e identificación bioquímica
Las muestras fueron tomadas sin previo aviso en la jornada normal de trabajo del turno de la mañana. Todas las superficies se muestrearon utilizando hisopos estériles (BD BBLTM CultureSwabTM Plus Collection & Transport System), excepto la muestra del aire circulante en los quirófanos ya que esta se tomó dejando expuesto un agar sangre (BIOBACTER® LTDA, agar sangre de cordero) durante dos horas.
Una vez recolectadas las muestras se trasladaron al laboratorio diagnóstico de la Facultad de Medicina Veterinaria y Zootecnia de la Universidad Cooperativa de Colombia sede Ibagué, se sembró cada una de las muestras en agar Sangre y Mac Conkey (BIOBACTER® LTDA), e incubación 37°C a 24 horas. Para la identificación bioquímica de las bacterias Gram negativas se utilizó el kit de bacterias entéricas no fermentadoras BBL (BD BBL CrystalTM Identification Systems Enteric/Nonfermenter ID Kit) y para las Gram positivas un kit especializado para bacterias de este tipo (BD BBL CrystalTM Identification Systems Gram-Positive ID Kit).
Pruebas de sensibilidad a los antimicrobianos
Los antibiogramas fueron realizados utilizando la técnica de difusión en agar según normas CLSI.17 Los sensidiscos marca OXOID® usados fueron: doxiciclina (30ug), sulfatrimetoprim (23.75ug sufametazina - 1,25ug Trimetoprim), gentamicina (10 ug), amoxicilina (10 ug), cloranfenicol (30ug), norfloxacina (10ug) y eritromicina (15ug).
Pruebas de conjugación bacteriana
Los experimentos de transferencia de la resistencia se realizaron mediante pruebas de conjugación bacteriana. Las bacterias con las que se realizaron las pruebas de conjugación fueron: Cepa receptora: Escherichia coli C600 Nal suplida por el Instituto de Biotecnología de la Universidad Nacional de Colombia, resistente al ácido nalidíxico y sensible a ciprofloxacino y gentamicina.
Cepas donadoras: Se utilizaron 2 cepas multirresistentes aisladas de las clínicas, que fueran sensibles al ácido nalidíxico al cual la receptora era resistente y resistentes a antibióticos a los cuales la cepa receptora era sensible.
1) Klebsiella pneumoniae sensible al ácido nalidíxido y resistente entre otros a ciprofloxacino. 2) Enterobacter cloacae sensible al ácido nalidíxico y resistente a gentamicina entre otros.
Los experimentos de conjugación se realizaron mediante la técnica de dilución en medio líquido y medio sólido por mezcla y apareo de cepa donante y receptoras.18 Se determinó en las tres cepas la concentración inhibitoria mínima (CIM) de los antibióticos a analizar, mediante el método de dilución en caldo de acuerdo con lo establecido por el CLSI.19
K. pneumoniae y E. cloacae fueron mezcladas individualmente con E. coli C600 Nal en una proporción de 1:10 a favor de la cepa receptora en caldo LB. Los cultivos fueron mezclados e incubados durante toda la noche a 37°C.
A partir de este cultivo, una alícuota de 100 µL se inoculó en placas de agar Muller Hinton suplementadas con ciprofloxacina, y ácido nalidíxico, para evaluar la transferencia de la resistencia a ciprofloxacino en claso de K. pneumoniae y placas de agar Muller Hinton suplementadas con gentamicina y ácido nalidíxico para evaluar la transferencia de la resistencia de E. cloacae a la gentamicina.
Resultados
Las 10 clínicas de animales de compañía seleccionadas respondieron afirmativamente a la carta de consentimiento informado sobre la toma de muestras sin previo aviso en sus instalaciones, equipo y personal médico.
El total de cultivos realizados en las clínicas fue de 50, correspondientes a 5 áreas muestreadas por clínica: mesa de exploración, piso, quirófano, fonendoscopio y manos del médico veterinario de turno.
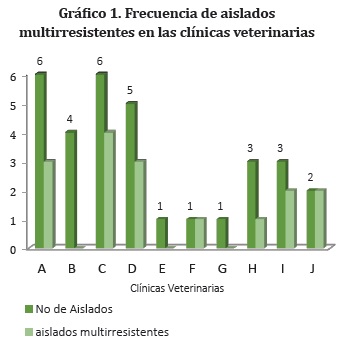
De los 50 cultivos, se obtuvieron 32 aislamientos correspondientes a 16 especies bacterianas. Ocho especies fueron consideradas multirresistentes por su resistencia a 2 o más antimicrobianos usados en la investigación, estas fueron aisladas en 7 de las 10 clínicas estudiadas (Gráfico 1).
Bacterias aisladas del ambiente hospitalario
De las 16 especies bacterianas, las que se encontraron con mayor frecuencia en las clínicas fueron: Staphylococcus intermedius en cuatro clínicas, dos aislados de quirófanos y 2 de pisos, Bacillus megaterium en 4 clínicas, 2 de quirófanos, 1 aislado de una mesa de procedimientos y el otro del piso de 1 clínica.
Acinetobacter baumanni en 3 lugares, mesa, manos y piso de clínicas diferentes, Pantoea aglomerans en 2 clínicas, quirófano y piso ambos multirresistentes y Burkhordelia cepacia en 2 clínicas, manos del médico de una clínica, y de mesa y piso de otra, los 3 aislados presentaron multirresistencia.
De todas las áreas de las clínicas incluyendo manos de veterinarios se aislaron microorganismos multirresistentes considerados potencialmente patógenos (Tabla 1).
De las 16 especies bacterianas aisladas de áreas diferentes en las 10 clínicas, 6 (37,5%) presentaron sensibilidad a todos los antimicrobianos probados: Actinomyces pyogenes, Bacillus brevis, Bacillus circulans, Rothia dentocariosa, Staphylococcus saprophyticus y Streptococcus intermedius. Dos especies (12,5%) fueron resistentes a un solo antimicrobiano A. baumanni y B. megaterium. Las demás especies (50%) mostraron resistencia a dos o más antimicrobianos (Gráfico 2).
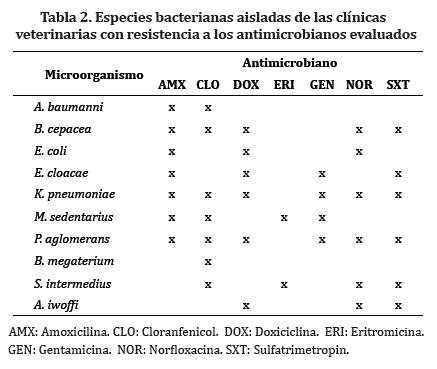
Comportamiento frente a los antimicrobianos usados. A los antibióticos que se les presentó mayor resistencia fueron la amoxicilina y el cloranfenicol ambos en el 43,75% delas especies aisladas, seguidos de doxiciclina, gentamicina y norfloxacina estos últimos en el 37,5% de las especies (Tabla 2).
Pruebas de conjugación. Luego de la mezcla y apareo entre cepa donante y receptoras creció E. coli C600 Nal transconjugante resistente a ácido nalidíxico y norfloxacina y E. coli C600 Nal transconjugante resistente a ácido nalidíxico y gentamicina.
Discusión
Este estudio da a conocer las bacterias que circulan en el ambiente de las clínicas veterinarias analizadas de la ciudad de Ibagué, muestra su perfil de resistencia a antibióticos y cómo en todas sus áreas se encontraron microorganismos potencialmente patógenos y multirresistentes a antimicrobianos, algunos capaces de transferir dicha resistencia a bacterias sensibles.
Las especies bacterianas encontrada en esta investigación comunes en áreas hospitalarias, Staphylococcus intermedius, Acinetobacter baumanni, Burkhordelia cepacea y Klebsiella pneumoniae son patógenos potenciales y/o albergan un conjunto de genes de resistencia a antibióticos que podrían colocar en riesgo la sanidad humana y animal. Estos microorganismos pueden contribuir a la aparición de infecciones adquiridas en estas clínicas y posiblemente a la epidemiología de infecciones oportunistas tanto en las clínicas como en la comunidad incluyendo zoonosis.
Estas bacterias pueden colonizar o infectar animales de compañía o a las personas y aumentar la diseminación de bacterias en el ambiente. En ausencia de signos clínicos, la identificación de pacientes o personal que labora en las clínicas potencialmente infecciosos es difícil. Por lo tanto, la implementación apropiada de medidas de control para evitar la propagación de estos organismos en el ambiente de clínicas veterinarias es muy importante.
Una de las limitantes de la investigación fue que las pruebas bioquímicas utilizadas para el aislamiento bacteriológico no discriminan entre S. intermedius de S. pseudointermedius según la actual reclasificación del Grupo S. intermedius; por esto en el estudio se designan a los aislados como S. intermedius y no se enfrentaron a meticilina.20 S. intermedius aislado en nuestro estudio de cuatro clínicas de pisos y quirófanos, es la principal causa de pioderma canino; su modo de transmisión ocurre principalmente por contacto directo.21
En un estudio realizado por Sanz en el 2009, mostró que fue la bacteria que con más frecuencia (50%) se aisló de heridas quirúrgicas en perros y gatos. S. intermedius es uno de los microorganismos que a nivel mundial ha demostrado mayor evidencia en el aumento de la resistencia.22
En esta investigación en tres de las clínicas se mostró multirresistencia. Al igual que en el presente estudio, S. intermedius fue aislado con mayor frecuencia del ambiente nosocomial de 2 sedes que conforman los hospitales clínicos veterinarios de la Universidad de Chile, en donde se tomaron hisopados en salas de hospitalización, consulta, rayos x y quirófanos aunque el estudio no especifica el área de la cual fue aislado.23
Derivados de la penicilina fueron los antibióticos comunes a los que este microorganismo presentó mayor resistencia, tanto en el ambiente de las clínicas veterinarias de la universidad de Chile, como en las áreas de las clínicas de Ibagué en la actual investigación.
Acinetobacter baumannii es un cocobacilo gramnegativo reconocido como patógeno nosocomial, en los últimos años ha sido designado como patógeno humano en "alerta roja" generando alarma entre la comunidad médica derivada en gran parte de su extenso espectro de resistencia a los antibióticos.24 Lemos y colaboradores encontraron la presencia de farmacorresistencia múltiple como el principal factor de riesgo para la mortalidad de pacientes con infección intrahospitalaria por A. baumannii en las unidades de cuidados intensivos de Colombia.25
La infección nosocomial por este microorganismo a nivel veterinario es una preocupación emergente. El rol de las acinetobacterias en infecciones en animales hospitalizados es en gran parte desconocido. Zordan y colaboradores en el 2011 muestran su incremento en la prevalencia en la adquisición de infecciones en hospitales veterinarios de Alemania.8 En esta investigación A. baumannii se encontró en tres de las clínicas estudiadas, en mesa, piso y manos, estas últimas merecen especial consideración a pesar de que ninguno de los aislados en el estudio mostró multirresistencia, ya que estudios muestran que la mayoría de A. baumanni causante de infecciones en animales ha sido adquirido en hospitales propagado principalmente a través de manos del personal sanitario.24
Burkhordelia cepacia llamada inicialmente Pseudomona cepacia por William Burkholder en 1950 como el agente causante de la descomposición bacteriana de bulbos de cebolla, fue catalogado en 1992 como un nuevo género, separándose por diferencias genéticas del género Pseudomona.26 A pesar de que en la literatura no se reporta como un patógeno nosocomial en medicina veterinaria, es llamado por algunos autores "el patógeno emergente multihuésped" ya que causa infecciones en humanos, animales y plantas pero también usado como biopesticida lo que ha causado controversia ya que estudios han evidenciado que el medio ambiente puede ser un reservorio para la adquisición de nuevas infecciones.26,27
En 1972 se describió por primera vez como patógeno oportunista en humanos, aislándose en pacientes inmunocomprometidos.28 En animales se ha encontrado causando neumonía en caballos, mastitis en ovejas, septicemia en aves y aislado de infecciones urinarias en perros.29,30 En este estudio B. cepacia se encuentra en dos clínicas, en mesa de exploración y en manos de un médico veterinario, ambos aislados presentan multirresistencia.
La familia Enterobacteriaceae por su ubicuidad dentro y fuera del cuerpo a menudo causa infecciones oportunistas en la comunidad y en pacientes humanos y animales hospitalizados.31
En la presente investigación enterobacterias se encontraron en varios sitios de las clínicas pero en baja frecuencia aunque todos los aislados presentaron multirresitencia: P. aglomerans, K. pneumoniae, E. coli y E. cloacae a diferencia de un estudio realizado en el Centro Médico Quirúrgico de pequeños animales de la Universidad Cooperativa de Colombia sede Bucaramanga, donde bacterias pertenecientes a esta familia (K. ozaenae, E. agglomerans y E. coli) fueron las más frecuentemente aisladas de varias superficies y objetos que tenían contacto con los animales.32 E. coli en la actual investigación se aisló solo de la mesa de una clínica a diferencia del estudio en hospitales veterinarios de Canadá donde se aisló del 92% de los centro médicos estudiados aunque con baja resistencia a los antimicrobianos probados.12
La mayoría de las investigaciones han relacionado la multirresistencia de las enterobacterias con la presencia de plásmidos; estas unidades de ADN extracromosómico portan genes de resistencia a uno o varios antibióticos que se transfieren entre especies bacterianas principalmente de la misma familia.33 En este estudio se realizaron pruebas de conjugación bacteriana en las que se buscaba la trasferencia de plásmidos portadores de resistencia.
En efecto las bacterias multirresistentes aisladas de las clínicas de la ciudad de Ibagué, K pneumoniae y E. cloacae, transfirieron su resistencia a una cepa receptora. Aunque en los experimentos de conjugación solo se probó la capacidad de transferir resistencia a un solo antibiótico y no se realizaron experimentos para la extracción de plásmidos. La cepa de E. cloacae utilizada en la prueba de conjugación fue aislada de las manos de un médico veterinario, esto es muy relevante ya que el principal mecanismo de transmisión de las enterobacterias es a través de las manos del personal sanitario que se coloniza cuando entra en contacto con pacientes que a su vez están colonizados.33
Conclusiones y recomendaciones
Es preocupante que en todas las áreas de las clínicas de Ibagué analizadas, se encuentren microorganismos potencialmente patógenos y multirresistentes en el ambiente hospitalario, incluyendo manos de veterinarios. La alta frecuencia de multirresistencia revela la existencia de fuertes presiones selectivas ejercidas por el uso indiscriminado de los agentes antimicrobianos en las clínicas de animales de compañía.
Esto muestra que las clínicas veterinarias se enfrentan a un gran desafío en materia de prevención, control y tratamiento de las infecciones por estos microorganismos, similares a las situaciones en hospitales humanos, por otro lado, la posibilidad de propagación del ser humano al animal o viceversa requiere atención especial.
En esta investigación se encontró que los pisos fueron los sitios donde existe más cantidad de microrganismos, que pueden actuar como reservorios ambientales de patógenos de animales de compañía, ya que estos tienen más probabilidades de estar contaminados con materiales infecciosos (heces, por ejemplo) y por la conducta exploratoria de los animales de colocar nariz y boca en estas áreas; por tal motivo, los pisos de las clínicas veterinarias requieren de una limpieza más rigurosa que los de hospitales humanos.
Tanto en medicina veterinaria como humana se deben llevar unas medidas básicas de control de infecciones con eficacia que pueden agruparse en 4 grandes áreas: (1) precauciones estándar dentro de ellas higiene de manos; (2) precauciones específicas que buscan evitar la transmisión de determinados patógenos desde un paciente colonizado o con una infección activa al resto de los pacientes o al personal sanitario; (3) medidas de limpieza y desinfección ambiental; y (4) actividades de vigilancia e intervenciones específicas.34
Este estudio preliminar apunta a la necesidad de la investigación en el control de infecciones en la comunidad de animales de compañía la medicina veterinaria. En Colombia se requieren estudios donde se cuantifique la frecuencia de infecciones adquiridas en hospitales (IAH), se correlacionen los microorganismos con las IAH, factores asociados con IAH, el papel de los reservorios ambientales y factores asociados con la reducción de la carga ambiental entre otros.
Además este estudio en la ciudad de Ibagué, forma parte de la "Solidaridad Internacional de la OIE, en la lucha contra la resistencia a los agentes antimicrobianos" y recomienda la creación de un Programa de Vigilancia y Control de las infecciones veterinarias en el país donde se conozcan las bacterias que circulan en los hospitales veterinarios, se desarrolle y establezca un sistema nacional armonizado para la recogida de datos sobre el seguimiento de la resistencia antimicrobiana en patógenos animales basado en los estándares de la OIE y vigilancia en el cumplimiento de las recomendaciones sobre asepsia, antisepsia y desinfección en los hospitales veterinarios.
El estudio concluye que la alta ocurrencia de aislamiento de patógenos potenciales portadores de genes de resistencia, combinado con políticas inadecuadas de control de la infección, proporciona una gran oportunidad para el desarrollo de infecciones adquiridas en hospitales (IAH), en comunidades veterinarias de animales de compañía.
Agradecimientos
A la Universidad Cooperativa de Colombia que a través del Comité Nacional para el Desarrollo de la Investigación CONADI, financió este proyecto, al profesor Iván Posada compañero de la facultad, por su acompañamiento, a los Doctores Rafael Muñoz y Yeison Yaima por su participación en el proyecto y al Instituto de Biotecnología de la Universidad Nacional de Colombia IBUN, especialmente a la Doctora Emilia María Valenzuela por su aporte humano, técnico y científico.
Referencias
1. FAO; OIE; OMS. Comunicado No 11/317. Boletín ONU, Sede de la Reunión técnica de alto nivel sobre enfermedades zoonóticas. México, Cuba, República Dominicana: Centro de Información de las Naciones Unidas; 2011. [ Links ]
2. Andrews B. Antimicrobial use in animal husbandry and its relationship to resistant bacteria in human health. In OIE International standards on antimicrobial resistance. Paris: 2013. [ Links ]
3. Diaz F. Antimicrobial use in animals: analysis of the OIE survey on monitoring of the quantities of antimicrobial agents used in health. In OIE International standards on antimicrobial resistance. Paris: 2013. [ Links ]
4. Scott RD. The direct medical costs of health care associated infections in U.S. hospitals and the benefits of prevention. National center for preparedness, detection, and control of infectious diseases. 2009. [ Links ]
5. Comité Internacional de la OIE. Resolución XXX. Directrices para el control de la resistencia a los antimicrobianos. París: 2003. [ Links ]
6. Justine A, Johnson D. Nosocomial infections. The veterinary clinics small animal practice. 2002;32:1101-1126. [ Links ]
7. Benedict KM, Morley PS, Van Metre DC. Characteristics of biosecurity and infection control programs at veterinary teaching hospitals. Journal of the American Veterinary Medical Association. 2008;233(5):767-773. [ Links ]
8. Zordan S, Prenger-Berninghoff E, Weis R, Van der Reijden T, Van den Broek P, Baljer G, Dijkshoorn L. Multidrug-resistant Acinetobacter baumannii in veterinary clinics, Germany. Emerg Infect Dis. 2011;17(9):1751-4. [ Links ]
9. Haenni M, Ponsin C, Metayer V, Medaille C, Madec J. Veterinary hospital-acquired infections in pets with a ciprofloxacin-resistant CTX-M-15-producing Klebsiella pneumoniae ST15 clone. J Antimicrob Chemother. 2012;67(3):770-1. [ Links ]
10. Weese JS, Faires M, Rousseau J, Bersenas AM, Mathews KA. Cluster of methicillin-resistant Staphylococcus aureus colonization in a small animal intensive care unit. J Am Vet Med Assoc. 2007;231(9):1361-4. [ Links ]
11. Julian T, Singh A, Rousseau J, Weese JS. Methicillinresistant staphylococcal contamination of cellular phones of personnel in a veterinary teaching hospital. BMC Research Notes. 2012;5:193. [ Links ]
12. Murphy C, Reid-Smith RJ, Boerlin P, Weese JS, Prescott JF, Janecko N, Hassard L, McEwen SA. Escherichia coli and selected veterinary and zoonotic pathogens isolated from environmental sites in companion animal veterinary hospitals in southern Ontario. Can Vet J. 2010;51(9):963-972. [ Links ]
13. Youn JH, Park YH, Hang'ombe B, Sugimoto C. Prevalence and characterization of Staphylococcus aureus and Staphylococcus pseudintermedius isolated from companion animals and environment in the veterinary teaching hospitalin Zambia, Africa. Comparative Immunology, Microbiology and Infectious Diseases. 2014;37(2):123-130. [ Links ]
14. Mackay D. Key success factors for surveys of antimicrobial sales and use in the European Union. O.I.E. Conferencia Mundial de la OIE sobre el uso responsable y prudente de los agentes antimicrobianos en los animales. París: 2013. [ Links ]
15. Donado P, Clavijo V, León M. Prevalence, risk factors, and antimicrobial resistance (AMR) profiles of Salmonella sp. in commercial broiler farms in two important poultry-producing regions of Colombia. JFP. 2011;75(6):1134-1138. [ Links ]
16. Vargas J, Máttar S, Monsalve S. Bacterias patógenas con alta resistencia a antibióticos: estudio sobre reservorios bacterianos en animales cautivos en el zoológico de Barranquilla. Infectio. 2010;14(1):6-19. [ Links ]
17. Clinical and Laboratory Standars Institute (CLSI). Performance standards for antimicrobial susceptibility testing. Document M100-S18. Eighteenth edition ed. 2009. [ Links ]
18. Calderón R, Sacsaquispe R, Pasterán FG, Galas MF, Javier Soto JP y cols. Caracterización molecular de klebsiella pneumoniae y Enterobacter cloacae productoras de ß-lactamasas de espectro extendido tipo shv-5 en una unidad de cuidados intensivos neonatal de lima. Rev peru med exp salud pública. 2003;20(3). [ Links ]
19. Clinical and Laboratory Standards Institute CLSI. Methods for dilution antimicrobial susceptibility tests for bacteria that grow aerobically; approved standard. Clinical and Laboratory Standards Institute CLSI. 2012;32(2). [ Links ]
20. Sasaki T, Kikuchi K, Tanaka Y, Takahashi N, Kamata S, and Hiramatsu K. Reclassification of phenotypically identified Staphylococcus intermedius strains. J clinl Microbiol. 2007;45(9):2770-2778. [ Links ]
21. DeBoer D. Canine staphylococcal pyoderma', US Companion Animal Health. 2006:26-28. [ Links ]
22. Sanz L, Junco C. Infecciones bacterianas de las heridas operatorias-Identification of the etiology of bacterial infections of surgical wounds. Hospitales Veterinarios. 2009;1(1). [ Links ]
23. Jara OA, Avendaño RP, Navarro VC. Identificación y estudio de susceptibilidad antimicrobiana de bacterias potencialmente responsables de infecciones nosocomiales en los hospitales veterinarios de la Universidad de Chile. Av. Cs. Vet. 2009;1&2:11-17. [ Links ]
24. Howard A, O'Donoghue M, Feeney A, Sleator RD. Acinetobacter baumannii. An emerging opportunistic pathogen. Virulence. 2012;3(3):243-250. [ Links ]
25. Lemos EV, De la Hoz Restrepo F, Alvis N, Quevedo E, Cañon O, León Y. Mortalidad por Acinetobacter baumannii en unidades de cuidados intensivos en Colombia. Rev Panam Salud Publica. 2011;30(4):287-94. [ Links ]
26. Gil DM. Bacteremia de curso fatal por Burkholderia cepacia: Revisión de la literatura a propósito de un caso clínico. Rev Chil Infect. 2001;18(1):41-44. [ Links ]
27. Sousa SA, Ramos CG, and Letãio JH. Burkholderia cepacia Complex: Emerging multihost pathogens equipped with a wide range of virulence factors and determinants. Int J Microbiol. Volume 2011, Article ID 607575, 9 pages doi:10.1155/2011/607575. [ Links ]
28. Frias A. Burkholderia cepacia (B. cepacia), a new pathogen in nosocomial infections clinic cases. Enf Inf. Microbiol. 2008;28(1):19-23. [ Links ]
29. Collobert C, Fortier G, Perrin R, Letot G, Andrioud D. Bacteria and fungi isolated from equine tracheobronchial aspirates. Prat Vet Equin. 1995;27:91-96. [ Links ]
30. Akkoç A, Kocabiyik Al, Özyigit MÖ, Cangül IT, Yilmaz R, Özakin C. Burkholderia cepacia and aeromonas hydrophila septicemia in an african grey parrot (psittacus erithacus erithacus). turkish journal of veterinary & animal sciences. 2008;32(3):233-236. [ Links ]
31. Fariñas MC, Martínez ML. Infecciones causadas por bacterias gramnegativas multirresistentes: enterobacterias, Pseudomona aeruginosa, Acinetobacter baumannii y otros bacilos. Enferm Infecc Microbiol Clin. 2013;31(6):402-409. [ Links ]
32. Chaparro JL, Hernández YK, Castellanos V, Arcila VH. Aislamiento, identificación y antibiograma de las bacterias presentes en el Centro médico quirúrgico veterinario Universidad Cooperativa de Colombia. Rev Col Cienc Pec. 2005;18(4):381-381. [ Links ]
33. Ocaña C, Rocchi A, Gasparotto I, et al. Bacteriemia por enterobacterias en adultos en un hospital universitario: análisis de cinco años. Rev. Argent. Microbiol. 2007;39(1):38-43. [ Links ]
34. Lupión C, López LE, Rodríguez JB. Medidas de prevención de la transmisión de microorganismos entre pacientes hospitalizados. Higiene de manos. Enferm Infecc Microbiol Clin. 2014;32(9):603-609. [ Links ]