Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Universidad y Salud
Print version ISSN 0124-7107On-line version ISSN 2389-7066
Univ. Salud vol.17 no.1 Pasto Jan./June 2015
Metodología rápida y sencilla para la determinación de colifagos somáticos como indicadores de contaminación fecal en una planta de tratamiento de agua localizada al noreste colombiano
Quick and easy methodology to determine somatic coliphages as indicators of fecal contamination in a water treatment plant located in northeastern Colombia
Raquel Amanda Villamizar-G.1, Oscar O. Ortíz-R.2, Enrique Aquiles-Darghan3
1 PhD. Nanociencia y nanotecnología. Profesora Auxiliar del Departamento de Microbiología, Facultad de Ciencias Básicas, Universidad de Pamplona. Pamplona, Colombia. e-mail: Raquel.villamizar@unipamplona.edu.co
2 PhD. en Ingeniería de procesos y ambiental. Profesor Asociado del Departamento de Ingeniería Industrial, Facultad de Ingenierías & Arquitectura - Universidad de Pamplona. Pamplona, Colombia. e-mail: oscarortiz@unipamplona.edu.co
3 PhD. en Estadística. Profesor Auxiliar del Departamento de Agronomía, Facultad de Agronomía. Universidad Nacional de Colombia. Santa Fé de Bogotá, Colombia. e-mail: e_darghan@hotmail.com
Fecha de recepción: Agosto 04 - 2014 / Fecha de aceptación: Mayo 26 - 2015
Resumen
Introducción: En el presente artículo se propone una metodología rápida y sencilla para determinar colifagos sómaticos en las diferentes etapas del tratamiento de agua de una planta del Nordeste Colombiano, con el fin de verificar la calidad del proceso de potabilización. Materiales y métodos: Se empleó la técnica de filtración por membrana para obtener el contenido fágico y posteriormente se cuantificó la presencia de los virus a través de la metodología de capa simple usando agar tripticasa de soya modificado. Resultados: El 88% de las muestras de agua analizadas resultaron ser positivas en alguna de las etapas del proceso de potabilización. La presencia de fagos aumentó en época de lluvias con recuentos máximos de 1310 UFP/100mL en la etapa de captación del agua y de 2,5 UFP/100mL en la etapa de cloración. La prueba no-paramétrica Chi cuadrado de homogeneidad en distribución corroboró estadísticamente la igualdad en distribución de las muestras positivas encontradas en cada una de las etapas de potabilización (p>5%) pues el muestreo fue fijado por indicador. Conclusión: La metodología empleada permitió en tan solo 12 horas determinar la presencia de colifagos somáticos en las diferentes etapas de tratamiento de agua de la planta objeto de estudio. Además, se comprobó la elevada resistencia de estas nanomáquinas naturales a los procesos de desinfección, que mostraron persistencia en etapas de almacenamiento y distribución, especialmente en época de lluvias.
Palabras clave: Agua, potabilización, bacterias, coliformes, colifagos. (Fuente: DeCS, Bireme).
Abstract
Introduction: In this article a quick and simple method is proposed to determine somatic coliphages in the different stages of water treatment in a plant in the northeast of Colombia, in order to verify the quality of the treatment process. Materials and methods: The technique of membrane filtration was used to get the phage content and subsequently through the methodology of single layer using tryptic soy agar modified, the presence of the virus was quantified. Results: 88% of the water samples analyzed were found to be positive in any of the stages of purification. The presence of phages increased during the rainy season with maximum counts of 1310 UFP/100 mL at the stage of uptake of water and 2.5 UFP/100 mL in the chlorination stage. Non-parampetrica Chi square homogeneous distribution test confirmed statistically equal distribution of positive samples found in each of the stages of purification (p> 5%) because the sample was determined by indicator. Conclusion: The methodology allowed to determine the presence of somatic coliphages at different stages of water treatment in the plant under study in only 12 hours. In addition, the high resistance of these natural nanomachines to the processes of disinfection was found, which showed persistence in warehousing and distribution stages, especially in the rainy season.
Keywords: Water, water purification, bacteria, coliforms, coliphages. (Source: DeCS, Bireme).
Introducción
Durante el último cuatrienio de esta década, la importancia del agua como vehículo transmisor de patógenos ha ido ganando más protagonismo, haciéndose necesario evaluar las condiciones microbiológicas y fisicoquímicas del agua potable que consumen las personas que habitan tanto en países desarrollados como en vía de desarrollo.1,2
Microbiólogos, epidemiólogos y responsables de la calidad de agua han debatido sobre la utilidad de hacer seguimiento y monitoreo a la presencia de virus y/o bacteriófagos, como indicadores de contaminación, comprobando así la eficiencia de los procesos de potabilización.3
Sin embargo, no existe un consenso aún al respecto y lo que se hace urgente, es una correcta gestión de la calidad del agua que vaya encaminada a cumplir con lo que establece el séptimo Objetivo de Desarrollo del Milenio (ODM), que es reducir a la mitad, para 2015, la proporción de personas sin acceso sostenible al agua potable y a servicios básicos de saneamiento.4,5
Los bacteriófagos son virus que infectan bacterias y su distribución es cosmopolita, estimándose que existe un total 1031 en todo el planeta y un rango de 104 a 108 en ambientes acuáticos siendo los colifagos somáticos de las familias Myoviridae y Siphoviridae los más abundantes.6,7
Métodos moleculares altamente específicos han sido ampliamente usados para hacer detección e identificación de bacteriófagos en diferentes fuentes.8-11 Sin embargo, existen muchas limitaciones en cuanto a costos, manejo, equipos sofisticados, personal entrenado, reactivos, laboratorios o instalaciones adecuadas, que hacen que su aplicación en países en vía de desarrollo sea poco practicable.12
Metodologías más convencionales, sencillas y efectivas, han sido empleadas para determinar la presencia de fagos. Tal es el caso Boudaud N et al.,13 en el año 2012, quienes investigaron el grado de remoción de los fagos MS2, GA y Qß para comprobar la eficiencia del proceso de tratamiento de agua a escala piloto. La detección de los fagos fue llevado a cabo usando el método de agar de capa doble. Beaudoin NR et al.,14 en el año 2007, aislaron fagos a partir de aguas residuales usando el ensayo de formación de calvas usando capas sólidas y blandas de agar TS. Los investigadores identificaron la presencia de los virus en 24 horas y exploraron con éxito su utilización en la remoción de bacterias patógenas en agua de parques recreacionales.
En Colombia, Campos C et al.,15 en el año 2002, introdujeron el uso de virus F+, somáticos y fagos de Bacteroides fragilis y los compararon con las bacterias tradicionales usadas como indicadores de contaminación fecal. Los resultados obtenidos por los autores mostraron mayor resistencia de los virus a los tratamientos de aguas residuales por medio de lagunas facultativas. Aricapa G et al.,16 en el año 2005, estudiaron la prevalencia de colifagos en el agua del acueducto de la vereda la Cabaña, en Manizales.
Para tal fin, emplearon el ensayo de formación de calvas en agar TSA modificado y reportaron recuentos entre 0-95 UFP/100 mL.16
Recientemente, Gaviria A et al.,17 en el año 2012, reportaron la formación de calvas sobre agar TS para establecer un protocolo para el aislamiento de bacteriófagos a partir de aguas residuales específicos para E. coli DH5α.
No obstante, la utilización de fagos plantea ciertos desafíos entre los que se encuentra la obtención de células hospederas que no exhiban resistencia a la infección por estos parásitos intracelulares obligados. Obtener células hospederas procedentes del mismo ecosistema donde habiten los bacteriófagos aumenta la especificidad en la interacción de virus-huésped, facilitando el proceso de detección.6-19
Por lo tanto, a través de esta investigación se adaptó una sencilla y rápida metodología para la determinación de colifagos somáticos que puedan ser empleados para verificar la eficiencia del proceso de potabilización. Para tal fin, se aisló una cepa de E. coli autóctona, presente en la fuente de captación de agua de la planta potabilizadora y se empleó como hospedera de los virus, lo que facilitó la observación de zonas de lisis en los ensayos experimentales llevados a cabo en el laboratorio.
Basado en la literatura científica reportada, este es el primer estudio aplicado a una planta de tratamiento de agua localizada en el Noreste Colombiano, con el que se buscó verificar sí el agua que consume la población, se encuentra libre de agentes patógenos que pudieran potencialmente afectar la salud pública de sus habitantes.
Materiales y métodos
Tipo de Estudio. El estudio realizado fue descriptivo. En el primer lugar, se generó una distribución bivariada del recuento de coliformes por etapa de evaluación (decantación, filtración y cloración). Posteriormente se obtuvo la distribución de las muestras positivas/negativas (presencia de fagos) en las muestras de agua de las diferentes etapas de potabilización.
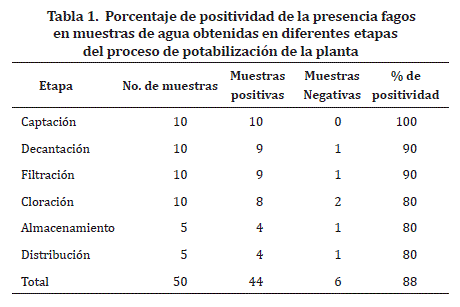
Se calculó el porcentaje de positividad de la presencia fagos en muestras de agua obtenidas en diferentes etapas del proceso de potabilización de la planta. Además, se obtuvieron los perfiles para el número de colifagos por etapa discriminado por período estacionario (seco, lluvioso). Finalmente se estimó el porcentaje de remoción de los indicadores microbiológicos (Coliformes totales. E. coli y colifagos) por etapa (bocatoma, decantación, filtración y cloración).
Población y muestra. Se seleccionaron de manera aleatoria diferentes puntos de muestreo a cada uno de los tanques empleados en el proceso de potabilización de agua de una planta de tratamiento localizada en el Noreste de Colombia.
Las muestras de agua recolectadas se clasificaron en dos grupos: muestras no tratadas (las cuales se colectaron en el lugar de captación del agua "bocatoma" denominada en adelante como "B") y muestras tratadas (colectadas en diferentes etapas del proceso de potabilización: decantación, filtración, cloración, almacenamiento y distribución), denominadas en adelante como D, F, C, A y Dt respectivamente.
Ajustándose a los lineamientos establecidos para las entidades de vigilancia y control dado por la Resolución 2115 dada por el Ministerio de la Protección Social y el Ministerio de Ambiente, Vivienda y Desarrollo Territorial Colombiano (MPS/MAVDT 2007) el número de muestras tomadas fue de 5 (1 por semana) en el mes de agosto de 2012 (período seco) y 5(1 por semana) en mayo de 2013 (período lluvioso) para los análisis microbiológicos de coliformes totales y E. coli en cada una de las etapas del proceso de potabilización.20
Lo anterior teniendo en cuenta que la población que surte la planta de tratamiento objeto de estudio es de 100.000 habitantes. Las muestras fueron recogidas por duplicado en frascos de vidrio estériles de 500 mL de capacidad. A los recipientes de vidrio empleados para la recolección de muestras en los puntos F, C, A y Dt se les adicionó previamente 0,1 mL/100 mL de tiosulfato de sodio al 1,8% (p/v) como declorinante. Las muestras fueron transportadas al laboratorio usando neveras provistas de hielo seco y fueron procesadas en un tiempo inferior a una hora después de su recolección (Adaptado de Wiedenmann A ).21
Cuantificación de coliformes totales y E. coli (CT y EC). La cuantificación de CT y EC se realizó empleando las técnicas sugeridas en la resolución 2215 de 2007 para análisis microbiológicos de aguas. Para el agua sin tratar "B" se empleó la técnica de sustrato definido usando caldo LMX-Fluorocult. Para las muestras tratadas (D, F, C, A y Dt) se empleó la técnica de filtración por membrana de acuerdo a la APHA, 1998, usando membranas estériles 0,45 µm de diámetro de poro (Pall Life Sciences®) y agar chromocult (Merck®) para el crecimiento selectivo y diferencial de coliformes y E. coli.22,23 Los resultados se reportaron como microorganismos/100 mL para el agua sin tratar y Unidades Formadoras de Colonia (UFC)/100 mL para las demás muestras, siguiendo los valores de referencia establecidos en la resolución. Como controles negativos se emplearon medios estériles sin inocular.
Preparación de la cepa hospedera de E. coli. La cepa hospedadora (E. coli) fue aislada a partir de una muestra de 100 mL agua sin tratar procedente de la etapa de B de la planta de tratamiento. La muestra fue diluida en base 10 hasta 10-2 en solución salina estéril al 0,85% y sembrada por duplicado en cajas de agar Chromocult. Seguidamente, las cajas fueron incubadas a 37°C/24 h (Adaptado de Carrilo EM y Lozano AM).24
Las colonias con crecimiento presuntivo fueron clasificadas mediante la coloración de Gram. Las colonias confirmadas fueron sembradas por agotamiento en agar tripticasa de soya (TSA). Posteriormente fueron alicuotadas en crioviales, conteniendo 2 mL de caldo tripticasa de soya (TSB) más glicerol al 10% y mantenidas a 4°C hasta su uso. Las cepas fueron reactivadas para los ensayos de determinación de fagos sembrando en agar TSA para obtener cultivos jóvenes de no más de 18 horas.
A partir de estos se preparó una solución con una densidad óptica (DO) de 0.5 (<300x106ufc/mL) a 600 nm usando espectrofotómetro (Thermo Spectronic Genesys 10 UV/Vis spectrophotometer®) equivalente al patrón 4 en la escala de Mac Farland.25 Como controles negativos se emplearon medios estériles sin inocular.
Aislamiento de colifagos. Este procedimiento se llevó a cabo, haciendo adaptaciones de la metodología reportada por Durán et al.26
El contenido fágico fue obtenido filtrando agua de las diferentes etapas del proceso de potabilización. Para las etapas B y D, se filtraron 500 mL de agua, las cuales fueron previamente centrifugadas a 3400 rpm por 15 minutos con el fin de sedimentar los sólidos presentes. Para las demás etapas (D, F, C, A y Dt), se filtraron 1000 mL usando filtros de membrana de 0,22 µm de diámetro de poro (Advantec). A partir del filtrado se llevaron a cabo diluciones seriadas en base 10 hasta 10-2 para cuantificar los colifagos.
Cuantificación de colifagos por el método de capa simple. Se siguió el método recomendado por la APHA,22 con algunas modificaciones. A 50 mL de agar TSA licuado, se le adicionó 0,08 g nitrato de amonio, 0,11 g de nitrato de estroncio, 3 mL de cloruro de trifenil tetrazolio (TTC, Sigma) al 1% (p/v), 3 mL de la suspensión bacteriana (OD=0,5) y 3 mL de la muestra de agua filtrada (o de sus respectivas diluciones).
La mezcla fue vertida en dos cajas de Petri que fueron seguidamente incubadas a 37°C/12-18 h. Finalmente, se hizo el recuento de las zonas de lisis o aclaramiento en cada una de las cajas (placas), las cuales fueron reportadas como Unidades Formadoras de Placas (UFP)/mL mediante la expresión (1/d) / C UPF = Xc d V, donde Xc , (1/d) y V representan respectivamente al promedio de placas, el recíproco de la dilución y el Volumen inoculado de acuerdo a Gaviria et al.17 Como controles negativos se emplearon medios estériles sin inocular.
Determinación del porcentaje de remoción microbiana. El porcentaje de remoción de coliformes totales (CT) y E. coli (EC) fue calculado para las muestras de agua tratadas (decantada, filtrada, clorada, almacenada y distribuida). Para evaluar la carga microbiana removida en cada etapa del proceso de potabilización se realizó una regla de tres simple considerando el valor de la media geométrica hallada para las muestras de bocatoma (100% de recuento) como el valor referencial.
Se determinó el porcentaje de CT y EC presente en cada muestra y por consiguiente el valor diferencial fue considerado el porcentaje de bacterias removidas en cada etapa del tratamiento del agua.27
Análisis estadístico. Los datos obtenidos fueron analizados mediante análisis inferencial, específicamente empleando la prueba Chicuadrado de homogeneidad en distribución, para probar la igualdad de proporción de muestras positivas y negativas por indicador.
Resultados
E. coli, fue aislada con éxito en agar Chromocult® a partir del agua de la bocatoma de la planta de tratamiento objeto de estudio. Este medio, permitió la identificación de colonias violeta características de este patógeno en 24 h que al microscopio óptico revelaron bacilos Gram negativos cortos, morfología característica de este patógeno.
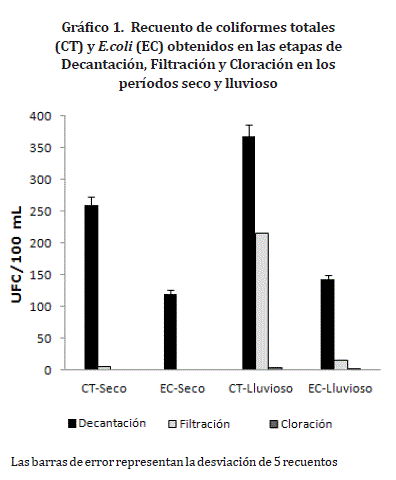
Al analizar la presencia de CT y EC, se encontró que en la muestra tomada en el punto B, los recuentos no presentaron cambios relevantes tanto en período seco, como en período lluvioso (>2400 bacterias/100 mL).
Este resultado concuerda con lo esperado, al tratarse de una muestra de agua cruda. Las muestras procedentes de los puntos D, F, C, A y Dt mostraron variaciones, siendo los recuentos más elevados en el período lluvioso.
El gráfico 1 muestra los resultados comparativos de los análisis hechos en los puntos D, F y C en los dos períodos de tiempo. Los recuentos obtenidos para CT y EC en las fases A y Dt fueron de 0UFC/100 mL en período seco y 2UFC/100 mL y 1UFC/100 mL en período de lluvias. Debido a la escala de la gráfica no son presentados, pues se hacen casi imperceptibles.
El método de capa simple sugerido por la APHA y modificado para este estudio, permitió la cuantificación de fagos de forma rápida y sencilla. El gráfico 2 muestra el crecimiento de fagos en el medio de cultivo TSA modificado. Las zonas de aclaramiento denotan los procesos líticos llevados a cabo por los colifagos sobre la cepa hospedera E. coli.
Para establecer la presencia puntual de colifagos, examinada en dos períodos de tiempo específicos, se adaptó la fórmula utilizada por Aricapa et al.,16 donde %P=#positivos/n*100, siendo n el número de muestras totales analizadas.
Los resultados obtenidos indicaron que el 88% de las muestras de agua analizadas, fueron positivas en alguna de las etapas del proceso de potabilización.
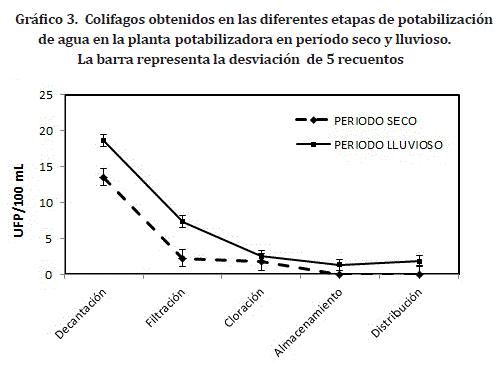
La presencia de colifagos aumentó en época de lluvias con recuentos máximos de 1310 UFP/100 mL, 18,6 UFP/100 mL, 7,3 UFP/100 mL y 2,5 UFP/100 mL, para el agua proveniente de las etapas B, D, F, C respectivamente. Este resultado coincide con lo reportado por Aricapa et al 2005.16 Además se encontró persistencia de los virus en las etapas de almacenamiento y distribución con recuentos de 1,3 UFP/100 mL y 1,8 UFP/100 mL. En contraste, en período seco se obtuvo recuentos de 1160 UFP/100 mL, 13,5 UFP/100 mL, 2,2 UFP/100 mL, 1,7 UFP/100 mL para la etapas B, D, F y C respectivamente (Gráfico 3). En las etapas de almacenamiento y distribución no se encontraron fagos en las muestras analizadas.
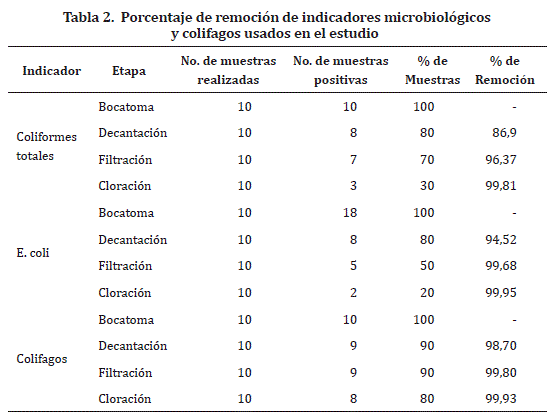
Para calcular los porcentajes de remoción se empleó la media geométrica de los recuentos obtenidos para CT, CF y colifagos que fueron presentadas en los gráficos anteriores. Se hizo un promedio de los resultados obtenidos en los tres indicadores (CT, CF y colifagos) tanto en período seco como lluvioso. Se tuvo en cuenta que los valores de referencia (tomados como el 100%) en la fase B no presentaban variaciones relevantes. Para los tres parámetros evaluados se observó un aumento progresivo en el porcentaje de remoción, como puede apreciarse en la tabla 2.
Para probar la homogeneidad en la distribución de muestras que resultaron positivas para cada indicador en las diferentes etapas, se utilizó la prueba Chi-cuadrado una vez comprobada la regla de Cochran de los valores esperados.
Esta prueba es equivalente a probar la igualdad de muestras positivas en los métodos de potabilización por patógeno, lo que significa probar la igualdad de casos positivos (y por ende negativos) en los distintos métodos utilizados. La prueba rindió un x2 de 3,129 y una significación de 0,79 (p>5%), por lo que puede aseverarse estadísticamente la homogeneidad en distribución.
Discusión
Microbiológicamente, la calidad del agua puede definirse con base a la presencia de ciertos indicadores de contaminación por materia fecal o materia orgánica, siendo los coliformes totales y E. coli, los más frecuentemente usados.28,29
En este estudio se encontró que el agua tratada en la planta analizada es apta para el consumo humano durante el período seco, ya que no se evidencia la presencia de CT ni EC en las etapas de cloración, almacenamiento y distribución, lo cual se ajusta a los valores exigidos por la Resolución 2115. Esto coincide con Avila S et al,30 quienes reportaron la ausencia de coliformes totales y E. coli realizados al agua potable consumida en la zona urbana de Guatavita, Cundinamarca. Morillo y Botero en el año 2005, también reportaron ausencia de coliformes totales (NMP/100 mL) en agua proveniente de la red de distribución en la Planta de Angostura/Venezuela.31
Sin embargo, en los análisis hechos en período lluvioso, los recuentos de CT y EC aumentaron ligeramente obteniendo resultados de 3UFC/100mL y 2UFC/100mL para CT y EC respectivamente, en la etapa de cloración, con persistencia en ocasiones de bacterias en la fase de almacenamiento y distribución. Esto es consistente con lo reportado por Cherchi C y Gu Z quienes realizaron estudios sobre el efecto de la desinfección por cloro en el crecimiento de E. coli (O157 H7 y K 12), las cuales mostraron elevada resistencia ante el estrés químico, especialmente aquellas que se encontraban en fase de crecimiento estacionario.32
En la etapa de almacenamiento, la contaminación puede derivarse del tiempo que transcurre hasta que el agua es distribuida, donde el nivel de cloro residual disminuye favoreciendo la proliferación bacteriana. Ya en la etapa de distribución, las contaminaciones cruzadas se deben a fallos en las redes de distribución, donde los materiales de construcción (hierro, PVC y/o polietileno) contaminados pueden llegar a interactuar con el agua.33,34
Aunque los coliformes totales, fecales, y E. coli son convencionalmente usados como indicadores de contaminación fecal, se han encontrado estudios en los que han sido reportados casos de enfermedades entéricas por consumo de agua en la cual no se había detectado coliformes.35,36
En este sentido, la utilización de fagos somáticos de Escherichia coli confieren mayores ventajas a la hora de ser utilizados como indicadores de la eficiencia de los procesos de potabilización.37,38
El fago MS2 por ejemplo es usado en Europa y EEUU para asegurar la calidad de los tratamientos de potabilización de agua. La presencia de colifagos se asocia con un riesgo potencial para la salud pública, debido a que son indicadores de contaminación fecal de origen no sólo bacteriano sino viral.
Esto se debe a las similitudes estructurales, propiedades fisicoquímicas y resistencia a los procesos de desinfección que poseen, comparable a los de algunos virus de origen antropogénico como los enterovirus.13
En este estudio, se determinó de forma rápida y sencilla la presencia de colifagos en las diferentes fases de potabilización del agua, permitiendo comprobar indirectamente la eficiencia del proceso potabilización aplicado en una planta del nordeste colombiano. La presencia de colifagos fue confirmada en medios semisólidos, caracterizada por la aparición de zonas de aclaramiento, también conocidas como calvas o placas que evidenciaron procesos de lisis celular llevados a cabo por el virus.33
En el gráfico 1 puede apreciarse el fenómeno mencionado y además, puede observarse que las calvas formadas difirieron en tamaño y forma, lo cual podría ser un indicativo de la existencia de un coctel de "colifagos" presentes en las muestras analizadas. Estos resultados coinciden con lo reportado por Ackermann W7 y Gaviria A et al.,17 quienes observaron diferencias en los tamaños de los halos producidos por colifagos aislados a partir de diferentes fuentes. No obstante, este hecho particular, debe ser confirmado en estudios posteriores a través de técnicas más especializadas como la microscopía electrónica o métodos moleculares.
En el agua de la Bocatoma "B", los recuentos de fagos alcanzaron valores promedio de 1310 UFP/100 mL y 1160 UFP/100 mL en período lluvioso y seco, respectivamente. Estos resultados son similares a los obtenidos por Morillo y Botero,32 al analizar bacteriófagos somáticos en aguas crudas en Maracaibo, Venezuela. La presencia de colifagos disminuyó a través de las diferentes etapas de potabilización y en período seco no se encontró presencia de ellos después de la etapa de cloración.
No obstante, en período lluvioso si hubo persistencia de los virus obteniendo recuento de 1,3 UFP/100 mL y 1,8 UFP/100 mL en las etapas de almacenamiento y distribución, respectivamente. Esto coincide con los resultados obtenidos por Aricapa G et al.,16 quienes determinaron que las precipitaciones son un factor influyente en el aumento del recuento fagos en aguas.
Investigadores han propuesto un límite permitido de colífagos de 0/100 mL de agua, para aguas de bebida, basándose en la incidencia y comportamiento de los colifagos y virus entéricos en agua cruda.35 De esta forma, el agua procedente de la planta objeto de estudio no cumpliría con los límites permisibles para este parámetro específicamente en período de lluvias.
Finalmente, al analizar los porcentajes de remoción de coliformes totales, E. coli y colifagos, se puede evidenciar que el proceso de potabilización redujo en un 99,8%, 99,9% y 99,9% cada uno de los indicadores, en la etapa de cloración respectivamente. Resultados similares obtuvieron Morillo y Botero32 con valores de remoción para CT entre 93,9% y 99,9% y para colifagos de 99,9% y 100%. Sin embargo cabe resaltar, que en época lluviosa se encontraron UFP en la etapa de cloración, almacenamiento y distribución, lo que confirma su alta resistencia de los colifagos a los procesos de desinfección llevados a cabo en la planta.
En bacteriófagos, el cloro induce daños oxidativos no específicos, dañando la integridad de la cápside y degradando el material genético. No obstante, existen algunos virus altamente resistentes a procesos de desinfección. Boudaud N, et al.,13 reportaron la presencia de fagos en etapas de posteriores la ultrafiltración de agua y han postulado al fago GA como un nuevo modelo a emplear en las plantas de tratamiento en lugar del fago MS2 debido a su elevada resistencia. Kreibel K et al,38 demostraron que el fago phi x174 es altamente resistente al estrés químico y podría ser empleado también como indicador debido a su resistencia a la acción de policloruro de aluminio.
Por tanto, estudios moleculares serían recomendables para poder determinar el género y la especie de los bacteriófagos encontrados en las etapas de almacenamiento y distribución de la planta de tratamiento analizada y así poder comparar su grado de resistencia con otros fagos reportados en la literatura.
Conclusión
A través del presente estudio, se logró adaptar una metodología rápida y sencilla que permitió de forma preliminar determinar la presencia de colifagos en muestras de aguas antes, durante y después del tratamiento de agua en una planta del nororiente colombiano en tan solo 12 horas. Además se evaluó la eficiencia del proceso de potabilización sobre bacteriófagos, poniendo de manifiesto que estos virus son altamente resistentes a los procesos de desinfección llevados a cabo, especialmente en época de lluvias. Por tanto, se sugiere introducir esta metodología en los análisis rutinarios de microbiología llevados a cabo en la planta objeto de estudio, que pueda contribuir junto con otros indicadores a garantizar la calidad del agua que consumen los habitantes de la población a la que surte.
Agradecimientos
Los autores desean agradecer la financiación obtenida por parte de Colciencias a través de la convocatoria 569, proyecto Código 112156934429 Contrato 400-2013 y de la Universidad de Pamplona, que facilitaron la realización de este estudio preliminar para detectar la presencia de virus en aguas.
Referencias
1. Tien JH, Earn DJD. Multiple transmission pathways and disease dynamics in a waterborne pathogen model. Bulletin of Mathematical Biology. 2010;72:1506-1533. [ Links ]
2. Nunes MM, Arrais de Alencar AL, Caldas ED. Investigation of food and water microbiological conditions and foodborne disease outbreaks in the Federal District, Brazil. Food Control. 2013;34:235-240. [ Links ]
3. Rezaeinejad S, Vergara G, Woo CH, Lim TT, Sobsey MD, Gin KYH. Surveillance of enteric viruses and coliphages in a tropical urban catchment. Water Research. 2014;58:122-131. [ Links ]
4. Castelló LD, Gil-González D, Alvarez-Dardet C, Hernández-Aguado I. The environmental millennium development goal: progress and barriers to its achievement. Environmental science & policy. 2013;13:154-163. [ Links ]
5. Hsu A, Lloyd A, Emerson JW. What progress have we made since Rio? Results from the 2012 Environmental Performance Index (EPI) and Pilot Trend EPI. Environmental Science & Policy. 2013;33:171-185. [ Links ]
6. Withey S, Cartmell E, Avery LM, Stephenson T. Bacteriophagespotential for application in wastewater treatment processes. Science of the Total Environment. 2005;339:1-18. [ Links ]
7. Ackermann W. Bacteriophage observations and evolution. Journal of Microbiology. 2003;154:245-251. [ Links ]
8. Vinje J, Oudejans SJ, Stewart JR, Sobsey MD, Long SC. Molecular detection and genotyping of malespecific coliphages by reverse transcription-PCR and reverse line blot hybridization. Applied Environmental Microbiology. 2004;70:5996-6004. [ Links ]
9. Wolf S, Hewitt J, Rivera M, Greening G. Detection and characterization of F+ RNA bacteriophages in water and shellfish: Aplication of a multiplex real-time reverse transcription PCR. Journal of Virological Methods. 2008;149:123-128. [ Links ]
10. Langlet J, Ogorzaly L, Schrotter JC, Machinal C, Gaboriaud F, Duval JFL, Gantzer C. Efficiency of MS2 phage and Qb phage removal by membrane filtration in water treatment: applicability of real-time RT-PCR method. Journal of Membrane Science. 2009;326:111-116. [ Links ]
11. Jones TH, Nattress FM, Dilts B, Olsen D, Muehlhauser V. Numbers of coliforms, E. coli, F-RNA phage, bovine enteric calicivirus and presence of non-0157 STEC on commercial vaccum packaged beef. Food Microbiology. 2014;42:225-231. [ Links ]
12. Yang S, Rothman RE. PCR-based diagnostics for infectious diseases: uses, limitations, and future applications in acute-care settings. The Lancet Infectious Diseases. 2004;4:337-348. [ Links ]
13. Boudaud N, Machinal C, David F, Bourdonnec A, Jossent J, Bakanga F, Arnal F, Jaffrezic MP, Oberti S, Gantzer C. Removal of MS2, Qb and GA bacteriophages during drinking water treatment at pilot scale. Water Research. 2012;46:2651-2664. [ Links ]
14. Beaudoin RN, DeCesaro DR, Durkee DL, Barbaro SE. Isolation of a bacteriophage from sewage sludge and characterization of its bacterial host cell. Rivier Acad J. 2007;3:1. [ Links ]
15. Campos C, Guerrero A, Cárdenas M. Removal of bacterial and viral fecal indicator organisms in a waste stabilization pond system in Chocontá, Cundinamarca (Colombia). Water Science and Technology. 2002;45:61-66. [ Links ]
16. Aricapa G, Pérez JE, Benavides D, López A. Prevalencia de colifagos en el agua del acueducto de la Vereda La cabaña del Municipio de Manizales. Biosalud. 2005;14:28-37. [ Links ]
17. Gaviria GA, González M, Castaño JO. Técnica para aislamiento de bacteriófagos específicos para E. coli DH5α a partir de aguas residuales. Revista MVZ Córdoba. 2012;2852-2860. [ Links ]
18. Hudson JA, Billington C, Cornelius AJ, Wilson T, Premaratne NJ. Use of a bacteriophage to inactivate Escherichia coli O157:H7 on beef. Food Microbiology. 2013;36:14-21. [ Links ]
19. Jofre J, Blanch AR, Lucena F, Muniesa M. Bacteriophages infecting bacteroides as a marker for microbial source tracking. Water Research. 2013;55:1-11. [ Links ]
20. Colombia. MPS/MAVDT. Ministerio de la Protección Social y Ministerio de Ambiente, Vivienda y Desarrollo Territorial de Colombia. Resolución 2115 de 2007. Bogotá DC: Ministerio; 2007. [ Links ]
21. Wiedenmann A, Langhammer W, Botzenhart K. A case report of false negative Legionella test results in a chlorinated public hot water distribution system due to the lack of sodium thiosulfate in sampling bottles. International Journal of Hygiene and Environment and Health. 2001;204:245-249. [ Links ]
22. APHA. American Public Health Association. Standard methods for the examination of water and wastewater. 20 Ed. American Public Health Association, Washington, D.C. 1998. [ Links ]
23. Byamukama D, Kansiime F, Mach RL, Farnleitner AH. Determination of Escherichia coli contamination with chromocult coliform agar showed a high level of discrimination efficiency for differing fecal pollution levels in tropical waters of Kampala, Uganda. Applied and Environmental Microbiology. 2000;66(2). [ Links ]
24. Carrillo EM, Lozano AM. Validación del método de detección de coliformes totales y fecales en agua potable utilizando Agar Chromocult. (Tesis). Facultad de Ciencias. Microbiología Industrial. Pontificia Universidad Javeriana. Bogotá, 2008. [ Links ]
25. Johnson N, Chang Z, Bravo-Almeida C, Michel M, Iversen C, Callanan M. Evaluation of indirect impedance for measuring microbial growth in complex food matrices. Food Microbiology. 2014;42:8-13. [ Links ]
26. Durán AE, Muniesa M, Méndez X, Valero F, Lucena F, Jofre J. Removal and inactivation of indicator bacteriophages in fresh waters. Journal of Applied Microbiology. 2002;92(2):338-47. [ Links ]
27. Leclerc H, Edberg S, Pierzo V, Delattre JM. Bacteriophages as indicators of enteric viruses and public health risk in groundwaters. Journal of Applied Microbiology. 2000;88:5-21. [ Links ]
28. Paruch AM, Mæhlum T. Specific features of Escherichia coli That distinguish it from coliform and thermotolerant coliform Bacteria and define it as the most accurate indicator of faecal Contamination in the environment. Ecological Indicators. 2012;23:140-142. [ Links ]
29. Kostyla C, Bain R, Cronk R, Bartram J. Seasonal variation of fecal contamination in drinking water sources in developing countries: A systematic review. Science of The Total Environment. 2015;514:333-343. [ Links ]
30. Ávila de Navia S, Estupiñán M. Calidad bacteriológica del agua de consumo humano de la zona urbana y rural del municipio de Guatavita. Cundinamarca, Colombia. Revista Cubana de Higiene y Epidemiología. 2011;50(2):163-168. [ Links ]
31. Morillo A, Botero L. Evaluación de la remoción de colifagos y bacterias indicadoras de contaminación en la Planta de tratamiento sur de aguas servidas de la ciudad de Maracaibo. Ciencia. 2005;13(2):147-161. [ Links ]
32. Chierchi C, Gu ZA. Effect on bacterial growth stage on resistance to chlorine disinfection. Water & Science. 2011;64:1. [ Links ]
33. Douterelo I, Husband S. Boxall JB. The bacteriological composition of biomass recovered by flushing an operational drinking water distribution system. Water Research. 2014;54:100-114. [ Links ]
34. Rasekh A, Brumbelow K. Drinking water distribution systems contamination management to reduce public health impacts and system service interruptions. Environmental Modelling & Software. 2014;51:12-25. [ Links ]
35. Gibson KE. Viral pathogens in water: occurrence, public health impact, and available control strategies. Current Opinion in Virology. 2014;4:50-57. [ Links ]
36. Alia MA, Herrawyb AZ, El-Hawaary SE. Detection of enteric viruses, Giardia and ryptosporidium in two different types of drinking water treatment facilities. Water Research. 2004;38:3931-3939. [ Links ]
37. Lee YD, Kim JK, Park JH. Characteristics of coliphage ECP4 and potential use as a sanitizing agent for biocontrol of Escherichia coli O157:H7. Food Control. 2013;34:255-260. [ Links ]
38. Kreißel K, Bösl M, Hügler M, Lipp P, Franzreb M, Hambsch B. Inactivation of F-specific bacteriophages during flocculation with polyaluminum chloride e A mechanistic study. Water Research. 2014;51:144-151. [ Links ]