Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Universidad y Salud
Print version ISSN 0124-7107On-line version ISSN 2389-7066
Univ. Salud vol.17 no.2 Pasto July/Dec. 2015
Miocardiocitos conducentes ventriculares
Leading ventricular cardiomyocytes
Doris Haydee Rosero-Salazar1, Mario Alejandro Ortiz-Salazar2, Liliana Salazar-Monsalve3
1 Mg. en Ciencias Biomédicas. Profesora del Departamento de Ciencias Básicas de la Universidad Icesi. Profesora del Departamento de Morfología Universidad del Valle. Cali, Colombia. e-mail: doris.rosero@correounivalle.edu.co
2 Mg. en Ciencias Básicas Médicas. Profesor Asistente, Investigador Grupo de Investigación Tejidos Blandos y Mineralizados Universidad del Valle. Cali, Colombia. e-mail: mariortiz@yahoo.com
3 Mg. en Morfología. Profesora Asociada, Coordinadora de Histología. Directora Grupo de Investigación Tejidos Blandos y Mineralizados Universidad del Valle. Cali, Colombia. e-mail: liliana.salazar@correounivalle.edu.co
Fecha de recepción: Enero 10 - 2015 / Fecha de aceptación: Septiembre 18 - 2015
Rosero-Salazar DH, Ortiz-Salazar MA, Salazar-Monsalve L. Miocardiocitos conducentes ventriculares. Rev Univ. salud. 2015;17(2):262-270.
Resumen
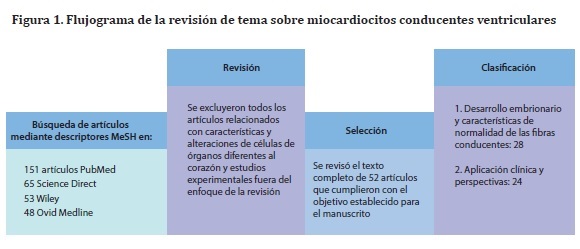
Objetivo: Exponer las características histológicas y funcionales que se presentan en el tejido muscular estriado cardiaco especializado en la conducción del estímulo eléctrico y sus implicaciones actuales en las arritmias cardiacas. Materiales y métodos: Se seleccionaron publicaciones en revistas indexadas en las bases PubMed, Wiley, Ovid-Medline y Science Direct. Los descriptores MESH utilizados para la búsqueda fueron cardiac myocytes, myocardium, heart conduction system. Se acoplaron los conceptos histology y arrhythmia. Se revisaron artículos publicados entre 1990 a 2014, originales, reportes de caso y revisiones, relacionados con los conceptos de desarrollo embrionario, diferenciación celular, morfología normal y alteración de los miocardiocitos conducentes ventriculares. Se revisó el resumen de 317 artículos, de los que se clasificaron 75 para lectura completa y de estos, 52 se seleccionaron para la redacción del presente artículo. Conclusión: Los estudios actuales se encaminan hacia las simulaciones del sistema de conducción para establecer otras causas de arritmia y opciones de tratamiento. La terapia con células indiferenciadas y las técnicas moleculares de modificación genética hacen parte de estos estudios, así como la implementación de terapias alternativas no invasivas en el tratamiento de las arritmias cardiacas.
Palabras clave: Miocardiocitos conducentes ventriculares, miocardio, arritmia cardiaca, ventrículo cardiaco. (Fuente: DeCS, Bireme).
Abstract
Objective: To expose the histological and functional characteristics that occur in heart striated muscle tissue specialized in the conduction of electrical stimulation and its current implications for cardiac arrhythmias. Materials and methods: Publications in indexed journals in PubMed, Wiley, Ovid-Medline and Science Direct databases were selected. The MESH descriptors used for the search were cardiac myocytes, myocardium and heart conduction system. The concepts of histology and arrhythmia were mated. Articles published from 1990 to 2014 were reviewed as well as the original ones, case reports and reviews related to the concepts of embryonic development, cell differentiation and normal morphology alteration of the leading ventricular cardiomyocytes. The summary of 317 articles were read, from which 75 were classified to complete reading and finally 52 were selected for the drafting of this article. Conclusion: Current studies are directed towards the driving system simulation to establish other causes of arrhythmia and its treatment options. Not only therapies with undifferentiated cells and molecular genetic modification techniques are part of these studies but also the implementation of alternative therapies that are not invasive in the treatment of cardiac arrhythmias.
Keywords: leading ventricular cardiomyocytes, myocardium, cardiac arrhythmia, cardiac ventricle. (Source: DeCS, Bireme).
Introducción
El corazón es el primer órgano embrionario funcional con la presencia de latido hacia el día 21 de gestación, necesario para la distribución y el intercambio de nutrientes, oxígeno y productos de desecho del cual es parte fundamental el sistema de conducción eléctrica. Sin este sistema, no sería posible la contracción sincrónica del miocardio.
El tejido muscular estriado cardiaco está compuesto por tres tipos de cardiomiocitos: contráctiles, que constituyen la mayor parte del músculo cardiaco; secretores, localizados únicamente a nivel atrial, encargados de la producción y liberación del péptido natriurético atrial y, conducentes, que conforman el sistema de conducción eléctrica del corazón, del cual hacen parte los miocardiocitos conducentes ventriculares (también denominados fibras de Purkinje), los cuales se describen por primera vez en 1839 por Johannes Evangelista Purkinje, anatomista y fisiólogo; los estudios en aves y mamíferos mostraron su asociación con el nodo atrio-ventricular y su función de propagación eléctrica a los miocitos cardiacos contráctiles.1
Los miocardiocitos conducentes ventriculares son células de localización subendocárdica y subepicárdica, distribuidas a manera de red en el miocardio ventricular, a nivel intramural y en el tabique interventricular donde establecen contacto con los miocitos contráctiles y hacen posible las contracciones sistólicas sincrónicas en ambas cavidades ventriculares. Se encuentran rodeadas por el tejido conectivo que les provee soporte, nutrición y la asociación entre sí, para adquirir eficiencia en la transmisión del impulso eléctrico a otro miocardiocito conducente o a uno contráctil. Una visión integral del estudio de las células que forman parte del sistema conducente del corazón, desde su origen embrionario, permite conocer parámetros relevantes utilizados en la práctica clínica, que constituyen perspectivas terapéuticas importantes para el tratamiento de enfermedades como las arritmias cardiacas.2,3
Materiales y métodos
El objetivo del presente artículo fue realizar una revisión completa sobre los cardiomiocitos conducentes ventriculares a partir del desarrollo embrionario, histología normal e implicaciones en las arritmias cardiacas. Para ello, se revisaron artículos originales, revisiones y reportes de casos, publicados entre 1990 a 2014 en las bases electrónicas Science Direct, PubMed, Ovid-Medline y Wiley, en inglés y en español. Los descriptores MeSH utilizados para la búsqueda fueron heart, myocardial fibers, arrhythmia, myocardium, and heart conduction system. De las 317 publicaciones revisadas, 52 fueron pertinentes para la redacción del artículo (Figura 1). Las imágenes que complementaron esta revisión fueron obtenidas de biopsias musculares procesadas en el Laboratorio de Histología de la Universidad del Valle; el software de toma de imágenes que se utilizó fue LASV3.8© (Leica Microsystems, Wetzlar, Alemania) adaptado a microscopio de luz Leica DM750© (Leica Microsystems, Wetzlar, Alemania), con cámara digital Leica DFC295© (Leica Microsystems Wetzlar, Alemania).
Resultados y discusión
Regulación molecular del desarrollo del sistema de conducción ventricular
El desarrollo del miocardio comienza con la formación del tubo cardiaco primitivo, el cual presenta elongación progresiva a medida que se forma el asa cardiaca, momento en el cual esta estructura ya genera el movimiento de la sangre mediante contracciones continuas hacia las aortas dorsales embrionarias. Dentro de esta bomba, las cámaras primitivas que darán lugar a atrios y ventrículos se desarrollan bajo la influencia de lateralidad de los genes Nodal y Lefty2, mientras que Tbx3 (T-box transcription factor 3) regula el desarrollo de ambos nodos. Este último factor de transcripción inhibe la persistencia de grupos restantes cerca del nodo atrio-ventricular, a fin de evitar la persistencia de focos ectópicos posteriores.4-6
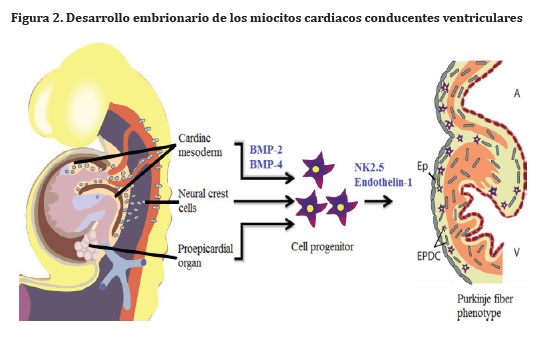
De la misma manera, Pax3 (paired box 3) determina en las células progenitoras la migración desde tres diferentes orígenes, los cuales corresponden al mesodermo cardiogénico, las células de la cresta neural y el órgano proepicardial, con el fin de proliferar y diferenciarse en un fenotipo contráctil de cardiomiocitos (Figura 2).7,8
El mesodermo cardiogénico se diferencia bajo la influencia de los factores de transcripción BMP-2 (bone morphogenic protein 2) y BMP-4 (bone morphogenic protein 4), producida por el endodermo faríngeo subyacente. Es responsable de la regulación de la expresión de FGF-8 (factor de crecimiento de los fibroblastos 8) un factor clave para la regulación de la síntesis de proteínas y, Cerberus, que inducen en las células del mesodermo esplácnico o visceral, la síntesis de Nkx 2.5 para regular la expresión genética y la diferenciación celular de mioblastos cardiacos. Wnt (wingless-type) es un inhibidor de la expresión de Nkx 2.5, por lo que factores como Crescent y DKK-1 (Dikkopf 1), ambos expresados en el mesodermo posterior no cardiogénico, son inductores potentes de la expresión de Nkx 2.5 al inhibir Wnt.9-12
Las células de la cresta neural juegan un papel importante en la formación del tabique conotroncal, que contribuye en la division del tronco arterial, en los canales aórtico y pulmonar. Se encuentran relacionadas también con el desarrollo del epicardio e indirectamente, en la inducción de cardiomiocitos para diferenciarse en células del sistema de conducción. El grupo conocido como células derivadas del epicardio (EPDC), da lugar al tejido conectivo del corazón, los fibroblastos y la túnica media de los vasos coronarios e interactúan con los cardiomiocitos periarteriales, estimulando la síntesis de endotelina-1 para inducir a través de señales paracrinas, cambios en el citoplasma y en el componente contráctil, con el fin de dar lugar al fenotipo de miocardiocitos conducentes ventriculares.13-16
El órgano proepicardial (PEO) se encuentra en los mamíferos alrededor del seno venoso, donde inicia su desarrollo como un conjunto de células mesoteliales, que luego forman grupos para constituir digitaciones cubiertas por mesotelio. Las células mesenquimales están involucradas en el desarrollo del tejido muscular estriado cardiaco y el sistema de conducción, para lo cual requiere también de la endotelina- 1.13,17-19
Estudios realizados en embriones de ratón demuestran la importancia de alfa-SMA (smooth muscle actin) en la bifurcación del fascículo atrioventricular y en la expresión de beta-MHC (myosin heavy chain). Los miocardiocitos conducentes ventriculares expresan esta proteína en menor medida en comparación con los cardiomiocitos contráctiles. Por otra parte, Tbx3 actúa como un represor transcripcional, es decir, es responsable de la regulación de la proliferación y la apoptosis en muchos tejidos, especialmente, en la diferenciación y mantenimiento del nodo sino atrial. Su producción disminuye en los ventrículos, lo que sugiere que la diferenciación de miocitos cardiacos conducentes ventriculares está bajo la influencia de factores tales como HF1-b y Nkx 2.5.20-23
EPDC da lugar a tejido conectivo del corazón, fibroblastos, túnica media de los vasos coronarios y conlleva al fenotipo de células musculares conducentes ventriculares. BMP-2: proteína ósea morfogenética -2, BMP-4 proteína morfogenética ósea -4, EP: células epicárdicas, EPDC: células derivadas del epicardio, A: atrio, V: ventrículo. Basado en Nature Reviews Cardiology 6, 317-321.19
Características histológicas
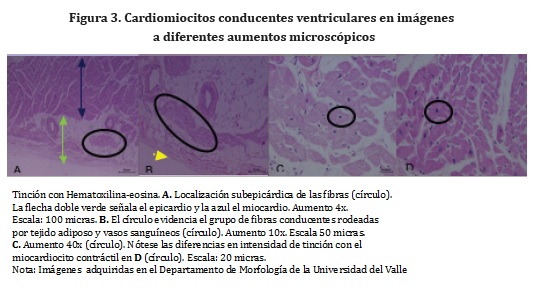
En los ventrículos derecho e izquierdo a nivel subepicárdico y subendocárdico, se encuentran las ramas provenientes del fascículo atrioventricular, constituidas por miocitos cardiacos conducentes y cardiomiocitos de transición. Morfológicamente, estas células conducentes ventriculares se definen como miocitos cardiacos especializados rodeados por el tejido conectivo del cual reciben irrigación y sostén; sin embargo, gradualmente pierden este conectivo circundante, con el fin de ganar eficiencia en la transmisión de impulso eléctrico a otro miocito conducente o a un miocito contráctil. Longitudinalmente observadas, son más largas que los cardiomiocitos contráctiles, mientras que en orientación transversal presentan una forma más redondeada, sin prolongaciones citoplasmáticas, con núcleo redondo u ovalado y evidencian tinción pálida del citoplasma cuando se someten a tinciones histoquímicas convencionales como hematoxilina-eosina, debido a la escasa proporción de miofibrillas contráctiles en su sarcolema (Figura 3).21.24
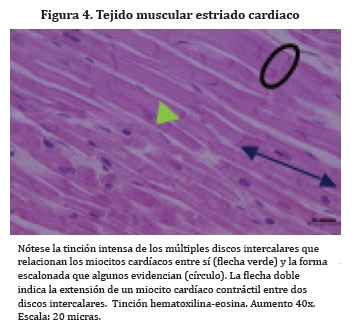
En relación con su ultraestructura, las fibras cardiacas conducentes presentan terminaciones similares a dedos que se unen con interdigitaciones de la célula vecina, para constituir los discos intercalares. Estas estructuras presentan una cantidad considerable de desmosomas asociados a múltiples filamentos intermedios y tinción más intensa dado por las proteínas que lo conforman (Figura 4). Se encuentran organizados a manera de escaleras de uno a tres pasos en las células conducentes o hasta treinta en las células contráctiles.
En el tejido muscular estriado cardiaco es posible encontrar también miocitos de transición que presentan aumento gradual de proteínas contráctiles, núcleo central, disminución de su diámetro, aumento en las proteínas del los discos intercalares y tinción pálida de su citoplasma. Se encuentran en mayor proporción en la cercanía de los nodos y el fascículo atrioventricular. Recientemente, fueron descritos mediante técnica de microscopía confocal al utilizar las técnicas de fluorescencia para conexina 40.25
Según lo descrito por Maguy et al. en el año 2009, en su estudio sobre reconstrucciones tridimensionales de muestras obtenidas de conejos, las uniones comunicantes entre miocitos conducentes, contráctiles y de transición, están compuestas por conexinas 40, 43 y 45, donde la conexina 40 presenta la mayor conductancia y predomina en las células musculares conducentes del ventrículo izquierdo. En la insuficiencia cardiaca congestiva, se da una disminución considerable de las conexinas 40 y 43.26
Los canales de sodio se encuentran también en mayor concentración en las células del ventrículo izquierdo, lo que explica su elevada velocidad de conducción. Estudios en ratones demuestran que la duración del potencial de acción en las fibras musculares conducentes ventriculares es superior a la de los miocardiocitos contráctiles, dada la mayor concentración de canales de sodio y la dinámica intracellular del ión calcio en estas células. Consecuentemente, los canales de calcio se encuentran en mayor proporción en los miocitos contráctiles.25,27
Respecto a los túbulos transversos, se relacionan con escasas regiones del retículo sarcoplásmico, dado que no constituyen cisternas terminales, por lo que su conformación es de díadas y no tríadas descritas solamente en el músculo esquelético. Esta es una de las diferencias entre ambos tipos de tejido muscular estriado, siendo la función de la díada en la propagación de impulso eléctrico, similar a la de la tríada.
A nivel del retículo sarcoplásmico, se han descrito dos regiones funcionalmente importantes: la región libre, forma una red laxa entre las miofibrillas que presenta la bomba de calcio y, la región de unión a la membrana y los túbulos T para formar las díadas. A su vez, presenta la región periférica, unida al sarcolema y la región que almacena los iones de calcio. El número de túbulos T varía de forma inversamente proporcional con el tamaño del órgano, lo cual explica las diferentes velocidades de contracción cardiaca con la edad.28 La abundante concentración de glucógeno que presentan los miocardiocitos conducentes, se almacena en gránulos o cuerpos citoplasmáticos, visibles en tinción Shift del ácido periódico o PAS.
Aplicación clínica
Las fibras musculares conducentes ventriculares constituyen el marcapaso terciario que asegura la continuidad y la sincronización de la contracción en el miocardio ventricular, dados sus mecanismos de expresión de conexinas y canales de sodio a nivel de la membrana celular. En las lesiones del nodo sinoatrial, el resto del sistema conducente procura llevar a cabo esta función, sin la sincronización característica, lo que da lugar a los diferentes tipos de arritmias.29 De la misma manera, en las bradiarritmias por bloqueos en el nodo atrioventricular, son los fascículos atrioventriculares hasta sus ramas subendocárdicas quienes continúan con la función de automatismo con una respuesta más lenta.
Las despolarizaciones que ocurren en las fases tempranas de la repolarización, generan latidos prematuros y taquicardia con fibrilación ventricular. Cuando se dan en las fibras conducentes, crean focos ectópicos arrítmicos con lesión del miocardio ventricular, lo que puede ser común en el post- infarto de miocardio, en alteraciones del intercambio iónico de entrada o salida durante la repolarización, algunos medicamentos antiarrítmicos y la isquemia miocárdica más de 30 minutos.30-34
Los procesos arritmogénicos en los que están involucradas las células miocárdicas conducentes ventriculares incluyen la insuficiencia cardiaca congestiva, el síndrome de QT prolongado y la taquicardia ventricular.35-38 Los modelos matemáticos, experimentos con células madre y matrices para regeneración de tejidos en el campo de la ingeniería tisular, han reproducido los procesos fisiológicos de intercambio iónico y características de las corrientes de entrada y salida, para simular los mecanismos de patogénesis.39 Por ejemplo, el modelo establecido por Iyer et al, en el año 2014, evidencia la influencia de los miocardiocitos conducentes ventriculares en este tipo de alteraciones por canalopatías debidas a mutaciones genéticas en los canales de sodio, en lo que se observan intervalos QT prolongados, más de lo normal que predispone a fibrilación ventricular maligna.40
Es fundamental para los miocitos cardiacos conducentes ventriculares, mantener la sincronía de la conducción del impulso eléctrico y su distribución uniforme en el miocardio ventricular. Alteraciones como los niveles elevados de potasio reducen la transmision generando contracciones asincrónicas.41 Los estudios en caninos llevados a cabo por Lin et al, en 2014, demuestran la relación entre los miocitos cardiacos conducentes ventriculares y la fibrilación ventricular. Al realizar ablación subendocárdica de las ramas subendocárdicas, se evidencia un QRS en el electrocardiograma más prolongado y una duración mayor en los intervalos QT.
Los miocardiocitos conducentes son capaces de tolerar la isquemia secundaria a la fibrilación, dado su mayor concentración de glucógeno en el citoplasma y el menor requerimiento de ATP para la conducción, que para la contracción; de ahí que las contracciones sean permanentes y asincrónicas, aún cuando hay un déficit en la función de los miocitos contráctiles.42 La ablación no quirúrgica mediante catéter y el tratamiento farmacológico asociado, continua siendo una de las alternativas de tratamiento más seguras utilizadas en diferentes tipos de fibrilación, ya sea asociadas a otras cardiopatías o a alteraciones de causa idiopática.43,44
Otras alternativas de tratamiento que están siendo objeto de estudio a través de ensayos clínicos y seguimientos, son las complementarias no invasivas, como la práctica de yoga y la acunpuntura como técnica mínimamente invasiva en regiones corporales específicas entre otras.45-47
Toise et al, en el año 2014, estudiaron la influencia de la práctica del yoga en el manejo de la ansiedad que genera la implantación de un desfibrilador automático, en 25 personas pertenecientes al grupo de intervención. Ellos asistieron a sesiones semanales de 80 minutos durante ocho semanas y presentaron menos eventos o complicaciones relacionadas con alteraciones en el ritmo cardiaco.48 El estudio publicado por Mehta et al, en 2014, en el que evaluaron la efectividad de la acupuntura en personas con diagnóstico de enfermedad cardiaca isquemica estable, mediante marcadores de función parasimpática y tono vagal, determinaron diferencias significativas entre los grupos en cuanto a menores niveles de estrés, estableciendo una propuesta para la prevención de muerte cardiaca súbita.49 De la misma manera, las revisiones sistemáticas publicadas recientemente, permitieron evidenciar resultados positivos, aunque aún no contundentes para implementarlas como opciones formales dentro del tratamiento de las enfermedades cardiovasculares.50-52 En la literatura científica revisada no se encontraron estudios en Colombia ni Latinoamérica, referentes al tema, pero sí intervenciones desde el punto de vista psico-social, encaminadas a fortalecer la adherencia al tratamiento convencional. Se considera entonces como uno de los campos de investigación a implementar, teniendo en cuenta el concepto del médico especialista, sin incurrir en abandono del tratamiento médico establecido y con criterios de inclusión claros. Se establecería como una intervención alternativa integral y con un seguimiento continuo de cada caso.46
Conclusión
Los estudios actuales se encaminan hacia las simulaciones del sistema de conducción para establecer otras causas de arritmia y alternativas de tratamiento. La terapia con células indiferenciadas y las técnicas moleculares de modificación genética hacen parte de estos estudios, así como la implementación de terapias alternativas no invasivas en el tratamiento de las arritmias cardiacas.
Agradecimientos
Los autores agradecen a la Dra. Carolina Pustovrh, PhD, al estudiante de Medicina Carlos Andrés Muñoz y a las profesionales del Laboratorio de Histología de la Universidad del Valle, por sus contribuciones y disposición en la redacción de este artículo.
Conflicto de intereses
Los autores declaran no tener conflicto de intereses.
Referencias
1. Boyden PA, Hirose M, Dun W. Cardiac Purkinje cells. Heart Rhythm. 2010;7(1):127-35. [ Links ]
2. Nabipour A. The anatomy and histology of the atrioventricular conducting system in the hedgehog (Hemiechinus auritus) heart. Turk J Zool. 2010;34(2):237-42. [ Links ]
3. Stankovicova T, Bito V, Heinzel F, Mubagwa K, Sipido KR. Isolation and morphology of single Purkinje cells from the porcine heart. Gen Physiol Biophys. 2003;22(3):329-40. [ Links ]
4. Anderson RH, Yanni J, Boyett MR, Chandler NJ, Dobrzynski H. The anatomy of the cardiac conduction system. Clin Anat. 2009;22(1):99-113. [ Links ]
5. Hatcher CJ, Basson CT. Specification of the cardiac conduction system by transcription factors. Circ Res. 2009;105(7):620-30. [ Links ]
6. Frank DU, Carter KL, Thomas KR, Burr RM, Bakker ML, Coetzee WA, et al. Lethal arrhythmias in Tbx3-deficient mice reveal extreme dosage sensitivity of cardiac conduction system function and homeostasis. Proc Natl Acad Sci U S A. 2012;109(3):E154-63. [ Links ]
7. Bhattacharya S, Macdonald ST, Farthing CR. Molecular mechanisms controlling the coupled development of myocardium and coronary vasculature. Clin Sci (Lond). 2006;111(1):35-46. [ Links ]
8. J Boullin JMM. The development of cardiac rhythm. Heart. 2005;91:874–5. [ Links ]
9. Salazar-García M, Sánchez-Gómez C, Contreras-Ramos A, et al. Los segmentos cardiacos primitivos, su implicación en la cardiogénesis normal aplicada a la cardiología pediátrica. Arch Cardiol Méx. 2006;76. [ Links ]
10. Sedmera D, McQuinn T. Embryogenesis of heart muscle. Heart Fail Clin. 2008;4(3):235–45. [ Links ]
11. Zaffran S, Frasch M. Early signals in cardiac development. Circ Res. 2002;91(6):457-69. [ Links ]
12. Cohen ED, Tian Y, Morrisey EE. Wnt signaling: an essential regulator of cardiovascular differentiation, morphogenesis and progenitor self-renewal. Development. 2008;135(5):789-98. [ Links ]
13. Hua LL, Vedantham V, Barnes RM, Hu J, Robinson AS, Bressan M, et al. Specification of the mouse cardiac conduction system in the absence of endothelin signaling. Dev Biol. 2014;393(2):245-54. [ Links ]
14. Rosenquist T, Finnell R. Another key role for the cardiac neural crest in heart development. Am J Physiol Heart Circ Physiol. 2007;292:H1225-H6. [ Links ]
15. Poelmann R, Lie-Venema H, Gittenbergerde A, Groot P. The role of the epicardium and neural crest as extracardiac contributors to coronary vascular development. Tex Heart Inst J. 2002;29(4). [ Links ]
16. Lie-Venema H, van den Akker NM, Bax NA, Winter EM, Maas S, Kekarainen T, et al. Origin, fate, and function of epicardium-derived cells (EPDCs) in normal and abnormal cardiac development. Scientific World Journal. 2007;7:1777-98. [ Links ]
17. Muñoz-Chápulia R, Macíasa D, González-Iriartea M, et al. El epicardio y las células derivadas del epicardio: múltiples funciones en el desarrollo cardiaco. Rev Esp Cardiol. 2002;55(10):1070-82. [ Links ]
18. Eralp I, Lie-Venema H, Bax NA, Wijffels MC, Van Der Laarse A, Deruiter MC, et al. Epicardium-derived cells are important for correct development of the Purkinje fibers in the avian heart. Anat Rec A Discov Mol Cell Evol Biol. 2006;288(12):1272-80. [ Links ]
19. Olivotto I, Cecchi F, Poggesi C, Yacoub MH. Developmental origins of hypertrophic cardiomyopathy phenotypes: a unifying hypothesis. Nat Rev Cardiol. 2009;6(4):317-21. [ Links ]
20. Franco D, Icardo JM. Molecular characterization of the ventricular conduction system in the developing mouse heart: topographical correlation in normal and congenitally malformed hearts. Cardiovasc Res. 2001;49(2):417-29. [ Links ]
21. Airey JA, Almeida-Porada G, Colletti EJ, Porada CD, Chamberlain J, Movsesian M, et al. Human mesenchymal stem cells form Purkinje fibers in fetal sheep heart. Circulation. 2004;109(11):1401-7. [ Links ]
22. Hoogaars WM, Engel A, Brons JF, Verkerk AO, de Lange FJ, Wong LY, et al. Tbx3 controls the sinoatrial node gene program and imposes pacemaker function on the atria. Genes Dev. 2007;21(9):1098-112. [ Links ]
23. Sizarov A, Devalla HD, Anderson RH, Passier R, Christoffels VM, Moorman AF. Molecular analysis of patterning of conduction tissues in the developing human heart. Circ Arrhythm Electrophysiol. 2011;4(4):532-42. [ Links ]
24. Ryu S YS, Andersen CR, Nakazawa K, Miyake F, James TN. Intramural Purkinje cell network of sheep ventricles as the terminal pathway of conduction system. Anat Rec (Hoboken). 2009;292(1):12-22. [ Links ]
25. Vaidyanathan R, O'Connell RP, Deo M, Milstein ML, Furspan P, Herron TJ, et al. The ionic bases of the action potential in isolated mouse cardiac Purkinje cell. Heart Rhythm. 2013;10(1):80-7. [ Links ]
26. Maguy A, Le Bouter S, Comtois P, Chartier D, Villeneuve L, Wakili R, et al. Ion channel subunit expression changes in cardiac Purkinje fibers: a potential role in conduction abnormalities associated with congestive heart failure. Circ Res. 2009;104(9):1113-22. [ Links ]
27. Atkinson A, Inada S, Li J, Tellez JO, Yanni J, Sleiman R, et al. Anatomical and molecular mapping of the left and right ventricular His-Purkinje conduction networks. J Mol Cell Cardiol. 2011;51(5):689-701. [ Links ]
28. Di Maio A, Ter Keurs HE, Franzini-Armstrong C. T-tubule profiles in Purkinje fibres of mammalian myocardium. J Muscle Res Cell Motil. 2007;28(2-3):115-21. [ Links ]
29. Mangoni ME, Nargeot J. Genesis and regulation of the heart automaticity. Physiol Rev. 2008;88(3):919-82. [ Links ]
30. Deo M, Boyle PM, Kim AM, Vigmond EJ. Arrhythmogenesis by single ectopic beats originating in the Purkinje system. Am J Physiol Heart Circ Physiol. 2010;299(4):H1002-11. [ Links ]
31. Corrias A, Giles W, Rodriguez B. Ionic mechanisms of electrophysiological properties and repolarization abnormalities in rabbit Purkinje fibers. Am J Physiol Heart Circ Physiol. 2011;300(5):H1806-13. [ Links ]
32. Romero L, Pueyo E, Fink M, Rodriguez B. Impact of ionic current variability on human ventricular cellular electrophysiology. Am J Physiol Heart Circ Physiol. 2009;297(4):H1436-45. [ Links ]
33. Hirose M, Stuyvers BD, Dun W, ter Keurs HE, Boyden PA. Function of Ca(2+) release channels in Purkinje cells that survive in the infarcted canine heart: a mechanism for triggered Purkinje ectopy. Circ Arrhythm Electrophysiol. 2008;1(5):387-95. [ Links ]
34. Bocchi L, Vassalle M. Characterization of the slowly inactivating sodium current INa2 in canine cardiac single Purkinje cells. Exp Physiol. 2008;93(3):347-61. [ Links ]
35. Xiao L, Koopmann TT, Ördög B, Postema PG, Verkerk AO, Iyer V, et al. Unique cardiac Purkinje fiber transient outward current ß-subunit composition: a potential molecular link to idiopathic ventricular fibrillation. Circ Res. 2013;112(10):1310-22. [ Links ]
36. Bogun F, Good E, Reich S, Elmouchi D, Igic P, Tschopp D, et al. Role of Purkinje fibers in post-infarction ventricular tachycardia. J Am Coll Cardiol. 2006;48(12):2500-7. [ Links ]
37. Ben Caref E, Boutjdir M, Himel HD, El-Sherif N. Role of subendocardial Purkinje network in triggering torsade de pointes arrhythmia in experimental long QT syndrome. Europace. 2008;10(10):1218-23. [ Links ]
38. Huang J, Dosdall DJ, Cheng KA, Li L, Rogers JM, Ideker RE. The importance of Purkinje activation in long duration ventricular fibrillation. J Am Heart Assoc. 2014;3(1):e000495. [ Links ]
39. Wang B, Wang G, To F, Butler JR, Claude A, McLaughlin RM, et al. Myocardial scaffold-based cardiac tissue engineering: application of coordinated mechanical and electrical stimulations. Langmuir. 2013;29(35):11109-17. [ Links ]
40. Iyer V, Sampson KJ, Kass RS. Modeling Tissue-and Mutation-Specific Electrophysiological Effects in the Long QT Syndrome: Role of the Purkinje Fiber. PloS one. 2014;9(6):e97720. [ Links ]
41. Hamamoto T, Tanaka H, Mani H, Tanabe T, Fujiwara K, Nakagami T, et al. In situ Ca2+ dynamics of Purkinje fibers and its interconnection with subjacent ventricular myocytes. J Mol Cell Cardiol. 2005;38(4):561-9. [ Links ]
42. Lin C, Jin Q, Zhang N, Zhou J, Pang Y, Xin Y, et al. Endocardial focal activation originating from Purkinje fibers plays a role in the maintenance of long duration ventricular fibrillation. Croat Med J. 2014;55(2):121-7. [ Links ]
43. Van Herendael H, Zado ES, Haqqani H, Tschabrunn CM, Callans DJ, Frankel DS, et al. Catheter ablation of ventricular fibrillation: importance of left ventricular outflow tract and papillary muscle triggers. Heart Rhythm. 2014;11(4):566-73. [ Links ]
44. Yagishita A, Yamauchi Y, Obayashi T, Hirao K. Idiopathic ventricular fibrillation associated with early repolarization which was unmasked by a sodium channel blocker after catheter ablation of atrial fibrillation. J Interv Card Electrophysiol. 2014;41(2):145-6. [ Links ]
45. Li D, Yang M, Zhao L, Zheng H, Li Y, Chang X, et al. Acupuncture for chronic, stable angina pectoris and an investigation of the characteristics of acupoint specificity: study protocol for a multicenter randomized controlled trial. Trials. 2014;15:50. [ Links ]
46. Brenyo A, Aktas MK. Review of complementary and alternative medical treatment of arrhythmias. Am J Cardiol. 2014;113(5):897-903. [ Links ]
47. Arslan M, Yesilçam N, Aydin D, Yüksel R, Dane S. Wet cupping therapy restores sympathovagal imbalances in cardiac rhythm. J Altern Complement Med. 2014;20(4):318-21. [ Links ]
48. Toise SC, Sears SF, Schoenfeld MH, Blitzer ML, Marieb MA, Drury JH, et al. Psychosocial and cardiac outcomes of yoga for ICD patients: a randomized clinical control trial. Pacing Clin Electrophysiol. 2014;37(1):48-62. [ Links ]
49. Mehta PK, Polk DM, Zhang X, Li N, Painovich J, Kothawade K, et al. A randomized controlled trial of acupuncture in stable ischemic heart disease patients. Int J Cardiol. 2014;176(2):367-74. [ Links ]
50. Chu P, Gotink RA, Yeh GY, Goldie SJ, Hunink MM. The effectiveness of yoga in modifying risk factors for cardiovascular disease and metabolic syndrome: A systematic review and meta-analysis of randomized controlled trials. Eur J Prev Cardiol. 2014. [ Links ]
51. Cramer H, Lauche R, Haller H, Dobos G, Michalsen A. A systematic review of yoga for heart disease. Eur J Prev Cardiol. 2014. [ Links ]
52. Cramer H, Lauche R, Haller H, Steckhan N, Michalsen A, Dobos G. Effects of yoga on cardiovascular disease risk factors: a systematic review and meta-analysis. Int J Cardiol. 2014;173(2):170-83. [ Links ]