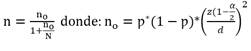Introducción
El estudio de gasometría sanguínea, es el conjunto de determinaciones analíticas que permiten obtener información rápida y precisa sobre el adecuado funcionamiento del sistema respiratorio y el estado ácido-base de la sangre a través de la medición de pH, presión parcial de oxígeno PO2, presión parcial de dióxido de carbono PCO2 y concentraciones de iones de bicarbonato [HCO+3] e hidrógeno [H+]1,2.
En el desarrollo de esta prueba clínica intervienen varias fases, la pre-analítica, analítica y post-analítica, cada una de las cuales presentan factores que afectan la calidad de los resultados. En la fase pre-analítica está la mayor probabilidad de introducir errores en la prueba, sin embargo, es la menos estudiada2. En ella, la trazabilidad en los datos de identificación del paciente3, la calidad de las jeringas4, el tipo de anticoagulante usado5, la temperatura de transporte de la muestra (agua helada a 4°C)6, temperatura del paciente7 y el tiempo de almacenamiento entre la toma de la muestra y su procesamiento6 son entre otros, factores determinantes en la calidad de los resultados; de ahí la importancia de su estandarización y control permanente.
Un error en la identificación de las muestras biológicas representa un problema grave, con repercusiones directas e inmediatas en la seguridad del paciente3,4. Según varios estudios internacionales, la proporción de estos errores es significante6,8. Por otra parte, en la mayoría de los hospitales, las muestras de sangre se toman mediante el uso de jeringas de plástico de polipropileno de alta densidad (impermeables a los gases)7. El equipo de extracción de sangre adecuado para los estudios de gases sanguíneos es la jeringa plástica heparinizada8. Sin embargo, se ve el uso de jeringas plásticas no heparinizadas a las que le adicionan de manera manual la heparina lo cual, muy frecuentemente, conlleva a errores en el balance del anticoagulante vs muestra, y con ello a errores en las mediciones llevadas a cabo en gasometría9-11.
Las condiciones del paciente también afectan los resultados de este análisis clínico. Los equipos miden generalmente el pH, la PO2 y el PCO2 a 37°C. Por lo tanto, los pacientes con temperatura corporal de 37°C o cercana a esta, tendrán resultados exactos que corresponden a los intervalos de referencia, mientras que los pacientes febriles o extremadamente hipotérmicos pueden tener resultados que difieren marcadamente de la verdadera concentración in vivo7,12.
El tiempo de almacenamiento entre la toma de la muestra y su procesamiento, es otro factor determinante de la calidad de los resultados de gases en sangre. Las células no están ausentes en esta muestra y estas aún mantienen su metabolismo a expensas del consumo de oxígeno, por lo cual la presión de oxígeno puede reportarse baja, asociado a un incremento de la acidificación de la sangre es decir, disminución del pH relacionado al incremento del lactato12-14. A este efecto final se le suma la capacidad de los gases de difundir a través de la pared de polipropileno de la jeringa, variable que a su vez está influenciada por la temperatura del medio externo y la cantidad de la muestra14,15.
Son varios los factores que afectan la calidad de los resultados de los estudios de gasometría, un análisis fundamental en el manejo del paciente crítico. Sin embargo, no se encontró evidencia científica relacionada con el tema en Colombia de aquí que el objetivo del estudio fue evaluar la calidad del proceso pre-analítico de los análisis de gasometría sanguínea solicitados en las unidades de cuidados críticos e intermedios de una institución hospitalaria de tercer nivel de la ciudad de Santiago de Cali.
Materiales y métodos
Se trató de un estudio analítico de corte transversal llevado a cabo en una institución hospitalaria de tercer nivel de la ciudad de Santiago de Cali.
La población de estudio fue conformada por 1.692 solicitudes y muestras para estudio de gases sanguíneos de pacientes hospitalizados en los servicios de las Unidades de Cuidados Intensivos (UCI) e Intermedio (UCIN) de la institución fuente de información, tomadas durante los cuatro meses (diciembre a marzo) que duro el estudio.
Para el cálculo de tamaño de la muestra se consideró la fórmula 1 16:
Donde “n” correspondió al tamaño de la población a estudio, este dato se proyectó con base en las estadísticas del 2016 (1.692); “p” fue la proporción de unidades de análisis que cumplían con las especificaciones de calidad pre-analítica para muestras de gasometría sanguínea. Dado que este dato se desconocía, para el momento del diseño del protocolo se consideró tomar el valor de 0,5, como opción más segura. En este sentido, la proporción de casos que no cumplieron con los criterios de calidad pre-analítica en gasometría fue de 1-p=0,5. Finalmente, el error muestral (d) fue de 5%.Esto conllevó a una muestra de 313 a la cual considerando un porcentaje de pérdida de datos del 30%, se le sumaron 101 unidades más para una muestra efectiva final de 414.
Se incluyó en el estudio aquellas solicitudes con sus respectivas muestras que llegaron durante el periodo de estudio, procedentes de las unidades de cuidados intensivos (UCI) 2, 3 y 4 y de la unidad de cuidados intermedios (UCIN).
La selección de las unidades de análisis se realizó a través de muestreo aleatorio estratificado. Los estratos fueron los turnos de la mañana, tarde y noche. Esto significó un aporte del 15% (62/414) tanto para el turno de la mañana como el de la tarde y del 70% (290/414) para el turno de la noche seleccionados al azar a partir de las UCI2, UCI3, UCI4 y UCIN.
La Tabla 1 presenta un resumen de las variables consideradas en el estudio. Estas se midieron como variables dicotómicas (presente o ausente).
Tabla 1 Grupo de variables consideradas en el estudio
| Variable | Concepto |
|---|---|
| Diagnóstico clínico | Procedimiento por el cual se identifica una enfermedad o estado de salud de una persona |
| Nombre completo del paciente | Nombre y apellidos completos de acuerdo a documento de identidad presentado |
| No de historia clínica | Correspondiente al número de cedula del paciente |
| Edad | Años cumplidos al momento de la solicitud y toma de muestra |
| Sala de hospitalización | Dependencia asistencial de la institución donde se encontraba hospitalizado el paciente: UCI2, UCI3, UCI4 y UCIN |
| No de cama | Cama asignada en el servicio de hospitalización |
| Fecha de toma de muestra | Año, mes y día que fue tomada la muestra |
| Hora de toma de muestra | Hora en formato militar a la cual se le toma la muestra |
| Tipo de jeringa usada | Sistema de extracción usado para la toma de muestra |
| Tipo de anticoagulante usado | Anticoagulante presente en el sistema de extracción o adicionado a la jeringa usada para la extracción de la muestra |
| T° del paciente al momento de la toma de la muestra | Medida relativa de calor o frío asociado al metabolismo del cuerpo humano tomada en grados centígrados (°C) |
| Nombre del médico que ordena el análisis | Nombre y apellido completo del médico tratante |
| Registro del médico que ordena el análisis | Es la inscripción, en el sistema de información definido por el Ministerio de Salud y Protección Social, del talento humano en salud que cumple con los requisitos establecidos en la Ley 1164 de 2007 |
| Nombre o iniciales de la persona que toma la muestra | Nombre y apellido completo de la persona que tomó la mustra |
| T° de traslado pre-analítico (T° TP) | Medida relativa de calor o frío asociado al medio de transporte de la muestra tomado en grados centígrados (°C). Fue medida por la diferencia entre varias temperaturas parciales: -Temperatura del medio de transporte al momento de recibir la muestra en el laboratorio y la T del medio de transporte al momento de su entrega a mensajería en el servicio donde se originó -Temperatura del medio de transporte de la muestra al momento de su procesamiento en el laboratorio y T° del medio de transporte al momento de recibir la muestra en el laboratorio |
| Tiempo pre-analítico total (TPT) | Lapso de minutos que demoró el traslado de la muestra (mx) desde el servicio donde se tomó hasta el laboratorio. Fue medido por la diferencia entre diferentes tiempos parciales: -Hora de recepción de la muestra en el laboratorio y hora de toma de muestra (mx). -Hora de procesamiento de la muestra (mx) y hora de recepción de la muestra en el laboratorio. A partir de estas dos variables se calculó: diferencia de tiempo entre entrega de muestra (mx)/solicitud a mensajería vs toma de muestra (mx); diferencia de tiempo entre recepción de la muestra (mx)/solicitud en el laboratorio vs tiempo de entrega por mensajería y diferencia de tiempo entre procesamiento de la muestra (mx) y recepción de esta con su solicitud en el laboratorio clínico. |
T° = temperatura. T° TP = Temperatura de traslado pre-analítico. TPT = Tiempo pre-analítico total
Instrumento y recolección de datos
En una matriz se consolidaron las variables de servicio de origen de la solicitud/muestra y el diagnóstico clínico, así como las especificaciones de calidad de las solicitudes y muestras a evaluar las cuales se apoyaron en las directrices de la Guía de Buenas Prácticas para la Seguridad del Paciente en la Atención en Salud17. Y en las de la Sociedad Española de Bioquímica y Patología Molecular18. La medición de las diferentes temperaturas parciales pre-analíticas de la muestra se realizó con un termómetro digital LACOR debidamente calibrado en el rango de -7°C a 25°C. La medición de los tiempos parciales pre-analíticos se llevó a cabo con un cronómetro digital marca CITIZEN. Toda la información fue recolectada por las investigadoras y cuatro asistentes de campo, previamente entrenados.
Análisis de los datos
A las variables cuantitativas se les calculó sus medidas de tendencia central (media, moda y mediana) y dispersión (DE) y a las variables cualitativas, proporciones y razones. Se valoró la distribución de los datos cuantitativos a través del Sktest. El análisis bivariado se llevó a cabo a través de tabulaciones cruzadas (Tabla de 2 x K) y usando el test de medianas y el Test de Kruskal Wallis (Test KW); de acuerdo a la distribución de los datos, se evaluó si existían diferencias estadísticamente significativas en el manejo de la muestra por unidad de servicio, turno, mes, semana de estudio y día de la semana.
Un análisis de correlación fue hecho entre la temperatura pre-analítica total (T°PT) y el tiempo pre-analítico total (TPT) usando el índice de correlación de Pearson. Todos los análisis, las gráficas y las tablas se llevaron a cabo en el software estadístico STATA 15 en su versión modem.
Consideraciones éticas
Esta investigación fue clasificada como un estudio sin riesgo según Resolución 8430 de 1993 del Ministerio de Salud de Colombia, siguió los lineamientos éticos expuestos en la Declaración de Helsinki de 1964, última revisión en 2002 y fue aprobado por el Comité Institucional de Revisión de Ética de la Universidad del Valle y el de la institución hospitalaria fuente de información. La propuesta fue presentada ante el coordinador de las unidades de cuidados críticos, personal de enfermería y médicos asistenciales de estos servicios quienes apoyaron la recolección de los datos a partir de registros hospitalarios, respetando la confidencialidad de los datos personales de los de los pacientes a quienes se les ordenaron los estudios de gasometría.
Resultados
Del total de 414 muestras biológicas con sus respectivas solicitudes procedentes de 125 pacientes que fueron incluidas en el estudio: 172 se recibieron en diciembre, 136 en enero, 34 en febrero y 72 en el mes de marzo. Los días martes, jueves y domingo se solicitó el mayor número de análisis gasométricos (222/414). En promedio llegaron 4 muestras por día, con un máximo de 7, lo cual ocurrió los días domingos. La mayoría de dichas solicitudes se presentaron en las horas de la noche, entre las 23:00 y las 24:00. Los pacientes a quienes se les tomaron las muestras se encontraban hospitalizados en estas unidades por problemas de insuficiencia respiratoria (35%), encefalopatía tóxica (33%), sepsis con insuficiencia renal (30%), y otras patologías (2%). La Tabla 2 resume los hallazgos de las variables de calidad de la solicitud y la muestra.
Tabla 2 Distribución de los datos mínimos requeridos en la solicitud y la muestra
| Solicitud | |||
|---|---|---|---|
| Presente % | Ausente % | ||
| Nombre completo del paciente | 100 | ||
| No de historia clínica | 100 | ||
| Edad | 100 | ||
| Sala de hospitalización | 100 | ||
| No de cama | 100 | ||
| Hora de toma de muestra | 100 | ||
| Tipo de jeringa usada | 100 | ||
| Tipo de anticoagulante usado | 100 | ||
| T° del paciente al momento de la toma de la muestra | 40 | 60 | |
| Nombre del médico que ordena el análisis | 100 | ||
| Registro del médico que ordena el análisis | 100 | ||
| Nombre de la persona que toma la muestra | 100 | ||
| Muestra | |||
| Presente % | Ausente % | ||
| Nombre completo | 100 | ||
| No de historia clínica | 100 | ||
| Fecha de toma de muestra | 100 | ||
| Hora de toma de muestra | 100 | ||
| Sala de hospitalización | 100 | ||
| Numero de cama | |||
| Nombre o iniciales de la persona que toma la muestra | 100 | ||
| T° del medio de transporte al momento de envío al laboratorio | 100 | ||
No= Número; T°= Temperatura
En las solicitudes no se hizo referencia al tipo de jeringa utilizada o anticoagulante cuando se usó jeringa no heparinizada. Sin embargo, el grupo de investigadores identificó esta proporción de muestras (9%), en ella no fue posible identificar el tipo de jeringa y heparina usada. La variable tiempo pre-analítico total (TPT) de la muestra, no presentó una distribución normal (Sktest, p<0,05). Cuando las muestras fueron trasladadas directamente por el personal de enfermería, la diferencia de tiempo entre la recepción de la muestra en el laboratorio clínico y su toma en el servicio estuvo por debajo de 30 minutos. Los tiempos parciales se resumen en la Figura 1.
La mediana y rangos de las diferencias de los tiempos pre-analíticos parciales considerados en este estudio se presentan en la Tabla 3.
Tabla 3 Distribución de las diferencias de los tiempos pre-analíticos parciales y el tiempo pre-analítico total de las muestras incluidas en el estudio en minutos
| Tiempos pre-analíticos parciales | Mediana | Rango |
|---|---|---|
| Hora de entrega de muestra a mensajería/hora de toma de muestra | 20 | 0-105 |
| Hora de recepción de la muestra en el laboratorio/hora de entrega de muestra a mensajería | 15 | 0-55 |
| Hora de procesamiento de la muestra en el laboratorio/hora de recepción en el laboratorio | 18 | 0-56 |
| Tiempo pre-analítico total (TPT) | 48 | 5-170 |
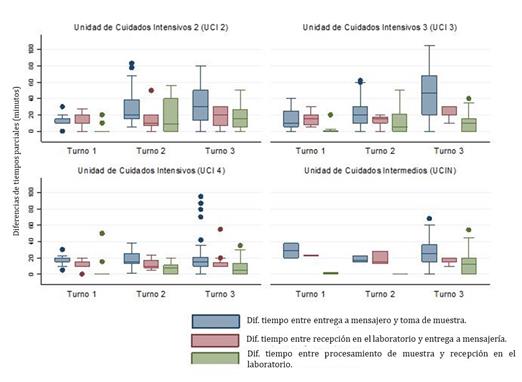
El test de Kruskal-Wallis mostró que las diferencias entre los tiempos pre-analíticos parciales por semana de estudio presentaban diferencias estadísticamente significativas X2= 71,540; p=0,0001) (Figura 2).
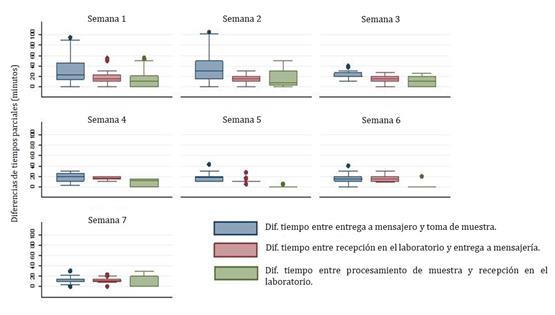
Figura 2 Distribución de los tiempos promedios de manejo pre-analítico de las muestras discriminadas por semana de estudio
Al evaluar cuantas muestras se manejaron en cada servicio durante el periodo en estudio, se encontró que la UCI2 entregó 129 muestras y la UCI3 124, estos dos servicios aportaron el 61,1% de las muestras en estudio.
La temperatura de almacenamiento de las muestras en el medio de transporte al momento de la entrega a mensajería estuvo entre 3,3°C a 21,2°C y al ser recibidas en el laboratorio entre 3,7°C a 21,1°C. La Figura 3 presenta la distribución de esta variable por turno.
Figura 3 Diferencias de temperaturas (°C) por servicio donde se originó la solicitud con su muestra discriminada por turno
Tomando como referente el TPT de 30 minutos (18) discriminado por servicios, se observó que las muestras procedentes de las UCI 2 y 3 presentaron los datos más prolongados por turno, por encima de 30 minutos, con diferencias estadísticamente significativas en relación con los otros dos servicios, UCI4 y UCIN (Test KW, X2=11,9083; p=0,008). El servicio con menos dispersión en esta variable fue la Unidad de Cuidados Intermedios (Figura 4).
En una tabulación cruzada entre temperatura de transporte óptima (≤4°C) y tiempo de traslado óptimo (≤ 30 minutos), se evidenció que 14 muestras de las 414 cumplieron con los valores establecidos por la Sociedad Española de Bioquímica y Patología Molecular18, 104/414 muestras llegaron dentro de los primeros 30 minutos pero con temperaturas superiores a 4°C, 8/414 llegaron con los 4°C pero más allá de los 30 minutos y 288/414 llegaron más allá de los 30 minutos con más de 4°C (Test de Medianas, p=0,047) (Tabla 4).
Tabla 4 Distribución de las muestras por unidad de cuidado que cumplieron con el estándar de temperatura de almacenamiento pre-analítico y tiempo de traslado
| Servicio | ≤ 4°C | > 4°C | Tiempo traslado ≤30 minutos | Tiempo traslado >30 minutos | Total de muestras |
|---|---|---|---|---|---|
| UCI2 | 0 | 129 | 31 | 98 | 129 |
| UCI3 | 4 | 120 | 30 | 94 | 124 |
| UCI4 | 6 | 88 | 49 | 45 | 94 |
| UCIN | 6 | 59 | 9 | 56 | 65 |
| Total de muestras | 16 | 396 | 119 | 293 | 412 |
Para finalizar, se evaluó la correlación entre las variables TPT y T°PT a través del índice de correlación de Pearson; los resultados mostraron una correlación positiva estadísticamente significante entre las dos variables (R=0,709; p=0,0001).
Discusión
Los resultados del estudio mostraron una baja adherencia a directrices o recomendaciones nacionales e internacionales en el manejo adecuado de muestras, específicamente la de gasometría, que pudieran afectar la seguridad del paciente y la toma de decisiones de los médicos en el manejo del paciente crítico.
Las muestras del estudio procedían de pacientes hospitalizados en unidades de cuidados críticos e intermedio, por lo tanto, eran pacientes que presentaban marcadas condiciones de vulnerabilidad clínica, en donde los cambios en PO2 y PCO2 y otros parámetros bioquímicos han mostrado ser determinantes en su pronóstico19.
Si bien los procedimientos pre-analíticos en este tipo de pruebas, son comunes a todos los exámenes de laboratorio, tienen asociadas ciertas variables que afectan la calidad de los resultados, las cuales están directamente relacionadas con las propiedades físico-químicas de los analitos que se están midiendo. El trabajo evaluó 5 de las 12 variables reportadas en la literatura internacional20.
Durante el desarrollo del proyecto se evidenció la ausencia de un protocolo institucional para la elaboración de una solicitud médica que cumpla con requisitos mínimos de identificación de los pacientes definidos por el Ministerio de Salud17 y con datos de relevancia para la toma de decisiones en el laboratorio clínico18. Según Baird11, la correcta identificación de la solicitud, la muestra y la concordancia entre los datos registrados en estas dos fuentes, es muy importante para la seguridad del paciente, dado que la toma de decisiones del médico con relación al balance hidroelectrolítico de un paciente crítico, en la mayoría de los casos involucra un resultado de gases en sangre. El rótulo de una muestra para estudio gasométrico debe contener no sólo identificadores únicos del paciente sino también la fecha y hora de toma de la muestra, su ubicación para garantizar que el paciente correcto se esté sometiendo a prueba y que se pueda llamar por teléfono ante un resultado crítico de inmediato21.
En contraste la guía de buenas prácticas para la seguridad del paciente en la atención en salud en Colombia, solo hace hincapié en un doble mecanismo de identificación que incluye el nombre del paciente y el número de cédula de ciudadanía el cual a su vez corresponde al número de historia clínica17.
Según el Comité de Estándares de Calidad para Laboratorios Clínicos de Estados Unidos (NCCLS), existen muchas oportunidades de mejora continua de la calidad en esta fase en lo que respecta al procedimiento de identificación inequívoca de muestras o especímenes, ya que el objetivo final es garantizar que el tipo de muestra adecuado, se recolecte en el recipiente adecuado, en el momento correcto y a partir del paciente correcto. La identificación precisa del paciente es, por lo tanto, fundamental y no puede darse por sentado22. Es por ello que el NCCLS y otros expertos internacionales han descrito que el rótulo de una muestra para estudio de gases en sangre debería contener como mínimo: nombre completo del paciente, edad/fecha de nacimiento, número de historia clínica, sala o servicio de hospitalización, cama de hospitalización, fecha y hora de toma de muestra, médico tratante, temperatura del paciente al momento de la toma de la muestra, estado de ventilación, sitio de toma de muestra, posición del paciente al momento de la toma de la muestra, tipo de anticoagulante usado, tipo de jeringa usada y persona que toma la muestra23-25.
En este estudio se excluyeron cinco de estas variables (fecha de nacimiento, médico tratante, estado de ventilación, sitio de toma de muestra y posición del paciente al momento de toma demuestra) y de las recolectadas se cumplió, en el total de los casos, con el registro del número de historia clínica y la hora de toma de muestra. Luego, no se observó datos suficientes para la identificación inequívoca del paciente y en un alto porcentaje tampoco la identificación de factores que pudieran afectar la calidad. Al respecto en este último punto el paciente crítico no maneja una temperatura corporal normal y, debido a su enfermedad o tratamiento, son hipotérmicos o hipertérmicos. La hipotermia se asocia con una disminución de PCO2 y PO2, como consecuencia del aumento de la solubilidad de estos gases, y la hipertermia se asocia con un aumento de PCO2 y PO2, como consecuencia de la disminución de la solubilidad10. Adicionalmente, el cambio dependiente de la temperatura en la PCO2 afecta de manera secundaria al pH de la sangre; de tal forma que la hipotermia se asocia con un aumento del pH y la hipertermia con un descenso de este11. En tal circunstancia, es apropiado aprovechar los algoritmos que comúnmente se proporcionan en el software de los analizadores de gases en sangre que permite que las mediciones realizadas a 37°C en el equipo, se corrijan matemáticamente a la temperatura corporal real del paciente. Este proceso no se llevó a cabo en más el 50% de las muestras incluidas en este estudio por la ausencia del dato de la temperatura del paciente.
Las variables T°PT y TPT, están relacionadas. Basados en estudios experimentales limitados, se ha logrado establecer que la demora en el análisis puede disminuir la PO2 y aumentar la PCO2 en sangre arterial almacenada a 4°C debido al metabolismo celular10. Sin embargo, la revisión de Baird11, describió que el exceso de exposición de las muestras en algunas jeringas plásticas a temperaturas ≤4°C trae problemas, primero porque en las muestras se duplica el coeficiente de solubilidad del oxígeno en la sangre (de 21,4 mL O2/L de plasma a 37°C a 39,5 mL O2/L de plasma a 4°C) y segundo por el aumento de la afinidad entre el oxígeno y la hemoglobina, conduciendo a una disminución inicial de la PO2 en la muestra. Este fenómeno aumentaría el gradiente de oxígeno de la atmósfera a la muestra por la contracción del polímero, que conlleva a un ensanchamiento de los poros del material, los cuales parecen permitir el intercambio de moléculas de oxígeno con el medio externo, pero limitan el paso de las moléculas de dióxido de carbono mucho más grandes. Este comportamiento fue observado por Mohammadhoseini et al.13.
Si bien analizar los cambios en la PO2 y PCO2 cuando se usan jeringas plásticas y almacenan muestras a diferentes temperaturas no fue objeto de estudio, es un trabajo interesante a considerar pues permitiría evaluar el impacto del tiempo y la temperatura en los actuales equipos de extracción11,26,27.
Un porcentaje significativamente alto de las muestras de este estudio fueron trasladadas al laboratorio directamente por el personal de enfermería, en ellas el TPT fue inferior a los 30 minutos. Esto es lo ideal cuando se toman muestras para gases sanguíneos con jeringas plásticas28,29, para Lippi et al.2, así como para Delost10 y Baird11, no hay razón para mantener la muestra en agua helada si es procesada dentro de los primeros 30 minutos de tomada.
Por otra parte, no fue posible identificar el tipo de heparina usada tanto en las jeringas ya heparinizadas como en las que no tenían heparina, situación bajo la cual también debía considerarse la cantidad de heparina. Hay varios estudios que muestran la influencia del tipo de anticoagulante en la calidad de los resultados de gasometría sanguínea. El efecto interferente del anticoagulante sobre la muestra de sangre puede producirse por quelación o por dilución, si se usa un preparado líquido añadido en exceso en jeringas corrientes no liofilizadas con heparina30,31. Una cantidad inadecuada de anticoagulante puede afectar hasta en un 28% la PCO29.
La presencia de burbujas de aire en las muestras también afecta la calidad de los resultados de la PO2 y pH. Calaf y Giner32, llevaron a cabo un estudio para valorar la calidad de cinco equipos de extracción de sangre arterial, los resultados permitieron concluir que dos de los cinco equipos valorados permitían obtener muestras con menos burbujas y mayor facilidad para eliminarlas en el 44% de los casos. Esta variable fue considerada en este estudio, puesto que se evidenció la práctica de solicitar las jeringas herparinizadas a los familiares de los pacientes hospitalizados en las unidades fuentes de información, sin embargo, no fue posible recolectar el dato. Esto representa una debilidad en el estudio y una oportunidad para considerar en investigaciones futuras. Lima-Oliveira et al.33, así como Calaf y Giner32, evaluaron cuatro tipos de jeringas, concluyendo que existían diferencias significativas entre los resultados del pH según equipo de extracción usado, los cuales iban acompañados de una disminución de la PCO2, debidas probablemente a la fuga de gas a través del material plástico de los dispositivos de recolección, además, uno de los equipos contaminaba menos la muestra.
Muchas pueden ser las causas de los errores pre-analíticos en los estudios de gasometría, incluyen tanto factores del paciente debidos a la presencia de interferencias por fármacos o dietas especiales, como por el procedimiento de toma de muestra y manejo pre-analítico22,23. Sin embargo, para Baird11) y Youssef et al.34, es posible hacer una buena mitigación de estos factores con procesos de capacitación continua, sensibilización de la importancia del manejo urgente o prioritario de estas muestras así como la estandarización de los procedimientos y evaluación de la adherencia a estos, a través del diseño de listas de chequeo para el control de calidad de las muestras que ingresan al laboratorio, del proceso de toma de muestras y gestión de la misma en la fase pre-analítica, entre otros. Sin embargo, son estrategias que en su conjunto nunca proporcionan el 100% de efectividad de aquí la importancia de la gestión del riesgo en la fase pre-analítica, que la mayoría de las veces se encuentra fuera del control del personal del laboratorio clínico debidamente entrenado y capacitado35.
Conclusión
Se identificó un bajo cumplimento de los estándares técnicos de las variables de temperatura y tiempos de traslados para gasometría. Estas dos son variables relacionadas, de manera que un efecto indeseable en una, impacta directamente en la otra. De aquí la importancia de controlar simultáneamente las dos variables. Se evidenció un bajo cumplimiento global de la guía nacional para la identificación de pacientes, solicitudes y muestras del Ministerio de la Protección Social para la seguridad del paciente. Estos lineamientos son insuficientes para la gestión del riesgo y seguridad del paciente desde el laboratorio clínico. La fase pre-analítica es una fase muy manual, razón por la cual, el primer paso para mejorarla es la documentación, estandarización y normalización de sus procedimientos que posteriormente han de ser socializados con el personal y controlados a través de listas de chequeo que permitan consolidar datos para el diseño y cálculo de indicadores de control. La responsabilidad de la calidad de los resultados analíticos es del personal de laboratorio y si bien, la de toma de muestra no es llevada por este, es imprescindible que los expertos del análisis clínico aporten su conocimiento y experticia en el diseño y vigilancia del cumplimento de los procedimientos pre-analíticos extralaboratorio que afectan sus mediciones.
Limitaciones y fortalezas
El no haber identificado el tipo de jeringa y el anticoagulante limitó mucho el análisis de los resultados, considerando estas fallas técnicas en el equipo de extracción. Los estudios identificados en la revisión bibliográfica indicaban la pertinencia de su valoración por institución con el fin de definir parámetros objetivos de compra de estos insumos. Por otra parte, no se recolectó la variable cantidad de volumen de muestra y la presencia de burbujas de aire, factores determinantes en la PO2, PCO2 y pH.