Introducción
La resistencia bacteriana es considerada una problemática de salud pública mundial que genera altas tasas de mortalidad. Aunque es de grandes proporciones, es posible minimizar su impacto, impulsando la búsqueda de nuevos productos como compuestos de origen metabólico y genes que puedan ser usados como antimicrobianos, cuyas fuentes sean producto de la biodiversidad natural de los ecosistemas, en este caso de la región nariñense1. Las principales causas de resistencia bacteriana se vinculan al uso de antibióticos en las fuentes primarias de alimentación humana2, en el entorno clínico y en la industria, ocasionando mecanismos que aumentan la probabilidad de generación de resistencia, multi-resistencia, resistencia-extrema y pan-resistencia3. Adicionalmente, la movilización humana facilita la diseminación de genes, la adaptación bacteriana a diferentes ambientes4 y finalmente, a los procesos ecológico-evolutivos que brindan mecanismos para la incorporación de material genético como plásmidos, transposones, integrones, entre otros, que conllevan al aumento de resistencia1. Complementariamente, las variaciones ambientales establecen condiciones ideales de distribución ilimitada de dichos genes, contribuyendo a la tolerancia a los antimicrobianos presentes en bacterias ambientales5.
En Colombia, la incidencia de infecciones bacterianas es elevada, cerca de 40% de los casos se dan en mujeres y 12% en hombres. Los antecedentes indican que el patógeno Escherichia coli, es responsable de 70% a 95% de las infecciones de origen bacteriano, y Staphylococcus aureus del 35%6.
El desarrollo de resistencia en estas bacterias ha resultado en la ineficacia de antibióticos de primera y segunda generación, por lo cual la tendencia es la búsqueda de microorganismos en zonas sin exploración humana con el fin de encontrar nuevas fuentes de antibióticos7. El aislamiento de microorganismos a partir de ambientes sin intervención humana ha permitido caracterizar diversas especies productoras de potenciales metabolitos antibacterianos, ejemplo de ello lo constituyen los actinomicetos8,9, bacilos Gram positivos formadores de cadenas micelares ubicados en gran variedad de ecosistemas, con pH bajo de suelo, disposición alta de materia orgánica9.
Los actinomicetos son un grupo catalogado como uno de los más prometedores para la obtención de fuentes de antimicrobianos, ya que actualmente producen entre 60% y 70% de los antibióticos del mercado farmacológico8. Dentro de los metabólitos (MS) con actividad antibiótica sintetizados por Streptomyces sp, se destaca un grupo de compuestos denominados policétidos y péptidos de síntesis no ribosomal, entre los cuales se encuentran sustancias de aplicación en medicina y biotecnología8. Estas bacterias requieren de condiciones específicas como cantidad de materia orgánica, pH, disponibilidad de sustratos en el suelo, que de acuerdo con lo descrito en la literatura10, presentaría características semejantes al ecosistema nariñense de la Reserva Ñambí11,12.
Teniendo como base la problemática de la Resistencia Antimicrobiana (RAM), este estudio se propuso aislar actinomicetos del bosque tropical de Nariño, con potencial producción de metabolitos inhibitorios contra bacterias multidrogo-resistentes. Para eso, se trabajó con actinomicetos que, de acuerdo con lo previamente descrito, son las principales bacterias productoras de agentes antibacterianos, se encuentran en ecosistemas poco explorados, y para su crecimiento, requieren de características biológicas y fisicoquímicas como las presentes en el bosque tropical de Nariño.
Materiales y métodos
Lugar de muestreo, colecta, transporte y tratamiento de suelo
Para el aislamiento de actinomicetos, se tomaron muestras de suelo de la reserva Natural Rio Ñambí, perteneciente al departamento de Nariño, Colombia; compuesta por un área aproximada de 1500 ha, formada por bosque pluvial premontano, ubicada a una altura entre 1100 y 1900 m.s.n.m. Esta se caracteriza por presentar altos índices de humedad como resultado de una precipitación media anual cercana a 8000 mm y temperatura promedio de 19 °C11. Se recolectaron de 5-10 g de muestras de suelo con una perforación en “V”, a una profundidad entre 2-8 cm9,13 tal como se presenta en la Tabla 1. El suelo presentó capas de hojarasca de aproximadamente 20 mm, ausencia de inclinación, tránsito o retención de cuerpos de agua, consecutivamente las alícuotas de suelo se almacenaron y transportaron bajo refrigeración a 4°C al laboratorio de Procesos Microbianos de la Universidad de Nariño para su respectivo procesamiento.
Componentes fisicoquímicos del suelo
La determinación de los componentes fisicoquímicos del suelo fue realizada in situ usando el equipo WTW Multi 343014. Los parámetros determinados fueron, pH, temperatura, luminosidad y humedad del suelo. Además, se realizaron análisis químicos de intercambio catiónico, materia orgánica, P, Ca, Mg, K, Al, Fe, Mn, Cu, Zn, B, N, C, S y densidad aparente14.
Aislamiento y caracterización morfológica, macroscópica y microscópica, y crecimiento de las actinobacterias
De cada muestra procesada9,15, se realizó siembra masiva por triplicado en los medios de cultivo: agar de aislamiento de actinomicetos, agar almidón amoniacal, agar sacarosa almidón y agar almidón caseína, cada uno con adición de Nistatina (20 µg/mL) como antifúngico, se incubaron a 30 °C por de 30 días, en incubadora marca BinderGmbH Bergstr 14 D-78532 Tuttlingen.
Una vez se verificó el crecimiento inicial de los actinomicetos, se observó macroscópicamente la presencia de micelio vegetativo, micelio aéreo, esporas, margen del aislado y elevación, además de la coloración del micelio, presencia de esporas y de exudados. Posteriormente, se realizó tinción de Gram para observar al microscopio (AmScope) a 100 X, presencia de células filamentosas Gram positivas formadoras de cadenas micelares16. Los aislados obtenidos fueron codificados con referencia al punto de muestreo (P1, P2, P3), la dilución madre (-3, -5, -7) y el número en secuencia en que fue aislado.
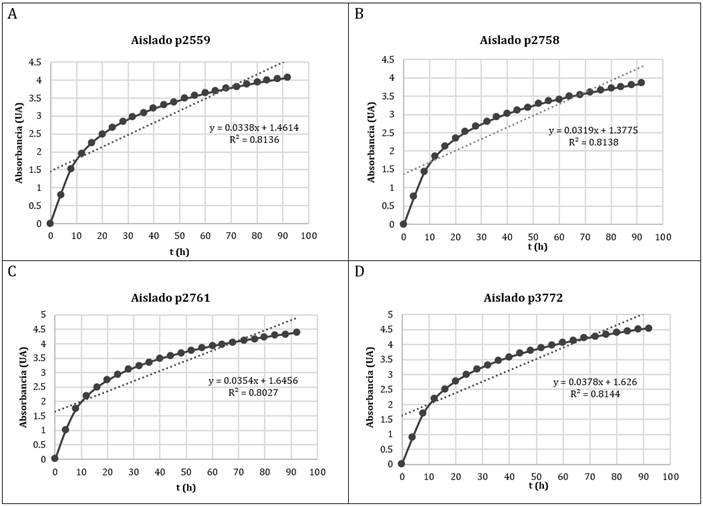
Para las bacterias que se identificaron posteriormente como Streptomyces sp, se realizó curva de crecimiento microbiano.
Identificación molecular
La extracción de DNA en los aislados se realizó por el método Salting Out17,18. La concentración final de DNA se determinó espectrofotométricamente usando el Nanodrop Thermo scientific, modelo Nanodrop One C. Finalmente, todas las muestras se ajustaron a la misma concentración para la amplificación del gen 16S RNAr. Para ello, se utilizaron los cebadores universales 27F [5´AGAGTTTGATCMTGGCTCAG 3´] y 1041R [5´CGGTGTGTACAAGACCC 3´]. La PCR se realizó en el equipo MULTIGENE OPTIMAX, Labnet International, Inc. Para eso, se preparó una mezcla que contenía Agua MilliQ, Buffer Colorless 5X (Promega), MgCl2 (Promega), de dNTP, cebadores (27F y 1041R), ADN polimerasa GoTaq R (Promega) y DNA. Para la reacción, se aplicaron los siguientes ciclos: inicio 2 min a 95 °C para desnaturalización inicial, seguido de 30 ciclos de 94 °C por 2 min, 55 °C por 1 min y 72 °C por 3 min, con una elongación final a 72 °C por 10 min. Los fragmentos de ADN amplificados por PCR se visualizaron por electroforesis en gel de agarosa a 1% usando como intercalante gel red (Biotium).
Los amplicones fueron secuenciados por la Empresa Corpogen mediante el contrato 064S-B-2019-SEC. Las secuencias obtenidas se editaron utilizando el programa ClustalW y BLAST. Para la secuencia parcial del gen 16S rRNA se alinearon con secuencias de nucleótidos almacenadas en las bases de datos GenBank/Ribosomal Database Project/NCBI.
Producción y extracción de metabolitos secundarios
Las esporas de los aislados fueron reactivadas a 30 °C durante 3 días en 10 mL de caldo tripticasa soja (TS), posteriormente 2 ml de este medio fueron inoculados en 200 mL de medio (R5) para aislamiento de actinomicetos Himedia Ref M490 (Proteína M-Sales de caseinato de sodio 2 g/L; L-Asparagina 0,1 g/L; Propionato de sodio 4 g/L; fosfato de hidrógeno dipotásico 0,5 g/L; sulfato de magnesio 0,1 g/L; sulfato ferroso 0,001 g/L; Agar 15 g/L; pH final de 8,1 a 25 °C± 0,2) recomendado como medio de estrés5,18. Se inocularon 2 ml de estos, en 200 mL de medio R518 e incubaron a 30 °C /180 rpm por 10 días. A partir de los siete días se detectó cambio de color en el medio de cultivo de los diferentes aislados18, indicando el agotamiento del sustrato principal y activación del metabolismo secundario18.
Terminada la incubación, al medio R5 se le adicionaron 100 mL de Acetato de etilo. La precipitación con acetato de etilo o mezclas con este, es un protocolo común en la obtención de compuestos con actividad antimicrobiana5,18, se agitó por dos horas a 180 rpm y por 1 h a 90 rpm; y finalmente se llevó a separación en embudo de decantación a temperatura ambiente. Se tomó la fase orgánica y se secó por rota-evaporación hasta obtener la menor cantidad posible de solución (Equipo Heidolph Rotary Evaporator Hei VAP)17.
Perfil de resistencia a antibióticos de las bacterias patógenas
Se determinó mediante la técnica de Bauer Kirby el perfil de resistencia de las bacterias patógenas E. coli y S. aureus aisladas de muestras hospitalarias y conservadas en el Banco de Células Primarias del Laboratorio de Procesos Microbianos de la Universidad de Nariño se determinó mediante la técnica de Bauer Kirby19,20. Los antibióticos usados fueron: (P) penicilina, (SAM) ampicilina (10μg), (AMC) amoxicilina (30μg), (CTX) cefotoxima (30μg), (STX) trimetroprim-sulfametoxazol (25μg), (CN) gentamicina (10μg), (ATM) aztreonam, (CIP) ciprofloxacina (5μg), (IPM) imipenem, (AK) amikacina (30μg), (S) estreptomicina (10μg) y (EM) eritromicina (30μg) (OXOID).
Pruebas de inhibición de bacterias patógenas por los extractos metabólicos
Para la prueba de inhibición se trabajó con el método de doble capa en Agar Mueller Hinton (MH), con 6 mm de diámetro por pozo21. Inicialmente, se adicionó la primera capa de agar MH y se perforaron los pozos, posteriormente, se adicionaron en el medio de cultivo 20 μL del extracto metabólico obtenido de cada aislado en cada pozo. Para el control negativo se utilizó agua destilada estéril y para el control positivo AMC (30μg). Finalmente, se incorporó otra capa de agar MH blando con las bacterias patógenas E. coli y S. aureus en solución. Los resultados fueron positivos (+) cuando hubo presencia de halos, y negativos (-) en ausencia.
Para la prueba de inhibición por sensidiscos se trabajó con Agar MH y con sensidiscos de 5 mm de diámetro. Inicialmente, se realizó siembra masiva de las bacterias patógenas en medio de cultivo. Posteriormente, se adicionaron 20 μL de los respectivos extractos metabólicos a los sensidiscos, el control positivo (+) fue AK (30μg) y el negativo (-) agua destilada estéril. Los halos producidos por los metabolitos antibacterianos del extracto en las pruebas de pozos y sensidiscos fueron medidos con un Calibrador Pie de Rey en mm, el crecimiento intermedio fue reportado como bacteriostático también fue medido. Se inoculó el solvente Acetato de etilo como control negativo18.
Concentración mínima inhibitoria (CMI)
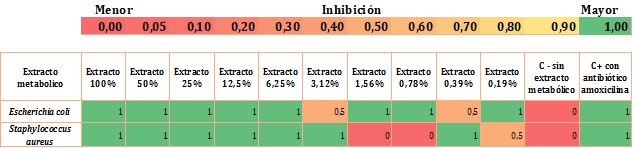
De acuerdo con los datos de inhibición encontrados se observó que el extracto con mayor efecto antibacteriano fue el producido por el aislado P3772. Previamente se reactivaron las bacterias patógenas en tubos con caldo LB e incubaron a 37 °C hasta obtener un valor de turbidez de 0,5 en la escala Mc Farland. Para determinar la CMI de este extracto, en placas de microtitulación 12 x 8 se adicionaron 80 μL de caldo estéril MH, 10 μL del medio LB que contenía a las bacterias patógenas y 10 μL del extracto metabólico en porcentajes de 100%, 50%, 25%, 12,5%, 6,25%, 3,125%, 1,56%, 0,78%, 0,39% y 0,19% para un volumen final de 200 μL. La columna 11 de la placa, sin adición del extracto metabólico se tomó control positivo y la columna 12 con AMC 30μg/ml, como control negativo. La placa preparada se incubó a 37 °C por 24 h. Transcurrido el tiempo, se agregaron 40 μL de Cloruro de trifenil-tetrazolium y se incubó por 12 h más. Las lecturas de inhibición se tomaron como negativas cuando el medio cambió a coloración roja (crecimiento bacteriano positivo) y como positivas cuando el medio no modificó su color (crecimiento bacteriano negativo), ya que la intensidad de la coloración rojiza es directamente proporcional a la actividad metabólica de los microorganismos. Los parámetros de evaluación definidos fueron Sensible (>5 pozos con inhibición), Intermedio (5 a 4 pozos con inhibición) y Resistente (<4 pozos con inhibición). Los resultados se procesaron en un Heatmap en Microsoft Excel, donde se realizó una matriz tomando 1 para sensible, 0,5 para intermedio y 0 para resistente.
Análisis del extracto metabólico por Cromatografía Líquida de Alta Resolución (HPLC)
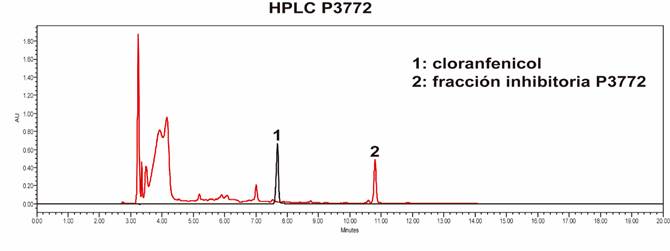
El extracto metabólico con la mayor actividad inhibitoria (P3772) fue analizado por Cromatografía Líquida de Alta Resolución (HPLC) en Columna Agilent ZORBAX Eclipse Plus C18 en el equipo Prominence Shimadzu. La fase móvil (A) fue H2O+ 0,1% ácido fórmico y (B) fue acetonitrilo + 0,1% de ácido fórmico; en gradiente desde 5% a 100% de B por 20 min con un flujo de 1mL/min. Como control, se realizó una corrida utilizando el cloranfenicol, como patrón, debido al tiempo de retención en el que este fue eluido de la columna cromatográfica, de modo que se compararon los perfiles cromatográficos.
Prueba de citotoxicidad
Esta prueba fue realizada para evaluar los 4 aislados identificados molecularmente como Streptomyces sp. Para eso, se sembraron separadamente y por triplicado, en agar sangre a concentración de 3% y 5%, y se incubaron a 30 °C por 7 días. Terminado el tiempo de incubación, se registró la formación de lisis (alfa o beta) o la ausencia de lisis (gamma), se comprobó la presencia de hemólisis gamma19.
Resultados
Análisis fisicoquímico de suelos
Los resultados de los análisis fisicoquímicos realizados mostraron que el punto 1 de muestreo (P1) presentó los menores valores de pH, luminosidad y humedad, contrario a los datos obtenidos en el punto 3 (P3), cuyos valores fueron mayores (Tabla 2).
Tabla 2 Pruebas fisicoquímicas tomadas en campo y análisis fisicoquímico de las muestras de suelo
| Parámetro | P1 | P2 | P3 |
|---|---|---|---|
| pH | 6,8 | 7,1 | 7,1 |
| Luminosidad* | 80 | 110 | 110 |
| Humedad* | 2 | 4 | 4,5 |
| Muestras de suelo | |||
| pH | 4,43 | 4,36 | 4,45 |
| Materia orgánica (%) | 32 | 24,5 | 19,7 |
| Fósforo (mg/Kg) | 13,6 | 4,83 | 4,33 |
| Intercambio catiónico (cmol/Kg) | 71,7 | 59,1 | 49,3 |
| Calcio (cmol/Kg) | 7,66 | 0,24 | 0,08 |
| Magnesio (cmol/Kg) | 2,48 | 0,36 | 0,37 |
| Potasio (cmol/Kg) | 0,6 | 0,27 | 0,29 |
| Aluminio (cmol/Kg) | 2,15 | 4,86 | 2,68 |
| Hierro (mg/Kg) | 205 | 190 | 113 |
| Manganeso (mg/Kg) | 10,1 | 0,4 | 1,2 |
| Cobre (mg/Kg) | 0,47 | 0,93 | 0,84 |
| Zinc (mg/Kg) | 1,78 | 0,93 | 0,84 |
| Boro (mg/Kg) | 0,18 | 0,33 | 0,38 |
| Nitrógeno (%) | 0,78 | 0,71 | 0,63 |
| Carbono (%) | 18,6 | 14,2 | 11,4 |
| Azufre (mg/Kg) | 10,3 | 4,13 | 2,37 |
| Densidad (g/cc) | 0,55 | 0,4 | 0,7 |
*Los valores de Luminosidad tienen escala de 0 a 2000 y los valores de humedad escala de 0 a 10
** P1, Punto 1; P2, Punto 2; P3, Punto 3
La cuantificación de P, Mg, K, Cu y S en los tres puntos fue menor que la reportada previamente11,12 para componentes fisicoquímicos de suelo (Tabla 2). La composición de los macronutrientes P, Mg, K y S, fue inferior a la óptima para suelos11.
El P3 presentó las cantidades más bajas de los elementos analizados en comparación con los otros puntos. Se presentaron bajos contenidos de P, Ca, Mg, Mn, Cu, Zn y S (Tabla 2, P3).
Aislamientos y crecimiento bacteriano
Se obtuvieron 11 aislados bacterianos, definidos por las características macro y microscópicas observadas. El agar de aislamientos de actinomicetos (AIA) suplementado con Nistatina fue seleccionado por presentar la mayor cantidad de colonias. Al realizar la tinción de Gram, y posteriormente observar al microscopio, se verificó que los 11 aislados obtenidos, presentaron las estructuras características de actinomicetos21. Las curvas de crecimiento construidas a partir de los aislados pertenecientes al género Streptomyces sp. se muestran en la (Figura 1).
Identificación molecular
Garantizada la integridad del ADN obtenido, se realizaron las amplificaciones correspondientes al 16S RNAr de los actinomicetos, y se obtuvo el fragmento de 1500 pb esperado. Al realizar los análisis de secuencias y comparar las secuencias de la amplificación del gen 16S rRNA respecto a las encontradas en el NCBI (National Center for Biotechnology Information), se determinó que 4 de los 11 aislados en estudio, correspondieron al género Streptomyces (Tabla 3).
En concordancia con los resultados obtenidos, los aislados P3772, P2761, P2758 y P2559 correspondieron al género Streptomyces sp.
Perfil de resistencia a antibióticos de las bacterias E. coli y S. aureus
Los perfiles de resistencia mostraron que E. coli fue resistente a P, CTX, SXT, ATM y CIP; sensible a SAM, CN, IPM, AK y sensibilidad intermedia a AMC. En cuanto a S. aureus mostró resistencia a ATM y sensibilidad a P, CTX, AK. Los demás antibióticos evaluados presentaron resultado indeterminado.
Tabla 3 Identificación por medio del análisis de secuencias de los aislados de bacterias obtenidos
| Aislado | Bacteria identificada | Cobertura (%) | Valor E | % Identidad | Código de acceso de la secuencia reportada en NCBI |
|---|---|---|---|---|---|
| P2566 | Bacillus haynesii | 99 | 0,0 | 91,34 | MK467606.1 |
| P3569 | Bacterium strainBS1487 | 100 | 0,0 | 100 | MK824675.1 |
| P3772* | Streptomyces sp | 99 | 0,0 | 100 | KX950858.1 |
| P2763 | Bacillus amyloliquefaciens | 100 | 0,0 | 99,39 | MN240439.1 |
| P3371 | Bacillus sp | 99 | 0,0 | 91,79 | MK418568.1 |
| P2761* | Streptomyces sp | 100 | 0,0 | 99,8 | KX950887.1 |
| P2758* | Streptomyces sp | 100 | 0,0 | 99,08 | AB841059.1 |
| P1718 | Bacillus sp | 100 | 0,0 | 100 | MH368455.1 |
| P3770 | Bacillus sp | 100 | 0,0 | 99,59 | AB970661.1 |
| P2360 | Bacillus sp | 100 | 0,0 | 89,45 | MK415572.1 |
| P2559* | Streptomyces sp | 78 | 2e-123 | 77,61 | MF769758.1 |
*Aislados correspondientes al género Streptomyces sp.
Pruebas de capacidad inhibitoria de los extractos metabólicos
Los resultados mostraron que el extracto P3772 presentó inhibición sobre E. coli y S. aureus en los dos métodos evaluados, por lo que se precisa como el más eficiente (Tabla 4). La generación de halos por el método de inhibición por sensidiscos fue mayor por verse facilitada la difusión de los compuestos que están en el extracto. Con relación a demás extractos analizados, P2759 no presentó actividad, mientras que los extractos P2559 y P2761 mostraron actividad antibacteriana sólo frente a E. coli. La tabla 4 , muestra el tamaño de los halos de inhibición, resultado de los ensayos realizados.
La ausencia de halos en el control (acetato de etilo) se observó en las dos metodologías aplicadas, comprobando que la actividad antibacteriana proviene de los extractos metabólicos evaluados (Tabla 4).
Tabla 4 Diámetro de los halos (mm) en las pruebas de inhibición
| Aislado | E. coli (a) | S. aureus (a) | E. coli (b) | S. aureus (b) |
|---|---|---|---|---|
| P2758 | 0 | 9 | 0 | 0 |
| P2559 | 0 | 0 | 2,55 | 0 |
| P2761 | 0 | 0 | 8,5 | 0 |
| P3772 | 10,1 | 15,66 | 9,76 | 15,33 |
| Acetato de etilo* | 0 | 0 | 0 | 0 |
*Control Acetato de etilo
(a) Inhibición por pozos; (b) Inhibición por sensidiscos
Concentración Mínima Inhibitoria (CMI)
Los resultados muestran inhibición en el crecimiento de E. coli, es decir, fue sensible al extracto P3772 a partir de concentraciones de 100 hasta 0,78% (Figura 2). Sin embargo, la concentración de 3,12% de extracto metabólico presentó un efecto intermedio de inhibición, reflejado por el crecimiento bacteriano en 3 pozos, aunque se presentara efecto inhibitorio en las concentraciones de 1,56%, 0,78%, 0,39% y 0,19%. Se precisa que para garantizar la actividad inhibitoria se requieren concentraciones del extracto P3772 mayores a 3,12%. En cuanto a S. aureus, se presentó un comportamiento similar al observado para E. coli, es decir, sensibilidad de la bacteria patógena a concentraciones mayores de 3,12%. Estos resultados corroboran el efecto antimicrobiano del extracto P3772 como prometedor en la inhibición.
Perfil cromatográfico del extracto metabólico P3772
La comparación de los perfiles cromatográficos del cloranfenicol (1), utilizado como control, y el extracto metabólico (2), se pueden observar en la Figura 3.
Como se esperaba, el resultado muestra la presencia de varios compuestos en el extracto P3772, lo que se evidencia por la cantidad de picos observados en la muestra, sin embargo, se destaca la presencia de un pico bien definido que es eluido durante tiempo de retención 10,8 min. Se espera a futuro estudiar a profundidad la composición del extracto, de modo que se pueda definir cuál o cuáles son los compuestos relacionados con la actividad antibiótica.
Discusión
La disminución de la eficacia de muchos antibióticos de uso común en la lucha contra las infecciones causadas por bacterias patógenas previamente descrita2, fue el principal incentivo para la realización de este estudio. Esa disminución se comprobó cuando se realizaron los ensayos de inhibición por parte de los antibióticos sobre E. coli y S. aureus aislados a partir de muestras obtenidas en hospitales de la región, con lo que se ratifica el fenómeno de la RAM en la región Nariñense. No obstante, es importante considerar estrategias exploratorias para encontrar nuevas fuentes de antibióticos en nichos sin explotación humana7,8 que puedan contribuir a subsanar esta problemática.
Como lo sugiere este estudio, la reserva del rio Ñambí cuenta con las características agroecológicas y bioquímicas que pueden contribuir con la biodiversidad de microorganismos, ya que es un ecosistema altiplánico, con altas condiciones de humedad, presencia de materia orgánica, y rico en nutrientes10. En este trabajo se logró obtener 11 aislados bacterianos, cuatro de ellos pertenecientes al género Streptomyces, caracterizados por medio de la amplificación del gen 16S RNAr, sin embargo, aunque fue poco el número de aislados, fue similar a lo descrito por otros autores para este tipo de ecosistema22. Algunas de las propiedades del suelo, tales como pH en un rango de valores entre 4,5 y 5,7, favorecen el crecimiento y biodiversidad de actinobacterias22, los valores de pH determinados en las muestras de suelo de este trabajo estuvieron dentro de este mismo rango, asimismo los correspondientes a materia orgánica disponible y la cantidad de nitrógeno, los cuales fueron altos22, por lo que se presume se debió presentar mayor diversidad. Otro factor importante que pudo incidir es que los actinomicetos son bacterias mesófilas con crecimiento entre 25 °C y 30 °C21, y la reserva presenta una fluctuación de temperatura entre 18 °C y 25 °C11, lo que influye considerablemente en la población de bacterias y podría explicar la poca variedad encontrada. Entre tanto, la disponibilidad de P, Mg, K y Cu en suelo es importante para el metabolismo bacteriano, ya que son elementos que actúan como cofactores enzimáticos10 y en este estudio fue baja. A pesar de eso, los niveles de K, Al, Fe, B, N y C, fueron más altos en los puntos de muestreo 1 y 2, de modo que se obtuvo mayor cantidad de aislados, ya que en estos se favoreció el crecimiento bacteriano, específicamente en los puntos de muestreo 1 y 2. Es importante considerar que se requieren más estudios para mejorar la caracterización de esa biodiversidad y así obtener más aislados de actinomicetos. Abarcar un área mayor para la toma de muestras de suelo y realizar muestreo en más puntos aumentará la posibilidad de obtener otros aislados y así obtener más fuentes probables de microorganismos productores de antibacterianos23.
Por otro lado, en este estudio, la finalidad de la búsqueda de actinomicetos, además de ser un primer acercamiento a la biodiversidad de estos en los ecosistemas de la región, fue determinar la potencial actividad antimicrobiana por extractos, productos del metabolismo secundario de los actinomicetos en condiciones de estrés. Diferentes autores han postulado al acetato de etilo como extractor, pues permite la separación de compuestos medianamente polares5,23; sin embargo, lo obtenido es un extracto bruto por lo que se dificulta establecer un precedente sobre su composición, ya que es grande la gama de compuestos que se pueden extraer en su aplicación. Se requiere de más estudios bioquímicos para su caracterización.
En este trabajo, se demostró la eficiencia del efecto antibacteriano de algunos de los extractos obtenidos sobre las cepas de E. coli y S. aureus multidrogo-resistentes, especialmente cuando se trató del obtenido a partir del aislado P3772, cuya actividad se presentó sobre ambas bacterias. Otros autores han descrito este mismo resultado, en sus estudios sobre actinomicetos obtenidos, al igual que en este estudio, en lugares poco explorados5,9,21,22. No obstante, la falta de información sobre la composición propia del extracto no permite puntualizar sobre los efectos que este tiene sobre las bacterias multidrogo-resistentes estudiadas. Pese a esto, la presencia de actividad inhibitoria de extracto de P3772 a tan baja concentración (>3,12%) determinada por la prueba de CMI permite concluir que el efecto inhibitorio sobre las bacterias multidrogo-resistentes analizadas fue contundente, y similar a lo descrito en otras investigaciones relacionadas con actinobacterias5,21,22,24. Este resultado junto a la ausencia de hemolisis testada en agar sangre sugieren que este extracto es una nueva fuente prometedora de antibacterianos, una vez se profundice en estudios bioquímicos sobre su composición.
Conclusiones
La reserva del Río Ñambi presenta las condiciones bioquímicas y agroecológicas necesarias para permitir el desarrollo de actinobacterias capaces de producir compuestos con actividad antibacteriana sobre cepas multidrogo-resistentes de origen hospitalario tales como E. coli y S. aureus.
El extracto metabólico producido por el aislado P3772 identificado molecularmente como Streptomyces sp. presentó la mejor actividad inhibitoria contra las bacterias multidrogo-resistentes E. coli y S. aureus en concentraciones mayores a 3,12% determinado por CMI.