Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Investigaciones Andina
Print version ISSN 0124-8146
Investig. andina vol.9 no.15 Pereira Sept. 2007
LA Leishmania spp. COMO ESTRATEGIA DE DIAGNÓSTICO Y TRATAMIENTO DE LA LeishmaniaSIS, UN ARTÍCULO DE REVISIÓN
Leishmania spp. AS A DIAGNOSTIC STRATEGY AND AS A TREATMENT OF LeishmaniaSIS; AN ARTICLE OF REVISION.
A Leishmania spp. COMO ESTRATÉGIA DE DIAGNÓSTICO E TRATAMIENTO DA LeishmaniaSIS, UM ARTIGO DE REVISÃO
Martha Cecilia Beltrán Cifuentes* cMSc,Patricia Durán Ospina** Msc, Luisa Fernanda Corredor Arias *** cMSc.
* Docente Biociencias Fundación Universitaria del Área Andina
** Docente de Microbiología y Farmacología Ocular. Fundación Universitaria del Área Andina
*** Docente de Biociencias Fundación Universitaria del Área Andina
Resumen
Introducción: Algunas enfermedades emergentes y reemergentes han venido en aumento de manera casi impredecible, en cuanto al sitio de origen. Tal es el caso de la enfermedad de Chagas, malaria, dengue, fiebre amarilla, rabia, Leishmaniasis, debido entre otros a factores de movilidad poblacional, demográficos, sociales y económicos que han llevado a que los microorganismos generen adaptaciones al medio cambiante, dificultando su diagnóstico y tratamiento por métodos convencionales.
Métodos: Se realizó una búsqueda exhaustiva en las bases de datos relacionadas con genómica y proteómica como el NCBI (National Center for Biotechnology Information), auspiciado por la U.S National Library of Medicine y el National Institute of Health, donde se cuenta con acceso a PubMed
Resultados: En la actualidad se han venido aplicando técnicas de marcadores moleculares, PCR (Reacción en Cadena de la Polimerasa) que complementan las pruebas bioquímicas y microbiológicas empleadas comúnmente en el diagnóstico. Conociendo la expresión genómica de estos parásitos, se podrán diseñar métodos nuevos más efectivos contra cepas resistentes a los fármacos disponibles en la actualidad y de prevención temprana.
Conclusiones: En este artículo se presenta una revisión bibliográfica, donde la información clínica del paciente es determinante para el diagnóstico, el cual puede ser confirmado con técnicas moleculares desarrolladas en tiempo real, para aportar al conocimiento molecular de la Leishmania spp, como estrategia de diagnóstico y tratamiento de esta patología.
Palabras clave: Leishmania; diagnóstico; métodos diagnósticos.
Abstract
Introduction: Some emerging and reemerging infirmities have been increasing in an almost unpredictable manner as far as site of origin. Such is the case with such diseases as Chagas, malaria, dengue, yellow fever, rabies, and Leishmaniasis. Various demographic, social, and economic factors, as well as population mobility have allowed microorganisms to generate adaptations to changing environments and thus make diagnosis and treatment by conventional methods more difficult.
Methodology: An exhaustive search was undertaken in the data bases related to genome and protein sequence information found at the NCBI (National Center for Biotechnology Information), part of the United States National Library of Medicine and the National Institutes of Health, all with direct access to PubMed.
Results: Today techniques using molecular markers, PCR (Polymerase Chain Reaction), are being used to complement the biochemical and microbiological tests commonly used in diagnoses. Understanding the genome of parasites allows researchers to design new more effective methods against strains resistant to current drugs and to enable early prevention.
Conclusions: This article presents a bibliographical revision where the clinical information of the patient is a major determinant in a diagnosis which can be confirmed through molecular techniques developed in real time to contribute to molecular knowledge of Leishmania spp. as a diagnostic strategy and treatment of this pathology.
Key words: Leishmania, diagnosis, diagnostic methods
Resumo
Algumas enfermidades emergentes e reemergentes têm aumentado de maneira quase indecifrável, quanto ao lugar de origem. Tais são os casos do Mal de Chagas, malária, dengue, febre amarela, raiva e leishmaniose, devido entre outros, a fatores de mobilidade populacional, demográficos, sociais e econômicos que levam microrganismos a gerarem adaptações ao meio mutante, dificultando seu diagnóstico e tratamento por métodos convencionais.
Métodos Realizou-se uma busca exaustiva nas bases de dados relacionadas com genômica e proteômica, como o NCBI (National Center for Biotechnology Information), auspiciada pela U.S National Library of Medicine e o National Institute of Health, onde se conta com aceso a PubMed.
Resultados Na atualidade aplicam-se técnicas de marcadores moleculares, PCR (Reação em cadeia da polimerasa) que complementam as provas bioquímicas e microbiológicas empregadas comumente no diagnóstico. Conhecendo a expressão genômica destes parasitas, se poderão desenhar métodos novos mais efetivos contra cepas resistentes aos fármacos disponíveis na atualidade e de prevenção rápida.
Conclusões Neste artigo se apresenta uma revisão bibliográfica, onde a informação clínica do paciente é determinante para o diagnóstico, o qual pode ser confirmado com técnicas moleculares desenvolvidas em tempo real, para contribuir ao conhecimento molecular da Leishmania spp, como estratégia de diagnóstico e tratamento desta patologia.
Palavras chave: Leishmania; diagnóstico; métodos diagnósticos.
Fecha de recibo: Junio/07 Fecha aprobación: Julio/07
Introducción
El diagnóstico de la Leishmaniasis se basa en una buena anamnesis y hallazgos clínicos, confirmándose con pruebas microbiológicas que comprenden: aislamiento e identificación del parásito, examen directo, estudio histopatológico de una muestra tomada por biopsia, las cuales sólo reportan el género, pero no arrojan datos sobre las especies ni la multiresistecia a los fármacos. Las pruebas moleculares, como la reacción en cadena de polimerasa (PCR) y la identificación de segmentos específicos de ADN, DNA mitocondrial, tienen gran valor como herramienta para el diagnóstico rápido y eficiente de enfermedades infecciosas de las diferentes cepas de Leishmania spp. proporcionando la selección del tratamiento adecuado. Esta alternativa en la tecnología diagnóstica es definitiva porque se reporta una reaparición de enfermedades como la Enfermedad de Chagas, Malaria, Dengue, Leishmaniasis, Fiebre Amarilla, Rabia, planteando un serio desafío para su control1.
Con relación a la Leishmaniasis, el número de casos reportados en Colombia durante 2005 fue cuatro veces mayor que el reportado en el 2001 y han surgido focos de transmisión en lugares que no reportaban casos en el pasado. Aunque la población más afectada siguen siendo hombres jóvenes que se introducen en el ciclo selvático por exposición ocupacional (militares, agricultores, grupos armados ilegales), la enfermedad también gana importancia en el contexto doméstico, y afecta a un número creciente de mujeres y niños. Se especula que estos patrones cambiantes en la dinámica de transmisión son consecuencia de la alteración de ecosistemas, como resultado del desplazamiento de poblaciones en áreas boscosas2.
En Risaralda, según el Informe Quincenal Epidemiológico Nacional (IQEN) de la Dirección General de Salud Pública del Ministerio de la Protección Social y de la Subdirección de Vigilancia y Control en Salud Pública del Instituto Nacional de Salud, son 37 los casos reportados a Marzo del 2007 por la Secretaría de salud de Risaralda3.
En las manifestaciones clínicas de Leishmaniasis, la forma cutánea adquiere importancia por ser la de mayor prevalencia. Históricamente el control de la Leishmaniasis Cutánea se ha limitado a la detección pasiva de casos y al tratamiento ambulatorio con antimonio pentavalente, a pesar de que es un medicamento costoso y de administración parenteral (intramuscular), por 20 días2.
Aunque la manifestación cutánea de Leishmanisis se reporta en lesiones de piel,4,5,6,7,8 hay otras lesiones severas que presentan compromiso en el área ocular, principalmente como lesiones en párpado, proptosis mecánica, lagoftalmos y blefaroconjuntivitis; para su diagnóstico se debe observar el tamaño de la lesión, la proximidad al borde palpebral, si hay presencia de triquiasis, opacidad corneal, queratitis, entre otros. Se ha reportado incluso conjuntivitis bulbar eritematosa9, 10.
La investigación en esta patología se enfoca en la interacción huésped-parásito y en los diferentes factores (respuesta inmune, virulencia, resistencia a medicamentos) que determinan distintas manifestaciones de la enfermedad y la falla terapéutica. Hay interés particular por la búsqueda de terapias alternativas como sales de antimonio, más seguras y de sencilla administración, en especial para la población infantil que ha demostrado una baja respuesta terapéutica. Adicionalmente, ante el creciente número de pacientes que no responden al tratamiento con antimoniales, se desarrollan estudios para entender la resistencia del parásito a los medicamentos anti-Leishmania como factor contribuyente en las fallas terapéuticas, al igual que la implementación de métodos de diagnóstico rápidos y efectivos, que por los hallazgos clínicos, una buena anamnesis, exploración física, los cultivos directos, los estudios histológicos, hacen el diagnóstico muy lento, mientras que con el conocimiento molecular de la Leishmaniasis, se tendrá una nueva herramienta como estrategia para el diagnóstico y control de la enfermedad más efectivo en menor tiempo11.
Materiales y métodos
Se realizó una búsqueda en las bases de datos relacionadas con genómica y proteómica como el NCBI (National Center for Biotechnology Information), auspiciado por la U.S National Library of Medicine y el National Institute of Health, donde se cuenta con acceso a PubMed, un servicio que incluye citaciones de MEDLINE y otras revistas científicas dedicadas a las ciencias biomédicas. Igualmente, proporciona información taxonómica de secuencias genéticas y proteicas, como estructura, función y comportamiento de cualquier tipo de biomolécula de interés. Trabaja con un nivel mínimo de redundancia y un alto nivel de integración con otras bases de datos relacionadas.
Se consultaron otras bases de datos especializadas como Hinari, Proquest, Science Direct, para acceder a revistas y artículos de investigación que brindan una visión amplia de la historia científica en el estudio de la Leishmaniasis, sus manifestaciones, tratamiento y diagnóstico. Otros sitios de consulta fueron los reportes de la OMS (Organización Mundial de la Salud).
Los criterios de selección de artículos se fundamentaron en los estudios moleculares para el diagnóstico y tratamiento de la Leishmaniasis; se descartaron las revisiones relacionadas con aspectos morfológicos, ciclos reproductivos, manifestaciones clínicas y distribución geográfica.
Resultados de la revisión
Características generales del genoma
La Leishmania posee un genoma con características poco ortodoxas en su organización y expresión, en comparación con la mayoría de los eucariotes13,30. En Leishmania muchos genes se encuentran agrupados en unidades de transcripción policistrónicas y hacen que cada transcrito primario sea un ARNm precursor policistrónico15. Los ARNm individuales son escindidos del precursor por medio de una reacción de trans-empalme, durante la cual una secuencia líder de 39 nucleótidos (miniexón, ME) se une a cada uno de los transcritos en el extremo 5'-, donándoles la estructura cap (residuo 7- metilguanosina) al mismo tiempo que el extremo 3'- de cada mARN es poliadenilado, y generan así los ARNm maduros16,31. Las unidades policistrónicas pueden contener múltiples copias de un gen en tandem, así como también genes relacionados o no relacionados entre sí15.
El genoma de Leishmania muestra una carencia acentuada de los factores conocidos de iniciación de la transcripción y la expresión génica está regulada casi completamente a nivel postranscripcional, a través del empalme de los ARNm y los mecanismos que involucran el procesamiento diferencial de la región no traducida 3' del ARNm (3'UTR). El genoma de Leishmania contiene secuencias de iniciación de la transcripción divergentes de las conocidas en otros eucariotes y éstas han sido explotadas como herramientas en el diseño de vectores de transfección12.
Las especies de Leisnhmania causan un espectro de enfermedades humanas en las regiones tropicales y subtropicales del mundo. En estudios a partir de Leishmania major se han reportado la secuenciación de 36 cromosomas de su genoma haploide que presenta un tamaño de 32.8 megabases y se han predecido 911 genes del RNA, 39 pseudogenes, y 8272 genes codificantes de proteínas, de los cuales al 36% se le atribuye una supuesta función 32.
Genes relacionados con la patogenicidad
La transfección o introducción de ácidos nucleicos al interior del microorganismo, facilita la cuantificación de células de Leishmania y permite realizar ensayos para el desarrollo de la terapia con drogas. El gen bacteriano lacZ (alfa - galactosidasa) permite la detección de parásitos en tejidos de ratón hasta 4 semanas después de la infección por medio de una reacción colorimétrica visualizada bajo el microscopio de luz33. Por otro lado, existe una correlación lineal entre el número de parásitos recombinantes que expresan el gen reportero luc (luciferasa de la luciérnaga Photynus pyralis) y la actividad luciferasa; por ello, la transfección con luc resulta muy útil para vigilar la progresión de infecciones dentro de macrófagos y tejidos hospederos, y la cuantificación rápida y sensible en pruebas de citotoxicidad de drogas por medio de luminometría34,35.
Además, la transfección estable en Leishmania permite estudiar algunos aspectos de la interacción del parásito con el sistema inmune. Los parásitos que expresan ovoalbúmina y alfa - galactosidasa fueron capaces de dirigir estas proteínas reporteras hacia el fagolisosoma, donde se procesaron para el reconocimiento por células CD4+, lo cual sugiere que el estudio de las vías procesadoras del complejo mayor de histocompatibilidad clase II utilizando parásitos de Leishmania modificados, podría ser una aproximación valiosa para estudiar aspectos de la interacción parásito-hospedero36.
Mediante experimentos de eliminación de genes se han identificado genes relacionados con la patogenicidad, importantes en el conocimiento del parásito dentro del insecto vector o del hospedero mamífero, pero no para su crecimiento en los medios rutinarios de cultivo37. Por ejemplo, el gen A2 fue esencial para la supervivencia de L. donovani en el macrófago, así como lo fueron la fosfomanomutasa (PMM) para L. mexicana y la proteína de choque térmico HSP100 para L. major38,39,40.
En la categoría de virulentos entran genes que están involucrados en la virulencia pero no la explican totalmente, cuya eliminación muestra pérdida cuantitativa pero no completa de virulencia y se puede retener la capacidad de producir lesiones aunque a una tasa más lenta que la de los parásitos de tipo silvestre41,42. Por ejemplo, la eliminación del arreglo de genes de cisteína proteinasa (LmCPb) en L. mexicana redujo la supervivencia intracelular en 80%41.
En otro estudio se observó que las lesiones inducidas por parásitos mutantes lmcpbse curan acompañadas de respuesta inmune Th1, a diferencia de las inducidas por parásitos de tipo silvestre, lo cual sugiere que las cisteína proteinasas de L. mexicana suprimen la respuesta inmune antiLeishmania43. Además, cuando L. major fue transfectada con un cósmido que expresa múltiples genes de CPB de L. mexicana, estos parásitos indujeron una respuesta IFNg significativamente inferior comparada con L. major silvestre. Estos datos indican que la inhibición de CPB podría probarse como estrategia inmunorreguladora para formas crónicas de Leishmaniasis
En otros ensayos, la eliminación de GP63, la proteína de superficie más abundante en el promastigote, produjo un efecto pequeño en el fenotipo de L. major in vitro (afectó el depósito del complemento) pero no tuvo efecto en las infecciones al insecto, al macrófago o al rató44.
De igual manera, la eliminación de los genes que codifican para las proteínas SHERP/HASP (proteína hidrofílica en membrana del retículo endoplásmico y mitocondria/proteína de superficie hidrofílica acilada), abundantes en estadio metacíclico infectivo45, y la ausencia de proteínas que intervienen en la síntesis de diferentes glicoconjugados implicados en la virulencia, tuvieron un efecto pequeño en la pérdida de virulencia46-50.
Acción de fármacos sobre proteínas o genes del parásito
Se ha reportado el uso de diferentes medicamentos para tratar la Leishmaniasis según la situación clínica u organismos (Ver Tabla 1)52.
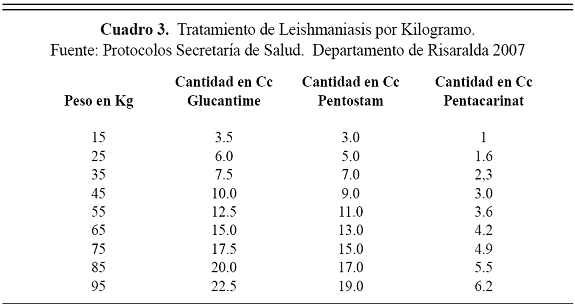
Las diferentes formas clínicas y manifestaciones del parásito, requieren de un tratamiento prolongado para la forma mucosa y visceral (Ver Cuadro 2). Los ajustes de tratamiento por Kilogramo de peso también deben ser tenidos en cuenta para la posología (Ver Cuadro 3). La administración de isotianato de pentamidina requiere de ajustes en la dosificación (Ver Cuadro 4). La Secretaría de Salud del Departamento de Risaralda establece como tratamiento a seguir ante esta parasitosis:5
En Leishmania la acción de los fármacos sobre proteínas o los genes del parásito está asociada a su resistencia a drogas y relacionada con la amplificación génica. Gran parte de los estudios de transfección se han enfocado a aclarar los mecanismos de resistencia a drogas61-74. El locus H, una región de 40 kb en el ADN genómico, se encuentra amplificado en forma de grandes círculos extracromosómicos, luego de la exposición de las células a varias drogas no relacionadas entre sí75. Para identificar los genes que confieren resistencia al arsénico y a los antimoniales, se clonaron fragmentos de la región H de L. major en un vector de expresión y luego se reintrodujeron al parásito en un alto número de copias, confirmando la asociación entre la presencia del gen lmpgp A en los constructos y el nivel de resistencia55,56.
Discusión
Las técnicas moleculares brindan un acercamiento al conocimiento del genoma de la Leishmania, técnicas consideradas como herramienta relevante para el diagnóstico y tratamiento, pues permiten selectividad al escoger el fármaco adecuado para cada especie. Ante los fallidos tratamientos por multiresistencia de las cepas, se dilucida la aparición de nuevas especias producto de mutaciones ante procesos de recombinación genética, fruto de la movilidad de las poblaciones. El uso de herramientas y técnicas moleculares, al igual que el análisis de restricción e hibridación molecular con sondas específicas, permite conocer la distribución geográfica de las especies de Leishmania que originan la Leishmaniasis en las diferentes zonas del país. La inmunofarmacología está tomando fuerza para el tratamiento bacteriano; en parasitología se empieza a abordar en la última década, gracias a estos hallazgos de la biología molecular.
Los reportes referentes a pruebas bioquímicas y microbiológicas para la detección de Leishmania resultan numerosos, comparativamente con las pruebas basadas en técnicas moleculares; sin embargo, de manera complementaria éstas podrían ser de primera elección en los Institutos de Salud, donde se requiere capacitación de personal idóneo para la ejecución e interpretación de estas técnicas moleculares, y la asignación de un presupuesto por parte de entidades gubernamentales.
Agradecimientos
Al Doctor Gustavo Adolfo Vallejo PhD. en Parasitología. Universidade Federal De Minas Gerais, UFMG, Brasil. Docente – Investigador Universidad del Tolima, por la revisión y asesoría sobre el tema. Publica v.6 n.3 Washington Sept. 1999
Referencias
1. Weissenbacher M., Salvatella R. Hortal M. El desafío de las enfermedades emergentes y reemergentes. Publicación Innovación, confiabilidad y gestión gremial. 2006. Uruguay [ Links ]
2. Centro Internacional de Entrenamiento e investigaciones médicas CIDEM. 2007. Cali-Colombia [ Links ]
3. Ministerio de la Protección Social. Instituto Nacional de Salud. Volumen 12, número 7- Abril 2007.Bogotá, DC. [ Links ]
4. World Health Organization. WHO Report on Global Surveillance of Epidemicprone Infectious Diseases. 2000. WHO/CDS/CSR/ISR. [ Links ]
5. Abrishami M, Soheilian Mm Farahi A. Dowlatiy successful tratment of ocular Leishmaniasis Eur J dermatol 2002; 12: 88-9 [ Links ]
6. Aouchiche, Hartani D. ophtalmic involvement in cutaneous Leishmaniasis med trop (mars) 1981 Sep-Oct; 41(5): 519-22. [ Links ]
7. García Almagro D. Leishmaniasis cutánea. En: España Alonso A, editor. Fisiopatología de las enfermedades cutáneas IV. 2004. [ Links ]
8. Madrid: Aula Médica; Quesada Cortés A, Campos Muñoz L, Rubio Flores C, Martín Díaz MA. [ Links ]
9. Nondy A, Addy M, Chowdhury AB. Leishmaniasis blepharo – conjunctivitis. Trop Ceogr med 1991;43: 303-6. [ Links ]
10. Neil DP, Deulsch J, comichael AJ, Taylor R. Eyelid Leishmaniasis in a patient with neurogenic petosis. Br J ophtalmol 1991; 75: 506-7. [ Links ]
10. Neil DP, Deulsch J, comichael AJ, Taylor R. Eyelid Leishmaniasis in a patient with neurogenic petosis. Br J ophtalmol 1991; 75: 506-7. [ Links ]
11. Cortázar TM. & Walker J. 2004. Manipulación genética y el estudio del parásito Leishmania. Biomédica. 24(4): 438 - 455 (Biomédica 2004_24_4_438-455 Tania Cortázar) [ Links ]
12. Gay L, Wilson M, Donelson J. The promoter for the ribosomal RNA genes of Leishmania chagasi. Mol Biochem Parasitol 1996;77:193-200. [ Links ]
13. Curotto de Lafaille M, Laban A, Wirth D. Gene expression in Leishmania: analysis of essential 5' DNA sequences. Proc Natl Acad Sci USA 1992;89:2703-7. [ Links ]
14. Kumar PV, Roozitalab MH, Lak P, Sadeghi E. Occular Leishmaniasis, a cause of blindness. Irn J Med Sci 1993; 18: 106-11. [ Links ]
15. Graham SV. Mechanisms of stage-regulated gene expression in Kinetoplastida. Parasitol Today 1995;11: 217-23. [ Links ]
16. Papadopoulou B, Huang XF, Boucher N, McNicoll F. Stage-specific regulation of gene expression in Leishmania. ASM News 2003;69:282-8. [ Links ]
17. Brittingham A, Miller M, Donelson J, Wilson M. Regulation of GP63 mRNA stability in promastigotes of virulent and attenuated Leishmania chagasi. Mol Biochem Parasitol 2001;112:51-9. [ Links ]
18. Burchmore RJ, Landfear S. Differential regulation of multiple glucose transporter genes in Leishmania mexicana. J Biol Chem 1998;273:29118-26. [ Links ]
19. Flinn H, Smith D. Genomic organization and expression of a differentially-regulated gene family from Leishmania major. Nucleic Acids Res 1992;20:755-62. [ Links ]
20. Argaman M, Aly R, Shapira M. Expresion of heat shock protein 83 in Leishmania is regulated posttranscriptionally . Mol Biochem Parasitol 1994;64:95-110. [ Links ]
21. Charest H, Zhang W, Matlashewski G. The developmental expression of Leishmania donovani A2 amastigote-specific genes is post-transcriptionally mediated and involves elements located in the 3' untranslated region. J Biol Chem 1996;271:17081-90. [ Links ]
22. Kelly BL, Nelson T, McMaster R. Stage-specific expression in Leishmania conferred by 3' untraslated regions of L. major leishmanolysin genes (GP63). Mol Biochem Parasitol 2001;116:101-4. [ Links ]
23. Brooks DR, Denise H, Westrop G, Coombs G, Mottram J. The stage-regulated expresion of Leishmania mexicana CPB cysteine proteases is mediated by an intercistronic sequence element. J Biol Chem 2001;276:47061-9. [ Links ]
24. Soto M, Requena J, Jimenez-Ruiz A, Alonso C. The mRNA coding for the nucleosomal protein H2A of Leishmania is polyadenylated and has stem-loops at the 3'- end. Nucleic Acids Res 1991;19:4554. [ Links ]
25. Boucher N, Wu Y, Dumas C, Dube M, Sereno D, Breton M et al. A common mechanism of stateregulated gene expression in Leishmania mediated by a conserved 3'-untranslated region element. J Biol Chem 2002;277:19511-20. [ Links ]
26. Wu Y, El-Fakhry Y, Sereno D, Tamar S, Papadopoulou B. A new developmentally regulated gene family in Leishmania amastigotes encoding a homolog of amastin surface proteins. Mol Biochem Parasitol 2000;110:345-57. [ Links ]
27. Mishra K, Holzer T, Moore L, LeBowitz J. A negative regulatory element controls mRNA abundance of the Leishmania mexicana paraflagellar rod gene PFR2. Eukaryot Cell 2003;2:1009-17. [ Links ]
28. Myung K, Beetham J, Wilson M, Donelson J. Comparison of the post-transcriptional regulation of the mRNAs for the surface proteins PSA (GP46) and MSP (GP63) of Leishmania chagasi. J Biol Chem 2002;277: 16489-97. [ Links ]
29. Gutiérrez JA, Puentes F, Moreno A, Patarroyo ME, Murillo L. Identification of a differentially expressed mRNA in axenic Leishmania panamensis amastigotes . Mem Inst Oswaldo Cruz 2001;96:835-8. [ Links ]
30. Mundodi V, Somanna A, Farrell P, Gedamu L. Genomic organization and functional expression of differentially regulated cysteine protease genes of Leishmania donovani complex. Gene 2002;282:257-65. [ Links ]
31. Sturm N, Campbell D. The role of intron structures in trans-splicing and cap 4 formation for the Leishmania spliced leader RNA. J Biol Chem 1999;274:19361- 7. [ Links ]
32. Alasdair C. Ivens,1* Christopher S. Peacock,1 Elizabeth A. Worthey,2The Genome of the Kinetoplastid Parasite, Leishmania major . Vol. 309. no. 5733, pp. 436 - 442 DOI: 10.1126/science.1112680 [ Links ]
33. Okuno T, Goto Y, Matsumoto Y, Otsuka H, Matsumoto Y. Applications of recombinant Leishmania amazonensis expressing egfp or beta-galactosidase gene for drug screening and histopathological analysis. Exp Anim 2003;52:109-18. [ Links ]
34. Sereno D, Roy G, Lemesre J, Papadopoulou B, Ouellette M. DNA transformation of Leishmania infantum axenic amastigotes and their use in drug screening. Antimicrob Agents Chemother 2001;45: 1168-73. [ Links ]
35. Roy G, Dumas C, Sereno D, Wu Y, Singh A, Tremblay MJ et al. Episomal and stable expression of the luciferase reporter gene for quantifying Leishmania spp. infections in macrophages and in animal [ Links ]
36. Kelly JM. Trypanosomatid shuttle vectors: new tools for the functional dissection of parasite genomes. Parasitology Today 1995;11:447-51. [ Links ]
37. Chang KP, McGwire B. Molecular determinants and regulation of Leishmania virulence . Kinetoplastid Biology and Disease 2002;1:1-7. [ Links ]
38. Garami A, Mehlert A, Ilg T. Glycosylation defects and virulence phenotypes of Leishmania mexicana phosphomannomutase and dolicholphosphatemannose synthase gene deletion mutants. Mol Cell Biol 2001;21:8168-83.1989;86:9119-23. [ Links ]
39. Zhang W, Matlashewski G. Loss of virulence in Leishmania donovani deficient in an amastigote-specific protein, A2. Proc Natl Acad Sci USA 1997;94:8807-11. [ Links ]
40. Hubel A, Krobitsch S, Horauf A, Clos J. Leishmania major Hsp100 is required chiefly in the mammalian stage of the parasite. Mol Cell Biol 1997;17:5987-95. [ Links ]
41. Mottram J, Souza A, Hutchison E, Carter R, Frame M, Coombs G. Evidence from disruption of the lmcpb gene array of Leishmania mexicana that cysteine proteinases are virulence factors . Proc Natl Acad Sci USA 1996;93:6008-13. [ Links ]
42. Alexander J, Coombs G, Mottram J. Leishmania mexicana cysteine proteinasedeficient mutants have attenuated virulence for mice and potentiate a Th1 response. J Immunol 1998;161:6794-801. [ Links ]
43. Buxbaum L, Denise H, Coombs G, Alexander J, Mottram J, Scott P. Cystein protease B of Leishmania mexicana inhibits host Th1 responses and protective immunity. J Immunol 2003;171:3711-7 [ Links ]
44. Joshi P, Kelly B, Kamhawi S, Sacks D, MacMaster W. Targeted gene deletion in Leishmania major identifies leishmanolysin (GP63) as a virulence factor. Mol Bichem Parasitol 2002;120:33-40. [ Links ]
45. McKean P, Denny P, Knuepfer E, Keen J Smith D. Phenotypic changes associated with deletion and overexpression of a stage-regulated gene family in Leishmania. Cell Microbiol 2001;3:511-23. [ Links ]
46. Ilg T. Lipophosphoglycan is not required for infection of macrophages or mice by Leishmania mexicana. EMBO J 2000;19:1953-62. [ Links ]
47. Turco S, Späth G, Beverley S. Is lipophpsphoglycan a virulence factor? A surprising diversity between Leishmania species. Trends Parasitol 2001;17:223-6. [ Links ]
48. Hilley JD, Zawadzki JL, McConville MJ, Coombs GH, Mottram JC. Leishmania mexicana mutants lacking glycosyl phosphatidyl inositol(GPI): protein transamidase provide insights into the biosynthesis and functions of GPI-anchored proteins. Mol Biol Cell 2000; 11:1183-95. [ Links ]
49. Garami A, Mehlert A, Ilg T. Glycosylation defects and virulence phenotypes of Leishmania mexicana phosphomannomutase and dolicholphosphatemannose synthase gene deletion mutants. Mol Cell Biol 2001;21:8168-83. [ Links ]
50. Wilson K, Collart FR, Huberman E, Stringer JR, Ullman B. Amplification and molecular cloning of the IMP dehydrogenase gene of Leishmania donovani. J Biol Chem 1991;266:1665-71. [ Links ]
51. Borda, C. Edgardo - Rea, María J. F. - Rosa, Juan R. Diagnóstico y tratamiento de la Leishmaniasis Tegumentar Americana en el Nordeste Argentino. Centro Nacional de Parasitología y Enfermedades Tropicales (CENPETROP) - Facultad de Medicina - UNNE.Santa Fe 1432 - (3400) Corrientes - Argentina. [ Links ]
52. Isaza Diana M., Restrepo Berta. La Leishmaniasis: conocimientos y prácticas en poblaciones de la costa del Pacífico de Colombia. Rev Panam Salud [ Links ]
53. Secretaria de Salud de Risaralda. Protocolos de tratamientos 2006 [ Links ]
54. Kündig C, Leblanc E, Papadopoulou B, Ouellette M. Role of the locus and the resistance gene on gene amplification frecuency in methotrexate resistant Leishmania tarentolae. Nucleic Acids Res 1999; 27:3653-9. [ Links ]
55. Ouellette M, Haimeur A, Grondin K, Légaré D, Papadopoulou B. Amplification of ABC transporter gene pgpA and of other heavy metal resistance genes in Leishmania tarentolae and their study by gene transfection and gene disruption. Meth Enzymol 1998; 292:182-92. [ Links ]
56. Anacleto C, Abdo MC, Ferreira AV, Murta S, Romanha A, Fernández A et al. Structural and functional analysis of an amplification containing a PGPA gene in a glucantime-resistant Leishmania (Viannia) guyanensis cell line. Parasitol Res 2003;90:110-8. [ Links ]
57. Coelho AC, Beverley S, Cotrim P. Functional genetic identification of PRP1, an ABC transporter superfamily member conferring pentamidine resistance in Leishmania major. Mol Biochem Parasitol 2003;130:83-90. [ Links ]
58. Callahan HL, Beverley SM. Heavy metal resistance: a new role for P-glycoproteins in Leishmania. J Biol Chem 1991;266:18427-30. [ Links ]
59. Papadopoulou B, Roy G, Ouellette M. A novel antifolate resistance gene on the amplified H circle of Leishmania. EMBO J 1992;11:3601-8. [ Links ]
60. Ouellette M, Borst P. Drug resistance and Pglycoprotein gene amplification in the protozoan parasite Leishmania. Res Microbiol 1991;142:737-46. [ Links ]
61. Arrebola R, Olmo A, Reche P, Garvey EP, Santi DV, Ruiz-Perez LM. Isolation and characterization of a mutant dihydrofolate reductase-thymidylate synthase from methotrexate-resistant Leishmania cells. J Biol Chem 1994;269:10590-6. [ Links ]
62. Cotrim PC, Garrity LK, Beverley SM. Isolation of genes mediating resistance to inhibitors of nucleoside and ergosterol metabolism in Leishmania by overexpression/ selection. J Biol Chem 1999;274:37723-30. [ Links ]
63. Liu X, Chang KP. The 63-kilobase circular amplicon of tunicamycin-resistant Leishmania amazonensis contains a functional N-acetylglucosamine-1-phosphate transferase gene that can be used as a dominant selectable marker in transfection. Mol Cell Biol 1992;12: 4112-22. [ Links ]
64. Henderson DM, Sifri CD, Rodgers M, Wirth DF, Hendrickson N, Ullman B. Multidrug resistance in Leishmania donovani is conferred by amplification of a gene homologous to the mammalian mdr1 gene. Mol Cell Biol 1992;12:2855-65. [ Links ]
65. Romero IC, Saravia NG, Walker J. Selective action of fluoroquinolones against intracellular mastigotes of Leishmania (Viannia) panamensis in vitro. Antimicrob Agents Chemother 2004 (enviado para publicación). [ Links ]
66. Segovia M. Leishmania gene amplification: a mechanism of drug resistance. Ann Trop Med Parasitol 1994;88:123-30. [ Links ]
67. Beverley SM. Gene amplification in Leishmania. Annu Rev Microbiol 1991;45:417- 44. [ Links ]
68. McKean P, Denny P, Knuepfer E, Keen J Smith D. Phenotypic changes associated with deletion and overexpression of a stage-regulated gene family in Leishmania. Cell Microbiol 2001;3:511-23. [ Links ]
69. Bello AR, Nare B, Freedman D, Hardy L. PTR1: a reductase mediating salvage of oxidized pteridines and methotrexate resistance in the protozoan parasite Leishmania major. Proc Natl Acad Sci USA 1994;91: 11442-6. [ Links ]
70. Légaré D, Papadapoulou B, Roy G, Mukhopadhyay R. Haimeur A, Dey S et al. Efflux systems and increased trypanothione levels in arsenite resistant Leishmania. Exp Parasitol 1997;87:275-82. [ Links ]
71. Ouellette M. Biochemical and molecular mechanisms of drug resistance in parasites. Trop Med Intern Health 2001;6:874-88. [ Links ]
72. Papadopoulou B, Roy G, Ouellette M. Frequent amplification of a short chain dehydrogenase gene as part of circular and linear amplicons in methotrexate resistant Leishmania. Nucleic Acids Res 1993; 21:4305-12. [ Links ]
73. Vasudevan G, Ullman B, Landfear S. Point mutations in a nucleoside transporter gene from Leishmania donovani confer drug resistance and alter substrate selectivity. Proc Natl Acad Sci USA 2001;98:6092-97. [ Links ]
74. Kink JA, Chang KP. Tunicamycin-resistant variants from five species of Leishmania mexicana amazonensis: expression of virulence associated with an increased activity of N-acetyl glucosaminyl transferase and amplification of its presumptive gene. Proc Natl Acad Sci USA 1987;84:1253-7. [ Links ]
75. Vasudevan G, Ullman B, Landfear S. Point mutations in a nucleoside transporter gene from Leishmania donovani confer drug resistance and alter substrate selectivity. Proc Natl Acad Sci USA 2001;98:6092-97. [ Links ]