Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Investigaciones Andina
Print version ISSN 0124-8146
Investig. andina vol.10 no.16 Pereira Apr. 2008
LA BIOLOGÍA MOLECULAR DE LEISHMANIA SPP. COMO PUNTO DE PARTIDA PARA NUEVAS ALTERNATIVAS DE TRATAMIENTO
AMOLECULAR BIOLOGY LEISHMANIA SPP NEW DRUGS RESISTANCE
A BIOLOGIA MOLECULAR DE LEISHMANIA SPP. COMO PONTO DE PARTIDA PARA NOVAS ALTERNATIVAS DE TRATAMENTO
Martha Cecilia Beltrán Cifuentes* cMSc, Patricia Durán Ospina** Msc, Luisa Fernanda Corredor Arias *** cMSc.
* Docente Biociencias Fundación Universitaria del Área Andina
** Docente de Microbiología y Farmacología ocular. Fundación Universitaria del Área Andina
*** Docente de Biociencias y Microbiología. Fundación Universitaria del Área Andina
Resumen
Introducción: en Colombia existen grupos de investigación en Leishmaniasis que han aunado esfuerzos para lograr la identificación del genoma de la Leishmania spp. Como profesionales de la salud es una prioridad conocerlos para entender los mecanismos de resistencia a fármacos.
Métodos: las bases de datos empleadas para esta búsqueda fueron entre otras: NCBI PubMed, MEDLINE, Science Direct, Nucleic Acids Research y Molecular and Biochemical Parasitology, publicaciones de la revista Biomédica y de varias Universidades.
Resultados: existen muchas especies de vectores distribuidos en todo el país. Las multiresistencias creadas por Leishmania sp. se basan especialmente en proteínas de membrana y mutaciones puntuales en el DNA del parásito y sus vectores.
Conclusiones: las técnicas de PCR deberían ser implementadas en la clínica para estudiar resistencias a fármacos. Los protocolos actuales contra Leishmaniasis no incluyen nuevas alternativas. Los tratamientos inmunomoduladores son una nueva esperanza para el tratamiento de esta enfermedad re-emergente.
Palabras clave: Leishmania spp, resistencia a fármacos, biología molecular.
Abstract
Introduction: In Colombia there are research groups in Leishmaniasis that have joined forces to achieve the identification of the genome of Leishmania spp. As health professionals know this is a priority to understand the mechanisms of drug resistance.
Methods: The databases used for this search were among others: NCBI PubMed MEDLINE, Science Direct, Nucleic Acids Research and Biochemical and Molecular Parasitology, as a publication of the journal Biomedical and several universities.
Results: There are many species and vectors distributed throughout the country. The multiresistents created by Leishmania spp. rely especially in membrane proteins and mutations in the DNA of the parasite and their delivery systems.
Conclusions: The PCR techniques should be implemented at the clinic to study resistance to drugs. The current protocols against Leishmaniasis not include additional alternatives. The treatments with immunomodulators are the new hope for treating this re-emerging disease.
Key words: Leishmania spp., drug resistance, molecular biology
Resumo
Introdução: Na Colômbia existem grupos de pesquisas em Leishmaniasis que têm somado esforços para a identificação do genoma da Leishmania spp. Como profs-sionais da saúde, é uma prioridade conecé-los para entender os mecanismos de resistência a fármacos.
Métodos: As bases de dados empregadas para esta busca foram, entre outras: NCBI PubMed, MEDLINE, Science Direct, Nucleic Acids Research e Molecular and Biochemical Parasitology, publicações da revista Biomédica e de varias Universidades.
Resultados: existem muitas espécies de vetores distribuídos em todo o país. As multi-resistências criadas por Leishmania sp. baseiam-se especialmente em proteínas de membrana e mutações pontuais no DNA do parasita e seus vetores.
Conclusões: As técnicas de PCR deveriam ser implementadas na clínica para estudar resistências a fármacos. Os protocolos atuais contra Leishmaniasis não incluem novas alternativas. Os tratamentos imuno-moduladores são uma nova es-perança para o tratamento desta enfermidade re-emergente.
Palavras chave: Leishmania spp, resistência a fármacos, biologia molecular.
Fecha de recibo: Noviembre/07 Fecha aprobación: Enero/08
Introducción
El término Genómica hace referencia a la parte de la Genética que trata del conocimiento total de la secuencia de bases nitrogenadas (adenina, timina, guanina, citosina) de su ADN. La investigación genómica acorta el camino hacia la investigación médica en la prevención, diagnóstico y tratamiento de las enfermedades transmisibles, teniendo un gran impacto en los estudios epidemiológicos como base para el diseño de nuevos mecanismos de atención de la salud en las entidades responsables en cada país. La disponibilidad de secuencias del genoma de agentes infecciosos para el ser humano, ha permitido que enfermedades como la leishmaniasis puedan ser estudiadas a fondo para contribuir con la Salud Pública1.
La investigación genómica se basa en la secuenciación del ADN, el análisis de la expresión de los genes, utilizando la bioinformática para el manejo e interpretación de los resultados. La genómica se complementa con la proteómica (estudio de proteínas) y la metagenómica (estudio de los metabolitos); el estudio de la interrelación entre genes, proteínas y metabolitos revelarán las categorías funcionales y estructurales de cualquier sistema viviente. El conocimiento de patrones particulares de expresión de genes en patógenos y su detección es útil para la identificación de moléculas blanco susceptibles para el desarrollo de nuevos antiparasitarios2.
Materiales y métodos
Las bases de datos empleadas para esta búsqueda fueron: NCBI (National Center for Biotechnology Information), auspiciado por la U.S National Library of Medicine y el National Institute of Health, PubMed, MEDLINE, al igual que comunicación verbal con algunos de los grupos que realizan diagnóstico molecular en los departamento del Tolima y Risaralda (Colombia).
También se consultaron otras bases de datos especializadas como Hinari, Proquest, Science Direct, reportes de la OMS (Organización Mundial de la Salud) y algunas revistas indexadas como el Journal of Biological Chemistry, Nucleic Acids Research, Molecular and Biochemical Parasitology, entre otras.
Los criterios de selección de artículos se fundamentaron en los estudios de Lesihmania sp. para el diagnóstico molecular de la Leishmaniasis, por lo cual se descartaron las revisiones relacionadas con aspectos morfológicos, ciclos reproductivos, manifestaciones clínicas y tratamientos, empleando los criterios de búsqueda con operadores booleanos con términos exactos: Leishmania OR genoma, Multiresistent AND leishmania, genomic AND Leishmania y Leishmania NOT case report. De los 63 artículos revisados, se descartaron 21, correspondientes a reportes de casos clínicos de años anteriores a 1989 y los artículos donde no se reportaban en la metodología las técnicas moleculares para diagnóstico y búsqueda de multiresistencias.
Tratamiento farmacológico actual contra la leishmaniasis.
Los protocolos de tratamiento autorizados por las Secretarías de Salud de Colombia, incluyen en la actualidad como fármacos de primera elección las sales de antimonio pentavalentes (antimoniato de N-metilglucamina), el estibogluconato de sodio, la Pentamidina y Meglumina entre otros (ver cuadro). Algunos de estos fármacos actúan inhibiendo los procesos bioenergéticos del parásito (glucólisis y oxidación de ácidos grasos), disminuyendo así el ATP y el ADP necesarios para el metabolismo, crecimiento y proliferación de los mismos. Otros como la pentamidina, aunque no se conoce con exactitud el mecanismo de acción, actúan sobre el DNA; sin embargo, muchos pacientes que no responden al tratamiento con antimoniales se han reportado en las últimas décadas3,4,5. Trabajos publicados por los grupos de investigación en Leishmania de mayor trayectoria en el país, indican que en Colombia existen más de 130 especies del vector de la Leishmania spp. (Lutzomia) y alrededor de 33 especies de Leishmania como: L gomezi, L panamiensis, L. Brasiliensis, L chagasi, L mexicana,L. Quasitownsendi, L youngi, L. Colombiana, L. Torvida, están siendo estudiados molecularmente y de algunos se ha logrado identificar plenamente su genoma6,7,8.
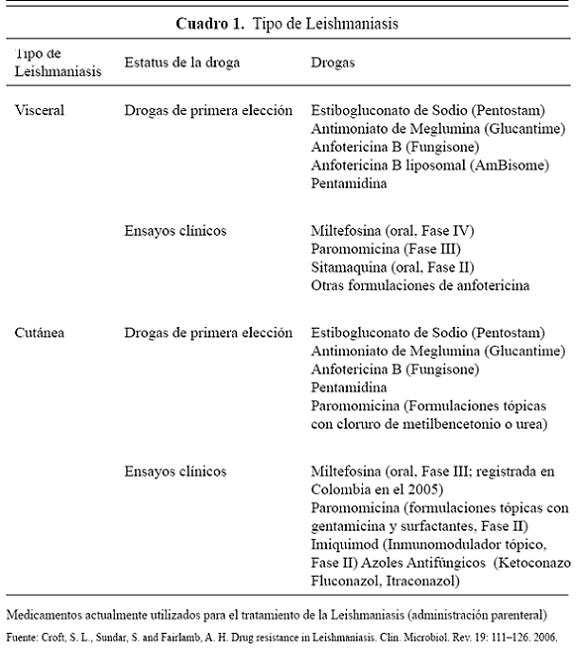
Debido a las multiresistencias a los fármacos y a los efectos adversos de los antimoniales como dolor abdominal, náuseas, vómitos, cefalea, debilidad, mialgias, artralgias y exantemas10, nuevos fármacos se están empleando para la Leishmaniasis visceral, como la miltefosina (hexadecilfosfocolina), un análogo de los fosfolípidos de la membrana celular del parásito frente al cual la leishmania spp. ha creado resistencia. Se cree que dicha resistencia puede producirse por la mutación de un posible transportador (LdMT) de fosfolípidos, en la membrana plasmática de las Leishmanias11. Algunas alternativas de tratamiento farmacológico corresponden a la sitamaquina y la paramomicina9.
Estudios moleculares de los genes de la Leishmania spp. como nuevos blancos de terapéutica, estudiando el genoma de la Leishmania spp, han permitido aclarar los mecanismos de resistencia a diferentes drogas12,13,14. Uno de los avances más representativos ha sido la ubicación de una región de 40 kb en el ADN genómico. En esta región ha sido posible identificar los genes que conferen resistencia al arsénico y a los antimoniales15,16.
Se ha podido observar que la resistencia a los antimoniales y a los arsenicales en Leishmania spp. es multifactorial, debido a sistemas como la proteína, PgpA, un transportador localizado en la membrana de las vesículas intracelulares, que confere resistencia por secuestro de grupos moleculares conjugados como el metaltripanotión y un sistema diferente a la PgpA que permite la salida de metales conjugados con tripanotión y las enzimas implicadas en su síntesis (ã-glutamilcisteína sintetasa y ornitina decarboxilasa)17,18.
Algunos fenotipos de parásitos que han presentado resistencia a los metales se presentan por mutaciones puntuales del genoma, que conllevan a una pérdida o ganancia de función metabólica. La pteridín reductasa (PTR1), responsable de la resistencia al metotrexato (MTX) en Leishmania spp., incrementa el nivel de folatos reducidos a través de una vía alterna, la cual compensa la inhibición de una enzima conocida como Sintetasa dihidrofolato timidilato-reductasa (DHFR-TS). La actividad PTR1 es esencial para la supervivencia de los parásitos in vitro en medios de cultivo definidos, pero no in vivo, debido que el parásito puede obtener pteridinas reducidas las cuales son sintetizadas de novo por el hospedero mamífero (18 ). Muchas de las enzimas del parásito son potencialmente susceptibles a inhibidores previamente desarrollados en otros sistemas, lo cual puede ser favorable para su identificación como blancos a través de la selección por drogas1.
Los estudios conducen a la identificación de genes esenciales cuya pérdida no es tolerable por el organismo y por ello, son blancos potenciales para el desarrollo de agentes anti- Leishmania19-40. Por ejemplo, la eliminación de N-miristoiltransferasa (NMT) en L. major produjo parásitos no viables. La eliminación de genes que codifican proteínas que se expresan constitutivamente en todos los estadios del parásito podrían ser blanco apropiado para el desarrollo de agentes anti-Leishmania. La eliminación de genes esenciales puede producir organismos auxótrofos (organismo que ha mutado o ha perdido la habilidad de sintetizar sustancias requeridas para su crecimiento y metabolismo) que requieran factores específicos de crecimiento, por ejemplo la eliminación de los genes de enzimas clave en la síntesis de poliaminas, como la espermidina sintasa (SPDSYN) y la ornitina decarboxilasa (ODC), que producen promastigotes auxótrofos para poliaminas, los cuales deben importar espermidina exógena para sobrevivir. Además el nivel de tripanotión, tiol único en tripanosomátidos que contiene espermidina componente principal de la defensa antioxidante, también se reduce. Así, estas enzimas esenciales son blancos prometedores para la validación terapéutica28, 37.
También se requiere conocer la estructura genómica del parásito para diseñar nuevos tratamientos empleando inmunosupresores e inmunomoduladores, como por ejemplo: la extracción de una proteína de las glándulas salivales de los vectores (Lutzomya y Phlebotumus), a la cual han denominado maxadilan o MAX 40 y aplicada en modelos animales funciona como una vacuna en el huésped. En España, científicos del CSIC (Consejo superior de investigaciones científicas) han realizado estudios con histatina, proteína aislada de la saliva humana, que se acumula en la mitocondria de la Leishmania41.
La técnica de reacción en cadena de la polimerasa para la detección de la resistencia a fármacos en Leishmania spp.
Existen varios métodos moleculares para la identificación de genes involucrados en la resistencia a fármacos; sin embargo, dichas técnicas aún no han sido utilizadas para realizar el tamizaje de estos genes en Leishmania spp. con el fin de implementar un tratamiento farmacológico apropiado. La técnica molecular más difundida en la clínica es la reacción en cadena de la polimerasa (PCR) consistente en la amplificación de secuencias genéticas específicas para obtener un gran número de copias de un fragmento de ADN particular del parásito. Esta técnica se destaca por su sensibilidad y especificidad, se ha empleado para diagnosticar la Leishmaniasis, pero aún no se ha reportado una PCR aplicada a la detección de los genes de resistencia a los diferentes fármacos, por lo cual el tratamiento para la Leishmaniasis se basa en la información recopilada solo para algunas cepas. La técnica de PCR tiene variaciones importantes como la PCR múltiple, en la cual se realiza la amplificación simultánea de varias secuencias genéticas en una única reacción: la PCR múltiple podría encontrar los diferentes genes implicados en la resistencia a fármacos en menor tiempo, de manera más eficiente y económica para obtener un resultado más confable.
Nuevas alternativas de investigación molecular en parasitología
Los estudios genómicos están generando importantes avances en ensayos de diagnóstico, desarrollo de fármacos y vacunas para el tratamiento y control de enfermedades parasitarias como la Leishmaniasis. En los últimos años los estudios de comunidades de organismos infecciosos han arrojado una importante información sobre su biodiversidad, a partir del análisis genómico de microorganismos sin cultivar (metagenómica), y del análisis proteómico de comunidades (metaproteçomica)2. Recientemente se introduce el concepto de farmacogenómicacomo el estudio del total de genes farmacológicamente relevantes, así como de la forma en que dichos genes manifestan sus variaciones y de qué manera estas variaciones pueden interaccionar para configurar el fenotipo de cada individuo, en lo que afecta a su respuesta a los medicamentos43. La bioinformática en este sentido, ofrece la capacidad de comparar y relacionar la información genética con una finalidad deductiva, capaz de ofrecer unas respuestas que no parecen obvias a la vista de los resultados de los experimentos. Todas estas tecnologías vienen justificadas por la necesidad de tratar información masiva, no individual, sino desde enfoques celulares integrados (genómica funcional, proteómica, expresión multigénica)1.
Discusión
Conociendo el genoma tanto del parásito como del vector, se puede avanzar en la aplicación de nuevos tratamientos, comprender las estrategias de control en distintas situaciones, observar la dinámica de las poblaciones tanto de los huéspedes como de los vectores, y divulgando los avances en estos campos; se puede como profesionales de la salud contribuir con los grupos bandera en estos estudios genómicos en el país, para aunar esfuerzos y controlar esta enfermedad re-emergente, que como se explicaba en la primera entrega de esta revisión, está aquejando a más población cada día. Así mismo fomentar la creación de grupos de excelencia para proseguir con estudios de costo-efectividad de las diferentes formas de implementación de medidas de promoción y prevención, educando en salud ambiental a la comunidad y continuar con la búsqueda de alternativas farmacológicas para bloquear las posibilidades al parásito de búsqueda de nuevos huéspedes.
REFERENCIAS BIBLIOGRÁFICAS
1. Mojica, T. y Sánchez, O. La proteomica, otra cara de la genómica. Nova Publicación Científica. 1: 1-116. 2003. [ Links ]
2. Mollerach, M. Genómica y proteomica, oportunidades y desafíos para la microbiología. Revista Argentina Microbiología. 38: 1-3. 2006. [ Links ]
3. Cortés-Selva, F., Campillo, M., Jiménez, I. A., Castanys, S., Bazzocchi, I. L., Pardo, L., et al. SAR Studies of Sesquiterpenes from Maytenus cuzcoina (Celastraceae) as Inhibitors of the Multidrug-Resistant Phenotype in a Leishmania tropica Line Overexpressing a P-Glycoprotein-Like Transporter. J Medicinal Chem. 2004. 47: 576-587. 2004. [ Links ]
4. Pérez-Victoria J. M., A. Di Pietro, Barron, D., A. G., Castanys, S. and Gamarro, F. Multidrug resistance phenotype mediated by the P-glycoprotein-like transporter in Leishmania: a search for reversal agents. Current Drug Targets. 3: 311-333. 2002. [ Links ]
5. Seifert, K., Matu, S., Pérez-Victoria F. J., Castanys, S., Gamarro, F. and Croft, S. Characterisation of Leishmania donovani promastigotes resistant to hexadecylphosphocholine (miltefosine). Inter J Antimicrob Agents. 22: 380-387. 2003. [ Links ]
6. Santamaría, E., Nubia, P., Zipa, J. y Ferro, C. Presencia en el peridomicilio de vectores infectados con Leishmania (Viannia) panamensis en dos focos endémicos en el occidente de Boyacá, piedemonte del valle del Magdalena medio, Colombia. Biomédica. v.26 supl.1. 2006 [ Links ]
7. Santamaría, E., Nubia, P., Puerta, C., y Ferro, C. Validación de la PCR en la detección de parásitos de Leishmania (Viannia) spp. en Lutzomya (Diptera Psychodidae) como herramienta en la definición de especies vectores de Leishmania Biomédica. 2005. [ Links ]
8. Ovalle, C., Porras, L., Rey, M., Ríos, M., Camargo, J. C. Distribución geográfica de especies de Leishmania aisladas de pacientes consultantes al Instituto Nacional de Dermatología Federico Lleras Acosta, E.S.E., 1995-2005. Biomédica. v.26 supl.1. 2006. [ Links ]
9. Croft, S. L., Sundar, S. and Fairlamb, A. H. Drug resistance in Leishmaniasis. Clin. Microbiol. Rev. 19: 111–126. 2006. [ Links ]
10. Aden A. Y. , Gustafsson, L.L., Ericsson, O., Hellgren, U. (Eds.). Handbook of Drugs for Tropical Parasitic Infections. 2ª ed. Taylor & Francis, Londres. 1995. [ Links ]
11. Pérez-Victoria, F. J., Castanys, S., Gamarro, F. Resistance to miltefosine in Leishmania donovani involves a defective inward translocation of the drug. Antimicrob Agents Chemo. 47: 2397-2403. 2003. [ Links ]
12. Arrebola, R., Olmo, A., Reche, P., Garvey, E. P., Santi, D. V. , Ruiz-Perez, L. M. Isolation and characterization of a mutant dihydrofolate reductase-thymidylate synthase from methotrexate-resistant Leishmania cells. J Biol Chem. 269:10590-6. 1994. [ Links ]
13. Cotrim, P. C, Garrity, L. K., Beverley, S. M. Isolation of genes mediating resistance to inhibitors of nucleoside and ergosterol metabolism in Leishmania by overexpression/ selection. J Biol Chem. 274:37723-30. 1999. [ Links ]
14. Liu, X. and Chang, K. P. The 63-kilobase circular amplicon of tunicamycin-resistant Leishmania amazonensis contains a functional N-acetylglucosamine-1-phosphate transferase gene that can be used as a dominant selectable marker in transfection. Mol Cell Biol.12: 4112-22. 1992. [ Links ]
15. Ouellette, M., Haimeur, A., Grondin, K., Légaré, D., Papadopoulou, B. Amplification of ABC transporter gene pgpA and of other heavy metal resistance genes in Leishmania tarentolae and their study by gene transfection and gene disruption. Meth Enzymol 292:182-92. 1998. [ Links ]
16. Anacleto, C., Abdo, M. C., Ferreira, A. V., Murta, S., Romanha A, Fernández A et al. Structural and functional analysis of an amplification containing a PGPA gene in a glucantime-resistant Leishmania (Viannia) guyanensis cell line. Parasitol Res. 90:110-8. 2003 [ Links ]
17. Papadopoulou B, Roy G, Ouellette M. A novel antifolate resistance gene on the amplifed H circle of Leishmania. EMBO J. 11:3601-8. 1992. [ Links ]
18. Ouellette M, Borst P. Drug resistance and P glycoprotein gene amplification in the protozoan parasite Leishmania. Res Microbiol. 142:737-46. 1991. [ Links ]
19. Price H, Menon M, Panethymitaki C, Goulding D, McKean P, Smith D. Myristoyl-CoA: protein Nmyristoyltransferase, an essential enzyme and potential drug target in kinetoplastid parasites. J Biol Chem. 278:7206-14. 2003. [ Links ]
20. Titus R, Gueiros-Filho F, de Freitas L, Beverley S. Development of a safe live Leishmania vaccine line by gene replacement. Proc Natl Acad Sci USA. 92: 10267-71. 1995. [ Links ]
21. Hassan P, Fergusson D, Grant KM, Mottram J. The CRK3 protein kinase is essential for cell cycle progression of Leishmania mexicana. Mol Biochem Parasitol. 113:189-98. 2001. [ Links ]
22. Sengupta T, Mukherjee M, Mandal C, Das A, Majumder H. Functional dissection of the C-terminal domain of type II DNA topoisomerase from the kinetoplastid hemofagellate Leishmania donovani. Nucleic Acids Res. 31:5305-16. 2003. [ Links ]
23. Selvapandiyan A, Duncan R, Debrabant A, Bertholet S, Screenivas G, Negi N et al. Expression of a mutant form of Leishmania donovani centrin reduces the growth of the parasite. J Biol Chem. 276:43253-61. 2001. [ Links ]
24. Tovar J, Cunningham M, Smith A, Croft S, Fairlamb A. Down-regulation of Leishmania donovani trypanothione reductase by heterologous expression of a trans-dominant mutant homologue: effect on parasite intracellular survival. Proc Natl Acad Sci USA 95: 5311-6. 1998. [ Links ]
25. Benzel I, Weise F, Wiese M. Deletion of the gene for the membrane-bound acid phosphatase of Leishmania mexicana. Mol Biochem Parasitol. 111:77-86. 2000. [ Links ]
26. Zhang K, Showalter M, Revollo J, Hsu F, Turk J, Beverley SM. Sphingolipids are essential for differentiation but not growth in Leishmania. EMBO J. 22: 6016-26. 2003. [ Links ]
25. Flaspohler J, Lemley K, Parsons M. A dominant negative mutation in the GIM1 gene of Leishmania donovani is responsible for defects in glycosomal protein localization. Mol Biochem Parasitol. 99:117-28. 1999. [ Links ]
27. Jiang Y, Roberts S, Jardim A, Cartet N, Shih S, Ariyanayagam M et al. Ornithine decarboxylase gene deletion mutants of Leishmania donovani. J Biol Chem. 274: 3781-8. 1999. [ Links ]
28. Roberts SC, Scott J, Gasteier JE, Jiang Y, Brooks B, Jardim A et al. S-adenosylmethionine decarboxylase from Leishmania donovani. Molecular, genetic, and biochemical characterization of null mutants and overproducers. J Biol Chem. 277: 5902-9. 2002. [ Links ]
29. Wiese M, Kuhn D, Grunfelder C. Protein kinase involved in fagellar-length control. Eukaryot Cell. 2: 769-77. 2003. [ Links ]
30. Dole V, Myler P, Stuart K, Madhubala R. Expression of biopterin transporter (BT1) protein in Leishmania. FEMS Microbiol Lett. 208: 89-91. 2002. [ Links ]
31. Cruz A, Beverley S. Gene replacement in parasitic protozoa. Nature. 348:171-3. 1990. [ Links ]
32. Cruz A, Coburn CM, Beverley S. Double targeted gene replacement for creating null mutants. Proc Natl Acad Sci USA. 88: 7170-4. 1991. [ Links ]
33. Curotto de Lafaille M, Wirth D. Creation of null/ +mutants of the a-tubulin gene in Leishmania enriettii by gene cluster deletion. J Biol Chem. 267: 23839-46. 1992. [ Links ]
34. El Fadili A, Kundig C, Ouellette M. Characterization of the folylpolyglutamate synthetase gene and polyglutamylation of folates in the protozoan parasite Leishmania. Mol Biochem Parasitol. 124: 63-71. 2002. [ Links ]
35. Maga JA, Sherwin T, Francis S, Gull K, LeBowitz JH. Genetic dissection of the Leishmania parafagellar rod, a unique fagellar cytoskeleton structure. J Cell Sci. 112: 2753-63. 1999. [ Links ]
36. Roberts S, Jiang Y, Jardim A, Carter N, Heby O, Ullman B. Genetic analysis of spermidine synthase from Leishmania donovani. Mol Biochem Parasitol. 115:217-26. 2001. [ Links ]
37. Hanson S, Adelman J, Ullman B. Amplification and molecular cloning of the ornithine decarboxylase gene of Leishmania donovani. J Biol Chem 267:2350-9. 1992. [ Links ]
38. Arastu-Kapur S, Ford E, Ullman B, Carter NS. Functional analysis of an inosine-guanosine transporter from Leishmania donovani. J Biol Chem 278: 33327-33. 2003. [ Links ]
39. Vasudevan G, Carter N, Drew M, Beverley S, Sánchez M, Seyfang A et al. Cloning of Leishmania nucleoside transporter genes by rescue of a transport-deficient mutant Proc Natl Acad Sci USA. 95:9873-8. 1998. [ Links ]
40. Rania S. Milleron, J.; Paul M.; Valle S.; Montoya A.; Yin H.;, Soong L.*, And Gregory C. Lanzaro. Antigenic diversity in maxadilan, a salivary protein from the sand fy vector of american visceral leishmaniasis. Am. J. Trop. Med. Hyg. 70: 286-293. 2004. [ Links ]
41. Rivas, L.; David, A. Péptidos antibióticos aucarióticos: ¿una nueva alternativa en clínica?. Enferm Infecc Microbiol Clin. 21: 358 – 365. 2003. [ Links ]
42. Steimer, W., et al. A new diagnostic tool in the management of antidepressive drug therapy. Clin Chem Acta. 308: 33-41. 2001. [ Links ]














