Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Investigaciones Andina
versão impressa ISSN 0124-8146
Investig. andina vol.10 no.17 Pereira set. 2008
ESTADO DE PORTADORES DE BORDETELLA PERTUSSIS EN ADOLESCENTES DE 12 A 19 AÑOS EN EL DEPARTAMENTO DEL TOLIMA, COLOMBIA, 2007
A STUDY INTO THE CARRIERS OF BORDETELLA PERTUSSIS BETWEEN 12 AND 19 YEARS OLD TOLIMA, COLOMBIA 2007
ESTADO DE PORTADORES DE BORDETELLA PERTUSSIS EM ADOLESCENTES DE 12 A 19 ANOS NO DEPARTAMENTO DO TOLIMA, COLÔMBIA, 2007.
Lina Sofía Morón Duarte*, Jaime Moreno** ,Martha Gracia*** ,María Elena Realpe** ,Gilma Lucia Peña Daza****
* Programa de entrenamiento en epidemiología de campo: Servicio de Epidemiología Aplicada, SEA. Residente Cohorte 2006-2008
** Grupo de Microbiología, Subdirección de Investigación, Instituto Nacional de Salud, Colombia
*** Grupo de Microbiología, Subdirección Red Nacional de Laboratorio, Instituto Nacional de Salud, Colombia
**** Secretaria de Salud del Tolima
Fecha de recibo: Mayo /08 - Fecha aprobación: Julio/08
Resumen
Antecedentes: se ha identificado Bordetella pertussis, en un porcentaje significativo en adolescentes y adultos, evidenciando su importancia como agente causante de hasta el 30% de los casos con este síndrome, que podrían jugar un papel importante en la transmisión de la enfermedad a niños lactantes.
Objetivo: determinar el estado de portador de B. pertussis en adolescentes del Tolima y evaluar la técnica reacción en cadena de la polimerasa (PCR) como herramienta diagnóstica en el estado de portador.
Materiales y métodos: estudio descriptivo de corte transversal; selección por muestreo aleatorio de 400 jóvenes de 12 a 19 años de edad. Recolección de muestras nasofaríngeas, procesadas con técnicas de cultivo: inmunofluorescencia directa (IFD) con anticuerpos policlonales y reacción en cadena de la polimerasa (PCR) de la IS4801-IS4802, en el Instituto Nacional de Salud.
Resultados: 400 muestras procesadas con cultivo negativo; 34(8,5%) positivas para IFD y 132(33%) para PCR. Las dos técnicas fueron positivas 29(17%) y 263(66%) negativas para IFD y PCR. Proporción de los positivos del total de la muestra 34,25%(137/400). Sensibilidad de la PCR respecto a la IFD fue de 85,3%(IC:95%, 68,2-94,5), especificidad de 71,9% (IC:95%, 66,9-76,3) VPP 22%(IC:95%, 15,4- 30,2) y VPN 98,1%(IC:95%, 95,5-99,3).
Conclusiones: se evidencia estado de portadores sanos en la población estudiada con diagnóstico por IFD y PCR; sin embargo, el cultivo bacteriano sigue siendo el “patrón de oro”, debido a esto, éste estudio no es concluyente. Es necesario evaluar continuamente el papel de los portadores de B. pertussis para establecer si existen portadores asintomáticos diagnosticados por cultivo.
Palabras clave: B. pertussis, tosferina, nasofaríngea, inmunofluorescencia directa (IFD), reacción en cadena de la polimerasa (PCR).
Abstract
Antecedents: studies have revealed that Bordetella Pertussis is present in a significant number of adolescents and adults, thus confirming its agency in the development of the syndrome in up to 30% of the cases examined. This may in turn play an important role in the transmission of the disease to breast fed children. To determine the nature of the bacteria B. Pertussis in adolescents carriers, residents of Tolima and to evaluate the efficacy of the polymerase (PCR) chain reaction strategy as a diagnostic medium on the carrier.
Methods: a field study conducted on a cross section of the population in which 400 youths between the ages of 12 and 19 were selected by means of random testing. Nasopharyngeal samples were collected and treated with live cultive techniques: direct immunofluorescence (IFD) with polyclonal antibodies on the one hand, and polymerase (PCR) IS4801-IS4802 chain reaction methods on the other. Treatment was undertaken in the National Institute for Health.
Results: 400 samples were treated with negative cultures: 34 (8.5%) tested positive with IFD and 132(33%) with PCR. Both techniques were positive 29(17%) and 263(66%) negative with IFD and PCR. Of the total samples taken 34.25% (137/400) were positive. The sensitivity of PCR in relation to IFD was 85.3% (IC:95%, 15,4- 30.2) and in relation to VPN was 98.1% (IC:95%, 95.5-99.3).
Conclusions: carriers of the strain tested with IFD and PCR are shown to be healthy, nevertheless the live bacteria remains the prototype of the illness and for this reason the study is inconclusive in its findings. A process of continual assessment into the condition of the B.Pertussis carriers is necessary in order to ascertain whether, amongst those diagnosed by live cultures, there are not those who are asymptomatic carriers.
Keywords: B.Pertussis, whooping cough, nasopharyngeal, direct immunofluorescence (IFD), polymer (PCR) chain reaction.
Resumo
Antecedentes: tem-se identificado Bordetella pertussis em significativo porcentagem de adolescentes e adultos, o que evidencia sua importância como agente causador de até 30% dos casos com esta síndrome, que poderiam ter um papel importante na transmissão da enfermidade a crianças lactantes.
Objetivo: determinar o estado de portador da B. pertussis em adolescentes do Tolima e avaliar a técnica reação em cadeia na polimarese (PCR) como ferramenta diagnóstica no estado de portador.
Materiais e métodos: estudo descritivo-transversal,.Seleção por amostra aleatória de 400 jovens de 12 a 19 anos de idade. Colheita de amostras nasofaringes, processadas com técnicas de cultivo imunofluorescência direta (IFD) com anticorpos policlonais e reação em cadeia da polimerese (PCR) da ISA801-ISA802 no Instituto Nacional de Saúde.
Resultados: 400 amostras processadas com cultivo negativo; 34 (8,5%) positivas para IED e 132 (33%) para PCR. As duas técnicas foram positivas 29 (17%) e 203 (66%) negativas para IED e PCR. Proporção dos positivos do total da amostra 34,25% (137/400). Sensibilidade da PCR respeito à IED foi de 85,3% (IC; 95%, 68,2-94,5), especificidade de 71,9% (IC 95%, 66,9-76,3) VPP 22% (IC 95%, 15,4- 30,2) e VPN 98,1% (IC 95%, 65,5-99,3).
Conclusões: evidencia-se estado de portadores sãos na população estudada com diagnóstico por IED e PCR; mas o cultivo bacteriano segue sendo o “padrão de ouro”. Devido a isto, este estudo não é conclusivo. É necessário avaliar continuamente o papel dos portadores de B. pertussis para estabelecer se existem portadores assintomáticos diagnosticados por cultivo.
Palavras chave: B. pertussis coqueluche nasofaringe imunofluorescência direta (IED) reação em cadeia da polimerase (PCR).
Introducción
Antes de 1940 la tosferina era la principal causa de morbilidad y mortalidad infantil en el mundo. Actualmente se estima que entre 200000 a 400000 niños mueren por esta causa en América, aunque la cifra puede ser mayor, dado que su presentación clínica suele confundirse con otras enfermedades respiratorias1. Estimaciones recientes indican que la incidencia global anual es de 60 millones de casos2; además, se considera que sólo se informa uno de cada 10 casos y las infecciones en los adultos por ser en general de presentación clínica atípica, no se diagnostican3.
La tosferina puede afectar a todos los grupos de edad, con mayor frecuencia en el grupo de 0 a 4 años. Es una enfermedad muy contagiosa con tasas de ataque del 90% e incluso mayores, en contactos no vacunados o susceptibles y con presencia de casos subclínicos hasta de un 50% en individuos vacunados o con antecedente de la enfermedad; información muy importante dado que esta población constituye una fuente de contagio para individuos susceptibles3.
Se ha identificado Bordetella pertussis, en un porcentaje importante en adolescentes y adultos, con cuadros clínicos de tos persistente, evidenciando la importancia de este microorganismo como agente causante de hasta el 30% de los casos con este síndrome4. Estas infecciones leves o asintomáticas parece que podrían jugar un papel importante en la transmisión de la enfermedad a niños lactantes5.
Algunos autores argumentan que después de determinados años de la vacunación la inmunidad disminuye considerablemente, y si no se refuerza, esta situación estaría condicionando un aumento en el número de adolescentes y adultos sin inmunidad protectora frente a la infección por B. pertussis6.
Aunque la mayor incidencia de tosferina se notifica en menores de un año, estudios recientes indican que esta enfermedad entre adolescentes y adultos es más frecuente de lo que se piensa7. En un estudio de la transmisión de la infección entre contactos familiares, se encontró que el 90% de los casos índice eran niños menores de 4 años, mientras que en el 53% de los casos la fuente primaria de infección eran las personas mayores de 13 años8. En un estudio realizado en París (Francia) con 217 individuos entre los 18 a 88 años de vida se encontró evidencia de infección por B. pertussis en un 32%, los cuales presentaban como característica clínica una tos reciente9.
La vigilancia de los casos de tosferina pone en evidencia el desplazamiento de los casos hacia los adolescentes y adultos, en los cuales el diagnóstico es poco frecuente, tanto por sintomatología como por la falta de confirmación por el laboratorio, lo cual conduce a que los adultos sean reservorios y fuente de infección para los niños10.
Los informes del Centro para el Control y Prevención de Enfermedades (CDC) de Estados Unidos, reportan que en el periodo comprendido entre 1997 y 2000, se presentaron 29134 casos de tosferina, de los cuales el 29% tenía entre 10 y 19 años, y el 20% más de 20 años de edad, lo cual permitiría argumentar que la enfermedad tiene una incidencia importante en los adolescentes y adultos11.
El comportamiento epidemiológico ha tenido cambios significativos para esta enfermedad, asociado con factores tales como una mejor vigilancia del evento por parte de la epidemiología, y disponibilidad de diagnóstico por el laboratorio. Por otro lado, la inmunidad conferida por la vacuna de células completas es transitoria y algunos autores informan que ésta podría perderse después de 6 a 10 años de colocada la vacuna12; otros en cambio dicen, que la inmunogenicidad completa es conferida cuando se administra la tercera dosis y se presenta un descenso de los anticuerpos específicos a los 15 a 18 meses después de administrada la dosis de refuerzo, donde la protección podría ser aproximadamente de un 50% y estaría ausente a los 12 años de vida2.
Antecedentes
La tosferina es una enfermedad bacteriana, causada por B. pertussis, que afecta al sistema respiratorio, tiene una fase catarral inicial, de comienzo insidioso, con tos irritante que poco a poco se vuelve paroxística, generalmente en 1 o 2 semanas y puede durar 1 o 2 meses; la segunda etapa es la fase espasmódica o paroxística que se caracteriza por accesos repetidos y violentos de tos, a menudo seguidos de vómitos. La tos paroxística típica está ausente con frecuencia en niños menores de 6 meses, adolescentes y adultos y la tercera fase es la convaleciente que puede durar hasta dos meses13.
B. pertussis es un cocobacilo corto, Gram negativo, que en cultivos viejos puede ser pleomórfico y adquiere forma filamentosa. Es aerobio obligado, de crecimiento lento, aislado por primera vez en 1906 por Bordet, Gengou y Mazool que lo identificaron como el agente causal de la tosferina14.
B. pertussis tiene una amplia gama de factores de virulencia, entre los cuales se incluyen moléculas encontradas en la superficie bacteriana que colaboran en la adherencia a las células respiratorias que ayudan en la fisiopatología de la tosferina. Los factores de virulencia se han dividido en moléculas de adhesión: la hemaglutinina filamentosa (FHA), la pertactina (PRN), la fimbria (FIM), la toxina pertúsica (PT) y el factor de colonización traqueal y las toxinas: la citotoxina traqueal (TCT), la adenilatociclasa (ACT) y la toxina pertúsica (PT)3.
La infección se transmite por vía aérea por contacto directo con las secreciones de las mucosas de las vías respiratorias de las personas infectadas o portadoras. El periodo de incubación de la enfermedad es de 7 a 10 días, la mayor transmisibilidad se produce durante la fase catarral, después disminuye progresivamente durante 3 semanas en la fase paroxística en pacientes no tratados con antibióticos13. Se transmite a los susceptibles antes que se sospeche el diagnóstico de tosferina, el 90% de los susceptibles en contacto cercano con un enfermo puede adquirirla1516. Es una de las infecciones de mayor transmisibilidad y las tasas de ataque oscilan entre el 50% en las escuelas y el 80 al 90 % en los contactos familiares17,18.
Magnitud de la tosferina en el ámbito mundial
A pesar de la vacunación, se ha reportado un incremento en la incidencia de la enfermedad en las últimas dos décadas19; según la Organización Mundial de la Salud (OMS), el 90% de los casos ocurre en los países en desarrollo y se estima que origina de 200000 a 300000 fallecimientos anualmente20.
La inmunización activa contra la tosferina, iniciada en 1940 en Estados Unidos, redujo las tasas de morbilidad y mortalidad para esta enfermedad. En el periodo de 1997 a 2000, los datos del CDC mostraron que de 29048 personas con tosferina, 8390 (29%) eran menores de un año, 3359 (12%) tenían entre uno y cuatro años, 2835 (10%) de cinco a nueve años, 8529 (29%) de 10 a 19 años, y 5935 (20%) eran mayores de 20 años21.
El número de casos de tosferina reportados en Latinoamérica en los últimos años muestra una tendencia a la disminución, cayendo de 9421 casos en 1999 a 3883 en 2004. Durante esos años la cobertura de la vacuna DPT3 en menores de 1 año fue entre 85% y 95%22.
A principios de 1998, la OMS llegó a la conclusión que la tosferina estaba lejos de ser erradicada; 62% de los casos reportados en el mundo eran niños menores de un año y 32% eran menores de tres meses de edad; dos tercios de los pacientes fueron contagiados por sus padres o hermanos. La incidencia actual de la tosferina se calcula en 3,6 casos por cien mil habitantes en el mundo, y el objetivo de la OMS es reducirla a un caso por 100.000 habitantes17.
Epidemiológicamente se presentan brotes cada 2 a 5 años, siendo los menores de 1 año los más afectados. En los adultos es poco sintomática, sin embargo, algunos reportan que puede ser endémica en este grupo de edad, mientras que en los lactantes puede provocar epidemias de largo alcance, especialmente en aquellos que no se encuentran vacunados3,23.
La tosferina en Colombia
En Colombia desde la implementación en 1978 del programa regular de vacunación e inclusión de la vacuna de DPT en menores de 5 años, la reducción de los casos de morbilidad y mortalidad ha sido considerable, con tendencia al descenso, una vez que las coberturas de vacunación con DPT comenzaron a aumentar24 (figura 1).
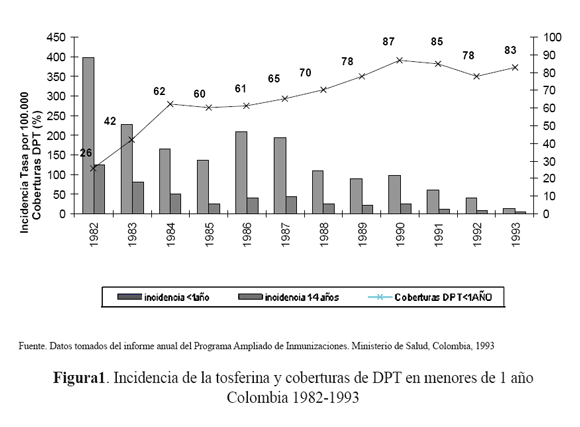
En los documentos revisados no se encontraron datos entre los años 1994 a 1996. A partir de 1997 se viene reportando al Sistema Nacional de Vigilancia en Salud Pública (SIVIGILA), y se realiza el diagnóstico bacteriológico por el Grupo de Microbiología del Instituto Nacional de Salud (INS).
Entre 1997 y 1999 se informaron un total de 1052 casos probables, con un promedio de 350 casos por año y una incidencia entre 0,8 y 1,0 por 100.000 habitantes. Para la construcción de este indicador se asumió que la totalidad de casos notificados fueron confirmados25. En el mismo periodo, el Grupo de Microbiología del INS confirmó un total de 62 casos por B. pertussis (comunicación institucional Grupo de Microbiología INS).
Durante el periodo de 2000-2004, se notificaron un total de 2546 casos probables de tosferina, con un promedio de 509 casos por año, de los cuales se confirmaron 321, es decir, 13% del total de los casos para este periodo y un acumulado de 5 defunciones. En el quinquenio, el promedio de la incidencia de la población total fue de 0,13 por 100.000 habitantes, y en el grupo de la población específica de menores de 5 años la incidencia fue de 0,5 (figura 2).
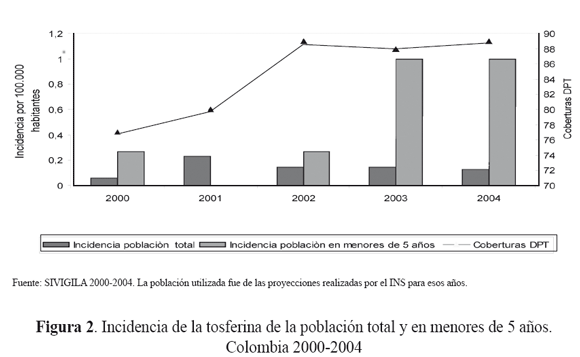
En 2005 se notificaron 1401 casos probables de tosferina, de los cuales 464 (33%) fueron casos probables, 107 (8%) confirmados por laboratorio, 14 (1%) confirmados por nexo epidemiológico, 18 (1%) clasificados como compatibles y 798 (57%) descartados. La incidencia en la población general fue de 0,3 por 100.000 habitantes; en los menores de 1 año fue de 5,6 por 100.000; y, en los menores de 5 años de 2,3 por 100.000. Se observó un aumento importante de la incidencia en menores de cinco años comparado con los años anteriores (fuente: SIVIGILA-SIVILAB 2005)26.
Los cinco departamentos que presentaron una mayor incidencia en menores de 5 años en el año 2005, fueron Guainía, Tolima, Cauca, Vichada y Nariño con incidencias por 100.000 habitantes de 16,1; 10,4; 7,4; 6,3 y 5,6 respectivamente. Cuando se compararon con las coberturas de vacunación para el biológico de DPT, se observó que en su gran mayoría los departamentos no alcanzaron coberturas útiles, lo cual podría explicar en parte la presencia de casos, sin olvidar que éste no es el único condicionante que existe para la presencia de casos de tosferina26 (figura 3).
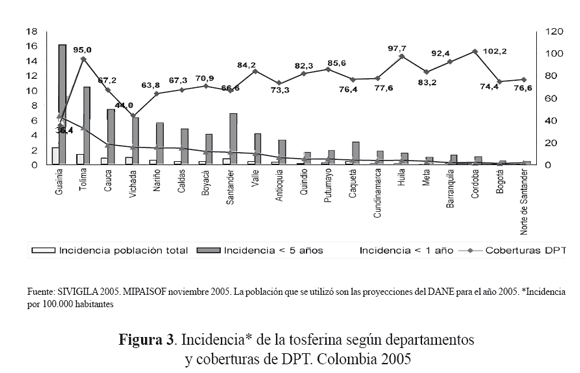
La incidencia en menores de cinco años por municipios con casos confirmados de tosferina, supera la meta propuesta a nivel nacional, que es reducirla a 1 caso por 100.000 menores de cinco años26.
De los 139 casos clasificados entre confirmados por laboratorio, nexo epidemiológico y compatibles, en el 2005 se presentaron 10 fallecimientos; no obstante, para la construcción del indicador de letalidad se tomaron únicamente los casos positivos por laboratorio (107 casos), de los cuales 7 murieron, para una letalidad durante el año de 6%, superior a la registrada entre el 2001, 2002 y 2004 que fue del 3%, 1,5% y 1,7% respectivamente27.
La tasa de letalidad por departamento (casos positivos por laboratorio) fue: - Tolima: dos casos, letalidad del 11% (2/18)
- Cauca: dos casos, letalidad de 20% (2/10)
- Huila: dos casos, letalidad del 50% (1/2)
- Guainía: un caso, letalidad del 100% (1/1)
- Barranquilla. un caso, letalidad del 50% (1/2)
El caso reportado por Guainía era un caso importado de Venezuela; y, el distrito de Barranquilla presentó letalidad por tosferina, pero su incidencia fue menor de 1 caso por 100.000 menores de 5 años.
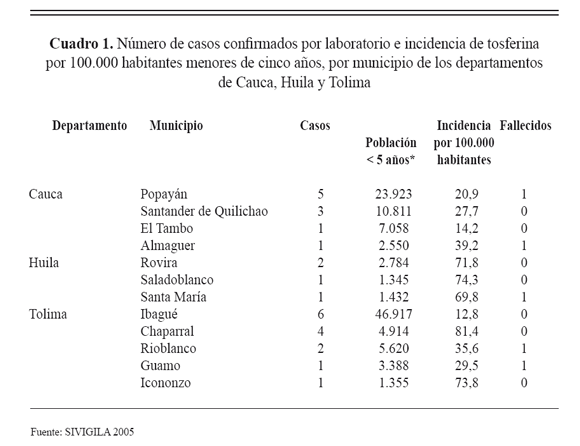
Los departamentos de Huila, Tolima y Cauca además de presentar en 2005 incidencias mayores de 1 caso por 100.000 menores de cinco años, tuvieron casos autóctonos fallecidos por tosferina y de acuerdo con estos dos criterios se clasificaron como departamentos de alto riesgo para este evento (cuadro 1).
Brotes de tosferina documentados en Colombia
De acuerdo con la literatura de informes epidemiológicos, en el país se han reportado varios brotes por tosferina, los cuales se han presentando con un comportamiento cíclico.
Entre los brotes documentados es común encontrar que las poblaciones más afectadas son los indígenas y comunidades rurales apartadas; por ejemplo, para 1993, en el departamento del Chocó, en la semana epidemiológica 34 se presentaron 244 casos de tosferina, los cuales procedían de dos regiones indígenas principalmente, Alto Baudó y Bojayá donde se presentaron el 72% y el 23% respectivamente del total de casos; los grupos de edad más afectados fueron los de 1 a 4 años y de 5 a 14 años con una letalidad del 10,5%24.
En marzo de 1994 en la población del Alto Naya en los departamentos del Cauca y Valle del Cauca se presentaron 31 casos, con una letalidad del 61,2%28; en mayo del mismo año en la población de El Jordán, departamento de Santander, se encontró una tasa de ataque global de 33%, con un total de 80 casos29. En el periodo de octubre de 1994 a enero de 1995 se identificó un brote de tosferina, en el litoral del San Juan, Chocó, en tres comunidades indígenas del grupo de los Waunanas (Taparalito, San José y Tiosirilio) y una comunidad negra (Las Delicias), con la ocurrencia de cinco muertes debido a esta enfermedad. Se identificaron 82 casos de tosferina con una tasa global de ataque de 22,6%. Las tasas de ataque en menores de 17 años, por localidad fueron: San José 15 casos (27,7%), Las Delicias 14 (45,1%) Taparalito, 41 (55.4%) y Tiosilirio, 12 (28,6%), además se observó que las tasas de ataque por edad encontradas fueron más altas para el grupo de menores de cinco años que para el resto de los grupos de edad; 0-1 años (55%), 2 a 4 años (50,8%). 5 a 8 años (34,6%) y 9 a16 años (25%)30.
En 1997 en las comunidades indígenas Bebarama, Bebará y Cumitá del municipio de Quibdó, Chocó, se presentaron 44 casos, con una letalidad del 18%31.
Para el año 2000, en el asentamiento indígena de Taminaka de la Sierra Nevada de Santa Marta, se reportaron 25 casos probables de tosferina en pacientes entre 1 y 8 años de edad, de los cuales se tomó muestra a 20 y en 4 de ellos se obtuvieron resultados positivos para B pertussis; además se les tomó muestra a 7 contactos asintomáticos, uno de los cuales fue positivo para B. pertussis32.
En el 2001, en la semana epidemiológica 10, en el municipio de Puerto Nariño (comunidad de Naranjales y Santa Clara del departamento de Amazonas), se presentó un brote con 6 casos iniciales, en edades entre los 4 y 24 años, confirmándose uno por laboratorio y el resto se confirmó por nexo epidemiológico; posteriormente se ratificaron 27 casos más, uno por laboratorio y el resto por nexo epidemiológico33.
Vacunas contra la tosferina
En las medidas de control, además del aislamiento de los casos y su terapia antibiótica, existe la inmunización con dos diferentes tipos de vacunas. El esquema de vacunación es de tres dosis en el primer año de vida a la edad de 2, 4 y 6 meses, siendo la edad mínima de aplicación las 6 semanas de edad; y refuerzos a los 18 meses y a los 5 años de edad15,16.
La vacuna celular fue introducida en 1940, compuesta por células inactivadas por calor y mostró ser relativamente eficiente en lo referente a combatir la enfermedad, pero la frecuencia y a veces la gravedad de los efectos secundarios han provocado una disminución en la aceptación de la misma y consecuentemente un aumento en el número de casos de tos convulsa34,35.
La vacuna acelular se prepara con extractos purificados de las moléculas de adherencia, de las toxinas o ambas; se considera que reduce cerca del 30% al 50% los efectos secundarios y tienen el mismo esquema de aplicación que la vacuna tradicional. Su eficacia se considera del 85% con tres o cinco componentes y del 59% con dos componentes. Todas contienen toxina pertussis detoxificada químicamente o por ingeniería genética y puede contener pertactina, FHA, fimbria (aglutinógeno 2 y 3)3.
La reemergencia de la tosferina aún en países con alta cobertura de vacunación, ha puesto de manifiesto una vez más las formulaciones actuales de las vacunas para erradicar la enfermedad36, 37; entre las causas posibles de este resurgimiento y una de las más aceptadas, es la selección de cepas de Bordetella antigénicamente diferentes a las cepas vacunales36. De hecho ya se han documentado variantes polimórficas en cepas causantes de epidemias36. Dicha variación se ha encontrado al menos en dos proteínas cuyo papel es esencial en la protección contra Bordetella: PT y PRN. La PT se expresa sólo en B. pertussis, mientras que PRN se expresa también en B. parapertussis y B. bronchiseptica. El polimorfismo en PT está restringido sólo a la subunidad S1 que contiene la actividad tóxica. Los datos obtenidos hasta el presente, muestran una clara divergencia entre las cepas vacunales y los aislamientos obtenidos de pacientes. Estos últimos se han clasificado como S1A mientras que las cepas vacunales, como S1B y S1D38, 39.
La Pertactin (PRN) es una proteína de membrana externa cuyos epitopes inmunodominantes y protectores incluyen dos regiones repetitivas denominadas regiones I y II. Los estudios publicados muestran que B. pertussis varía fundamentalmente a nivel de la región I, a partir de la cual se han clasificado las distintas variantes en Prn1, Prn2 y Prn3. Las variaciones encontradas en los aislamientos obtenidos de pacientes corresponden a Prn2 y Prn3, mientras que los de las cepas vacunales en uso corresponden a Prn138, 40.
Métodos diagnósticos
Los métodos de diagnóstico de tosferina son directos, basados en el aislamiento de la bacteria en cultivo, o en la detección de algunos de sus componentes o productos realizada por la inmunofluorescencia directa (IFD) y reacción en cadena de la polimerasa (PCR)41.
El método de elección para el diagnóstico de la B. pertussis o B. parapertussis es el aislamiento de la bacteria en el cultivo, que es muy específico, pero presenta la desventaja de carecer de una adecuada sensibilidad18; el cultivo puede verse afectado por factores, tales como el tipo de muestra, el tiempo de evolución de la enfermedad y la administración previa de antibióticos. El aspirado nasofaríngeo constituye la mejor muestra y su rendimiento es superior al aportado por el frotis nasofaríngeo. El mejor momento para la toma de muestras para cultivo se da al final del periodo de incubación, durante la fase catarral42,43.
La detección en muestras clínicas de B. pertussis y B. parapertussis mediante IFD puede proporcionar un diagnóstico rápido, sin embargo, es un método subjetivo en cuanto a la interpretación de sus resultados y requiere de personal experto para la lectura44.
En una investigación realizada en Colombia y publicada en 1997 respecto al diagnóstico por IFD, concluyó que esta técnica puede ser empleada para el diagnóstico de la tosferina, siempre y cuando se tenga especial cuidado en la interpretación de la lectura, basada en la morfología microscópica del microorganismo y el grado de intensidad de la fluorescencia. Para lograrlo, es indispensable el empleo de cepas control y de personal entrenado en la lectura de la prueba45.
La PCR aporta agilidad al diagnóstico de tosferina; las muestras utilizadas en PCR también son el aspirado nasofaríngeo y los frotis nasofaríngeos, aunque en este caso los requerimientos de transporte y preservación son menos estrictos. Los blancos de amplificación usadas con más frecuencia son la región promotora de gen que codifica para la toxina pertussis (PT), la secuencia de inserción IS481 y genes como el de la adenilato ciclasa y el de la porina46.
Portador
La definición de portador es aquella persona que no presenta síntomas clínicos reconocibles de una enfermedad, pero que la incuba o alberga, siendo una fuente potencial de infección16. En la revisión de la literatura científica para B. pertussis no se encuentran estudios dirigidos a demostrar el estado de portador de la bacteria, sin embargo, algunos autores lo mencionan y dejan entrever la importancia que juegan los portadores en el asentamiento de esta enfermedad en la comunidad44, 49.
La tosferina en adultos y adolescentes es uno de los factores que condicionan la persistencia de la enfermedad, por tanto, el propósito de este estudio es determinar el estado de portador de B. pertussis en adolescentes y evaluar la técnica de reacción en cadena de la polimerasa (PCR), como una herramienta diagnóstica en el estado portador.
Materiales y métodos
La investigación se realizó mediante la aplicación de un estudio descriptivo de corte transversal para la detección de portadores de B. pertussis.
Para la selección de la muestra se evidenció el grado de compromiso e interés de los departamentos con mayor incidencia y letalidad en menores de 5 años durante el 2005, siendo el departamento de Tolima el que manifestó el mayor grado de compromiso para apoyar el desarrollo de la investigación hasta su finalización. A continuación, se tomó el total de la población entre los 12 y 19 años de edad (proyección 2005 del DANE) en los municipios del departamento con casos confirmados para tosferina, utilizando una prevalencia del 50%, con una confianza del 95% y un error del 5% (cuadro 2). La selección de la muestra fue obtenida en Statcalc Epi-Info 6.04.

El tamaño de la muestra requerida por el departamento, se tomó específicamente en los municipios participantes, que aportaron los casos confirmados de B. pertussis durante el año 2005. Para la distribución de la toma de las muestras se tuvo en cuenta la distribución porcentual de la población en cada municipio (cuadro 3).
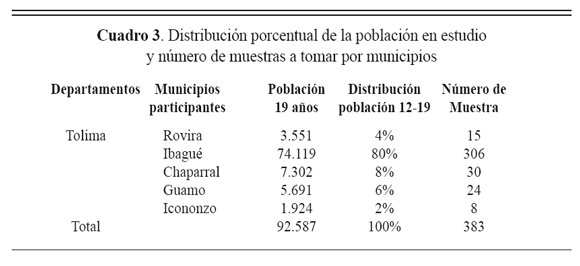
Criterios de inclusión del ente territorial
- Tasas de incidencia de tosferina en el departamento mayor de 1,0 por cien mil menores de cinco años, durante el año 2005 y al menos un caso fallecido con reporte de laboratorio positivo para Bordetella pertussis.
- Casos presentados y fallecidos autóctonos del departamento.
- Participación de los municipios en donde se presentaron casos por tosferina.
Criterios de inclusión del individuo participante
- Personas entre los 12 a 19 años de edad residentes en los municipios del departamento que cumplen con el criterio anterior.
- Que no hubiesen recibido antibióticos por lo menos 15 días antes de la toma de la muestra.
- Aceptación en la participación del estudio.
Sitios de selección de los participantes
- Los participantes se seleccionaron de las instituciones educativas de primaria o bachillerato ubicadas en los municipios seleccionados.
Criterios de exclusión del individuo
- Individuo con pólipos nasales o desviación del tabique nasal.
Control de sesgos
- Los sesgos de información se controlaron utilizando un instrumento estructurado para la recolección de los datos y personal previamente entrenado en su aplicación.
- Los sesgos de selección de las instituciones educativas de primaria y bachillerato se disminuyeron a través de un muestreo aleatorio que se realizó entre ellas en cada municipio. Es decir, una vez sectorizadas las instituciones educativas y totalizadas respectivamente, se realizó el muestreo aleatorio y su respectiva selección.
- Para disminuir los sesgos de participación respecto a la variable sexo, se realizó una selección aleatoria entre 2 listas, una por cada género, de los posibles participantes voluntarios.
Toma y procesamiento de muestras
A cada participante en el estudio se le tomó un frotis nasofaríngeo y el diagnóstico se realizó por las técnicas de cultivo, reacción en cadena de la polimerasa (PCR) e inmunofluorescencia directa (IFD), las cuales fueron procesadas por el Grupo de Microbiología del Instituto Nacional de Salud.
En la toma de la muestra nasofaríngea se utilizó un hisopo estéril de alambre flexible, delgado, con punta de alginato de calcio. Se sentó al participante en una silla y con la cabeza ligeramente inclinada hacia atrás (en 30º a 40º), el operador introdujo el hisopo (el alambre del hisopo previamente se moldea formando media luna) siguiendo el piso de la nariz, hasta chocar con la pared posterior de la nasofaringe. El hisopo se dejó in-situ durante 5 segundos, para permitir que el alginato se impregnase con la secreción nasofaríngea; luego se practicó una suave rotación del hisopo en 180º, antes que se procediera a retirarlo.
El primer hisopo se utilizó para sembrar la muestra en placa con medio de Reagan Lowe con cefalexina e inmediatamente se transportó al Grupo de Microbiología del INS. Con el segundo hisopo se realizaron dos extendidos en dos láminas portaobjetos, las cuales se dejaron secar al ambiente y fijar con metanol y el hisopo se colocó en un vial estéril. Todas las muestras fueron etiquetadas con el código de inclusión del participante y remitidas al Grupo de Microbiología del INS, y se siguieron las recomendaciones de bioseguridad necesarias47.
En la IFD las láminas previamente fijadas se tiñeron con anticuerpos monoclonales marcados con fluoresceína (FA Bordetella pertussis BD 223591, FA Bordetella parapertussis BD 223781, Beckton Dickinson) y se leyeron en el microscopio de fluorescencia registrando la presencia o ausencia de fluorescencia. En la PCR se realizó la extracción del ADN en buffer de lisis GT (tiocionato de guanidina, DTT, Tris 1M) y se purificó por el método de etanol isopropanol. Para la PCR se utilizó los iniciadores BPIS4801 5’GACTTCGTCTTCGTGGCCAT’3 y BPIS4802 5`GTACAGCGCGCCCGATGCCT’3 reportados por Farell y colaboradores14 y la metodología descrita por el Departamento de Servicios Generales, Commonwealth de Virginia de Estados Unidos (comunicación institucional).
Consideraciones éticas
El estudio se ajustó a los establecido en la Resolución 008430 de 1993 del Ministerio de Salud de Colombia, según su artículo 11 numeral b, se clasifica como de riesgo mínimo, debido a que se emplearon registros de datos a través de procedimientos comunes, consistentes en una toma de muestra y su respectivo examen de laboratorio para la identificación de los portadores de B. pertussis. Además, prevaleció el criterio del respeto a la dignidad y la protección de los derechos y bienestar de los participantes.
Se solicitó el consentimiento y asentimiento informado en forma escrita a todos los representantes y participantes menores de 18 años de edad; a los participantes de 18 y 19 años de edad se les solicitó únicamente consentimiento informado, dando información clara y fácilmente comprensible sobre los objetivos de la investigación, así como la voluntad de participar en ésta.
Resultados
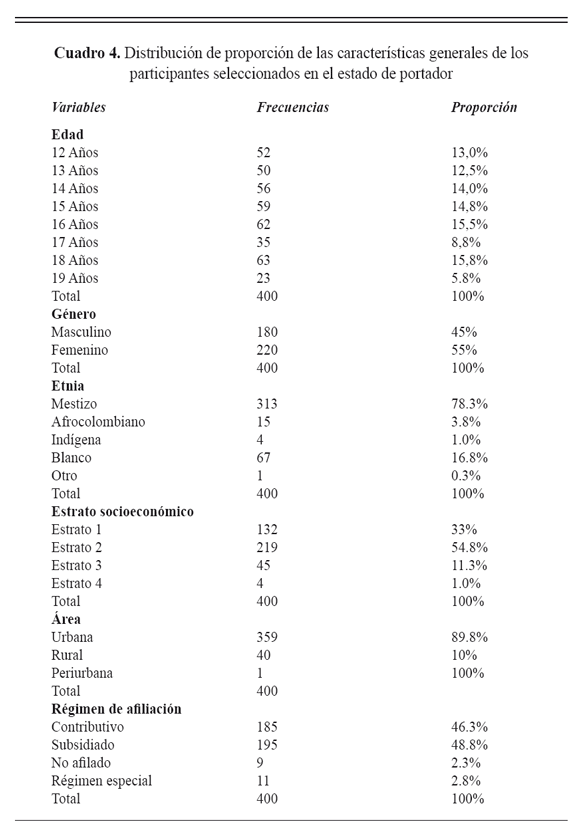
Se seleccionaron un total de 400 adolescentes entre los 12 y 19 años de edad, a los cuales se les tomaron muestras de hisopado nasofaríngeo. Entre las características generales de los participantes, n=180 (45%) fueron del sexo masculino y n=220 (55%) del sexo femenino; el estrato socioeconómico más frecuente fue el dos con n=219 (54,8%), seguido del estrato uno con n=132 (33%). En cuanto al régimen de afiliación al Sistema General de Seguridad social en Salud (SGSSS): subsidiado n=195(48,8%), contributivo n=185 (46,3%), especial n=11 (2,8%) y no afiliados con un n=9 (2,3%) (Cuadro 4).
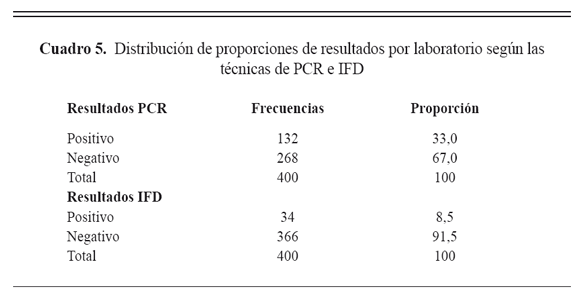
En cuanto al diagnóstico por el laboratorio, de las 400 muestras procesadas se obtuvo que para el cultivo fueron negativas. El 8,5% (n=34) fueron positivas para IFD y el n=132 (33%) para PCR, las dos técnicas fueron positivas en el n=29 (17%), un n=263 (66%) fueron negativas para IFD y PCR. La proporción de los positivos en el total de la muestra fue de 34,25%(137/400) (Cuadro 5).
La sensibilidad de la PCR respecto a la IFD fue de 85,3% (IC:95%, 68,2-94,5), la especificidad de 71,9% (IC:95%, 66.9- 76.3) VPP de 22%(IC:95%, 15.4-30.2) y el VPN 98,1%(IC:95%, 95.5-99.3) (Cuadro 6).

Discusión de resultados
Los métodos diagnóstico de B. pertussis son directos, basados en el aislamiento de la bacteria en cultivo, o en la detección de algunos de sus componentes o productos, realizada por la inmunofluorescencia directa (IFD) y reacción en cadena de la polimerasa (PCR)49. El método de elección para el diagnóstico de la B. pertussis es el aislamiento de la bacteria en el cultivo, que es muy específico, pero presenta la desventaja de carecer de una adecuada sensibilidad50; el cultivo puede verse afectado por factores, tales como el tipo de muestra, el tiempo de evolución de la enfermedad y la administración previa de antibióticos. El aspirado nasofaríngeo constituye la mejor muestra y su rendimiento es superior al aportado por el frotis nasofaríngeo. El mejor momento para la toma de muestras para cultivo se da al final del periodo de incubación, durante la fase catarral51, 52.
La detección en muestras clínicas de B. pertussis mediante IFD puede proporcionar un diagnóstico rápido, sin embargo, es un método subjetivo en cuanto a la interpretación de sus resultados y requiere de personal experto para la lectura50.
En una investigación realizada en Colombia y publicada en 1997 respecto al diagnóstico por IFD, concluyó que esta técnica puede ser empleada para el diagnóstico de la tosferina, siempre y cuando se tenga especial cuidado en la interpretación de la lectura, basada en la morfología microscópica del microorganismo y el grado de intensidad de la fluorescencia. Para lograr esto, es indispensable el empleo de cepas control y de personal entrenado en la lectura de la prueba53.
La PCR aporta agilidad al diagnóstico de tosferina; las muestras utilizadas en PCR también son el aspirado nasofaríngeo y los frotis nasofaríngeos, aunque en este caso los requerimientos de transporte y preservación son menos estrictos. Los blancos de amplificación usadas con más frecuencia son la región promotora de gen que codifica para la toxina pertussis (PT), la secuencia de inserción IS481 y genes como el de la adenilato ciclasa y el de la porina54.
A pesar de la importancia que aportan las técnicos de IFD y PCR en la identificación de la B. pertussis, para definir el estado de portadores, es necesario realizar el aislamiento de la bacteria por cultivo para definir claramente este papel.
Debe tenerse en cuenta: el portador es aquella persona carente de síntomas clínicos reconocibles de una enfermedad, pero que la incuba o alberga, siendo una fuente potencial de infección55. En la revisión de la literatura científica para B. pertussis, no se encontraron estudios específicos dirigidos a demostrar el estado de portador de la bacteria, sin embargo, algunos autores lo mencionan y dejan entrever la importancia que juegan los portadores en la presencia de esta enfermedad en la comunidad50,56.
De acuerdo a los resultados obtenidos por los diagnósticos por IFD y PCR, se evidencian portadores sanos en la población estudiada; sin embargo, el cultivo bacteriano sigue siendo el “patrón de oro”; por este motivo éste estudio no es concluyente. El papel de los portadores de B. pertussis, necesita una evaluación continua a través de investigaciones al respecto para establecer si realmente existen portadores asintomáticos diagnosticados por cultivo o si definitivamente este papel es más teórico que real.
Referencias Bibliograficas
1World Health Organization. Pertussis vaccines. Wkly Epidemiol Rec. 2005; 80(4):31-39. [ Links ]
2 Martín A. Vacuna contra la Difteria, Tosferina, y Tétanos.2000; Archivos venezolanos de puericultura y pediatría. Vol: 63 suplemento 3. [ Links ]
3 Salgado Vélez, H. Manual de Inmunización Humana. Bogotá: Editora Médica Colombiana S.A.; 2001. [ Links ]
4 Mink CM, C. JD, Chistenson P., Lewis K, Pineda E Shlian D, Dawson JA and Blumberg DA. A Search for Bordetella pertussis infection in university students. Clin Infect Dis 1992; 29: 1239-42. [ Links ]
5 Cherry JD. Pertussis in the preantibiotic and prevaccine era, with emphasis on adults pertussis. Clin Infect Dis 1999; 28 (supl 2): S107-11. [ Links ]
6 Fine PEM. Adult pertussis: a Salesmans dream and an epidemiologists nightmare. Biologicals 1997; 25: 195-8. [ Links ]
7 Cherry JD. The role of Bordetella pertussis infections in adults in the epidemiology of pertussis. Dev Biol Stand Basel Karger. 1997; 89: 181-6. [ Links ]
8 Shimitt-Grohè S, Cherry JD, Heininger U, Uberall MA, Pineda E and Stehr K. Pertussis in German adults. Clin Infect Dis 1995: 21 860-6. [ Links ]
9 Silberg S, Njamkepo E, Parent du Chatelet I, Partouche H, Gueirard P, Ghasarissian Schlumberger M et. al. Evidence of Bordetella pertussis infection in adults presenting with persistent cough in a French area with very high whole - cell coverage.J Infec Dis 2002; 186: 415-8. [ Links ]
10 Perret P, Cecilia. Vacuna anti-pertussis para uso en adolescentes y adultos. Rev Chil Infectol. 2006; vol.23, no.3, p.257-260. [ Links ]
11Centers for Diseases Control and Prevention. Pertussis - United State, 1997-2000. JAMA 2002; 287: 977-9. [ Links ]
12 Cofre G, J. Coqueluche en adultos y adolescentes. Rev Chil Infectol 2003; 20 (supl 1): 52-8. [ Links ]
13Organización Panamericana de la Salud. Control de la difteria, la tosferina, el tétanos, la infección por Haemophilus influenzae tipo b y la hepatitis B: guía práctica. Unidad de inmunizaciones de la Organización Panamericana de la Salud. Washington: OPS; 2006. Publicación Científica y Técnica: 604. [ Links ]
14 Ledermann D., W. Breve historia de la Bordetella pertussis, una elusiva damisela. Rev Chil Infectol. 2004; 21: 241- 46. [ Links ]
15 Quevedo, L. Vacunas en pediatría. Segunda edición. Bogotá: Editorial Medica Panamericana; 2004. [ Links ]
16 De Aristegui J, Corretger JM, García F, Hernández T, Moroga F, Gonzalo CR et.al. Manual de vacunas en pediatría. 2a ed. Madrid; 2002. [ Links ]
17 López LA. Pertussis: microbiología y diagnóstico. Publicación técnica Nº 5. México, D. F. Instituto Nacional de Epidemiología; 1991. [ Links ]
18 Friedman RL. Pertussis: the disease and new diagnostic methods. Clin Microbiol Rev 1988; 1: 365-76. [ Links ]
19. Isacson J, Trollfors B, Taranger J, Zackrissson G, Lagergard T. How common is whooping cough in a nonvaccinating country. Pediatric Infect Dis J 1993; 12:284-8. [ Links ]
20 WHO position paper. Pertussis vaccine. Weekly Epidemiological Record 1997; (18): 137- 42. [ Links ]
21 Centers for Disease Control and Prevention. Guidelines for the control of pertussis outbreak. CDC [en línea] 2005 [fecha de acceso 2 noviembre de 2005]. Disponible en: http://www.cdc.gov/nip/publications/pertussis /guide/htm. [ Links ]
22 Organización Panamericana de la Salud. Boletín de Inmunizaciones. OPS [en línea] 2005 agosto [fecha de acceso 2 diciembre de 2005]; 27 (4). Disponible en: http:// www.paho.org/Spanish/AD/FCH/IM/sns2704.pdf. [ Links ]
23 Cherry JD. Historical review of pertussis and the classical vaccine. JDC 1996; 174 (supl 3): S259 - 62. [ Links ]
24 Ministerio de Salud. Informe anual del programa ampliado de inmunizaciones 1993. Bogotá: Ministerio de Salud Bogotá; 1993. [ Links ]
25 Ministerio de Salud. División General de Salud Pública. Sistema Nacional de Vigilancia en Salud Pública. Informe ejecutivo semanal, semana epidemiológica 52, diciembre 26 a enero 1 de 2000. Bogotá: Ministerio de salud; 2000. [ Links ]
26 Morón L. Enfermedades inmunoprevenibles. Vigilancia en salud pública de la tosferina en Colombia 2005. Informe Quincenal Epidemiológico Nacional 2006; 11(6):80-6. [ Links ]
27 Morón L. Enfermedades inmunoprevenibles. Vigilancia en salud pública de la tosferina en Colombia, 2005. Informe Quincenal Epidemiológico Nacional 2006; 11(5):65-6. [ Links ]
28 Varona M, Botero JH, Coy G, Méndez F, López J, Gómez L, Estudio de un brote de tosferina, en la región del Alto Naya Valle del Cauca. Pediatría 1994; 29: 222-27. [ Links ]
29 De la Hoz F, Ortega I, Ramírez A, Cárdenas V. Estudio de un brote de tosferina En Jordán (Santander) Pediatría 1994; 29: 217-21. [ Links ]
30 Jara HJ. Gómez L, Correa G, Cárdenas V. Brote de tosferina, litoral del San Juan, Chocó Octubre de1994 a enero de 1995. Biomédica 1996; 16(sup.1)53-4. [ Links ]
31 Mejía F, Jiménez F, Jarupia JH, Moreno JF, Correa LF, Tabares Z. Brote de tosferina en la comunidad indígena Bebarama, Chocó, junio- julio de 1997 Informe Quincenal Epidemiológico Nacional 1997; 2 (14): 197-203. [ Links ]
32 Ministerio de Salud, División de promoción y prevención. Sistema nacional de vigilancia en salud pública. Informe ejecutivo semanal, Oficina de epidemiologia, semana epidemiológica 4, enero 23 al 29 de 2000. Bogotá: Ministerio de Salud; 2000. [ Links ]
33 Ministerio de Salud, División General de Salud Pública. Sistema nacional de vigilancia en salud pública. Informe ejecutivo semanal, semana epidemiológica 10 marzo 4 al 10 de 2001. Bogotá: Ministerio de Salud; 2001. [ Links ]
34 Trollfors B. Bordetella pertussis whole-cell vaccine efficacy and toxicity. Act Pediatric Scand 1984; 73: 417- 25. [ Links ]
35 Miller E, Ashworth LA, Redhead K. Effect of schedule on reactogenicity and antibody persistence of acellular and whole-cell pertussis vaccines: value of laboratory tests as predictors of clinical performance. Vaccine1997; 15:51-60. [ Links ]
36 Mooi F, Hallander H, Wirsing von Koing C. Epidemiological typing of Bordetella isolates: recommendations for standard methology. Eur. J. Clin. Microbiol. Infect. Dis. 2000; 19:174 - 81. [ Links ]
37 De Moissac YR, Ronald SL, Peppler MS. Use of pulsed-field gel electrophoresis for epidemiological study of Bordetella pertussis in whooping cough outbreak. J. Clin. Microbiol. 1994; 32:402-08. [ Links ]
38 Rodríguez ME, Hellwig SSM, Hozbor D. Fc receptor-mediated immunity against Bordetella pertussis. J Immunol 2001; 167: 6545-51. [ Links ]
39 Hellwig SM, Rodríguez ME, Berbers GAM. Central role of pertactin in immunity against Bordetella pertussis. J Infect Dis 2003; 188: 738-42. [ Links ]
40 Fingermann M, Fernández J, Sisti F, Rodríguez ME, Hozbor D. Bases epidemiológicas y moleculares para la reformulación de una vacuna del calendario nacional de vacunación. [En línea] 2005 [fecha de acceso 3 febrero de2006]. Disponible en la Worl Wide Web: http://www.boletinfarmacos.org/112003/investigaciones092002A. htm. [ Links ]
41 Sanz J, De Ory F. Diagnóstico de laboratorio de tosferina. Papel de la serología. Enferm Infecc Microbiol Clin 2002; 20: 212 - 8. [ Links ]
42 Bejuk J, Begovac J, Bace A, kuzamanovic-Sterk N, Aleraj B. Culture of Bordetella pertussis from three upper respiratory tract specimens. Pediatr Infect Dis J 1995; 12:504-09. [ Links ]
43 Hoppe JE. Update on epidemiology, diagnosis, and treatment of pertussis. Eur J Clin Microbiol Infect Dis; 1996; 15: 189-93. [ Links ]
44 Leedermann D. Walter. Quimioprofilaxis en coqueluche. Rev Chil Infectol 2004; 21: (supl.1): S31-S33. [ Links ]
45 Muñoz N, Gómez L, Agudelo C. La inmunofluorescencia en el diagnóstico de la tosferina: experiencia de un laboratorio de referencia. Biomédica 1997; 17: 34-9. [ Links ]
46 Riffelmann M, Wirsing von Ko¨nig CH, Caro V, and N. Guiso for the Pertussis PCR Consensus Group. Nucleic acid amplification tests for diagnosis of Bordetella infections. J Clin Microb 2005; 43:4925-9. [ Links ]
47 Manual de toma y procesamiento de muestras para el diagnóstico de tosferina. Grupo de Microbiología, Instituto Nacional de Salud. 2003. [ Links ]
48 Farrell DJ, Daggard G, Mukkur TK. Nested duplex PCR to detect Bordetella pertussis and Bordetella parapertussis and its application in diagnosis of pertussis in onmetropolitan Southeast Queensland, Australia. J Clin Microb 1999; 37: 606 -10. [ Links ]
49 Sanz J, De Ory F. Diagnóstico de laboratorio de tosferina. Papel de la serología. Enferm Infecc Microbiol Clin 2002; 20: 212 - 8. [ Links ]
50 Leedermann D. Walter. Quimioprofilaxis en coqueluche. Rev Chil Infectol 2004; 21: (supl.1): S31-S33. [ Links ]
51 Bejuk J, Begovac J, Bace A, kuzamanovic-Sterk N, Aleraj B. Culture of Bordetella pertussis from three upper respiratory tract specimens. Pediatr Infect Dis J 1995; 12:504-09. [ Links ]
52 Hoppe JE. Update on epidemiology, diagnosis, and treatment of pertussis. Eur J Clin Microbiol Infect Dis; 1996 ; 15: 189-93. [ Links ]
53 Muñoz N, Gómez L, Agudelo C. La inmunofluorescencia en el diagnóstico de la tosferina: experiencia de un laboratorio de referencia. Biomédica 1997; 17: 34-9. [ Links ]
54 Riffelmann M, Wirsing von Ko¨nig CH, Caro V, and N. Guiso for the Pertussis PCR Consensus Group. Nucleic acid amplification tests for diagnosis of Bordetella infections. J Clin Microb 2005; 43:4925-9. [ Links ]
55 De Aristegui J, Corretger JM, García F, Hernández T, Moroga F, Gonzalo CR et.al. Manual de vacunas en pediatría. 2a ed. Madrid; 2002. [ Links ]
56 Sapián L, Valdespino J, Salvatierra B, Tapia-Conyer R, Gutiérrez G, Macedo J, Sepúlveda J. Seroepidemilogy of whooping cough in México. Salud Pública Mex 1992; 34: 177-185. [ Links ]














