Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Investigaciones Andina
Print version ISSN 0124-8146
Investig. andina vol.12 no.20 Pereira Apr. 2010
RESISTENCIA Y SENSIBILIDAD A WARFARINA
RESISTANCE AND SENSIBILITY TO WARFARINA
RESISTÊNCIA E SENSIBILIDADE A WARFARINA
Carlos Isaza*, Julieta Henao*, Leonardo Beltrán*
* Grupo de Investigación en Farmacogenética, Facultad de Ciencias de la Salud, Universidad Tecnológica de Pereira, Pereira, Colombia.
Resumen
La warfarina, el anticoagulante oral de mayor prescripción en el mundo, es un fármaco difícil de manejar por su estrecho margen terapéutico, amplia gama de interacciones y gran variabilidad inter-individual en la respuesta. De una cohorte de 145 pacientes en anticoagulación crónica con warfarina reportamos una serie de casos de sensibilidad (dosis ≤ 15 mg/semana) y de resistencia (dosis ≥ 70 mg/ semana) al fármaco y, tras una breve revisión de sus aspectos farmacológicos relevantes, discutimos los posibles factores causantes de estas respuestas exageradas al medicamento.
Palabras clave: warfarina, farmacogenética, CYP2C9, VKORC1, CYP4F2.
Abstract
Warfarin is the most prescribed oral anticoagulant in the world. The handling of this drug is difficult due to it's narrow therapeutic range, wide variety of interactions, and great inter-individual variability in the response. In a cohort of 145 patients prescribed with warfarin, a series of cases of susceptibility (dose≤15 mg/ week) and resistance (doses≥70 mg/week) are reported here. After a brief review of relevant pharmacological aspects, we discuss the possible factors causing these exaggerated responses to the drug.
Keywords: warfarin, pharmacogenetics, CYP2C9, VKORC1, CYP4F2.
Resumo
O warfarina, o anticoagulante oral de maior prescrição no mundo, é um fármaco difícil de manipular por sua estreita margem terapêutica, ampla gama de interações e grande variabilidade inter-individual na resposta. De um corte de 145 pacientes com anticoagulação crônica com warfarina, reportamos una serie de casos de sensibilidade (doses ≤ 15 mg/semana) e de resistência (doses ≥ 70 mg/semana) ao fármaco e, após uma breve revisão de seus aspectos farmacológicos relevantes, discutimos os possíveis fatores causadores destas respostas exageradas ao medicamento.
Palavras chave: warfarina, farmacocinética, CYP2C9, VKORC1, CYP4F2.
Fecha de recibo:Agosto/2009
Fecha aprobación: Enero/2010
Introducción
Desde 1939 se reportaron las propiedades hemorrágicas de derivados coumarínicos presentes en hierbas consumidas por el ganado; pero sólo en 1948 la warfarina (4-hidroxicoumadin) fue introducida al mercado como potente rodenticida. Con estos antecedentes no es difícil entender por qué los médicos fueron inicialmente reacios a reconocer los potenciales terapéuticos de la warfarina y sólo a partir en 1951 se aceptó su uso en humanos para prevenir la enfermedad tromboembólica (1).
Actualmente la warfarina es el anticoagulante oral prescrito mayoritariamente para la prevención y el tratamiento de desórdenes tromboembólicos arteriales y venosos, pese a estar entre los medicamentos asociados con alta incidencia de efectos indeseables; su reacción adversa más común y peligrosa es el sangrado, que puede llegar a ser fatal. Al estrecho margen terapéutico del fármaco se agrega la gran variabilidad interindividual en la respuesta al tratamiento, así como sus numerosas interacciones farmacológicas, factores que se conjugan para hacer de la warfarina un medicamento difícil de manejar, con un importante número de pacientes que oscilan entre el riesgo de sangrado y la insuficiente anticoagulación (2).
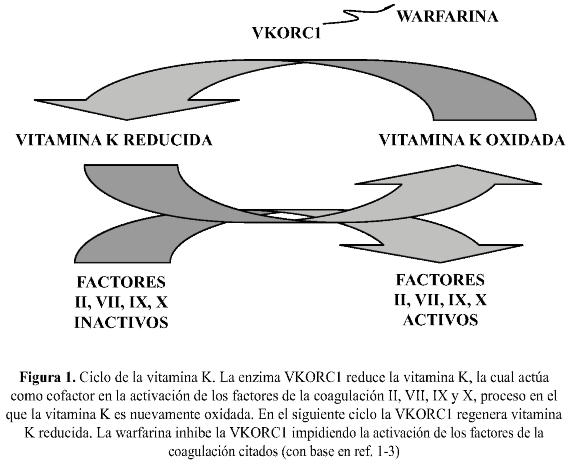
La warfarina inhibe la enzima "complejo 1 de la epóxido reductasa de vitamina K" (VKORC1), impidiendo la activación de los factores de la coagulación II, VII, IX y X, que dependen de la vitamina K reducida. Su efecto anticoagulante tarda unos 4-5 días en instalarse, mientras se agotan estos factores dependientes de lavitamina K y se rompe el llamado "ciclo de la vitamina K" (figura 1) (2).
Los pacientes prescritos con este fármaco se monitorizan con el tiempo de protrombina, expresado como el INR (International Normalized Ratio), el cual mide la actividad de los mencionados factores de coagulación dependientes de la vitamina K. Actualmente existe consenso acerca de que el INR entre 2 y 3 presenta la mejor relación de seguridad/eficacia para la mayoría de las indicaciones clínicas aprobadas con warfarina (fibrilación auricular, accidente cerebro vascular recurrente, trombosis venosa profunda, embolismo pulmonar, cardiomiopatía, enfermedad coronaria) (2).
La dosis requerida para alcanzar un adecuado estado de anticoagulación con warfarina depende de variables como edad, género, Índice de Masa Corporal, contenido alimentario de vitamina K, comorbilidad (como diabetes mellitus, enfermedad coronaria y falla cardíaca) y comedicación con fármacos que inducen o inhiben la farmacocinética de la warfarina, o que alteran la coagulación por otros mecanismos (46). (Figura 1)
En teoría la lista de fármacos capaces de interaccionar con warfarina es enorme y los pacientes deben ser advertidos acerca de agregar o suspender cualquier medicamento, producto herbario o alimento/suplemento alimenticio rico en vitamina K, aunque sólo unas cuantas sustancias han demostrado en forma consistente que son capaces de interferir los efectos de la warfarina en forma clínicamente relevante (4,6,7). Esto significa que las precauciones son muchas pero las contraindicaciones relativamente pocas al momento de co-prescribir warfarina con otros agentes. En muchos casos, cuando se agrega o suspende un medicamento con potencial interacción, basta con monitorizar cuidadosamente el INR y hacer los correspondientes ajustes. Los momentos críticos ocurren cuando se inicia warfarina a un paciente que ya toma otro fármaco con el cual puede haber interacción, o cuando se suspende o agrega el otro fármaco a un paciente con un esquema de dosificación estable de warfarina (8).
En las dosis efectivas individuales de warfarina también inciden factores relacionados con polimorfismos genéticos, en particular de los genes VKORC1 y CYP2C9. La evidencia indica que hasta el 60% de la respuesta farmacológica a los anticoagulantes cumarínicos puede atribuirse a factores genéticos, principalmente a polimorfismos de estos dos genes (9). El gen CYP4F2 hace una pequeña contribución a las dosis de los anticoagulantes coumarínicos, y otros genes (PROC, GGCX, FVII) también parecen importantes en determinados grupos étnicos (10-18).
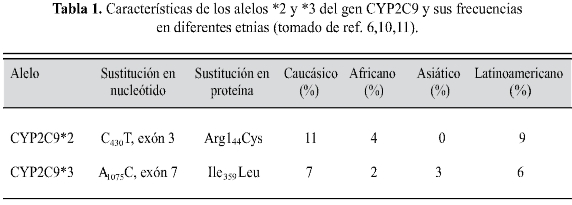
Polimorfismo CYP2C9. Los genes que codifican enzimas metabolizadoras de fármacos exhiben alto grado de polimorfismo y algunos alelos codifican enzimas con actividad catalítica deficiente, normal o excesiva, condición que da origen, respectivamente, a los fenotipos "poor metabolizer" (PM o poco metabolizador), "extensive metabolizer" (EM o extenso metabolizador) y "ultrarapid metabolizer" (UM o metabolizador ultrarrápido) (1). Para el gen CYP2C9 se han reportado más de un centenar de alelos (Kirchheiner), pero sólo las variantes defectuosas CYP2C9*2 y CYP2C9*3 son comunes y las principales responsables del fenotipo metabolizador lento de warfarina prácticamente en todos los grupos étnicos estudiados, aunque las frecuencias con que se presentan dichos alelos varían entre las etnias (tabla 1). Esto se refleja en las llamadas "diferencias inter-étnicas" en la sensibilidad a warfarina: las dosis promedio de warfarina para alcanzar un INR entre 2 y 3 son de 3.4 mg/día en orientales, 5.1 mg/día en caucásicos y 6.1 mg/día en negros; tales hallazgos se correlacionan muy bien con las prevalencias de los alelos de susceptibilidad a la warfarina (6,10,11,19,20).
En la mutación CYP2C9*2 se produce una sustitución 430C>T en el exón 3, lo cual se traduce en un cambio de Arg por C en el aminoácido 144 de la enzima, que decrece su actividad catalítica en 30-50% debido a que la enzima pierde capacidad de interactuar con NADPH durante la reacciones oxidativas (21,22). Por otro lado, el alelo CYP2C9*3 consiste en la sustitución 1075A>C en el exón 7 y el consecuente cambio de Ile por Leu en la posición 359 de la enzima. El alelo 1075C tiene disminuida la afinidad de la enzima CYP2C9 por su sustrato warfarina, con una pérdida estimada de actividad catalítica de la enzima hasta de un 80% (21). (Tabla 1)
Polimorfismo VKORCI. En el ciclo de la vitamina K la enzima VKORC1 se encarga de reducir la epóxido de vitamina K para que pueda reutilizarse (figura 1) (23). El alelo -1639G>A está situado en la región del promotor del gen VKORC1 y se asocia con cambios en su transcripción y en la síntesis de enzima, de tal forma que las personas con el alelo mutado -1639A disponen de menores cantidades de enzima VKORC!, lo que los hace más susceptibles a los efectos anticoagulantes de los antagonistas de la vitamina K. En efecto, la evidencia muestra que dicha variante alélica está asociada con cambios de hasta el 30% en el INR, de tal forma que los pacientes portadores del alelo mu-tado necesitan dosis significativamente menores del anticoagulante para alcanzar un determinado INR, comparados con los portadores del alelo nativo -1639G (18,24).
Polimorfismo CYP4F2. El gen CYP4F2 codifica la enzima vitamina K1 oxidasa, cuya función es degradar la vitamina K1. El polimorfismo 1347C>T (también llamado alelo V433M, porque cambia Val por Met en la posición 433 de la enzima) disminuye la cantidad de enzima disponible y, en consecuencia, los pacientes con el alelo 1347T tienen elevados niveles hepáticos de vitamina K1, por lo que necesitan dosis mayores de warfarina para lograr la misma respuesta anticoagulante de quienes portan el alelo nativo 1347C (25-26). Por ejemplo, se ha reportado que pacientes con los dos alelos TT requieren aproximadamente 1 mg/ día más de warfarina que los pacientes portadores del doble alelo CC (27).
En resumen, debido a la cantidad de variables demográficas, clínicas, farmacológicas y genéticas que determinan la respuesta a warfarina, existe mucha variabilidad inter-individual en las dosis requeridas para alcanzar una condición estable de anticoagulación terapéutica. Si bien la mayoría de pacientes consigue valores de INR entre 2 y 3 con dosis alrededor de los 35 mg/semana (~5 mg/ día), algunos sólo se mantienen en este rango de INR con dosis excesivamente altas o bajas. Las personas con resistencia a warfarina (dosis ≥ 70 mg/sem) o con sensibilidad a warfarina (dosis ≤ 15 mg/sem) constituyen un desafío para el prescriptor, pero también una magnífica oportunidad para explorar e identificar las razones de estas respuestas farmacológicas atípicas. En este estudio nos propusimos identificar los casos de resistencia y sensibilidad a warfarina, en una cohorte de pacientes anticoagulados en forma crónica.
Materiales y métodos
En un estudio encaminado a identificar las variables que más inciden en las dosis de warfarina en pacientes colombianos, para proponer un algoritmo de dosificación del fármaco, reclutamos 145 pacientes mayores de edad y de ambos sexos, en anticoagulación crónica por diferentes condiciones médicas, con INR en el rango 2-3 por lo menos durante los dos meses previos a la incorporación en el estudio. Mediante entrevista personal recogimos datos demográficos y clínicos de los pacientes (género, edad, peso, talla, comorbilidad, indicación y dosis de warfarina, INR, comedicación) y los tipificamos para los genes reportados como más predictivos de las dosis del fármaco: CYP2C9, VKORC1 y CYP4F2. Se excluyeron pacientes con enfermedad hepática, renal y tiroidea no compensada, síndrome de mala absorción, alcoholismo crónico y cáncer. El protocolo fue aprobado desde el punto de vista técnico y bioético por el Comité de Bioética de la Universidad Tecnológica de Pereira
Genotipificación. Previa extracción del DNA genómico de células obtenidas de sangre o mucosa bucal, se procedió a la amplificación de dos fragmentos del gen CYP2C9; tres del gen VKORC1; uno del gen CYP4F2 y uno del gen PROC, en los cuales quedan incluidos los SNPs a ser estudiados. Para la genotipificación se aplicó la técnica de mini-secuenciación o "ddNTP primer extensión" ampliamente descrita en la literatura. La presencia de los polimorfismos fue confirmada por secuenciación directa de muestras
Análisis estadístico. Todos los análisis se hicieron con el software SPSS 15.0 for Window; se utilizó estadística paramétrica.
Resultados
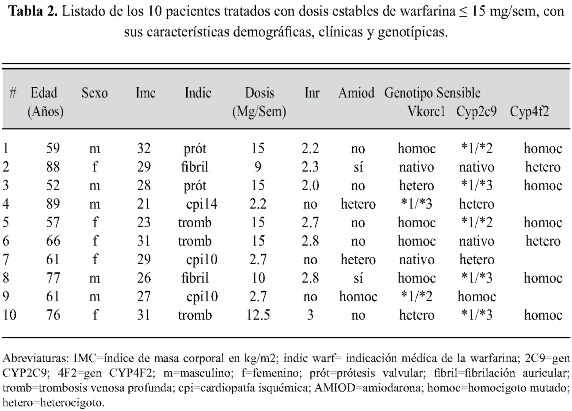
Sensibilidad a warfarina En la tabla 2 se relacionan los 10 pacientes tratados con dosis de warfarina < 15 mg/ sem, con sus respectivas características demográficas, clínicas y genotípicas. El 50% eran mujeres, la edad promedio del grupo fue de 68.6±13 años, su IMC=27.7±3.6 kg/m2 y tomaban una dosis media de warfarina de 12.6±2.5 mg/sem.
Resistencia a warfarina
Caso 1. Mujer de 53 años, con IMC=22.2 kg/m2. Consume 95 mg/sem de warfarina (INR=2.53) debido a un episodio de tromboflebitis profunda y tromboembolismo pulmonar La paciente recibe además carbamazepina para una epilepsia y debido a enfermedad autoinmune. Desde el punto de vista genético la paciente no es portadora de mutaciones implicadas en modificación de la respuesta a warfarina (VKORC1, CYP2C9, CYP4F2).
Caso 2. Mujer de 26 años, con IMC=19.5 kg/m2. Tiene hermanos con historia de eventos trombo-embólicos recurrentes. Debido a un episodio de tromboflebitis profunda secundaria a trombofilia no especificada, la paciente es medicada con 70 mg/sem de warfarina (INR=2.6) más danazol, este último reportado como un agente androgénico que potencia los efectos de la warfarina e incrementa el riesgo de sangrado (28). Adicionalmente esta paciente es homocigota mutada para el alelo -1639G>A, lo que la haría aún más susceptible a warfarina.
Caso 3. Hombre de 47 años, con IMC=20 kg/m2, fumador actual. Consume 70 mg/ sem de warfarina (INR=2.05) debido a prótesis valvular aórtica + fenitoina debido a epilepsia. Su perfil genético corresponde a un homocigoto nativo para los genes asociados con respuesta a warfarina (VKORC1, CYP2C9, CYP4F2).
Discusión
Respecto a las probables causas de la exagerada respuesta a warfarina, encontramos que el 100% de los pacientes tenía entre uno y tres marcadores genéticos de susceptibilidad y dos de ellos recibían además co-tratamiento con amiodarona (tabla 2). En el marco de las interacciones farmacológicas, el antiarrítmico amiodarona aparece en forma consistente como el principal medicamento causante de sensibilidad a warfarina, debido a que es un poderoso inhibidor de enzimas del citocromo P-450, entre ellas la CYP2C9 (29).
Por otro lado, se dice que hay resistencia a warfarina cuando sus requerimientos son iguales o superiores a 70 mg/sem para mantener el INR en el rango terapéutico (30). Una vez descartada la no adherencia al tratamiento, el error de laboratorio, la mala absorción y la ingesta excesiva de vitamina K, deben considerarse los factores hereditarios y las interacciones farmacológicas como los determinantes en las dosis terapéuticas de warfarina. La carbamazepina (caso 1) es potente inductor de la enzima CYP2C9, responsable de la degradación de la S-warfarina (metabolito activo del fármaco), pero además la paciente consume azatioprina, otro fármaco inductor de resistencia a warfarina, por un mecanismo aún no definido y raramente reportado (18,31).
Con relación al caso 2, contrario a lo que podría esperarse de la interacción warfarina-danazol y del genotipo VKORC -1639AA, no le encontramos explicación a la de warfarina-resistencia de esta paciente, pero nos inclinamos a especular que su resistencia al anticoagulante es causada por su trastorno trombofílico de base (32).
En el caso 3 parece evidente que la resistencia a warfarina es provocada por la fenitoina, otro agente inductor de la enzima CYP2C9 metabolizadora de la S-warfarina (2,7).
Agradecimientos
Esta investigación fue financiada por Colciencias, la Universidad Tecnológica de Pereira, Audifarma SA y la Empresa Social del Estado Salud Pereira.
Conflicto de intereses
Los autores declaran que no tienen conflicto de intereses.
REFERENCIAS
1. Majerus PW, Tollefsen DM. Blood coagulation and anticoagulant, thrombolytic, and antiplatelet drugs. In: Brunton LL, Lazo JS, Parker KL, editors. Goodman and Gilman's. The Pharmacological Basis of Therapeutics, 11 ed. International edition, Mc.Graw-Hill; 2006. p.1467-1488. [ Links ]
2. Ansell J, Hirsh J, Hylek E, Jacobson A, Crowther M, Palareti G. Pharmacology and management of the vitamin K antagonists: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines (8th Edition). Chest 2008;133(6 Suppl):160S-198S. [ Links ]
3. Isaza C, Sepúlveda-Arias JC, Henao J. La farmacogenómica en medicina. Colomb Med 2009; 40(3):327-46. [ Links ]
4. Greenblatt DJ, von Moltke LL. Interaction of warfarin with drugs, natural substances, and foods. J Clin Pharmacol 2005; 45(2):127-32. [ Links ]
5. García D, Regan S, Crowther M, Hughes RA, Hylek EM. Warfarin maintenance dosing patterns in clinical practice: implications for safer anticoagulation in the elderly population. Chest 2005; 127(6):2049-56. [ Links ]
6. Rettie AE, Jones JP. Clinical and toxicological relevance of CYP2C9: drug-drug interactions and pharmacogenetics. Annu Rev Pharmacol Toxicol 2005; 45:477- 94. [ Links ]
7. Holbrook AM, Pereira JA, Labiris R, McDonald H, Douketis JD, Crowther M, Wells PS. Systematic overview of warfarin and its drug and food interactions. Arch Intern Med. 2005; 165(10):1095-106. [ Links ]
8. Sweetman SC (editor). Martindale. The complete drug reference. Pharmaceutical Press (London). 34 ed; 2005. [ Links ]
9. Lippi G, Franchini M, Favaloro EJ. Pharmacogenetics of vitamin K antagonists: useful or hype? Clin Chem Lab Med 2009; 47(5):503-15. [ Links ]
10. Kirchheiner J, Brockmoller J. Clinical consequences of cytochrome P450 2C9 polymorphisms. Clin Pharmacol Ther 2005; 77(1):1-16. [ Links ]
11. LLerena A, Dorado P, O'Kirwan F, Jepson R, Licinio J, Wong ML. Lower frequency of CYP2C9*2 in Mexican-Americans compared to Spaniards. Pharmacogenomics J 2004; 4(6):403-6. [ Links ]
12. Sconce EA, Khan TI, Wynne HA, Avery P, Monkhouse L, King BP, Wood P, et al. The impact of CYP2C9 and VKORC1 genetic polymorphism and patient characteristics upon warfarin dose requirements: proposal for a new dosing regimen. Blood 2005; 106(7):2329-33. [ Links ]
13. Wadelius M, Chen LY, Eriksson N, Bumpstead S, Ghori J, Wadelius C, Bentley D, et al. Association of warfarin dose with genes involved in its action and metabolism. Hum Genet. 2007; 121(1):23-34. [ Links ]
14. Lindh JD, Holm L, Andersson ML, Rane A. Influence of CYP2C9 genotype on warfarin dose requirements-a systematic review and meta-analysis. Eur J Clin Pharmacol 2009; 65(4):365-75. [ Links ]
15. Takeuchi F, McGinnis R, Bourgeois S, Barnes C, Eriksson N, Soranzo N, Whittaker P, et al. A genome-wide association study confirms VKORC1, CYP2C9, and CYP4F2 as principal genetic determinants of warfarin dose. PLoS Genet. 2009; 5(3):e1000433. [ Links ]
16. Kimura R, Miyashita K, Kokubo Y, Akaiwa Y, Otsubo R, Nagatsuka K, Otsuki T, et al. Genotypes of vitamin K epoxide reductase, gamma-glutamyl carboxylase, and cytochrome P450 2C9 as determinants of daily warfarin dose in Japanese patients. Thromb Res 2007; 120(2):181-6. [ Links ]
17. Fuchshuber-Moraes M, Perini JA, RosskopfD, Suarez-Kurtz G. Exploring warfarin pharmacogenomics with the extreme-discordant-phenotype methodology: imxact of FVII polymorphisms on stable anticoagulation with warfarin. Eur J Clin Pharmacol 2009; 65(8):789-93. [ Links ]
18. Wadelius M, Chen LY, Lindh JD, Eriksson N, Ghori MJ, Bumpstead S, Holm L, et al. The largest prospective warfarin-treated cohort supports genetic forecasting. Blood 2009; 113(4):784-92. [ Links ]
19. Dang MT, Hambleton J, Kayser SR. The influence of ethnicity on warfarin dosage requirement. Ann Pharmacother 2005; 39(6):1008-12. [ Links ]
20. Johnson JA. Ethnic differences in cardiovascular drug response: potential contribution of pharmacogenetics. Circulation 2008; 118:1383-93. [ Links ]
21. Schelleman H, Limdi NA, Kimmel SE. Ethnic differences in warfarin maintenance dose requirement and its relationship with genetics. Pharmacogenomics 2008; 9(9):1331-46. [ Links ]
22. D'Andrea G, D'Ambrosio R, Margaglione M. Oral anticoagulants: Pharmacogenetics Relationship between genetic and non-genetic factors. Blood Rev 2008; 22(3):127-40. [ Links ]
23. Garcia AA, Reitsma PH. VKORC1 and the vitamin K cycle. Vitam Horm 2008; 78:23-33. [ Links ]
24. Yuan HY, Chen JJ, Lee MT, Wung JC, Chen YF, Charng MJ, et al. A novel functional VKORC1 promoter polymorphism is associated with inter-individual and inter-ethnic differences in warfarin sensitivity. Hum Mol Genet 2005; 14(13):1745-51. [ Links ]
25. McDonald MG, Rieder MJ, Nakano M, Hsia CK, Rettie AE. CYP4F2 is a vitamin K1 oxidase: An explanation for altered warfarin dose in carriers of the V433M variant. Mol Pharmacol 2009; 75(6):1337-46. [ Links ]
26. Pérez-Andreu V, Roldán V, Antón AI, García-Barberá N, Corral J, Vicente V, González-Conejero R. Pharmacogenetic relevance of CYP4F2 V433M polymorphism on acenocoumarol therapy. Blood 2009; 113(20):4977-9. [ Links ]
27. Caldwell MD, Awad T, Johnson JA, Gage BF, Falkowski M, Gardina P, Hubbard J, et al. CYP4F2 genetic variant alters required warfarin dose. Blood 2008;111(8):4106-12. [ Links ]
28. Meeks ML, Mahaffey KW, Katz MD. Danazol increases the anticoagulant effect of warfarin. Ann Pharmacother 1992; 26(5):641-2. [ Links ]
29. Schulman S, El Bouazzaoui B, Eikelboom JW, Zondag M. Clinical factors influencing the sensitivity to warfarin when restarted after surgery. J Intern Med 2008; 263(4):412-9. [ Links ]
30. Sinxadi P, Blockman M. Warfarin resistance. Cardiovasc J Afr 2008; 19 (4):215- 7. [ Links ]
31. Vazquez SR, Rondina MT, Pendleton RC. Azathioprine-induced warfarin resistance. Ann Pharmacother 2008; 42(7):1118-23. [ Links ]
32. Santamaria MG, Agnelli G, Taliani MR, Prandoni P, Moia M, Bazzan M, Guazzaloca G, et al. Thrombophilic abnormalities and recurrence of venous thromboembolism in patients treated with standardized anticoagulant treatment. Thromb Res 2005; 116(4):301-6. [ Links ]