Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Investigaciones Andina
Print version ISSN 0124-8146
Investig. andina vol.12 no.21 Pereira Sept. 2010
SOPORTE NUTRICIONAL EN ENFERMEDAD PULMONAR: UNA REVISIÓN SISTEMÁTICA
PARENTERAL NUTRITION IN CHRONIC OBSTRUCTIVE PULMONARY DISEASE
SUPORTE NUTRICIONAL EM ENFERMIDADE PULMONAR: UMA REVISÃO SISTEMÁTICA
Rodolfo A. Cobróles Vega - MD*
* Especialista en Cirugía General. Instructor Nacional TNT Coordinador GSMN Hospital Universitario San Jorge de Pereira. Profesor Asociado Programa de Medicina Universidad Tecnológica de Pereira. Envío de correspondencia: rocabster@gmail.com
Resumen
Introducción: los pacientes con enfermedad pulmonar aguda (Síndrome de Dificultad Respiratoria Aguda -SDRA/ Lesión Pulmona Aguda-LPA) o crónica (Enfermedad Pulmonar Obstructiva Crónica- EPOC), presentan una importante alteración de su estado nutricional. La pérdida de peso tiene un efecto negativo en el curso clínico de estos pacientes. Las causas incluyen un disbalance energético, un incremento en las citoquinas, hipoxia y uso de glucocorticoides. El soporte nutricional está usualmente indicado como terapéutica o como apoyo en el tratamiento.
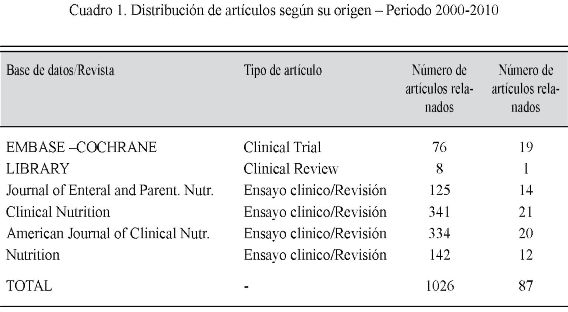
Métodos: ésta es una revisión sistemática de literatura que consultó 1.026 números y seleccionó 87 artículos por su calidad y pertinencia.
Resultados: se han propuesto diversas fórmulas de Nutrición Enteral (NE) y parenteral (NP) para contrarrestar los efectos adversos relacionados con el incremento en las demandas de ventilación mecánica de los pacientes alimentados con fórmulas estándar con altos contenidos de carbohidratos. Sin embargo, el uso de fórmulas especiales en pacientes con enfermedad pulmonar sigue siendo objeto de controversia.
Conclusión: esta revisión sistemática tuvo como propósito mostrar los principales factores asociados con la malnutrición en las enfermedades pulmonares y examinar objetivamente el uso de las fórmulas de nutrición enteral y parenteral en enfermedad pulmonar aguda y crónica. Incluye los estudios que evalúan la eficacia de estas fórmulas y aporta recomendaciones básicas para su uso en enfermedades pulmonares específicas.
Palabras clave: síndrome de dificultad respiratoria del adulto (SDRA); lesión pulmonar aguda (LPA); enfermedad pulmonar obstructiva crónica (EPOC); nutrición enteral, nutrición parenteral, ácidos grasos poliinsaturados omega 3
Abstract
Introduction: the potential for altered nutritional status in critically ill patients with either acute (Acute Respiratory Distress Syndrome-ARDS/Acute Lung Injury-ALI) or chronic pulmonary disease (Chronic Obstructive Pulmonary Disease) is significant. Weight loss in patients with chronic obstructive pulmonary disease has a negative effect on the clinical course of the patient. Causes of weight loss in this population are known to include effects of an energy imbalance, increased cytokines, hypoxia, and glucocorticoid use. Nutritional support is often indicated as a treatment modality.
Methods: we searched 1026 articles and was selected 87 articles.
Results: several enteral and parenteral formulas (EN-PN) have been suggested to help counteract the possible adverse respiratory effects associated with a standard formula with higher carbohydrates content to reduce ventilator demand of the patients. However, the use of these specialized enteral formulas in individuals with pulmonary disease remains controversial.
Conclusion: the purposes of this systematic review was to synthesize the factors associated with malnutrition in pulmonary diseases and to evaluate the rationale for use of modified parenteral and enteral formulas in both chronic and acute pulmonary disease. This paper includes the available studies evaluating the efficacy of these formulas, and provides overall recommendations for the use of specialized formulas in individuals with pulmonary disease.
Keywords: acute respiratory distress syndrome, acute lung injury, chronic obstructive pulmonary disease, enteral nutrition, parenteral nutrition, omega-3 fatty acids
Resumo
Introdução: os pacientes com enfermidade pulmonar aguda (Síndrome de Dificuldade Respiratória Aguda -SDRA/ Lesão Pulmonar Aguda -LPA) ou crônica (Enfermidade Pulmonar Obstrutiva Crônica- EPOC), apresentam uma importante alteração de seu estado nutricional. A perda de peso tem um efeito negativo no curso clínico destes pacientes. As causas incluem um desequilíbrio energético, um incremento nas citoquimicas, hipoxia e uso de glucocorticoides. O suporte nutricional está usualmente indicado como terapêutico ou como apoio no tratamento.
Métodos: este é uma revisão sistemática da literatura que consultou 1026 números e selecionou 87 artigos por sua qualidade e pertinência.
Resultados: têm-se proposto diversasfórmulas de Nutrição Enteral (NE) e parenteral (NP) para contra restar os resultados adversos relacionados ao incremento nas demandas de ventilação mecânica dos pacientes alimentados com fórmulas uniformes com altos conteúdos de carboidratos. Mas o uso de fórmulas especiais em pacientes com doenças pulmonar segue sendo objeto de controvérsia.
Conclusão: esta revisão sistemática teve como propósito mostrar os principais fatores associados à má nutrição nas enfermidades pulmonares e examinar objetivamente o uso das fórmulas de nutrição enteral e parenteral em enfermidades pulmonares agudas e crônicas. Inclui estudos que avaliam a eficácia destas fórmulas e traz recomendações básicas para seu uso em enfermidades pulmonares específicas.
Palavras chave: síndrome de dificuldade respiratória do adulto (SDRA); lesão pulmonar aguda (LPA); enfermidade pulmonar obstrutiva crônica (EPOC); nutrição enteral, nutrição parenteral, ácidos grassos poliinsaturados omega 3
Fecha de recibo: Febrero/2010
Fecha aprobación: Agosto/2010
Introducción
La enfermedad pulmonar obstructiva crónica y la falla respiratoria constituyen patologías de alta prevalencia en los centros hospitalarios de Colombia y del mundo. Su presentación aguda o crónica reagudizada implica entre otras consecuencias prolongadas estancias hospitalarias, y en Unidades de Cuidado Intensivo (UCI) tiempos largos de dependencia al ventilador, en resumen, una alta morbilidad y mortalidad, así como enormes costos hospitalarios.
Adicionalmente, muchos de estos pacientes cursan con pobres estados nutricionales que influyen negativamente en todas las variables antes mencionadas.
Pese a los importantes avances de los últimos años, algunos aspectos de la terapia nutricional en pacientes con Enfermedad Pulmonar Obstructiva Crónica (EPOC), Lesión Pulmonar Aguda/Sindrome de Dificultad Respiratoria del Adulto (LPA/ SDRA) permanecen sin respuesta clara. A pesar de las investigaciones realizadas, existen serias controversias en lo que respecta al tipo de nutriente ideal, la ruta de administración, la clase de mezcla y sus reales ventajas, principalmente en términos de la disminución en la morbilidad, la mortalidad, la estancia en UCI y el tiempo de uso del ventilador.
La presente revisión pretende mostrar los más importantes avances en este campo y proponer, a la luz de la medicina basada en la evidencia, algunas recomendaciones sobre el manejo nutricional de este grupo de pacientes.
Método
Se realizó una búsqueda en las siguientes bases de datos: OVID (Full Text) (20002010), SCIENCE DIRECT (20002010), MEDLINE vía PubMed (20002010), Cochrane Central Register of Controlled Trials (2000-Abril de 2010) and ClinicalTrials.gov (2000-2010).
Adicionalmente se revisaron las revistas especializadas: Journal of Parenteral and Enteral Nutrition, Nutrition and Clinical Practice, American Journal of Clinical Nutrition, Clinical Nutrition y Nutrition, durante el mísmo período con el fin de soportar conceptualmente la fisiopatología y las implicaciones nutricionales del paciente con EPOC o LPA/SDRA.
Se incluyeron solo estudios controlados aleatorizados (ERCT), estudios antes-después de tratamiento (pre-post) y metaanálisis referidos exclusivamente a la relación terapia nutricional: enfermedad pulmonar aguda (LPA/SDRA) o crónica (EPOC).
La estrategia de búsqueda incluyó los siguientes términos MESH: LUNG DISEASE, PULMONARY DISEASE, ACUTE LUNG INJURY, CHRONIC OBSTRUCTIVE PULMONAR DISEASE, ACUTE RESPIRATORY DISTRESS SYNDROME combinado con el operador booleano AND a los términos MESH: NUTRITION, NUTRITIONAL SUPPORT, ENTERAL NUTRITION, PARENTERAL NUTRITION, CRITICAL CARE.
La etapa de selección arrojó un total de 1026 artículos relacionados, de los cuales 87 cumplieron los requisitos de inclusión. (Cuadro 1)
Basado en estos hallazgos se presentan una serie de recomendaciones clínicas respecto al soporte nutricional en el grupo de pacientes con enfermedad pulmonar aguda o crónica.
Enfermedad pulmonar y desnutrición
La magnitud del problema de la desnutrición en el paciente hospitalizado quedó evidenciado en el estudio publicado por Nutrition en el 2003. Los resultados muestran que uno de cada dos pacientes hospitalizados por cualquier causa presenta desnutrición, siendo de moderada a severa hasta en el 50% de la población de estudio (1).
La Enfermedad Pulmonar Obstructiva Crónica (EPOC) es una causa frecuente de hospitalización en muchos centros de atención del mundo. La desnutrición puede llegar al 60% para los pacientes hospitalizados y oscilar entre el 25 y el 65% para los pacientes ambulatorios. Datos del Instituto Nacional de Salud de Estados Unidos reportan que cerca del 10% de los americanos mayores de 45 años padecen de esta enfermedad y se constituye en la cuarta causa de muerte.
En cifras netas, aproximadamente 14 millones de personas tienen EPOC, 12.5 millones cursan con bronquitis crónica y casi 2 millones padecen de enfisema. Globalmente el EPOC se convierte en la duodécima enfermedad del mundo con mayor prevalencia, y se proyecta hacia el quinto lugar en la prevalencia y el tercero en mortalidad, hacia el año 2020 (2).
Adicionalmente, la pérdida de peso y la malnutrición proteico-calórica son aspectos prominentes de los pacientes con EPOC, especialmente en el grupo con enfisema. Las reservas pulmonares se agravan con la pérdida progresiva de peso, al punto que el volumen espiratorio forzado en un segundo (VEF-1) puede estar hasta en un 35% por debajo de lo predicho. Esta fatiga respiratoria se manifiesta en forma de disnea, infecciones respiratorias frecuentes y disminución en la función de los músculos principales y accesorios respiratorios (3,4,5).
Esta asociación desnutrición-EPOC es letal. El bajo peso y la pérdida importante de masa magra se encuentran asociadas a un pobre pronóstico. La supervivencia de un paciente con EPOC asociada a caquexia y FEV1 <50% es aproximadamente de 2-4 años (Evidencia tipo IIb) (6).
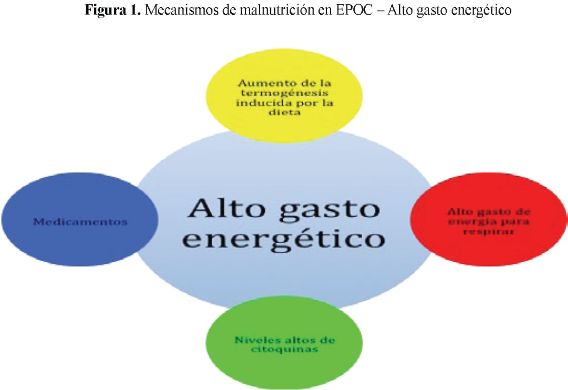
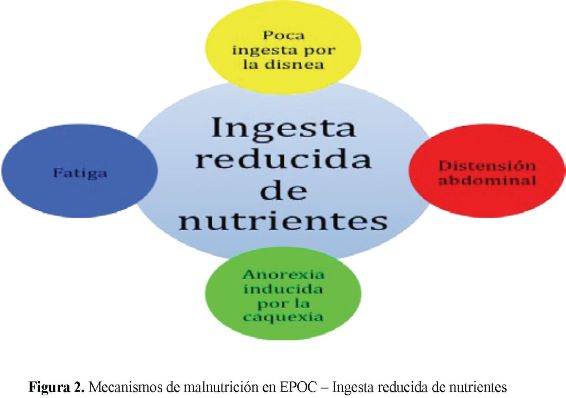
El esfuerzo respiratorio se traduce en un hipermetabolismo agravado por el gasto energético basal elevado, la ingesta insuficiente de nutrientes y el ineficiente uso de los sustratos energéticos. (Figuras 1 y 2)
El carácter inflamatorio que ahora se le reconoce a la enfermedad explica algunos de los cambios bioquímicos de los pacientes con EPOC. Se destacan una disminución de las enzimas oxidativas y caída en los insumos necesarios para el ciclo de Krebs (7).
Existe un aumento en la producción de las citoquinas y su actividad catabólica. Por ejemplo, en pacientes con enfisema se aprecia una reducción en la síntesis de proteína y aumento en su tasa de degradación a nivel muscular tal y como ocurrre cuando se administra Factor de Necrosis Tumoral (FNT-a) a miocitos in vitro.8 Además de esta citoquina, se observan aumentos en el factor soluble (sFNT-R 55 y sFNT-R75) y en la interleukina-6, entre otros. La hipoxia crónica de los pacientes con enfisema también incrementa los niveles de interleucina-1B y de FNT-a a nivel del macrófago alveolar.
Adicional a la astenia que induce la desnutrición, los pacientes con EPOC cursan con pobre tolerancia al ejercicio secundaria a la obstrucción al flujo de aire, al deterioro de la mecánica pulmonar y a la disfunción muscular, secundaria al bajo aporte de oxígeno (9, 10).
Es previsible que, el grupo de pacientes con EPOC exacerbado, tienda a presentar mayor pérdida de peso, en una espiral de deterioro que puede conllevar a la muerte (11).
La disnea crónica también contribuye en forma indirecta a la desnutrición, porque induce ingestión involuntaria de aire al estómago e impide la masticación y la deglución. El uso crónico de esteroides o de medicamentos P2 agonistas, ambos agentes hipercatabólicos, contribuyen a agravar aún más el problema. Esa catabolia de los glucocorticoides se explica en un aumento de la proteólisis y en una inhibición de la síntesis y transporte de los aminoácidos en la célula muscular. Un mecanismo sinérgico con la acidosis y la malnutrición, que contribuyen a una degradación mayor de la proteína muscular (12).
En resumen, el paciente con EPOC es un paciente desnutrido. Ello significa una alteración en una importante serie de eventos metabólicos íntimamente relacionados, entre los cuales se destacan: la interacción de células inmunes y fagocitos; la liberación de poderosas citoquinas que comprometen el uso de los sustratos nutricionales; la evocación de una respuesta inmune específica, secundaria a la exposición del antígeno por parte del macrófago al linfocito; la supresión de la lipoproteinlipasa del adipocito y la desaparición de la ingesta de alimento a nivel central.
Soporte Nutricional en EPOC
Mallampalli publicó una completa revisión sobre este tópico en la revista Nutrition in Clinical Practice en el 2004 (13). Los resultados mostrados permiten inferir que aunque es claro que la desnutrición aumenta la morbilidad en EPOC, la instauración de regímenes nutricionales agresivos no se traduce en una mejoría en el pronóstico final (14).
Ferreira, Lacasse y cols. revisaron la evidencia existente sobre los reales beneficios de una suplementación nutricional en pacientes con EPOC estables. Se tuvieron en cuenta 14 estudios (487 pacientes). El efecto del soporte nutricional fue pequeño. Con la excepción de dos estudios (15,16), en general no se demostró efecto benéfico sobre las medidas antropométricas ni sobre la función pulmonar o la capacidad para el ejercicio (17).
Las fórmulas enriquecidas con ácidos grasos poliinsaturados (del grupo co-3) han mostrado su efectividad en pacientes estables con EPOC. Su uso prolongado produce mejorías en parámetros clínicos y de laboratorio, tales como el test de disnea al ejercicio y la disminución de citoquinas del tipo Leucotrieno B4, FNT-a e interleuquina-8 en esputo, respectivamente (18).
Lo anterior se podría explicar de la siguiente manera: Un individuo normal requiere en promedio 25 a 30 calorías por kilo por día. Es evidente que una disminución en el aporte calórico diario tendrá efectos en las funciones corporales, entre ellas, la pulmonar. Si a una persona sana se la somete en forma voluntaria a una restricción calórica severa (menos de 500 calorías al día), este régimen hipocalórico se traduce en disminución del volumen minuto y en una caída de la respuesta compensatoria a la hipoxia.
En forma crónica, la restricción calórica produce pérdida de la masa muscular, alteraciones de la función y movilidad del diafragma y de los músculos accesorios de la respiración. Adicionalmente, el trabajo respiratorio se incrementa en promedio diez veces más por efectos de la disnea. La desnutrición conlleva disminución de las proteínas séricas pulmonares, alteraciones en la tensión superficial intraalveolar y efectos deletéreos en la síntesis y degradación del surfactante pulmonar, lo cual se traduce en una mayor dificultad para la movilización de secreciones y en un aumento secundario de la probabilidad de infección (19.
Basados en la anterior argumentación, la opción terapéutica más lógica sería la de aumentar la cantidad de nutrientes como una manera de contrarrestar los nocivos efectos de la desnutrición sobre el sistema respiratorio. Sin embargo, esta iniciativa puede acarrear otros problemas, el mayor de los cuales se resume en el aumento de la producción final de dióxido de carbono, que, a su vez, implica un aumento en el aporte calórico mediado por carbohidratos. Este incremento en el dióxido de carbono debe ser excretado por vía aérea, lo que conlleva un incremento en el trabajo respiratorio de un paciente con una limitada función pulmonar.
Y es que cada uno de los tres macronutrientes utiliza una cantidad definida de oxígeno y produce un total definido de dióxido de carbono. La división produce lo que se conoce como cociente respiratorio. Los carbohidratos tiene el RQ más alto y las grasas el menor.
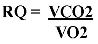
El efecto de la ingesta de carbohidratos en el paciente con EPOC fue estudiado por Talpers y cols. Cuando se comparó la producción de dióxido de carbono en pacientes con fórmulas fijas 60: 20 (60% de carbohidratos y 20% de grasa) Vs. pacientes con fórmulas isocalóricas variables (porcentaje de carbohidratos que oscilaron entre 45% y 75% del gasto calórico total) se halló que la producción de dióxido de carbono era directamente proporcional al incremento en las calorías (por encima del 50% de los requerimientos basales) lo cual permite concluir que más que modificar el porcentaje de los macronutrientes en la dieta, lo que importa es evitar el exceso de calorías no proteicas.
En resumen, un objetivo racional para instaurar terapia nutricional en pacientes con EPOC, es calcular el Gasto Energético Basal (GEB) e incrementar no más de un 30% adicional al gasto calculado. En cuanto al aporte proteico aunque no existe consenso en la literatura, es probable que cálculos que oscilen alrededor de 1.5 gramos/kilogramo/día, sean razonablemente seguros.
Sobre el uso de fórmulas específicas en EPOC, las revisiones objeto de este artículo tuvieron en cuenta al menos dos variables: la condición general del paciente (ambulatorio u hospitalizado) y su estado nutricional. Los resultados de estudios no controlados sugieren que la relación lípido-carbohidrato afecta la producción de CO2, pero solamente en pacientes sobrealimentados en Unidad de Cuidados Intensivos (UCI) y a la producción de CO2 y lipogénesis secundaria inducida por el exceso del aporte calórico (20).
En pacientes ambulatorios estables, se compararon fórmulas orales ricas en grasa (55.2% grasa, 28.1% carbohidratos) con fórmulas a expensas de carbohidratos (31.5% grasa, 54.5% carbohidratos). A diferencia de los pacientes control y de aquellos que recibieron la fórmula hipergrasa, los pacientes que tomaron alta carga de carbohidratos experimentaron mayores consumos de oxígeno, mayor producción de CO2, incrementos en el RQ y tiempos mayores de ventilación-minuto (21).
Adicionalmente los estudios aciertan al demostrar un efecto benéfico de los suplementos orales ricos en grasa, en aquellos pacientes con EPOC y desnutrición, principalmente enparámetros como el RQ, VCO2, VO2 y el volumen espiratorio forzado (22,23).
Desde la década de los 80, se han publicado diferentes estudios que evalúan el papel de las fórmulas hipergrasas para facilitar el destete del ventilador en el grupo de pacientes con EPOC que se encuentran hospitalizados. La mayoría de los resultados obtenidos reportan una reducción en los tiempos de ventilador del grupo de estudio, al compararlos con pacientes que recibieron fórmula estándar debido a una disminución del RQ (24).
Sin embargo, más que la constitución misma de la fórmula, lo importante es evitar el exceso de calorías. Se resalta el efecto sobre el RQ y los aumentos proporcionales en el VCO2 con algunas desventajas, entre las que se destacan: el retardo en el vaciamiento gástrico y el alto costo de la fórmula.
Pese a que aún no existe consenso en el porcentaje de grasa ideal de la fórmula enteral, la ruta de administración genera menos controversia. Como son pacientes con alto riesgo de padecer eventos de broncoaspiración, (25) la ruta pospilórica parece ser la elección. Sin embargo, reportes recientes sugieren que la ruta intragástrica es segura y bien tolerada. La suspensión de la nutrición enteral debido a la presencia repetida de altos residuos gástricos, es una razón suficiente para cambiar a una ruta pospilórica. Adicionalmente la elección de la ruta será considerada por el equipo de trabajo, como la adherencia a protocolos específicos institucionales (26, 27).
Soporte nutricional en LpA/SDRA
A pesar de haber sido descrita desde 1967, los criterios diagnósticos del Síndrome de Dificultad Respiratoria del Adulto (SDRA) sólo fueron establecidos hasta 1994. De lo anterior podría inferirse el carácter polimórfico de la enfermedad y su etiología variada. Independiente de la definición de SDRA que se utilice, el cuadro incluye a la Lesión Pulmonar Aguda (LPA) como una forma más precoz y menos grave de una enfermedad que, en pleno desarrollo, puede constituirse en la forma clínica más severa de falla respiratoria hipoxémica.
La incidencia de LPA/SDRA en Estados Unidos oscila entre 56 y 82 casos por 100.000 personas/año. En Norteamérica y Europa, la sepsis severa (de origen pulmonar o extrapulmonar), se constituye en el evento precedente en la aparición de LPA/SDRA (28).
Pese al alto perfil de morbimortalidad que conlleva (30% a 40%), (29) cercano al de enfermedades como el cáncer de seno y el complejo VIH/SIDA (30), la etiología del evento LPA/SDRA permanece oscura. Su tratamiento, por lo tanto, sólo está dirigido a brindar el soporte ventilatorio y no ventilatorio que, de otra manera, conllevaría a la muerte.
El soporte nutricional en SDRA tiene un importante espacio dentro de la terapia, porque muchos de estos pacientes presentan ayuno prolongado (entre 5 y 10 días) agravado por el estado hipermetabólico generado por el SDRA.
Explicado como un fenómeno de carácter inflamatorio, es decir, como una respuesta inflamatoria de carácter agudo que ocasiona daño a las células endoteliales y epiteliales, alteraciones del complejo alveolo-capilar y edema pulmonar secundario, (31, 32, 33) los últimos 15 años de investigación en nutrición han introducido fármaconutrientes con un efecto potencial como moduladores de la cascada inflamatoria característica de esta patología. Específicamente se han estudiado las fórmulas enterales con alta proporción de Ácidos Grasos ω-3 (PUFA ω-3).
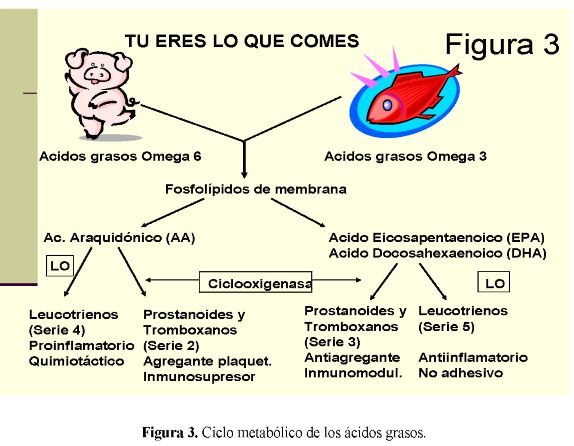
La Figura 3 presenta en forma resumida el ciclo metabólico de los ácidos grasos en atención a su origen y estructura química. Los peces de agua fría (v.g sardinas, atún) son ricos en ácido eicosapentaenoico (EPA) y en ácido docosahexaenoico (DHA), metabolitos activos del ácido alfa linolénico (ALA). Esta alta relación EPA/DHA es el resultado de la ingesta de alimentos ricos en fitoplancton presentes en su cadena alimenticia. Aunque el plancton marino puede ser metabolizado en forma eficiente de ALA a EPA y DHA por la vía de las desaturasas, los seres humanos tienen una limitada capacidad para sintetizar EPA y DHA en condiciones basales (sólo el 8% de la dieta es metabolizado) lo cual los hace necesarios en la dieta y fundamentales en la suplementación de pacientes en estado crítico (34).
En presencia de SDRA, la síntesis de ácidos grasos se deriva, vía Ácido Araquidónico (AA), hacia la producción de leucotrienos de la serie 4 y prostanoides de la serie 2, con claros efectos proinflamatorios e inmunosupresores.
Específicamente se forman prostanoides de la serie 2 (v.g. tromboxano A2, prostaglandina E2) con actividad proinflamatoria, al promover la incorporación plaquetaria, la trombosis microvascular y la producción de otras citoquinas inflamatorias. La PGE2 tiene actividad proinflamatoria e inmunosupresora, induce fiebre, incrementa la permeabilidad vascular y suprime la proliferación de linfocitos T. Adicionalmente, el metabolismo del AA por parte de la 5-lipooxigenasa incrementa la producción de leucotrienos de la serie 4, los cuales también tienen actividades proinflamatorias (35).
De otra parte, el metabolismo de EPA y DHA por las mismas enzimas forma prostanoides y leucotrienos de las series 3 y 5 respectivamente, entre ellos el tromboxano A3, la prostaglandina E3 y el leucotrieno B5. Sus principales acciones son de tipo antiinflamatorio al inhibir la agregación plaquetaria, la quimiotaxis y la adhesión celular (36). (Figura 3)
Por lo anterior, es previsible dado este carácter inflamatorio, que su modulación puede afectar favorablemente el pronóstico de SDRA. Surgen así los inmunonutrientes, con una actividad antinflamatoria y utilidad en aquel grupo de patologías en las cuales el componente inflamatorio sea crucial (37).
Ahora se sabe que la relación de los lípidos ω6:ω3 de la dieta, tiene la potencial capacidad de influenciar la respuesta inmune (38).
En el grupo de las fórmulas especializadas, aquellas que contienen predomino de ácidos grasos poliinsaturados ω-3 (PUFAs ω-3), son probablemente los más importantes y estudiados. Una fórmula que contenga una mezcla específica de lípidos con altas fuentes de ácido γ-linolénico (GLA; 18:3 n-6) y de ácido eicosapentaenoico (EPA; 20:5 n-3) puede revertir la tendencia inflamatoria en SDRA, al incrementar la producción de prostaglandinas de la serie 1 y leucotrienos de la serie 5 cuyos metabolitos están asociados a un estado antiinflamatorio y vasodilatador. Adicionalmente estas fórmulas contienen altas cantidades de α-tocoferol, β caroteno, ácido ascórbico y antioxidantes que pueden tener un papel benéfico en el curso de una SDRA (39).
Los resultados de los diferentes estudios de aplicación de fórmulas enterales especializadas para pacientes pulmonares son controvertidos. Aunque en algunos parámetros se aprecia una clara mejoría, la mayoría de ellos no acierta a demostrar una disminución notable en la mortalidad, lo cual al compararlo con los costos que ocasiona su uso, hace cuestionable su indicación y masificación. Es probable que una formula densa (1.5 - 2.0 Kcal/ ml) deba ser considerada en aquellos pacientes que requieran restricción en la ingesta de líquidos (40).
Los datos preclínicos demuestran efectos positivos del uso de EPA y GLA sobre la producción de mediadores inflamatorios, el intercambio gaseoso y el transporte de oxígeno. Específicamente los estudios de SDRA inducida por endotoxinas en murinos, muestran importantes diferencias en la población alimentada con aceite de maíz, en comparación con aquella sometida a dietas ricas en EPA y GLA. En el primer grupo se apreció un incremento más temprano y prolongado en la permeabilidad pulmonar y en la aparición de hipotensión. El efecto benéfico observado en la dieta suplementada, muy posiblemente se debió a la disminución de mediadores proinflamatorios dependientes del AA tales como leucotrienos de la serie 4 (LTB4), tromboxanos de la serie 2 (TXB2) y Prostaglandina E2 (PGE2). 41, 42
Estudios en humanos muestran por su parte, una mejoría significativa en los parámetros de ventilación, disminución del número de días de soporte ventilatorio y de estancia en Unidad de Cuidados Intensivos (UCI). (43,44). Los pacientes con SDRA que recibieron EPA más GLA presentaron un incremento en la oxigenación arterial (PaO2/FIO2) y una disminución significativa en el número de neutrófilos en fluido bronquial, al compararlos con el grupo sometido a fórmula estándar. Incluso se ha llegado a demostrar un efecto preventivo en la formación de nuevas úlceras de decúbito en pacientes con LPA. (45).
Pontes-Arruda y cols. en Brasil, demostraron efectos benéficos de una dieta enteral enriquecida con EPA y GLA más antioxidantes, en pacientes con sepsis severa y choque séptico sometidos a ventilación mecánica. En efecto, al compararlos con una dieta isonitrógena, los pacientes sometidos a la fórmula especial presentaron una reducción del 19.4% en la mortalidad (p=.037). Además tuvieron mejores parámetros ventilatorios, un mayor número de días libres de ventilador (13.4 vs 5.8 p< .001), mayor número de días fuera de UCI (10.8 vs 4.6 p< .001) y menor desarrollo de SDOM (46). Singer y col. revisaron la evidencia y registran beneficios similares a los de Pontes-Arruda y cols. pero también advierten pocos beneficios e incluso riesgos de su uso en otro grupo de pacientes críticos en UCI (47,48).
La única revisión sistemática existente hasta la fecha de esta revisión concluye que, en pacientes con LPA/SDRA y sépsis, las fórmulas con EPA + GLA pueden modular la respuesta inflamatoria sistémica, mejorar el intercambio de gases, reducir la tasa de SDOM, el tiempo de ventilación mecánica y el riesgo de mortalidad (49).
REFERENCIAS
1 Correia MITD, Campos ACL: "Prevalence of hospital malnutrition in Latin America: The Multicenter ELAN Study. Nutrition. 2003; 19: 823-25. [ Links ]
2. Beauchesne M. Management of Chronic Obstructive Pulmonary Disease: A Review. Journal of Pharmacy Practice. 2001; 14; 126. [ Links ]
3 Sahebjami H, Sathianpitayakul E. Influence of body weight on the severity of dyspnea in chronic obstructive pulmonary disease. Am J Respir Crit Care Med. 2000;161:886-890. [ Links ]
4 Wouters E. Nutrition and metabolism in COPD. Chest. 2000;117(Supp):274S-280S. [ Links ]
5 Schols MWJ. Nutrition in chronic obstructive pulmonary disease. Curr Opin PulmMed. 2000;6:110-115. [ Links ]
6 Anker SD, John M, Pedersen PU, Raguso C, Cicoira M, et al. ESPEN Guidelines on Enteral Nutrition: Cardiology and Pulmonology. Clinical Nutrition.2006; 25, 311-318. [ Links ]
7 Vermeeren M, Wouters EF, Nelissen LH, van Lier A, Hofman Z et al. Acute effects of different nutritional supplements on symptoms and functional capacity in patients with chronic obstructive pulmonary disease. Am J Clinical Nutrition. 2001; 73: 295 - 301. [ Links ]
8 Engelen M, Deutz N, Mostert R, Wouters E, Schols A. Response of whole-body protein and urea turnover to exercise differs between patients with chronic obstructive pulmonary disease with and without emphysema. Am J Clinical Nutrition. 2003; 77: 868 - 874. [ Links ]
9 Fuidi JP. Performance enhancement in chronic obstructive pulmonary disease. Chronic Respiratory Disease, 2004;1; 2; 95-98. [ Links ]
10 Mann, R. Management of Chronic Obstructive Pulmonary Disease. American Journal of Lifestyle Medicine, 2009;3;6; 458-465. [ Links ]
11 Schols A, Broekhuizen R, Weling-Scheepers C, Wouters E. Body composition and mortality in chronic obstructive pulmonary disease. Am J Clinical Nutrition. 2005;82;53-59 [ Links ]
12 Berry JK, Baum C. Malnutrition in Chronic Obstructive Pulmonary Disease: Adding Insult to Injury. AACN Clinical Issues Volume 12, Number 2, pp. 210-219. 2001 [ Links ]
13 Mallampalli A. "Nutritional Management of the Patient with Chronic Obstructive Pulmonary Disease". Nutrition in Clinical Practice. 2004;19;6; 550-556. [ Links ]
14 Ferreira IM, Brooks D, LacasseY, Goldstein RS, et al. "Nutricional supplementation for stable chronic obstructive pulmonary disease". Cochrane Database Syst. Rev 2002; (1): CD 000998. [ Links ]
15 Broekhuizen R, Wouters EF, Creutzberg EC, Weling-Scheepers CA, Schols AM. Polyunsaturated fatty acids improve exercise capacity in chronic obstructive pulmonary disease. Thorax. 2005;60;5:376-382. [ Links ]
16 Ali T, Bennoor KS, Begum N. Effects of nutritional modification on anthropometry and lung functions of COPD patients. Chest. 2007;132;4:532. [ Links ]
17 Ferreira I, Brooks D, Lacasse Y, Goldstein R, White J. Nutritional supplementation for stable chronic obstructive pulmonary disease. Cochrane Database of Systematic Reviews 2005, Issue 2. Art. No.: CD000998. DOI: 10.1002/14651858.CD000998. pub2 [ Links ]
18 Feibi Chi, Effects of o-3 Polyunsaturatedfatty Acids on Inflammatory Markers in Chronic Obstructive Pulmonary Disease. Nutrition in Clinical Practice. 2006; 21; 5; 533-534 [ Links ]
19 Gosker HR, Wouters E, Ger, van der Vusse G, Schols A. Skeletal muscle dysfunction in chronic obstructive pulmonary disease and chronic heart failure: underlying mechanisms and therapy perspectives. Am. J. Clinical Nutrition, May 2000; 71: 1033 - 1047. [ Links ]
20 McClave SA, Martindale RG, Vanek VW, McCarthy M et al. Guidelines for the Provision and Assessment of Nutrition Support Therapy in the Adult Critically Ill Patient: Society of Critical Care Medicine (SCCM) and American Society for Parenteral and Enteral Nutrition (A.S.P.E.N.). Journal Parent Enteral Nutr. 2009;33;3: 277-316. [ Links ]
21 Vermeeren MA, Wouters EF, Nelissen LH, van Lier A, et al. Acute effects of different nutritional supplements on symptoms and functional capacity in patients with chronic obstructive pulmonary disease. Am J Clin Nutr. 2001;73:295-301. [ Links ]
22 Cai B, Zhu Y, Ma Y, et al. Effect of supplementing a high-fat, low-carbohydrates enteral formula in COPD patients. Nutrition. 2003;19:229-232. [ Links ]
23 Engelen M, Rutten E, De Castro C, Wouters E, Schols A, Deutz N. Supplementation of soy protein with branched-chain amino acids alters protein metabolism in healthy elderly and even more in patients with chronic obstructive pulmonary disease Am J Clinical Nutrition. 2007; 85: 431 - 439. [ Links ]
24 Malone, A. The use of Specialized Enteral Formulas in Pulmonary Disease. Nutr Clin Pract. 2004;19:557-562. [ Links ]
25 Chen Y. Critical Analysis of the Factors Associated with Enteral Feeding in Preventing VAP: A Systematic Review. J Chin Med Assoc 2009;72(4):171-178. [ Links ]
26 Rice T, Swope T, Bozeman S, Wheeler AP. Variation in enteral nutrition delivery in mechanically ventilated patients. Nutrition. 2005; 21: 786-792. [ Links ]
27 Sobotka L, Soeters P, Raguso CA, Jolliet P, et al. Basics in Clinical Nutrition: Nutritional support in critically ill and septic patients. e-SPEN, the European e-Journal of Clinical Nutrition and Metabolism. 2010;5: e97-e99. [ Links ]
28 Wheeler AP, Bernard GR. Acute lung injury and the acute respiratory distress syndrome: a clinical review. An important overview of the diagnosis and management of ARDS. Lancet. 2007; 369:1553-1564 [ Links ]
29 Flaaten H, Gjerde S, Guttormson AB, et al. Outcome after acute respiratory failure is more dependent on dysfunction in other vital organs than on the severity of the respiratoryfailure. Crit Care. 2003;7:R72-R77. [ Links ]
30 Pontes-Arruda A. The Use of Special Lipids in the Treatment of Inflammatory Lung Disease. Clinical Nutrition Insight. 2007: 1-4 [ Links ]
31 Elamin EM, Camporesi E. Evidence-based Nutritional Support in the Intensive Care Unit. International Anesthesiology Clinics, 2009; 47;1:121-138. [ Links ]
32 Malone A. Specialized Enteral Formulas in Acute and Chronic Pulmonary Disease. Nutrition in Clinical Practice.2009;24;6:666-674. [ Links ]
33 Puneet P, Moochhala S, Bhatia M. Chemokines in acute respiratory distress syndrome. Am J Physiol Lung Cell Mol Physiol 2005; 288:L3-L15. [ Links ]
34 Mizock BA. Immunonutrition and critical illness: An update. Nutrition (2010), doi:10.1016/j.nut.2009.11.010 [ Links ]
35 Mayer K, Seeger W. Fish oil in critical illness. Curr Opin Clin Nutr Metab Care 2008; 11:121-127. [ Links ]
36 Calder PC. Immunomodulation by omega-3 fatty acids. Prostaglandins Leukot Essent Fatty Acids 2007; 77:327-335. [ Links ]
37 Dewey A, Baughan C, Dean TP, Higgins B, Johnson I, Eicosapentaenoic acid (EPA, an omega-3 fatty acid from fish oils) for the treatment of cancer cachexia. Cochrane Database of Systematic Reviews. 1, 2009. [ Links ]
38 Bulger EM, Jurkovich GJ, Gentiello LM, et al: Current clinical options for the treatment and management of acute respiratory distress syndrome. J Trauma 2000; 48:562-572 [ Links ]
39 Malone AM, Specialized Enteral Formulas in Acute and Chronic Pulmonary Disease. Nutrition in Clinical Practice. 2009;24;6:666-674. [ Links ]
40 Lindaren BF, Ruokonen E, Magnusson-Borg K, Takala J, et al. Nitrogen sparing effect of structured triglycerides containing both medium and lung-chain fatty acids in critically ill patients: a double blind randomized controlled trial. Clin Nutr. 2001;20:43-48. [ Links ]
41 Oltermann MH. Nutrition support in the acutely ventilated patient. Respir Care Clin N Am 2006; 12:533-545. [ Links ]
42 Suchner U, Katz DP, Furst P, Beck K, Felbinger TW, Thiel M, Senftleben U, Goetz AE, Peter K Impact of sepsis, lung injury, and the role of lipid infusion on circulating prostacyclin and thromboxane A2 Intensive Care Medicine. 2002;28;2:122-129. [ Links ]
43 Tehila M, Gibstein L, Gordgi D, Cohen JD, Aspira M, et al. Enteral fish oil, borage oil and antioxidants in patients with acute lung injury (ALI). Clin Nutr. 2003;22(Suppl):S20. [ Links ]
44 Cook D, Meade M, Guyatt G, et al. Trials of miscellaneous interventions to wean from mechanical ventilation. Chest. 2001;120(suppl):438S-444S. [ Links ]
45 Theilla M, Singer P, Cohen J, Dekeyser F. A diet enriched in eicosapentanoic acid, gamma-linolenic acid and antioxidants in the prevention of new pressure ulcer formation in critically ill patients with acute lunginjury: a randomized, prospective, controlled study. Clin Nutr 2007; 26:752-757. [ Links ]
46 Pontes-Arruda A, Albuquerque AM, et al. Effects of enteral feeding with eicosapentaenoic acid, y-linolenic acid, and antioxidants in mechanically ventilated patients with severe sepsis and septic shock. Crit Care Med. 2006;9: 2325-2333. [ Links ]
47 Singer P, Theilla M, Fisher H, Gibstein L, Grozovski E, Cohen J. Benefit of an enteral diet enriched with eicosapentaenoic acid and gamma-linolenic acid in ventilated patients with acute lung injury. Crit Care Med. 2006;34:1033-1038. [ Links ]
48 Singer P, Shapiro H. Enteral omega-3 in acute respiratory distress syndrome. Current Opinion in Clinical Nutrition and Metabolic Care. 2009; 12:123-128. [ Links ]
49 Pontes-Arruda A, DeMichele S, Seth A, Singer P. The use of an inflammation modulating diet in patients with acute lung injury or acute respiratory distress syndrome: a meta-analysis of outcome data. J Parent Ent Nutr 2008;32:596-605. [ Links ]
50 Elamin EM, Hughes LF, Drew D. Effect of enteral nutrition with eicosapentaenoic acid (epa), gamma-linolenic acid (gla), and antioxidants reduces alveolar inflammatory mediators and protein influx in patients with acute respiratory distress syndrome (ARDS). Chest. 2005;128,4:255s-b. [ Links ]
51 Pacht ER, DeMichele SJ, Nelson JL, et al: Enteral nutrition with eicosapentaenoic acid, gamma-linolenic acid and antioxidants reduces alveolar inflammatory mediators and protein influx in patients with acute respiratory distress syndrome. Crit Care Med 2003; 31:491-500 [ Links ]
52 Nelson JL, DeMichele SJ, Pacht ER, Wennberg AK. Effect of enteral feeding with eicosapentaenoic acid, gamma-linolenic acid, and antioxidants on antioxidant status in patients with acute respiratory distress syndrome. JPEN. Journal of parenteral and enteral nutrition. 2003;27,2:98-104. [ Links ]
53 Liu W-Q, Chen X-Y, Huang C-H Effect of enteral nutrition support on immune function in chronic obstructive pulmonary disease patients undergoing mechanic ventilation. Chinese Journal of Clinical Nutrition. 2007;15;5:285-288. [ Links ]
54 Lovinelli G, Marinangeli F, Ciccone A, Ciccozzi A, Leonardis M, Paladini A, Varrassi G Minerva anestesiologica. 2007;73;1-2:65-76 [ Links ]
55 Sabater J, Masclans JR, Sacanell J, Chacon P, Sabin P, Planas M. Effects on hemodynamics and gas exchange of omega-3 fatty acid-enriched lipid emulsion in acute respiratory distress syndrome (ARDS): a prospective, randomized, double-blind, parallel group study. Lipids in health and disease. 2008;7:39. [ Links ]
56 Lekka ME, Liokatis S, Nathanail C, Galani V, Nakos G. The impact of intravenous fat emulsion administration in acute lung injury. American Journal of Respiratory and Critical Care Medicine. 2004;169;5:638-644. [ Links ]
57 Suchner U, Katz DP, Furst P, Beck K, Felbinger TW, Thiel M, Senftleben U, Goetz AE, Peter K. Impact of sepsis, lung injury, and the role of lipid infusion on circulating prostacyclin and thromboxane A2. Intensive Care Medicine. 2002;28;2:122-129. [ Links ]
58 Suchner U, Katz DP, Fürst P, Beck K, Felbinger TW, Senftleben U, Thiel M, Goetz AE, Peter K. Effects of intravenous fat emulsions on lung function in patients with acute respiratory distress syndrome or sepsis. Crit Care Med. 2001;29;8:1569-1574 [ Links ]
59 Hasselman M, Reimund JM. Lipids in the nutritional support of the critically ill patients. Curr Opin Crit Care. 2004;10:449-455. [ Links ]
60 Pontes-Arruda A, DeMichele S, Seth A, Singer P. Enteral Nutrition with Eicosapentaenoic Acid (EPA) y y Linolenic Acid (GLA) and antioxidants in critical illness: A meta-analysis Evaluation of outcome data. Cochrane Database of Systematic Reviews. 2009. [ Links ]
61 Effect of alanyl-glutamine dipeptide on insulin resistance and outcomes in critically ill patients with chronic obstructive pulmonary disease and respiratory failure Qiang X-H, Jiang H, Jin X-D, Kang Y, Yi Q Chinese Journal of Evidence-Based Medicine. 2007;7;9:645-649 [ Links ]
62 Marchesani F, Valerio G, Dardes N, Viglianti B, Sanguinetti CM Effect of intravenous fructose 1,6-diphosphate administration in malnourished chronic obstructive pulmonary disease patients with chronic respiratory failure Respiration. 2000;67;2:177-182 [ Links ]