Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Investigaciones Andina
Print version ISSN 0124-8146
Investig. andina vol.15 no.26 Pereira Apr. 2013
Creación de una matriz orgánica como componente estructural de una biocerámica de fosfato tricálcico colombiano
Development of an organic scaffold as an estructural component of a colombian tricalcium phosphate (ctcp)
Criação de uma matriz orgânica como componente estrutural de uma biocerâmica de fosfato tricálcico colombiano (ftcc)
María Chitiva. EP*; Sergio Sánchez.EP*; Giovanni Correa.EP*; María Tovar. Msc*, Jesús Daza, Msc**
* Facultad de Odontología. Fundación Universitaria San Martín. Bogotá D.C angelicachitiva@hotmail.com
** Departamento de Nutrición y Bioquímica. Pontificia Universidad Javeriana, Bogotá D.C.jdaza@javeriana.edu.co
Resumen
Objetivo: comparar microestructuras de matrices en Fosfatos Tricálcicos Colombianos (FTCC) utilizando aalbúmina, colágeno y alcohol polivinílico, variando presión y temperatura, confirmados mediante scaninng electron microscopy (SEM).
Materiales y métodos: se utilizó el FTCC1 de ABASQUIMLTDA y FTCC2 de EMU; mezclados con distintos agentes formadores de poros hidratados con solución salina al 0.9%, agua destilada, sometidos a 8 Toneladas, 1200°C, observados al (SEM).
Resultados: colágeno y albúmina no formaron matriz, el PVA creó macro-microporosidad, el FTCC1 estableció conglomerados de unión molecular entre partículas, sistemas de cristalizacion definidos, con interconexiones químicas, una porosidad de 10 ¡m. En el FTCC2 se encontraron matrices de morfología más plana, uniones intermoleculares fuertes, con microporos 3µm.
Conclusiones: la estabilidad de las interconexiones mejora las propiedades mecánicas por asociación química entre las partículas del FTCC y el polialcohol, mediadas por elevada presión y temperatura; la regularidad del poro es el espacio liberado al fundirse el PVA.
Palabras Clave: Proteínas de la Matriz Extracelular; Análisis de Matrices Tisulares; Calcio; Reactividad - Estabilidad.
Abstract
Objective: to compare microstructures of tricalcium phosphate matrices in Colombia (FTCC) using albumin, collagen, polyvinyl alcohol and varying pressure and temperature, electron microscopy confirmed scaninng (SEM).
Materials and methods: we used to ABASQUIMFTCC1 FTCC2 LTDA and EMU, mixed with different pore forming agents hydrated with 0.9% saline, distilled water subjected to 8 Tons, 1200 ° C, observed at (SEM).
Results: collagen and albumin, non-formed matrix, the macro-formed PVA microporosity, the junction FTCC1 molecular clusters formed between particles, defined crystallization systems with chemical interconnections, a porosity of 10 microns, the matrices were found FTCC2 morphology flatter, strong intermolecular bonds, microporous 3µm.
Conclusions: the stability of interconnections improves the mechanical properties by chemical association between the particles and the polyol FTCC mediated by elevated temperature and pressure, the regularity of the pore space is released by melting the PVA.
Key Words: Extra Cellular Matriz Proteins; Tissue Array Analysis; Reactivity Stability
Resumo
Objetivo: comparar microestruturas de matrizes em Fosfatos Tricálcicos Colombianos (FTCC) utilizando albumina, colágeno e álcool polivinílico, variando pressão e temperatura, confirmados mediante scaninng eletrom microscopicos (SEM).
Materiais e métodos: utilizou-se o FTCC1 de ABASQUIM Ltda. e FTCC2 de EMU; mesclados com distintos agentes formadores de poros hidratados com solução salina a 0.9%, agua destilada, submetidos a 8 Toneladas, 1200°C, observados ao (SEM).
Resultados: colágeno e albumina não formaram matriz, o PVA criou macro-microporiosidade, o FTCC1 estabeleceu conglomerados de união molecular entre partículas, sistemas de cristalização definidos, com interconexões químicas, uma porosidade de 10 ¡m. No FTCC2 encontraram-se matrizes de morfologia mais plana, uniões intermoleculares fortes, com microporos 3µm.
Conclusões: a estabilidade dessas interconexões melhora as propriedades mecânicas por associação química entre as partículas do FTCC e o poli-álcool mediadas por elevada pressão e temperatura, a regularidade do poro é o espaço liberado ao fundir-se o PVA.
Palavras Chave: Proteínas da Matriz Extracelular; Análise de Matrizes Tissulares; Cálcio; Reatividade - Estabilidade.
Fecha de recibo: Junio/2012
Fecha aprobación: Noviembre/2012
Introducción
Los biomateriales con base en fosfatos de calcio (FC) utilizados en regeneración ósea (RO), son reconocidos por sus características de biocompatibilidad, bioactividad y biodegradabilidad (1). El Fosfato tricálcico (FTC) es una cerámica macro-microporosa, bioreabsorbible, biodegradable, biocompatible y osteointegrable. Estructuralmente presenta macroporosidad, estimulando la osteoconducción por neovascularización y colonización de tejido óseo (TO) y microporosidad, incrementando su bioactividad de intercambio entre cristales y hueso.
Actualmente los avances en ingeniería de tejidos (2) tienen como objetivo la modificación de la porosidad de los materiales, que serán usados como injertos para facilitar e incrementar la velocidad de degradación, que aún se considera muy lenta, y debe ser similar a la formación de nuevo TO. Igualmente la macroporosidad busca colonización de células óseas y neovascularización del injerto para la formación de TO mineralizado (3).
El desarrollo de biocerámicas se genera por la integración fisicoquímica de elementos sintéticos poliméricos, buscando la adherencia molecular entre las partículas de fosfatos, mediante preparaciones de suspensiones, geles y polímeros (4).
Reportes previos han utilizado agentes formadores de poros (AFP), adheriendo las partículas de FC, generando poro y siendo eliminados posteriormente.
Miao en 2004 (5) propuso un método para la fabricación de matrices cerámicas de cementos de FC porosos utilizando espumas de poliuretano. Sometidas a 1200°C por 2 horas, obtuvieron macroporos hasta 1mm y microporos desde 5 micras, aumentado la porosidad en un 70%; las interconexiones entre macro y microporos se hizo mayor.
Ribeiro en 2006 (6) desarrolló una cerámica porosa de ß-FTC, utilizando un agente de consolidación y generador de espuma (Albúmina de Huevo-AH); se sinterizaron las muestras a 1250°C por 30 minutos. Las espumas presentaron una distribución variada de poros con geometría esférica e interconexiones adecuadas, para usarse como injerto.
Matsuno en 2006 (7) desarrolló una esponja compuesta biodegradable para RO, derivada de la combinación de ß-FTC y colágeno, evaluando la proporción óptima de granulos de ß- FTC y colágeno y la formación ósea in vivo. Los gránulos de ß-FTC poroso fueron mezclados con una solución de atelocolágeno hidroclorado. Las mezclas fueron secadas por congelación y sujetas a tratamiento hidrotermal in vacuo. Evaluadas histológicamente después de cuatro semanas de implantación en defectos óseos de tibia de perros, descubrieron que la esponja de colágeno se degradaba con un resultado en el proceso de neoformación ósea en la superficie de los granulos de ß-FTC. A las 12 semanas se observó que la esponja estaba completamente degradada y remodelada por hueso laminar.
Hockin en 2006 (8) fabricó un CFC macroporoso y estable; investigó los efectos que ocasionaban los AFP y las fibras absorbibles, mezclando manitol soluble en agua con el CFC, en fracciones de masas de 0 al 50%. Estas matrices inyectables aproximaron la fuerza flexural a las descritas para implantaciones de hidroxiapatita porosa sintetizada, y a la correspondiente al hueso.
Kang en 2007 (9), combinó ácido láctico con ß-FTC para la fabricación de matrices porosas, fueron expuestas frente a fluidos corporales simulados dinámicos y estáticos, a una temperatura de 37°C durante 24 semanas. Los resultados mostraron la aparición de una gran capa de apatita sobre la superficie de las matrices, disminución en el peso molecular y en la fuerza compresiva, en las expuestas al flujo en fluidos corporales simulados.
Espanol en 2009 (10) estudió la caracterización y control de la porosidad de los cementos de a-FTC con el uso de Albúmina Bovina. Mediante porometría de mercurio, determinó una presentación bimodal y la distribución del tamaño del poro, que afecta directamente absorción y penetración de la Albúmina Bovina. Determinó que la porosidad intrínseca mayor de los FC no aseguraba una penetración menor de la proteína, sino que dependía de la distribución adecuada de los poros.
Panzavolta en 2009 (11) preparó matrices compuestas porosas con esponjas de gelatina de piel porcina secadas por congelación; estas matrices evidenciaron una interconexión microestructural con formación de poros entre 350-170 micras; igualmente las propiedades físicas mejoraron por el aumento de la resistencia a la compresión. Generalmente estos conjugados se obtienen de formas granulares sometidos a presión y a temperaturas altas, para volatilizar o solubilizar el AFP.
Uno de los aspectos relevantes en el diseño de las biocerámicas, es la manipulación de la arquitectura de los materiales para obtener poros homogéneos y estandarizados, que pueden oscilar entre 100-1000 µm (12).
Teniendo en cuenta el estudio de Miranda et al (13), donde se analizan las propiedades físico, químicas y mecánicas de los Fosfatos Tricácicos Colombianos solos, es importante comparar las microestruc-turas formadas por dos FTCC invitro, por cuanto en el País no se han realizado estudios previos referentes a creación de matrices orgánicas (MO) como componente estructural de una biocerámica a base de FTCC, incorporando tres diferentes AFP; dos de ellos de origen natural proteico (Colágeno y Albúmina) y otro sintético (Alcohol Polivinílico) (PVA).
Materiales y métodos
Se manejó un estudio experimental de laboratorio in vitro de investigación básica cualitativa y cuantitativa. Se realizó un muestreo por conveniencia; se seleccionaron dos FTCC del 98% de pureza.Unkilodecadafosfatodenominado FTCC1 (blanco), casa comercial C.I. ABASQUIM LTDA. (Bogotá), y FTCC2 (amarillo), casa comercial INDUSTRIAS EMU S.A., (Siberia/Cundinamarca); 500 gr colágeno liofilizado (CL) de origen bovino, casa comercial QUÍMICOS Y CPVASULAS LTDA. (Bogotá), 500 gr de albúmina de huevo (AH), casa comercial DISPROALQUIMICOS S.A. (Bogotá) cada uno del 95% de pureza y 250 gr de PVA; casa comercial FLUKA (Suiza).
Como variables independientes los dos FTCC, el tipo de AFP: CL, AH y PVA, sustancias hidratantes: Suero Fisiológico (SF) 0.9% y Agua Destilada. Como variables dependientes, tamaño del poro, tipo de estructura, estabilidad dimensional y sistema de cristalización.
Los sesgos se controlaron al realizar pruebas en laboratorios especializadas, con guías de manejo de estandarización internacional según normas técnicas de calidad, con la tecnología necesaria y la oportuna calibración de equipos y realización de las pruebas por el mismo operador. Se manejó el microscopio óptico (Leitz), estereoscopio (Sorvall), microscopio de barrido electrónico-(SEM) (JEOL), agitador magnético (Rocker), amalgamador (millenium 2000), tamices de 600, 250 y 125 micras, termoregulador (Jica), horno de cocción de cerámicas (Vulcan A-550), cámara de metalización (Denton Vacuum), balanza analítica (Shimadzu AY120), prensa hidráulica, torno (Motura super 30-550a), los programas Motic 2000 y NIH IMAGE J para mediciones de imágenes del SEM; para el análisis estadístico se utilizó el programa past program.
Prueba definitiva
Para el PVA y los FTCC se realizó un tamizaje de homogenización a 125 micrómetros y el PVA entre 250 y 600 micrómetros. Se tomaron 0.33 gr. de la muestra homogenizada de FTCC y 3 p/p%; se llevó a prensa hidráulica con manómetro en un troquel de acero BT42 y BT310 para estandarizar la matriz. Se aplicó la compresión a 82.84 kN equivalente a 8 toneladas (8T), obteniendo pastillas, las cuales se colocaron en las muflas calibradas a 1200°C durante 4 horas. Para exponer los poros formados en las pastillas, se hicieron cortes con sierra de diamante de 0.17mm de espesor a baja revolución e irrigación constante de Suero Fisiológico al 0.9 %; los fragmentos obtenidos se sometieron a metalización y observación en SEM.
Resultados
Los resultados de la prueba piloto determinaron que aun al modificar los protocolos de homogenización, temperatura, hidratación, no se obtuvieron características de estabilidad de los fosfatos, por lo cual se continuaron las pruebas con el PVA, porque este cuenta con potencial de adherencia molecular de partículas de otra naturaleza y la biocompatibilidad por sus características de evaporación, al ser sometido a altas temperaturas.
Teniendo en cuenta que el objetivo general era la elaboración de una matriz, se modificó el protocolo omitiendo la hidratación (ya que el uso de un hidratante modificaría las características adhesivas del PVA) y manejando una técnica de homogenización en seco de las partículas de fosfato y alcohol. Las pastillas obtenidas después del proceso de cocción mostraron bordes definidos, dureza y estabilidad, difíciles de fracturar; sin embargo, macroscópicamente se observó la formación de espacios muertos de tamaños irregulares y canales grandes, por lo cual se observaron a transiluminación para ver la densidad de las muestras y distribución de las partículas.
Se evidenció agregación física de las partículas de fosfato; el PVA funcionó como agente adherente de estas partículas al evaporarse y elevarse la temperatura, creando porosidad y canales poco regulares, situados al centro de la pastilla. Hacia los bordes se observa mayor densidad de los agregados; la irregularidad de los espacios dejados por la evaporación del alcohol se tendría que controlar con la estandarización del tamaño de la partícula, tanto del fosfato como del PVA, por lo cual se decidió realizar una selección del tamaño de las partículas del PVA y de los fosfatos, con el uso de tamices para segregar en tres tamaños distintos.
y desintegración. Mantuvieron la evidente porosidad macroscópica, se trituraron y se repitió el procedimiento de compresión y cocción, bajo el mismo protocolo. Se obtuvieron pequeñas muestras de formas rectangulares, con cortes finos y definidos conseguidas con una sierra de diamante montada en el torno, irrigando constantemente con solución salina (SS) al 0.9 % con el resultado de las imágenes (Figs. 1-4).
Análisis imágenes en SEM
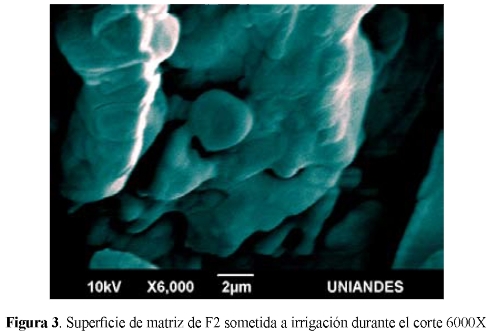
La imagen en SEM con un aumento de 6000X corresponde a la morfología de la matriz de FTCC1, elaborada con PVA, sometida a presión de 8T y a 1200°C, irrigada con SS al 0.9% en la superficie durante el corte con sierra. Se observan partículas geométricamente definidas y la íntima conexión entre ellas, producto de la acción del PVA, actuando como AFP; evidenciando la macro y microporosidad. (Fig 2).
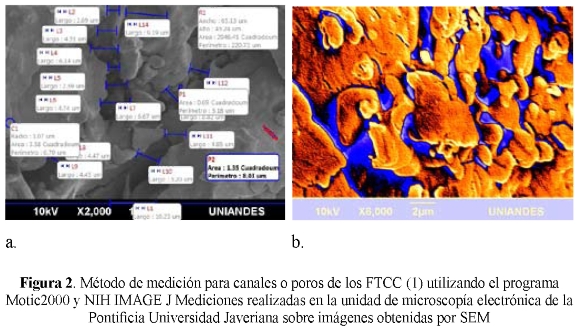
La imagen en SEM con un aumento de 2000X (Fig. a) corresponde a la morfología de la matriz de un fosfato tricálcico colombiano amarillo, elaborada con alcohol polivinílico, sometida a presión de 8 toneladas y a temperatura de 1200°C, que no fue irrigada con suero fisiológico al 0.9% en su superficie durante el corte con sierra; donde se observan los conglomerados de partículas poco definidas geométricamente y la ausencia de sistemas de cristalización. (Fig. b)
La imagen en SEM analizada por el programa NIH IMAGE, corresponde a la morfología de la matriz de un fosfato tricálcico colombiano amarillo, elaborada con alcohol polivinílico, donde se observan contrastes identificados con colores que enmarcan el sistema de microporos (azul) y no hay separación clara entre partícula y partícula dentro de los conglomerados, mostrando una morfología más plana. (Fig. 3)
La imagen en SEM con un aumento de 6000X corresponde a la morfología de la matriz de F2, elaborada con PVA, sometida a presión de 8T, 1200°C, irrigada con SF al 0.9% en la superficie durante el corte con sierra; se observa que la mayoría son superficies compactas de fosfato, con superposición de conglomerados de morfología redondeada; se evidencian las interconexiones entre conglomerados y la formación de poros de distintos diámetros. (Fig.4)
La imagen en SEM analizada por el programa NIH IMAGE J corresponde a la morfología de la matríz de un fosfato tricálcico colombiano amarillo, elaborada con alcohol polivinílico, donde se observan contrastes identificados con colores que enmarcan el patrón de porosidad entre 3.80 y 9.95 µm, con promedio de poro 6.58 µm (azul), y se evidencia separación clara entre partícula y partícula asociadas químicamente, para formar conglomerados aislados y superpuestos de morfología variable.
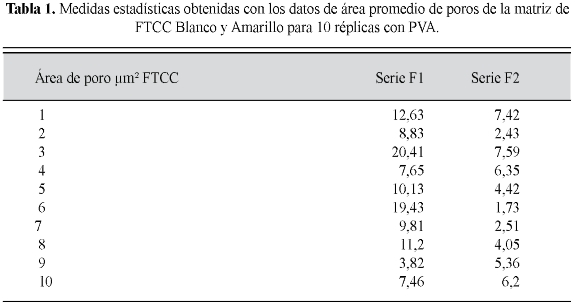
Según mediciones realizadas, se pudieron observar las siguientes medidas estadísticas que determinaron los diámetros (µm) y consecuentemente las áreas (µm2) de los poros en dos FTCC: resultados comprobados mediante 10 réplicas (Tabla 1).
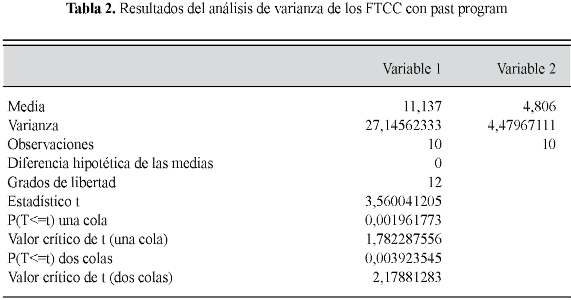
El nivel de aceptación y confiabilidad de las pruebas son estimadas para un a =0,05. En la medida de los poros de FTCC Blanco y Amarillo se evidencia la superioridad en área de fosfato FTCC1. Sin embargo, se valida esta apreciación con la estadística descriptiva y análisis univariado. Para prueba de normalidad se utilizó la prueba de Shapiro Wilk con el resultado de p=0,21182; prueba significativa para normalidad del FTCC1 y p=0,4609, con normalidad significativa para el FTCC2.
Se utilizó una prueba t para diferencia simple de comparación de media y para encontrar las diferencias significativas fue aplicada con resultados para dos colas con una P=0,003923545 confirmado la hipótesis buscada Ha= µ1 µ2 (Tabla 2).
Discusión de resultados
El FTCC es un biomaterial sustitutivo óseo aloplástico, que ha demostrado ser generador de matriz como andamiaje para la RO, principio conocido como osteoconducción, gracias a la adición de diversos elementos de adherencia molecular entre las partículas del fosfato, de lo que se ha valido la ingeniería de TO para tal fin. Entre los elementos utilizados se cuenta con Colágeno, Albúmina, PVA, entre otros, que a la vez de crear interconexiones fisicoquímicas entre las moléculas, se comportan como AFP (12).
Los dos FTCC fueron previamente analizados sin formar matriz en anteriores investigaciones, por lo cual en la presente fueron combinados con tres de los elementos mencionados (Albúmina, Colágeno y Alcohol poli-vinílico), para observar la estabilidad que podían otorgar a los fosfatos en medio acuosos. Se realizaron pruebas bajo protocolos establecidos por los laboratorios de microscopía óptica de la Universidad Javeriana y el laboratorio de SEM de la Universidad de los Andes, siendo concluyentes y permitiendo el control de los posibles sesgos; así mismo el tamaño muestral, la calibración de los equipos y la realización de las pruebas por un solo operador, permitieron la generalización de los resultados.
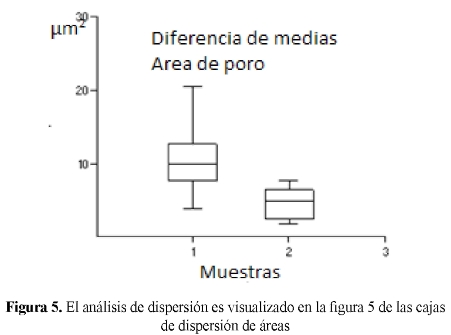
Lo anterior admitió la aceptación de la hipótesis alterna, en la cual se planteó que la MO con PVA, sometida a 8T de presión y a 1200°C, proveen mayor estabilidad dimensional a los FTCC comparada con las matrices formadas con Colágeno y con Albúmina; el PVA fue el material que de los tres generó estabilidad dimensional en la MO, por tanto fue el que se analizó mediante SEM, observando la formación de canales, de macro y microporos, y la morfología específica de la matriz de FTCC1 y FTCC2. La prueba t establece que hay una diferencia significativa por cuanto P= 0,003923545. Se observó que el FTCC1 formó conglomerados de partículas unidas químicamente con sistemas de cristalización definidos (hexagonales, octogonales y rectangulares), mientras que la microestructura de la matriz de FTCC2 mostró uniones químicas fuertes, pero sin un sistema de microcristales marcado, por el contrario se observaron formas planas, amorfas y asimétricas en la superficie de la pastilla creada. La irrigación durante el corte permitió deducir que las uniones entre partículas se veía favorecida por el agente hidratante (SS 0.9%). La superficie de las muestras que no fueron hidratadas, mostró líneas de separación entre partícula y partícula. Las pruebas piloto realizadas permitieron descartar el Colágeno y la Albúmina, al formar matrices de fosfatos que terminaban por disolverse en medio acuoso.
Ribeiro en 2006, (6) establece que la fabricación de la biocerámica porosa de ß-FTC lograda con la adición de AH, logra estabilidad y permite la fase cristalina de la matriz, siendo sintetizada a 1250°C por 30 minutos, comparado con los resultados obtenidos para la albúmina adicionada a FTCC, demuestra el error en la prueba de sinterización, aunque la temperatura fue similar 1200°C, el tiempo de exposición fue 8 veces mayor (4 horas), lo que pudo llevar a la desnaturalización de la proteína, por lo cual perdía su acción adherente de las partículas en medio acuoso.
Matsuno en 2008, (7) estableció la capacidaddeuniónde las partículas de FTC con PVA, al mezclarlo con alginato como componentes de una matriz inyectable, y su posibilidad de estabilización en medio acuoso en una solución de ácido algínico, obteniendo porosidades entre 100-1000 micras en conglomerados de partículas de morfología redondeada, por procesos de liofilización con nitrógeno líquido y sintetización a 1100°C durante 10 horas. Extrapolado a la obtención de la matriz con el FTCC1, mostró una disminución en el tamaño de los poros (promedio de 10 micras), por el engrosamiento de las interconexiones entre partículas, haciendo más gruesas las paredes de los canales y poros, gracias al sistema de cristalización definido rectangular, hexagonal y octogonal al ser solamente sintetizados, sin el uso de elementos de gelificación (25-26).
Almirall en 2007 (15) estableció que la presencia de partículas más grandes en las matrices formadas con ß-FTC, modifica el tamaño del poro variando el proceso de osteoconducción, angiogénesis y proliferación celular. Así, Arias en 2007 (13) afirmó que los materiales de sustitución ósea deben tener un tamaño de poro que permita la colonización tanto de células óseas (osteoblásticas y osteoclásticas) como de neo-angiogénesis, además de tener microporosidades y conexiones entre las partículas. Sin embargo, uno de los principales inconvenientes de las cerámicas de FC son sus propiedades mecánicas, dado que el tamaño del poro genera que sean materiales frágiles por tener interconexiones muy delgadas, presentando un bajo poder de compresión y tracción; permitiendo la colonización celular y neoformación vascular, debido a que los osteoblastos miden de 20 a 50 micras y los osteoclastos de 10 a 20 micras, pero no sería útil usarlo en forma de bloques por su fragilidad a carga.
La investigación actual mostró que al adherir químicamente las partículas de FTCC con el PVA, forma interconexiones más grandes disminuyendo el tamaño del poro concomitantemente (10 micras promedio en el fosfato1 y 3 micras en el FTCC2), dificultando el proceso de osteoconducción, aunque la estandarización de protocolos permitiría controlar el tamaño del poro en investigaciones futuras, conservando así la propiedad de resistencia a la compresión (16-17-18).
Barazarte en 2011 (14) estableció el tamaño del poro de FTCC1 y FTCC2 sin dopajes y dopados con Zinc y Magnesio, comparándolo con el tamaño del poro de FTC comercial Cerasorb® sin formar matrices, encontrando que el FTCC1 presenta poros entre 0.011-32 micras con un promedio de 0.217 micras cuando es dopado con Zinc; el FTCC2 con poros entre 0.007-18 micras con promedio de 0.487 micras cuando es dopado con Zinc, y el FTC comercial Cerasorb® desde 0.007-173 micrómetros con un promedio de 25 micras, evidenciando que la matríz obtenida con el FTCC1 al adicionarle PVA mejora el tamaño del poro (promedio: 10.7 micras), sumándole resistencia a factores físicos como la compresión, tensión y tracción. Para el caso del FTCC2, el tamaño del poro se conserva estable comparado con el estudio anterior, aunque muestra rigidez estructural, lo que permitirá la modificación de la estructura a conveniencia de los futuros investigadores (19-20-21).
El PVA por su parte, además de ser agente de unión molecular entre partículas, evidenció su evaporación completa al sometérsele a temperaturas altas, dando vía a la biocompatibilidad al no dejar restos solubles en las matrices (22-2324).
Todo lo anterior demostró que la investigación in vitro de los FTCC, lleva a su presunción como material valido de sustitución ósea a posteriori, cumpliendo a cabalidad con los estándares ideales reportados en la literatura.
REFERENCIAS
1. Bernales, D; Caride, F; Lewis,A. Membranas de colágeno polimerizado: consideraciones sobre su uso en técnicas de regeneración tisular y ósea guiada. Rev. Cubana de investigaciones biomédicas. 2004; 23( 2): 65-74 [ Links ]
2. Guevara, C; Romero, Gloria; Calle, Martha, et al. Desarrollo de una biocerámica Biomimética para uso específico en odontología. Rev. Acad. Colomb. Cienc. 2006; (117):595-604 [ Links ]
3. Hutmacher, D.W. "Scaffolds in tissue engineering bone and cartilage". En: Biomaterials, (2000); Vol. 21, p. 2529-2543. [ Links ]
4. Zhang, Faming; Chang, Jiang; Lu Jianxi et al. Fabrication and Mechanical -Properties of Dense/Porous ß- Tricalcium Phosphate Bioceramics. Key Engineering Materials. 2007; 330-332, 907-910 [ Links ]
5. Miao, X.; Liu,Hu; Wong, A . Porous Calcium Phosphate Ceramics Prepared by Coating Polyurethane Foams with Calcium Phosphate Cemens. JMaterials Letters. 2004; 58(3-4): 397-402 [ Links ]
6. Ribeiro, C., Bressiani, J.C., Bressiani, A.H.A. Estudo da técnica de consolidação utilizando albumina. Na obtenção de cerâmicas porosas de ß-TCP. 17° CBECIMat -Congresso Brasileiro de Engenharia e Ciência dos Materiais, 2006;49-60 [ Links ]
7. Matsuno, Tomonori; Tatsuo Nakamura, Tatsuo; Kuremoto, Koh-Ichi et al. Development of ß- Phosphate/ Collagen Sponge Compoiste for Bone Regeneration. Dental Materials J.2006; 25 (1): 138-144 [ Links ]
8. Hockin, Xu; Weir, Michael; Burguera, E. et al. Injectable and macroporous calcium phosphate cement scaffold. J. Biomaterials. 2006; 27, 42794287. [ Links ]
9. Kang, Yunquing, Xu, Xiujuan, Yin Guangfu et al. A comparative study of the in vitro degradation of poly (L-lactic acid)/b-tricalcium phosphate scaffold in static and dynamic simulated body fluid. European Polymer J. 2007; 43, 1768-1778. [ Links ]
10. Espanol, M., Pérez, R., Montufar, E. et al. Intrinsic porosity of calcium phosphate cements and its significance for drug delivery and tissue engineering PVAplications. Acta Biomaterialia 2009; 5,2752-2762 [ Links ]
11. Panzavolta, S;Fini M.; Nicoletti, A.Et al, Porous composite scaffolds based on gelatin and partially hydrolized a-tricalcium phosphate. Rev. Acta Biomaterialia 2009; 5, 636643 [ Links ]
12. Miranda, Y; Betancourt, I. Correa Giovanni, Daza Jesús, Tovar María E. Comparación de las propiedades físicas, químicas y mecánicas de los Fosfatos Tricálcicos Colombianos solos. Rev. Teoría y Praxis Investigativa. Fundación Universitaria del Área Andina 2011;6(2):17-31 ISSN1900-39380 [ Links ]
13. Arias, J. Nuevos enfoque para mejorar las propiedades mecánicas y biológicas de compuestos cálcicos para su uso como sustituto óseo. Rev. electronic veterinaria; España 2007; 8, 982-998 [ Links ]
14. Barazarte, M; Santacaterina, M; Lucero, R. Comparación del tamaño de poros de dos FTCC con Cerasorb®, Bionnovation® y Aloinjerto de la Fundación Cosme y Damián. [Trabajo de grado Especialista en Semiología y cirugía oral. Fundación Universitaria San Martín, Postgrados de Odontología]. Bogotá:2011, 136 [ Links ]
15. Almirall, J.A.; Delgado, Alfonso. FC porosos: Métodos de preparación. VII Congreso de la Sociedad Cubana de Bioingeniería Habana 2007;1-4 [ Links ]
16. Ball, M.D; Connor, D.O; Pandit, A. Use of tissue transglutaminase and fibronectin to influence osteoblast responses to tricalcium phosphate scaffolds. J. Mater Sci: Mater Med. 2009; 20,113-122 [ Links ]
17. Cabrera, J; Paredes, C; Urday, E. Preparación y caracterización de películas de PVA conteniendo nanopartículas de TiO2. Rev. Iberoamericana de Polímeros 2007; 8(4): 323-332 [ Links ]
18. Cai, S; Xu G.; Yu, X. Fabrication and biological characteristics of ò-tricalcium phosphate porous ceramic scaffolds reinforced with calcium phosphate glass. J. Mater Sci: Mater Med. 2009; 20, 351-358 [ Links ]
19. Cano, J. Distracción Alveolar Histogénica mediante un prototipo de distractor alveolar: Estudio histomorfométrico en mandíbula de perro Beagle [Tesis Doctoral. Facultad de Odontología Universidad Complutense.] Madrid (2003) [ Links ]
20. Fielding, G; Bandyopadhyay, A; Bose, S. Effects of silica and zinc oxide doping on mechanical and biological properties of 3D printed tricalcium phosphate tissue engineering scaffolds. J. Dental Materials. 2011; 1-10 [ Links ]
21. Franco, J; Souto, A; Rey, P. Procesamiento cerámico de ß-TCP para la fabricación de piezas implantables. Boletín de la Sociedad Española de Cerámica y Vidrio.2006; 45, 265-270 [ Links ]
22. Franco, J; Souto, A; Rey, P et al Obtención de Fibras policristalinas de ß- Ca3 (PO4)2 para su empleo como material de relleno en procesos de reparación ósea. Boletín de la Sociedad Española de Cerámica y Vidrio. 2007; 46, 56-61 [ Links ]
23. Garzón, D; Cortés, C; Roa, M.Análisis por elementos finitos del proceso de regeneración ósea. Facultad de Ingeniería Universidad Nacional. Bogotá. 2004;1 [ Links ]
24. Hernández, E; Cruz, R; Robledo, F. Caracterización del alcohol polivinílico usado en recubrimientos de base acuosa.Rev. Mexicana de Ciencias Farmacéuticas. 2007; 38(002):15-25 [ Links ]
25. Lin, Kaili; Chen Lei; Qu, Haiyun et al. Improvement of mechanical properties of macroporous b-tricalcium phosphate bioceramic scaffolds with uniform and interconnected pore structures. J. Ceramics International 2011; 37,2397-2403. [ Links ]
26. Pawlina, Wojciech, Ross, Michaell. Histología: Texto y Atlas color con Biología Celular y molecular. Ed. Médica Panamericana. Buenos Aires.2007; CPVA título 8,219 [ Links ]
27. Santana, E. Bone substitutes of tricalcium phosphate. Rev. Chilena de Ortopedia y Traumatología 2007; 48,12-18 . [ Links ]





![Diagnosis Long-chain hydroxy acyl-CoA dehydrogenase deficiency, by fibroblasts incubation with [9, 10)(N)-³H] palmitic and [9,10)(N)-³H] miristic acids](/img/en/next.gif)