Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Investigaciones Andina
Print version ISSN 0124-8146
Investig. andina vol.15 no.27 Pereira Sept. 2013
Evaluación de la respuesta y seguridad a diferentes esquemas de tratamiento antirretroviral en Colombia
Response assessment and safety of different schemes of Anti-HIV Agents in Colombia
Avaliação da resposta e segurança a diferentes esquemas de tratamento antirretroviral em Colombia
Jorge Enrique Machado Alba*, Xavier Vidal Guitart**
* Grupo de Investigación en Farmacoepidemiología y Farmacovigilancia. Universidad Tecnológica de Pereira-Audifarma S.A. (Colombia) Correo: machado@utp.edu.co
** Programa de doctorado en Farmacología. Universitat Autònoma de Barcelona
Resumen
Introducción: establecer variables asociadas a falla terapéutica, adherencia al tratamiento, cambio de esquema y efectos indeseables asociados al tratamiento de VIH/SIDA.
Métodos: estudio de corte transversal realizado en población de pacientes con diagnóstico de VIH/SIDA en tratamiento antirretroviral de 19 ciudades colombianas afiliados al Sistema General de Seguridad Social en Salud. Se evaluaron variables socio-demográficas, esquemas terapéuticos, tiempo desde inicio de la terapia y cambio de esquema, reporte de falta de adherencia, falla terapéutica y efectos indeseables. Se hicieron análisis bivariados y multivariados.
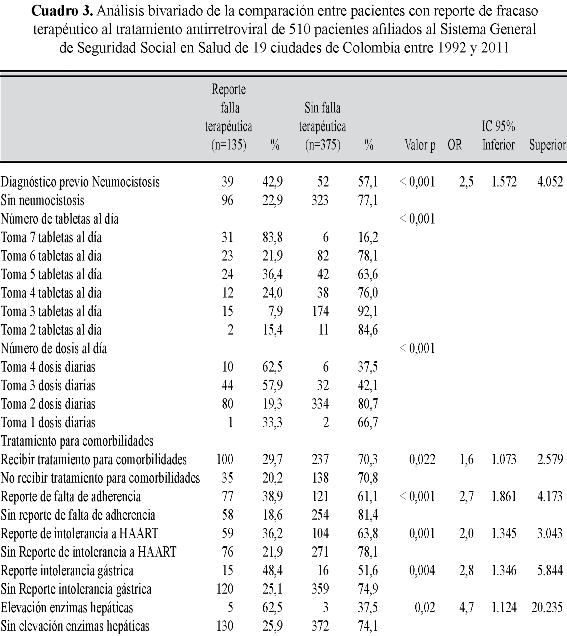
Resultados: se hallaron 510 pacientes; el tratamiento antirretroviral sufrió modificaciones al primer esquema en 56,4% de casos. Se reportó: falta de adherencia en 38,8%, falla terapéutica en 26,5% de pacientes; las reacciones adversas más frecuentes fueron: dislipidemia (14,9%), intolerancia gástrica (9,2%) y anemia (7,1%). El régimen de tratamiento Lamivudina/Zidovudina + Efavirenz se asoció con menor riesgo de cambio de esquema (p<0,001), de falla terapéutica (p<0,001) y de intolerancia (p<0,001). El fracaso terapéutico se asoció con antecedentes de neumocistosis, tomar 7 pildoras al día, repartidas en 3 a 4 dosis diarias, en tratamiento para diferentes comorbilidades, con falta de adherencia y efectos indeseables asociados a los antirretrovirales.
Conclusiones: la identificación de los esquemas de tratamiento asociados con peor tolerabilidad por su riesgo de afectar la adherencia al manejo del VIH, con más tabletas diarias y consumidos varias veces al día, permite orientar la selección de medicamentos que garanticen mayor adherencia y tolerabilidad.
Palabras clave: Infecciones por VIH; Fármacos Anti-VIH; Farmacovigilancia; Toxicidad de Medicamentos; Lamivudina; Zidovudina; Efavirenz (fuente: DeCS)
Abstract
Introduction: estimate variables associated with treatment failure, treatment adherence, schema change and adverse reactions associated with the treatment of HIV/AIDS.
Methods: cross-sectional study conducted in a population of patients with HIV/ AIDS antiretroviral treatment in 19 cities of Colombia affiliates at Social Security System in Health. We assessed socio-demographic variables, treatment regimens, and time from start of therapy and schema change, report non-adherence, treatment failure and adverse reactions. Were used bivariate and multivariate analysis.
Results: we found 510 patients, antiretroviral therapy was modified to the first scheme in 56.4% of cases, nonadherence in 38.8%, treatment failure in 26.5% of patients, and the most common adverse reactions were: dyslipidemia (14.9%), gastric intolerance (9.2%) and anaemia (7.1%). The treatment regimen Lamivudine / Zidovudine + Efavirenz was associated with lower risk of schema change (p <0.001), treatment failure (p <0.001) and intolerance (p <0.001). Treatment failure was associated with a history of pneumocystosis, taking 7 pills a day, divided into 3-4 daily doses, in treatment for different comorbidities, lack of adherence and adverse effects associated with antiretrovirals.
Conclusions: the identification of treatment regimens associated with poorer tolerability for their risk of affecting adherence to HIV management, with more tablets daily and consumed several times a day can guide the selection of drugs to ensure greater adherence and tolerability.
Key words: HIV Infections; Anti-HIV Agents; Pharmacovigilance; Drug Toxicity; Lamivudine; Zidovudine; Efavirenz (source: MeSH).
Resumo
Introdução: estabelecer variavéis associadas à falha terapêutica, aderência ao tratamento, mudança de esquema e efeitos indesejaveis associados ao tratamento de VIH/SIDA.
Métodos: estudo de corte transversal realizado em grupos de pacientes com diagnóstico de VIH/SIDA em tratamento antirretroviral de 19 cidades colombianas filiados ao Sistema Geral de Segurança Social em Saúde. Avaliaram-se variavéis socio-demográficas, esquemas terapêuticos, tempo desde o inicio da terapia e mudança de esquema, anotação sobre falta de aderência, falha terapêutica e efeitos indesejaveis. Foram feitas análises bivariados y multivariados.
Resultados: acharam-se 510 pacientes, e o tratamento antirretroviral sofreu modificações ao primeiro esquema em 56,4% dos casos, se reportou: falta de aderência em 38,8%, falha terapêutica em 26,5% dos pacientes; as reações adversas mais frequentes foram: dislipidemia (14,9%), intolerência gástrica (9,2%) e anemia (7,1%). O regime de tratamento Lamivudina/Zidovudina + Efavirenz se associou com menor risco de mudança de esquema (p<0,001), de falha terapêutica (p<0,001) e de intolerância (p<0,001). O fracasso terapêutico se associou com antecedentes de neumocistosis, tomar 7 comprimidos por dia, distribuido em 3 a 4 doses diárias, em tratamento para diferentes comorbilidades, com falta de aderência e efeitos indesejados associados aos antirretroviraies.
Conclusões: a identificação dos esquemas de tratamento associados com pior tolerância pelo risco de afetar a aderência ao tratamento do VIH, com mais comprimidos diários e consumidos várias vezes ao dia, permite orientar a seleção de medicamentos que garantam maior aderência e tolerabilidade.
Palavras Chave: Infecções por VIH; Farmacos Anti-VIH; Farmacovigilância; Toxicidade de Medicamentos; Lamivudina; Zidovudina; Efavirenz (fonte: DeCS).
Fecha de recibo: Diciembre/2012
Fecha aprobación: Junio/2013
Introducción
En el año 2010 se estimó que unos 34 millones de personas convivían con la infección por VIH/SIDA, con muertes por esta causa de unos 1,8 millones (1). En Colombia se reportó para el año 2011 aproximadamente 75.620 casos de VIH/ SIDA (2).
Cada vez más personas acceden a la terapia antirretroviral y se calcula que 6.650.000 actualmente la reciben, lo cual se asocia con una disminución en el número de fallecidos a consecuencia de la enfermedad y con mayor sobrevida, lo que contribuye a una reducción en el número de personas que cada año contraen la infección por el virus (1, 2).
El manejo del VIH/SIDA se basa en el empleo de medicamentos antirretrovirales (HAART por terapia antirretroviral altamente activa según sigla en inglés), con la cual se logra una importante efectividad para mantener bajas o nulas cargas virales. Sin embargo, algunos factores como defectos en la inmunidad del individuo, la capacidad viral de generar resistencia, la intolerancia a los fármacos y la falta de adherencia al tratamiento, llevan a reducir los resultados satisfactorios esperados (35). La efectividad se determina con la evaluación de la respuesta mediante la medición de la carga viral, que debe ser indetectable o menor de 50 copias/mL para considerarse óptima (5, 6).
En Colombia se emplea una gran diversidad de esquemas antirretrovirales, incluso en combinaciones que superan en número a las recomendadas por las guías nacionales de tratamiento de VIH/SIDA y del Programa Conjunto de las Naciones Unidas (1), pero también se encuentra que los antirretrovirales utilizan las dosis diarias definidas (DDD) que recomienda la Organización Mundial de la Salud (OMS) en los intervalos de tiempo apropiados, pero con escaso acceso a las pruebas de resistencia del virus (5-8).
Esta investigación se realiza con una muestra aleatoria de la misma población de un estudio previo sobre todos los pacientes afiliados a una Empresa Promotora de Salud (EPS) de Colombia, que estuviesen en tratamiento antirretroviral hasta abril de 2011. Se evaluaron las variables asociadas con la respuesta, el fracaso terapéutico y la seguridad de los esquemas empleados (5). Para ello se propuso establecer el porcentaje de pacientes que tuviesen reporte de falla terapéutica, el grado de adherencia al tratamiento, la necesidad de cambio de esquema y la incidencia de efectos indeseables asociados a la medicación, con el fin de mejorar la calidad de la atención del programa de VIH/SIDA.
Materiales y métodos
Estudio de corte transversal realizado en una población de 510 pacientes, que corresponde a la totalidad de personas con diagnóstico de infección por VIH que se encontraban en tratamiento antirretroviral de 19 ciudades (Armenia, Barranquilla, Bogotá, Bucaramanga, Cali, Cartagena, Cúcuta, Girardot, Ibagué, Manizales, Medellín, Montería, Neiva, Pereira, San José de Guaviare, Santa Marta, Sincelejo, Valledupar y Villavicencio) y afiliados al Régimen Contributivo del Sistema General de Seguridad Social en Salud (SGSSS) de Colombia de una Empresa Promotora de Salud (EPS) entre enero de 1996 y abril de 2011.
Previo consentimiento informado, un médico entrenado se encargó de la recolección de la información desde la historia clínica y los registros de laboratorio de cada paciente; se tuvieron en cuenta las siguientes variables:
a- Demográficas: edad, sexo, estado civil, tiempo de evolución de la enfermedad (en meses), diagnóstico durante el embarazo.
b- Esquemas de tratamiento empleados con sus dosis expresadas en medida usual y en DDD, tiempo transcurrido entre el diagnóstico y el inicio de la terapia, tiempo transcurrido desde el inicio de la terapia y la necesidad de cambio de la misma (antes de un año, entre uno y dos años o después de dos años).
c- Reporte de falta de adherencia.
d- Reporte de falla terapéutica.
e- Reporte de efectos indeseables asociados al uso de los antirretro-virales.
f- Reporte de complicaciones por causa de la infección por VIH (infección por oportunistas, hospitalizaciones, cáncer).
g- El costo directo del tratamiento mensual.
El trabajo contó con el aval de la EPS y del Comité de Bioética de la Universidad Tecnológica de Pereira, y se enmarca en la categoría de investigación sin riesgo según la resolución No. 8430 de 1993 del Ministerio de Salud de Colombia, que establece las normas científicas, técnicas y administrativas para la investigación en salud.
Para el análisis de los datos se utilizó el paquete estadístico SPSS® 19.0 (IBM, USA) para Windows. Los estadísticos descriptivos utilizados fueron: media, desviación estándar y valores máximo y mínimo para las variables continuas, y porcentajes para las variables categóricas. Se manejó la prueba de chi al cuadrado para la comparación de variables categóricas. Se aplicaron modelos de regresión logística binaria aplicando como variables dependientes en cada caso el esquema de tratamiento antirretroviral, el tiempo transcurrido para el cambio de esquema y el reporte de falla terapéutica. Para determinar el tiempo transcurrido desde el inicio hasta el cambio de esquema, se empleó el método de Kaplan-Meier. Se predeterminó el nivel de significancia estadística en p<0,05.
Resultados
Se encontró un predominio de personas de sexo masculino (383 [75,1%] hombres y 127 [24,9%] mujeres con una relación 3:1), con edad promedio de 41,0±11,4 años, estado civil acompañado (n=295, 57,8%) y solo (n=215, 42,2%); tiempo de evolución de la enfermedad en promedio de 72,8±44,2 meses, tiempo promedio entre el diagnóstico e inicio del HAART de 9,2±17,8 meses, tiempo promedio de duración del tratamiento de 63,4±38,4 meses. En 21 casos (16,5% de las mujeres) se hizo el diagnóstico de la infección por VIH durante los controles de embarazo.
Según los grupos de fármacos se observó que predominan los Inhibidores Nucleósidos de la Transcriptasa Inversa (INTR) (n=1071, 62,1%), Inhibidores de Proteasa (n=362, 21,0%), Inhibidores No Nucleósidos de la Transcriptasa Inversa (INNTR) (n=279, 16,2%), Inhibidores de la Integrasa (Raltegravir, n=10, 0,6%), Inhibidores de la fusión (Enfuvirtide, n=4, 0,2%).
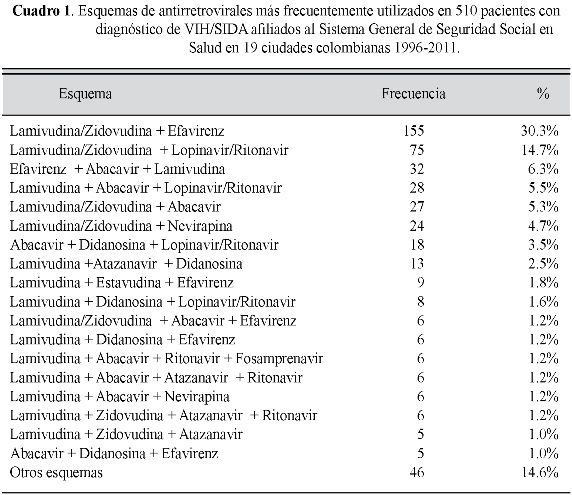
En el cuadro1 se observan los esquemas de HAART más frecuentemente empleados. Para 510 pacientes se hallaron 64 esquemas diferentes. (Cuadro 1)
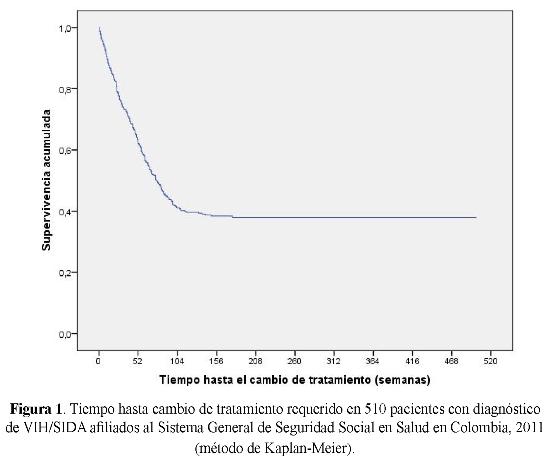
Se observó que el tratamiento antirretroviral sufrió modificaciones al primer esquema que recibió el paciente en 288 casos (56,4%), distribuidos en: cambio durante el primer año (n=187, 36,7% del total de pacientes), entre uno y dos años (n=92, 18,0%) y en más dos años (n=9, 1,8) y los restantes 222 pacientes (43,6%) continuaban con la terapia original (ver figura 1).
La falta de adherencia se reportó en 198 pacientes (38,8% de los casos); se incluyeron como posibles causas: el desconocimiento de la importancia de no suspenderla, la pérdida del estado de afiliado al SGSSS y la intolerancia. Se registró falla terapéutica en 135 casos (26,5%), lo cual obligó a replantear el esquema HAART empleado. El porcentaje de efectividad de la terapia antirretroviral con carga viral indetectable o menor de 50 copias/mL, se estimó en 65,3% de pacientes.
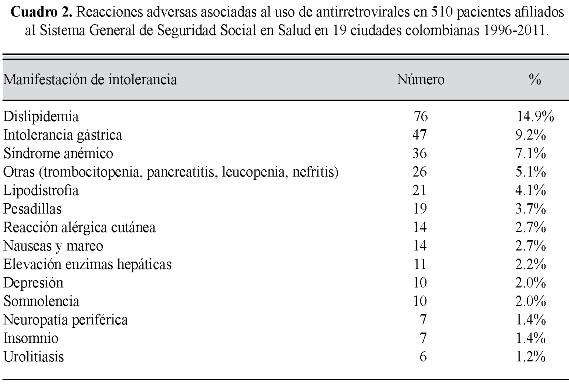
Los eventos indeseables reportados con mayor frecuencia pueden observarse en el cuadro 2.
También se encontró que 216 pacientes (42,3%) tenían antecedente de hospitalización alguna vez a consecuencia del VIH o complicaciones asociadas, y de estos 161 casos (74,5% de los egresos) tuvo una sola internación; 37 (17,1%) fueron internados en dos ocasiones; 15 (6,9%) en tres ocasiones, pero hubo casos de 4 a 6 hospitalizaciones.
Cinco pacientes tenían como antecedente desarrollo de algún tipo de neoplasia, tales como carcinoma gástrico, de cuello uterino o linfoma Hodgkin, y cuatro más un Sarcoma de Kaposi; otras 17 (3,2%) personas tenían co-infección diagnosticada con el virus de la hepatitis B. Las infecciones por oportunistas más comunes fueron candidiasis (n=162, 31,8%) y neumocistosis (n=91, 17,8%).
Comparación por esquemas de tratamiento
El esquema de tratamiento Lamivudina/ Zidovudina+Efavirenz se asoció de manera estadísticamente significativa con menor riesgo de que el manejo sea modificado (19,9% Vs. 72,1% otros esquemas; p<0,001); menor riesgo de falla terapéutica (6,6% Vs. 36,0% otros esquemas; p<0,001, RR:0,1; IC95%:0,066-0,241); menor riesgo de intolerancia (11,4% Vs. 41,9% otros esquemas; p<0,001, RR:0,2; IC95%:0,106-0,303), entre ellos de intolerancia gástrica (1,8% Vs. 8,1% otros esquemas; p:0,005, RR: 0,2; IC95%:0,062-0,693), síndrome anémico (0,0% Vs. 9,3% otros esquemas; p<0,001, RR:0,9; IC95%:0,877-0,928) y pesadillas (0,0% Vs. 3,5% otros esquemas; p:0,015, RR:0,96; IC95%: 0,946-0,985) y finalmente con menor riesgo de sufrir hospitalizaciones a consecuencia de complicaciones del VIH/SIDA (33,1% Vs. 45,9% otros esquemas; p:0,006, RR:0,6; IC95%:0,396-0,859).
Mientras que el esquema Lamivudina/ Zidovudina+Lopinavir/Ritonavir se asoció con mayor riesgo de desarrollar dislipidemia (13,3% Vs. 4,8% otros esquemas; p:0,004, RR:3,0; IC95%: 1,367-6.731) y urolitiasis asociada al uso de antirretrovirales (4,0% Vs. 0,7% otros esquemas; p:0,014, RR:6,0; IC95%:1,188-30,307), pero menor riesgo de síndrome anémico (0,0% Vs. 7,4% otros esquemas; p:0,015, RR:0,92; IC95%:0,902-0,951). El esquema Lamivudina+Abacavir+Efavirenz se asoció con menor riesgo de reporte de falta de adherencia (15,6% Vs. 40,4% otros esquemas; p:0,005, RR:0,3; IC95%:0,104-0,723), pero mayor riesgo de desarrollar síndrome anémico (18,8% Vs. 5,4% otros esquemas; p:0,003, RR:4,0; IC95%:1,518-10,601).
El modelo Lamivudina+Abacavir+ Lopinavir/Ritonavir se asoció a mayor riesgo de reporte de falla terapéutica (44,4% Vs. 25,5% otros esquemas; p:0,03, RR:2,3; IC95%:1,067-5,140) y el esquema Lamivudina/Zidovudina+Abacavir se asoció con un menor riesgo de sufrir hospitalizaciones a consecuencia de complicaciones por VIH/SIDA (22,2% Vs. 42,9% otros esquemas; p:0,034, RR:0,4; IC95%:0,151-0,961).
El esquema Lamivudina/Zidovudina+ Nevirapina también se asoció con menor riesgo de reporte de falla terapéutica (4,2% Vs. 27,6% otros esquemas; p:0,011, RR:0,1; IC95%:0,015-0,854) y menor riesgo de ser hospitalizado (20,8% Vs. 42,8% otros esquemas; p:0,033, RR:0,3; IC95%:0,129-0,957).
Mientras que al esquema Abacavir+ Didanosina+Lopinavir/Ritonavir se asoció a mayor frecuencia de reportes de falta de adherencia (72,2% Vs. 37,6% otros esquemas; p:0,003, RR:4,3; IC95%:1,514-12,298).
Comparación según tiempo transcurrido entre inicio del tratamiento antirretroviral y el cambio de esquema terapéutico.
Los cambios de esquema en un periodo menor de un año se asociaron con reporte de intolerancia gástrica (9,9% Vs. 3,8% otros tiempos de cambio de esquema; p:0,005, RR:2,8; IC95%:1,328-5,907), síndrome anémico (13,5% Vs. 1,9%; p<0,001, RR:8,1; IC95%:3,287-20,182), pesadillas (4,2% Vs. 1,3%; p:0,036, RR:3,4; IC95%:1,014-11,491), falta de adherencia (47,4% Vs. 33,6%; p:0,002, RR:1,8; IC95%:1,213-2,563) y reporte de falla terapéutica (35,4% Vs. 21,1%; p<0,001, RR:2,0; IC95%:1,377-3,065).
Cuando el cambio de esquema se dio entre el primero y segundo año de iniciado el tratamiento, se encontró una asociación estadísticamente significativa con intolerancia gástrica (12,9% Vs. 4,6% otros tiempos de cambio de esquema; p:0,002, RR:3,1; IC95%:1,450-6,644), lipodistrofia (6,5% Vs. 1,7%; p:0,008, RR:4,0; IC95%:1,325-12,315), elevación de enzimas hepáticas (5,4% Vs. 0,7%; p:0,001, RR:7,8; IC95%:1,840-33,418), urolitiasis (5,4% Vs. 0,2%; p<0,001, RR:23,6; IC95%:2,728-204,814), falta de adherencia (54,8% Vs. 35,3%; p<0,001, RR:2,2; IC95%:1,415-3,516) y falla terapéutica (59,1% Vs. 19,2%; p<0,001, RR:6.0; IC95%:3,773-9,853).
El cambio de esquema después de dos años de iniciado el tratamiento se asoció con reacciones de hipersensibilidad (10,0% Vs. 1,6% otros tiempos de cambio de esquema; p:0,046, RR:6.8; IC95%:0,772-60,504), urolitiasis (10,0% Vs. 1,0%; p:0,009, RR:11,0; IC95%:1,164-103,944) y falla terapéutica (70,0% Vs. 25,6%; p:0,002, RR:6,7; IC95%:1,728-26,616).
El esquema de tratamiento Lamivudina/ Zidovudina+Efavirenz se asoció con menor riesgo de cambio antes del primer año (16,1% Vs. 42,5% otros esquemas; p<0,001, RR:0,27; IC95%:0,167-0,407), mientras que los esquemas Lamivudina/ Zidovudina+Abacavir(8,9% Vs. 3,1% otros esquemas; p:0,005, RR:2,9; IC95%:1,341-6,678) y Lamivudina/ Zidovudina+Abacavir+Efavirenz (2,6% Vs. 0,3% otros esquemas; p:0,020, RR:8,4; IC95%:0,983-73,102) con un mayor riesgo.
El mismo esquema Lamivudina/ Zidovudina+Efavirenz se asoció con menor riesgo de cambio entre uno y dos años (14,0% Vs. 36,7% otros esquemas; p<0,001, RR:0,3; IC95%:0,151-0,521), mientras que Abacavir+Didanosina+Lopinavir/ Ritonavir (8,6% Vs. 2,4% otros esquemas; p:0,003, RR:3,8; IC95%:1,469-9,991) y Lamivudina+Didanosina+Efavirenz(3, 2% Vs. 0,7% otros esquemas; p:0,043, RR:4,6; IC95%:0,914-23,163) con un riesgo incrementado.
Comparación según reporte de falla terapéutica
Las variables que se asociaron con mayor riesgo de falla terapéutica se pueden observar en el cuadro 3.
Los esquemas que se asociaron con menor riesgo de falla terapéutica fueron Lamivudina/Zidovudina+Efavirenz (6,6% Vs. 36,0% otros esquemas; p<0,001, RR:0,1; IC95%:0,066-0,241) y Lamivudina/Zidovudina+Nevirapina (4,2% Vs. 27,6% otros esquemas; p:0,011, RR:0,1; IC95%:0,015-0,854), pero los esquemas Lamivudina+ Abacavir+Lopinavir/Ritonavir (44,4% Vs. 25,5% otros esquemas; p:0,030, RR:2,3; IC95%:1,067-5,140) y Lamivudina+Didanosina+Lopinavir/Ritonavir (87,5% Vs. 25,5% otros esquemas; p<0,001, RR:20,4; IC95%:2,492-167,841) mostraron un mayor riesgo a que se reportase el fracaso en el tratamiento.
Recibir un tratamiento cuyo costo es mayor de US$ 275 mensuales (tasa representativa del mercado a 30 de abril de 2011: US$ 1 = 1813 pesos colombianos) (61,5% Vs. 23,6% otros esquemas; p<0,001, RR:5,2; IC95%:2,631-10,236) se asoció con mayor riesgo de reporte previo de fracaso, y el riesgo fue menor con los esquemas inferiores de US$ 275 (14,9% Vs. 70,8% otros esquemas; p<0,001, RR:0,07; IC95%:0,044-0,119). La falla terapéutica se asoció de manera significativa especialmente con el cambio de esquema después de dos años de tratamiento (70,0% Vs. 25,6% otros esquemas; p:0,002, RR:6,7; IC95%:1,728-26,616).
Discusión
El tratamiento HAART cambió definitivamente el pronóstico de los pacientes con VIH/SIDA y logró convertirlo de incurable a una enfermedad crónica controlable, lo que lleva a que tenga los mismos problemas de falta de adherencia descritos para la diabetes, la hipertensión arterial, la tuberculosis y otras (1, 4). El registro de pobre adherencia en el 38,8% de los pacientes se encuentra en el rango reportado por otros estudios que lo sitúan entre 23,0% y 55,0% (9-12). Las razones descritas por los pacientes para no adherirse al tratamiento como el desconocimiento de la importancia de su continuidad y la intolerancia, son similares a lo reportado por Dube NM et al (10) y Crabtree-Ramírez B et al (13), pero la condición de pérdida del estado de aseguramiento al SGSSS solo es una situación similar a la expuesta por Pádua CA. et al en Brasil, donde se asoció la falta de continuidad del tratamiento con la pérdida del empleo (14).
También debe considerarse que el abuso de alcohol, el número de píldoras que corresponde tomar al día y la necesidad de cambio del esquema, pueden influir en la adhesión a la terapia (12). Cabe resaltar que el esquema Lamivudina+Abacavir+Efavirenz, se asoció con menor riesgo de reporte de falta de adherencia y es uno de los sugeridos como elección para comenzar el tratamiento por la OMS (1).
Los grupos de medicamentos son los mismos que se reportaron en trabajos previos hechos en el país, que muestran incluso similar variedad de asociaciones y el empleo inicial de los esquemas recomendados por la OMS, y equivalente al que se encontró en Venezuela (1, 5, 8, 15). Es llamativa la gran cantidad de regímenes utilizados, lo cual ya se registró en Italia, donde los médicos tratantes incluso prescriben esquemas no sugeridos por las guías (16).
El fallo terapéutico es temido por los clínicos del mundo entero pues eleva la morbilidad, las hospitalizaciones, la mortalidad y obliga a replantear el manejo farmacológico, muchas veces por esquemas más costosos (17-19). En este caso se reportó que alrededor del 26,5% de los pacientes tuvieron un fracaso en la terapia emprendida, lo que obligó a seleccionar nuevos esquemas que permitieran lograr el control de la infección. Los esquemas Lamivudina/Zidovudina+Efavirenz y Lamivudina/ Zidovudina+Nevirapina que se asociaron con menor riesgo de falla terapéutica, coinciden con ser parte de los sugeridos como primera línea por la OMS (1, 19). Otros estudios muestran alguna asociación entre fracaso y edad menor de 30 años y con el sexo femenino, lo que no se presentó en esta cohorte; también se relaciona con el uso de un INNTR y con falta de adherencia como sí ocurrió en este caso (13, 20).
Debe considerarse que la aparición de toxicidad es la razón principal de cambios de régimen, incluso de los de primera línea (10). Las reacciones adversas reportadas en este estudio son menos frecuentes que las mostradas por otros autores como fueron dislipidemia (14,9% Vs. 25,0%), síndrome anémico (7.1% Vs. 16,2-30,5%), lipodistrofia (4,1% Vs. 23,9%), neuropatía periférica (1.4% Vs. 10,6%), rash (2,7% Vs. 8,3%-18,3), alteraciones renales (1,2% Vs. 16,6%), pesadillas (3,7% Vs. 22,2), intolerancia gástrica (9,2% Vs. 32,1%), nauseas (2,7% Vs. 51,2%) e insomnio (1,4% Vs. 32,1%), lo cual puede mostrar diferencias entre las poblaciones o un subregistro de las manifestaciones de intolerancia en nuestro país (10, 1315, 20, 21). El esquema Lamivudina/ Zidovudina+Efavirenz, hizo parte del grupo de pautas que mostraron menor riesgo de desarrollar efectos indeseables, situación contraria a la que expuso Pádua et al, que asocia a efavirenz con frecuente aparición de reacciones adversas (20).
Los esquemas de tratamiento preferidos tras el fracaso fueron Lamivudina+Abacavir+Lopinavir/ Ritonavir y Lamivudina+Didanosina+ Lopinavir/Ritonavir, lo cual difiere de algunas de la recomendaciones que incorporan esquemas de segunda línea que proponen a Zidovudina y Tenofovir asociados a Lopinavir/Ritonavir. Dichos esquemas además de ser más costosos se han asociado con mayor frecuencia que otros a reacciones adversas (10).
La elevada frecuencia del antecedente de ser hospitalizado a consecuencia de la infección o las complicaciones asociadas difiere de los mostrado por Padua et al (42,3% Vs. 10,3% a 24,4%) en poblaciones de Brasil, situación que debe estar ligada a la calidad de la atención ambulatoria, al nivel de control de la infección, al estado inmunológico alcanzado con la terapia y a la oportunidad en la prestación de los servicios de cuidado de la salud por parte de las instituciones responsables (14, 20).
Existen datos que relacionan el uso del esquema Lamivudina/Zidovudina+ Efavirenz con ser menos rentable, más costoso y menos eficaz que un régimen que contenga Tenofovir+Lamivudina+N evirapina, lo cual no pudo ser evaluado en este trabajo por el escaso uso de tenofovir al momento de la recolección de la información (22).
En principio debe considerarse que la HAART reduce los costos del cuidado médico de los pacientes con VIH/SIDA, como resultado de la disminución en la incidencia de infecciones oportunistas y la correspondiente disminución en la atención intrahospitalaria de estos. Sin embargo, no debe olvidarse que para conducir una adecuada terapia es necesario realizar algunas pruebas de laboratorio rutinarias que resultan costosas, tales como la medición de carga viral, test de resistencia a los fármacos e incluso monitoreo de niveles sanguíneos de estos, útiles para optimizar el tratamiento. Adicionalmente el uso de HAART conlleva efectos adversos que pueden requerir tratamientos también costosos (18).
Ensayos clínicos y estudios observacionales han demostrado que cerca del 50% de los pacientes que reciben terapia antirretroviral, no alcanzan a largo plazo una supresión completa en la carga viral, por razones que incluyen la dificultad para adherirse a la terapia, el desarrollo de resistencia y la aparición de efectos indeseables a los medicamentos. Estos pacientes se ven obligados a cambiar por una combinación de antirretrovirales diferente, siendo varias veces manejados con regímenes más agresivos, que frecuentemente incluyen un número mayor de medicamentos, que elevan los costos y la toxicidad (18). También, se ha encontrado que el tratamiento mejora la calidad de vida y reduce el ausentismo laboral, lo cual disminuye también los costos para un sistema sanitario que como el colombiano está basado en el aseguramiento. En consecuencia, debería considerarse la necesidad de realizar evaluaciones económicas en general y análisis de costo efectividad en particular, como metas para la toma decisiones de los mejores medicamentos (16, 18, 23).
Entre las limitaciones de este trabajo se encuentra que se trata de una población cautiva afiliada al régimen contributivo del SGSSS y por lo tanto las conclusiones solo son aplicables a personas con similares características; no se hizo un análisis de costos derivados por la atención sanitaria y solo se incluyeron los costos directos de los medicamentos, además la información fue obtenida de las historias clínicas lo cual puede subestimar la aparición de reacciones adversas medicamentosas por falta de su registro.
De acuerdo a los resultados de este estudio, se pueden definir los rasgos prevalentes de los pacientes con fracaso terapéutico al HAART, como individuos con antecedentes de haber sufrido neumocistosis, tomar 7 píldoras de diferentes fármacos al día repartidas en 3 a 4 dosis diarias, en tratamiento para diferentes comorbilidades con reporte de falta de adherencia, aparición de efectos indeseables asociados a alguno de los antirretrovirales, en particular intolerancia gástrica y elevación de enzimas hepáticas, que estaban recibiendo los esquemas Lamivudina+Abacavir+Lopinavir/ Ritonavir y Lamivudina+Didanosina+ Lopinavir/Ritonavir. Mientras que los pacientes que estaban recibiendo los esquemas Lamivudina/ Zidovudina+Efavirenz y Lamivudina/ Zidovudina+Nevirapina, tuvieron menor riesgo de presentar un fracaso terapéutico, los cuales son ampliamente recomendados por la OMS (1).
La identificación de los esquemas de tratamiento asociados con peor tolerabilidad por su riesgo de afectar la adherencia al manejo del VIH, además de aquellos que requieren de más tabletas diarias y que deben ser consumidos varias veces al día, permite orientar la selección de pautas de manejo más adecuadas con medicamentos que brinden mayor seguridad y garanticen que el paciente se adhiera satisfactoriamente, lo cual incluso puede a largo plazo reducir los costos de la atención sanitaria. Además es importante buscar e identificar oportunamente los pacientes con fracaso terapéutico para reducir el riesgo de esquemas aún más costosos, al igual que la notificación temprana de las reacciones adversas medicamentosas que puedan obligar al paciente a abandonar la terapia, lo cual elevaría la probabilidad de fracaso (16, 18, 23). Se requieren más estudios que tomen poblaciones mayores y de los diferentes regímenes de salud que existen en el país.
Referencias
1. WHO U, Unicef. Global HIV/AIDS response. Epidemic Update and Health Sector Progress Level Progress Towards Universal Access Progress Report 20112011. [ Links ]
2. Ministerio de Protección Social Colombia. Seguimiento de la Declaración de compromiso sobre el VIH/SIDA, Informe UNGASS-2010. 2010. p. 6-182. [ Links ]
3. Clavel F, Hance A. HIV drug resistance. New England Journal of Medicine 2004; 350 (10):1023-35. [ Links ]
4. Murphy E, Collier A, Kalish L, Assmann S, Para M, Flanigan T, et al. Highly active antiretroviral therapy decreases mortality and morbidity in patients with advanced HIV disease. Annals of internal medicine 2001; 135 (1):17-26. [ Links ]
5. Machado-Alba J, Vidal X. Effectiveness of antiretroviral treatment in Colombia. Revista Panamericana de Salud Pública 2012;32 (5):360-7. [ Links ]
6. Díaz C. Guía para el manejo del VIH/SIDA basado en la evidencia Colombia. Ministerio de protección social; 2006. [ Links ]
7. Machado-Alba J, Alzate J. Patrones de prescripción de antirretrovirales en 997 pacientes colombianos. Biomédica 2008; 28 (1):78-86. [ Links ]
8. Machado-Alba J, González D, Vidal X. Effectiveness of antiretroviral treatment in patients from Pereira and Manizales. Revista de Salud Pública 2011;13 (3):492-503. [ Links ]
9. Scanlon M, Vreeman R. Current strategies for improving access and adherence to antiretroviral therapies in resource-limited settings. HIV/ AIDS (Auckland, NZ)2013;5:1. [ Links ]
10. Dube M, Summers R, Tint K-S, Mayayise G. A pharmacovigilance study of adults on highly active antiretroviral therapy, South Africa: 2007-2011. Pan African Medical Journal 2012; 11 (1). [ Links ]
11. Musiime S, Muhairwe F, Rutagengwa A, Mutimura E, Anastos K, Hoover D, et al. Adherence to highly active antiretroviral treatment in HIV-infected Rwandan women. PloS one 2011;6 (11):e27832. [ Links ]
12. Bonolo P, César C, Acúrcio F, Ceccato M, Menezes C, Álvares J, et al. Non-adherence among patients initiating antiretroviral therapy: a challenge for health professionals in Brazil. AIDS 2005;19: S5-S13. [ Links ]
13. Crabtree-Ramírez B, Villasís-Keever A, Galindo-Fraga A, del Río C, Sierra-Madero J. Effectiveness of highly active antiretroviral therapy (HAART) among HIV-infected patients in Mexico. AIDS research and human retroviruses 2010; 26 (4):373-8. [ Links ]
14. Pádua C, César C, Bonolo P, Acurcio F, Guimarães M. Self-reported adverse reactions among patients initiating antiretroviral therapy in Brazil. Brazilian Journal of Infectious Diseases 2007; 11 (1):20-6. [ Links ]
15. Lugo L, Miquilareno M, Figueredo A, Silva M, Rodríguez Morales A. Respuesta a la terapia antirretroviral altamente activa en pacientes de 50 años de edad o más viviendo con infección VIH/SIDA; Highly actve antirretroviral therapy responce in patients over 50 years old living with HIV/AIDS infection. Gac. med Caracas 2012; 120 (4):292-301. [ Links ]
16. Ammassari A, Angeletti C, Murachelli S, Girardi E, Antinori A. Prescription patterns and costs of antiretroviral therapy in HIV-infected native patients: theoretical impact of a regional therapeutic protocol. Journal of the International AIDS Society 2012; 15 (6):18392. [ Links ]
17. Fernández L, Fernández L, Romero S. Rate of genotypic mutations and resistance to antiretroviral drugs in a general hospital. Farmacia Hospitalaria (English Edition) 2011;35 (4):191-6. [ Links ]
18. Yazdanpanah Y. Costs associated with combination antiretroviral therapy in HIV-infected patients. Journal of Antimicrobial Chemotherapy 2004; 53 (4):558-61. [ Links ]
19. El-Sadr W, Lundgren J, Neaton J, Gordin F, Abrams D, Arduino R, et al. CD4+ count-guided interruption of antiretroviral treatment. New Engl J Med2006; 355 (22):2283-96. [ Links ]
20. Pádua C, Cesar C, Bonolo P, Acurcio F, Guimarães M. High incidence of adverse reactions to initial antiretroviral therapy in Brazil. Brazilian journal of medical and biological research 2006; 39 (4):495-505. [ Links ]
21. Agarwal D, Chakravarty J, Chaube L, Rai M, Agrawal N, Sundar S. High incidence of zidovudine induced anaemia in HIV infected patients in eastern India. Indian J Med Res 132, 2010:386-9. [ Links ]
22. Bendavid E, Grant P, Talbot A, Owens D, Zolopa A. Cost-effectiveness of antiretroviral regimens in the World Health Organization's treatment guidelines: a South African analysis. AIDS (London, England) 2011; 25 (2):211. [ Links ]
23. Gardner E, Maravi M, Rietmeijer C, Davidson A, Burman W. The association of adherence to antiretroviral therapy with healthcare utilization and costs for medical care. Applied health economics and health policy 2008; 6 (2-3):145-55. [ Links ]