Introducción
Una biopelícula o 'Biofilm' es una comunidad microbiana sésil, compuesta de células adheridas a un sustrato de manera irreversible, incrustada en una matriz de sustancias poliméricas extracelulares producidas por si mismas1-5; se pueden encontrar en todos los ambientes y representan hoy uno de los principales desafíos en entornos tanto industriales como médicos6, donde se han relacionado desde el desarrollo de placa dental, hasta convertirse en causantes de endocarditis7. Dentro de las ventajas que representa para un microorganismo estar incluido en una biopelícula, se encuentra la protección contra el medio ambiente, la disponibilidad de nutrientes, cooperación en el metabolismo, así como el intercambio genético, lo cual le asegura una supervivencia a través del tiempo8 y por lo tanto su presencia en un organismo vivo puede desencadenar una infección crónica9.
Las biopelículas se han podido aislar desde dispositivos médicos como catéteres venosos centrales, tubos endotraqueales2, válvulas cardíacas artificiales, prótesis articulares10, lentes o marcapasos, hasta del medio ambiente11, así como en plástico, vidrio, metal, minerales, sistemas de aguas8,12 e incluso se han visto involucrados en sistemas de suministro de agua en unidades dentales13. De igual manera en plantas, animales y humanos en los cuales son responsables de infecciones tanto agudas como crónicas4,14,15. Estudios refieren como ejemplo clásico de biopelícula la caries dental o placa bacteriana16, la cual si no es controlada a tiempo puede llegar a causar periodontitis 17.
Las biopelículas son motivo de preocupación comercial, ya que están involucradas en la obstrucción de tuberías y corrosión de cascos de buques, así como en los sistemas de producción acuícola4,14. Otros estudios refieren su presencia en alimentos tales como mariscos y lácteos, causando intoxicaciones que pueden llevar a la muerte19,20.
Sin embargo, no todo es perjudicial en ellas; también ofrecen grandes beneficios, por ejemplo, su uso en el manejo de aguas residuales, fugas de gas y remediación en suelos contaminados y aguas21. Son conocidas por su potencial para convertir los materiales derivados de la agricultura en productos de valor comercial, como alcoholes y ácidos orgánicos. De igual manera, se ha observado que las biopelículas juegan un papel importante en la producción de alimentos, ya que se logra obtener vinagre comercial utilizando varias especies de bacterias productoras de ácido acético. Este tipo de vinagre es valorado por su mayor calidad organoléptica, en comparación con el vinagre producido por otro tipo de procesos22.
En cuanto a las poblaciones de microorganismos que pueden hacer parte de una biopelícula, estas consiguen ser de una sola especie bacteriana o frecuentemente se componen de diferentes especies que colectivamente dan lugar a una comunidad; y en otros casos, logran estar embebidos hongos y algas4,23,24.
Se ha observado que las bacterias que viven en una biopelícula son más resistentes a los antibióticos, que aquellas que viven de forma libre; su resistencia se debe en gran medida a que las subpoblaciones de microorganismos que las integran poseen un metabolismo menos activo y por lo tanto baja susceptibilidad a los fármacos, los cuales se dirigen a microorganismos de rápido crecimiento25. De igual manera, otros estudios refieren que esta resistencia puede estar dada por la adquisición de nuevos genes de otros microorganismos que están embebidos en la biopelícula26 y por ende generan multi-resistencia a los tratamientos convencionales27,28.
Debido a esta gran variedad de microorganismos que tienen la capacidad de producir biopelículas y afectar la salud humana, se hace necesario recopilar información reciente y detallada que aporte un amplio conocimiento de cómo hoy en día las bacterias han desarrollado diferentes mecanismos más complejos y hacen que sus niveles de patogenicidad aumenten paulatinamente por procesos de simbiosis, se adapten a diferentes medios y se conviertan en un problema emergente para la salud humana.
Materiales y métodos
Estrategia de búsqueda: para obtener la información necesaria y dar respuesta al objetivo planteado sobre la descripción de las principales características de las biopelículas relacionadas con procesos patológicos en humanos se realizó una investigación teórica de tipo 'revisión sistemática de la literatura científica', en conformidad con la declaración PRISMA, en la cual se postulan de manera clara y explícita los pasos y la validez del proceso metodológico29.
El objetivo principal es disminuir al máximo el riesgo de sesgo; por tanto se estableció un límite de búsqueda en años de artículos publicados desde el 2005 hasta el 2015, escritos en inglés. Se llevó a cabo una búsqueda en las siguientes bases de datos electrónicas: Science Direct y PubMed.
Por sensibilidad y con el objeto de utilizar la terminología adecuada para la búsqueda y permitir encontrar toda la información relacionada con el tema, se emplearon descriptores DeCS/MeSH
Por especificidad se planteó una ruta de búsqueda, utilizando la combinación de los descriptores encontrados mediante operadores booleanos.
En cuanto a exhaustividad se utilizaron descriptores No DeCS; de igual manera se incluyó literatura gris obtenida en el buscador genérico Google Scholar, eligiendo investigaciones halladas con la ruta de búsqueda establecida que no se encontraran publicadas en revistas indexadas.
Los descriptores de búsqueda planteados fueron: biofilm, biofilms, pathogenicity, humans, "environment, degradation" y su combinación en la ruta de búsqueda fue la siguiente para cada una de las bases de datos elegidas:
Science Direct
2004 and TITLE-ABSTR-KEY(biofilm OR biofilms) AND ABSTRACT(pathogenicity) AND (humans) AND NOT "environment, degradation" PUBMED ((((biofilm(Title/Abstract) OR biofilms(Title/Abstract))) AND (pathogenicity(Title/Abstract) AND humans(Title/Abstract))) NOT "environment, degradation"(All Fields))
Criterios de elegibilidad de los artículos: el proceso de selección de los artículos para la revisión sistemática comienza con la fase de elegibilidad, que se definió a partir de la aplicación de criterios de inclusión y exclusión. Como criterios de inclusión se definió que los artículos fueran originales, publicados en los últimos 10 años, escritos en inglés, que describieran el proceso de formación de las biopelículas en humanos, identificaran a los microorganismos presentes en las biopelículas, definieran el mecanismo de acción en el proceso patológico en humanos, y las enfermedades relacionadas con dichos procesos patológicos.
Como criterio de exclusión de los artículos se definió el tratar asuntos sobre patogenicidad o mecanismos de acción descritos a partir de estudios con biopelículas In vitro o estudios realizados en cultivos celulares. En el proceso de tamización inicial se empleó el software de Gestión de Referencias EndNote®, con el cual se eliminaron los artículos duplicados presentes entre las bases de datos.
Resultados Discusión
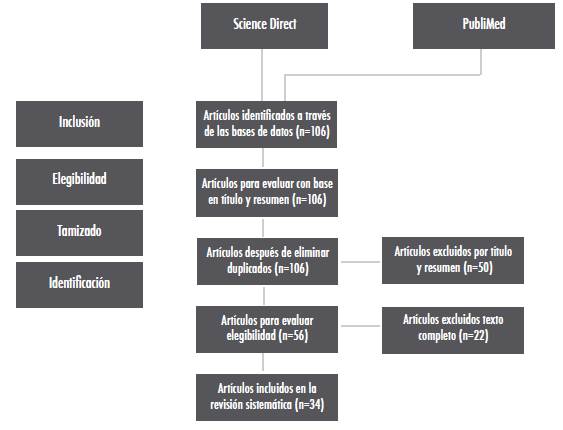
La búsqueda mediante las rutas descritas anteriormente arrojó un total de 106 artículos (ScienceDirect 63, PubMed 43) (Figura 1). En el proceso de eliminación de referencias duplicadas utilizando el software EndNote®, no se identificaron tales referencias; como valoración inicial se analizaron 106 artículos con base en título y resumen, después de esta evaluación se descartaron 50 artículos al no cumplir con los criterios de inclusión determinados referentes a la pregunta de investigación planteada. Se analizaron en texto completo 56 artículos, de estos no fueron incluidos 22 ya que su contenido no se enfocaba a la patogenicidad o formación de biopelículas en humanos. Como literatura gris se seleccionó un artículo de investigación original. Finalmente se incluyeron en el estudio 34 artículos, más el artículo de literatura gris. (Figura 1)
Las discrepancias en la aplicación de los criterios de inclusión y exclusión se resolvieron por consenso, y en caso de persistir el desacuerdo, se acudió a un tercer experto en el tema.
Agentes etiológicos involucrados en la formación de biopelículas en humanos:
la información recolectada de los 35 artículos incluidos en la revisión sistemática, evidencia como en los humanos se ha descrito una gran variedad de microorganismos relacionados con la formación de biopelículas, causantes de diversas enfermedades e infecciones. (Tabla 1)
Tabla 1 Agentes etiológicos involucrados y su relación en la formación de biopelículas en humanos
| Agente etiológico | Relación con la formacón de biopelículas | Referencias |
|---|---|---|
| Staphylococcus epidermidis | Infeccciones nosocomiales. Bacteriemias, dispositivos médicos como catéteres venosos central y urinarios, prótesis de válvulas para el corazón y lentes de contacto. | 11,30 |
| Pseudomonas aeruginosa | Fibrosis quística. Infecciones nosocomiales. | 31,32 |
| Staphylococcus lugdunensis | Infecciones de la piel y de tejidos blandos. | 33 |
| Staphylococcus aureus | Infecciones nosocomiales. | 34 |
| Candida spp | Infecciones invasivas. Infecciones nosocomiales. Candidiasis vulvovaginal. | 2,8,35,36 |
| Cándida tropicalis | Candidemia. Infecciones del tracto urinario. Infecciones nosocomiales. | 3 |
| Streptococccus pyogenes | Infecciones invasivas así como con fascitis necrotizante, sepsis, dermatitis atópica, shock séptico, faringitis e impétigo. | 15,37,38 |
| Eikenella corrodens | Placa dental. | 39 |
| Yersinia enterocolitica | Gastroenteritis. Septicemia. | 40 |
| Klebsiella pneumoniae | Infecciones nosocomiales y comunitarias. | 41 |
| Escherichia coli | Infecciones del tracto urinario (ITU) Infecciones nosocomiales. | 42 |
| Escherichia coli enteroagregativa | Diarrea. | 43 |
| Streptococcus mutans | Caries. Endocarditis. | 44 |
| Vibrio cholerae | Cólera. | 45 |
Caracterización de biopelículas descritas en humanos. Diferentes estudios han demostrado que la formación de biopelículas genera mecanismos de supervivencia de los microorganismos involucrados en ellas. La formación de complejos de biopelículas es altamente dinámico, comienza con una fijación primaria a la superficie, que es reversible y altamente dependiente de las propiedades fisicoquímicas y las interacciones electrostáticas entre los microorganismos y el sustrato6,11,25,33,36,46,47. A continuación se presenta la maduración de la biopelícula, lo cual implica la producción de una matriz adhesiva y protectora (compuesta de agua, poli-sacárido extracelular, proteínas, ADN, entre otras) que tiene como función la estabilización de la arquitectura15,48 junto con la multiplicación bacteriana, con presencia de canales de agua, iones, y el intercambio de nutrientes así como la comunicación entre microorganismos a partir del quorum sensing (QS); este es un proceso por el cual las bacterias producen y detectan moléculas de señal y coordinan de ese modo su comportamiento en la biopelícula, dependiendo de la densidad celular mediante la regulación de población y la competencia de nutrientes con implicaciones importantes para el proceso infeccioso14,15,38.
La biopelícula confiere una resistencia a la terapia con antibióticos2 y plantea importantes problemas de salud; un ejemplo importante de biopelícula es la placa dental humana44. Finalmente, hay desprendimiento de la biopelícula, colonización de nuevos nichos, reinicio del ciclo de formación de la biopelícula, y el subsecuente proceso patológico asociado, acorde al órgano blanco involucrado. Este proceso aún es poco conocido, pero es muy probable que el desprendimiento que garantiza la regeneración y la difusión de la biopelícula para la reubicación de las células liberadas a otro sitio, sea un proceso adaptativo44.
La biopelícula proporciona condiciones aptas para el crecimiento en medio hostil11. También se ha reportado cómo las biopelículas suministran protección hacia los microorganismo que están embebidos en ellas frente al sistema inmunitario del hospedero, haciendo que el tratamiento en contra de las infecciones asociadas se convierta en un reto33.
La formación de biopelículas es reconocida como un factor de virulencia importante14, ya que se ha observado que se presenta transferencia horizontal de genes en los microorganismos que la conforman4,38; un ejemplo claro de esto es Escherichia coli 42.
La propiedad hidrofóbica de superficies es un factor importante en la adhesión de las bacterias y en la formación de biopelículas, tanto en superficies vivas como inertes 14. Igualmente se han reportado como factores que facilitan la creación de biopelículas: la composición química, la estructura de la superficie y rugosidad. Los factores que rodean a la biopelícula también desempeñan un papel importante, por ejemplo, un medio que contiene glucosa en altas concentraciones, la capacidad de acoger microorganismos y captarlos en esa matriz extracelular, los cambios en la expresión de genes implicados en procesos de adherencia, además la bio-síntesis y metabolismo de aminoácidos, que acompañan la estabilización y el mantenimiento de la biopelícula a través del tiempo y el espacio 14.
Sitio blanco para la potencial formación de biopelículas: las biopelículas tienen la capacidad de formarse en sitios tanto inanimados como animados, condición que favorece el establecimiento de la misma, así como el desarrollo de infecciones y las enfermedades asociadas. En la Tabla 2 se describen algunos de los sitios anatómicos que presentan mayor relevancia de acuerdo con la literatura científica.
Tabla 2 Sitios donde se pueden formar biopelículas
| Sitios | Referencias |
|---|---|
| El epitelio de la cavidad oral y dientes, corazón, próstata, epitelio vaginal y tejido gastrointestinal | 6,36,38,39 |
| Sistema respiratorio y urinario | 6,31,41 |
| Piel y tejidos blandos | 33,38,46 |
| Tejido sanguíneo | 38,46 |
| Tejido óseo | 14 |
| Sistema renal | 41,48 |
| Lentes de contacto, catéteres intravesculares, fístulas de hemodiálisis, válvulas artificiales, marcapasos, implantes articulares y prótesis faríngea, prótesis dentales | 25,32,36 |
Factores involucrados en el desarrollo de biopelículas: las bacterias embebidas en biopelículas son menos susceptibles a los antibióticos y la matriz de exopolisacaridos las protege de procesos como opsonización y fagocitosis, incluso se ha observado el desarrollo de procesos de comunicación entre las bacterias, lo que conduce a la expresión de diversos factores de virulencia41. Este tal vez es el factor más crítico asociado a las biopelículas, donde mayor énfasis e interés se ha despertado en los últimos años, ya que los antibióticos que actualmente se han desarrollado actúan solo sobre bacterias planctónicas y no sobre bacterias asociadas a biopelículas; esto hace que las biopelículas se conviertan en un factor de virulencia que a su vez se ve potenciado por los factores de virulencia de cada microorganismo que conforma la biopelícula; algunos de esos factores descritos en la literatura científica son:
Klebsiella pneumoniae: se ha detectado la capacidad para formar biopelículas, presentándose esta en el 88,8% de las cepas aisladas, como un potencial promotor de formación de biopelículas en áreas tanto animadas como inanimadas. En estas cepas se encontró una relación en cuanto a factores de virulencia como Fimbrias tipo 1, y la adhesiva subunidad Fim H y se ha observado a la Fimbria tipo 3, es otro factor de virulencia que contribuye a la formación de biopelículas asociada principalmente a infecciones renales, pulmón, vejiga, entre otros 41. Es de vital importancia prestar atención a este factor ya que este tipo de bacterias también han sido relacionadas, en pacientes inmunocomprometidos, al desarrollo de enfermedades de tipo nosocomial, con mayor relación a pacientes con catéteres 41.
Streptococcus pyogenes: este microorganismo posee Pili, estructuras adhesivas que contribuyen a los pasos iniciales de la infección bacteriana, es decir, adhesión y colonización de los tejidos del huésped, cumpliendo un papel fundamental en el desarrollo de las biopelículas6.
Staphylococcus epidermidis: en cuanto a la formación de biopelículas, los artículos relacionan presencia de dicha biopelícula con la producción de una adhesina de polisacárido (PIA), que según su estructura básica se denomina poli-N-acetilglucosamina (PNAG) 25,33; así como a la presencia de Operon Agr, Operon Sar y la producción de quorum sensing relacionado con el Autoinductor-2 (AI-2) 30. Usualmente Staphylococcus epidermidis es considerado como un comensal de la piel. Sin embargo se pudo observar su capacidad de adherirse mediante microscopia electrónica de barrido, por medio de estos elementos descritos anteriormente.La producción de (PIA) se ha visto relacionada con el gen icaADBC, categorizado como un elemento muy importante en la formación de biopelículas, hasta tal punto de considerar que aquellas cepas que no poseen este gen son clasificadas como no patógenas; gen que está siendo utilizado como un marcador genético para la determinación de patogenicidad en cepas de Staphylococcus epidermidis11,30.
Staphylococcus lugdunensis: esta bacteria es considerada como un comensal de la piel, comúnmente observado colonizando la región perineal y rara vez los orificios nasales o cavidad nasal. S. lugdunensis debe ser calificado como un patógeno cuando es aislado de pacientes con infecciones óseas y articulares, incluyendo infección de prótesis articular y osteomielitis vertebral. Varios informes de S. lugdunensis revelan que puede desarrollar infecciones tanto en pacientes inmunodeprimidos como en pacientes inmunocompetentes y proceder con un severo curso clínico; también han reportado casos de sepsis y shock séptico. S. lugdunensis posee genes Agr para la codificación del sistema quorum sensing contribuyendo a sus factores de virulencia33. De igual manera se ha observado que tiene la capacidad de unirse a proteínas como colágeno tipo I y IV, fibronectina, laminina, entre otras debido a la codificación del gen vwbl.
Staphylococcus aureus: su patogenicidad respecto a la formación de biopelículas se ha visto coordinada por el gen regulador accesorio del sistema Agr. A través de un estudio se examinó la asociación de 'agr' Grupo II, así como la resistencia a la meticilina y los niveles de producción de biopelículas, observándose que esta combinación puede afectar el curso de las infecciones causadas por S. aureus18,33,34. De igual manera se ha encontrado relación directa con la presencia del gen CodY4.
Pseudomona aeruginosa: su patogenicidad ha sido reportada por medio de la utilización de un sistema de comunicación dependiente de la interacción entre célula y célula conocido como 'quorum sensing' (QS), que es útil para coordinar el comportamiento del grupo de microorganismos que conforman la biopelícula, favoreciendo la virulencia de la misma. Dentro del sistema QS está la producción de señal quinolona Pseudomonas (PQS), siendo un punto clave para ser atacada por medicamentos y poder contrarrestar la fibrosis quística que ha sido una de las enfermedades relacionadas con formación de biopelículas31,46. Se han observado moléculas relacionadas como N-acyl homoserina lactona (AHLs) dentro de las cuales se destacan dos: 3OC12-HSL y C4-HSL 4,18. En esta bacteria la presencia de Zinc (Zn) o Cobre (Cu), induce la expresión de dos componentes, el CzcRS metal inducible (TCS) que activa la expresión de una bomba de flujo de metal CzcCBA que al mismo tiempo modula la expresión de factores de virulencia para controlar el sistema de QS.
En pacientes con Fibrosis quística, se ha observado que el esputo está naturalmente enriquecido con Zn y se ha visto que el Zn es un factor clave que interviene en dos fases del proceso de infección por P. aeruginosa: en primer lugar, Zn facilita una fase inicial mediante la promoción de la inducción de la expresión de factor de virulencia estimulando la formación de biopelículas. Adicionalmente, la presencia de Zn induce resistencia a carbapenem tanto en células planctónicas como en células en biopelículas.
La habilidad para formar una biopelícula ha llegado a ser considerada como un factor de virulencia determinante en Pseudomona aeruginosa, por lo tanto se ha referido en la literatura que se presenta un aumento lineal en la formación de biopelículas en presencia de Zn. De lo anterior se puede concluir que en aquellos pacientes con fibrosis quística en los cuales se observe una mayor presencia de Zn en el esputo, habrá mayor probabilidad de desarrollar biopelículas ante la presencia de Pseudomona aeruginosa 31. Otro factor de virulencia relacionados con la formación de biopelículas en Pseudomona aeruginosa es la formación de fimbrias, producidas por el Cup, de las cuales se han observado 4 tipos diferentes de fimbrias (CupA, CupB, CupC y CupE) 49.
Candida albicans: la formación de biopelículas por Candida albicans en superficies inertes recientemente ha sido un tema de investigación, y los autores han descrito una relación directa de la especie con factores de virulencia y su capacidad para producir biopelículas determinando que el más importante es la hidrofobicidad de la célula de superficie. Este hongo tiene la capacidad de cambiar de una forma de crecimiento a otro (dimorfismo), dependiendo de las condiciones del ambiente, lo que permite la colonización e invasión de diversos órganos y tejidos, relacionándose de forma directa con la generación de bio-películas a partir de la formación de hifas, sobretodo en el proceso de maduración. En aquellos casos donde se utilizan materiales de silicona en medicina, las hifas tienen la capacidad de dañarlos penetrándolos profundamente, expandiéndose y endureciendo el material, haciendo que el dispositivo pierda su función para la cual fue designado47. De igual manera se ha observado que los hongos presentes en las biopelículas son mucho más resistentes a agentes anti-fúngicos en comparación con las formas planctónica.
Candida albicans se ha observado que posee bombas de flujo codificadas por genes CDR y MDR, las cuales se encuentran relacionadas con la formación de biopelículas8, al igual que los genes MDR1, CDR1, CDR22 y el gen flo837 que ayudan a la formación de biopelículas. También se ha observado la presencia de biopelículas en otras especies de candidas como son C. parapsilosis, C. tropicalis36,47 y Candida glabrata, la cual codifica para un grupo de adhesinas de las familia EPA (adhesinas epiteliales)3.
Eikenella corrodens: se ha observado como factor de virulencia relacionado en la formación de biopelículas la codificación de un ligando de unión a lectina conocido como EcLS N- acetil-galactosamina, que media la unión de la bacteria con muchas células del tejido del hospedero39. Esta bacteria se ha visto relacionada con la formación de placa dental.
Listeria monocytogenes: este microorganismo se ha visto relacionado en la formación de biopelículas. Aunque no es habitante usual en el humano, se ha observado que es un potencial patógeno al igual que Listeria ivanovi, relacionados con efectos adversos en la salud humana a través de la ingesta de los mismos. Se tiene evidencia de contaminación por Listeria monocytogenes en leche cruda de cabra y oveja; la excreción de Listeria en la leche puede persistir durante toda la lactancia, contribuyendo así a un mayor riesgo en la salud humana 50.
Escherichia coli: se observa relación directa en la formación de biopelículas con la presencia de pili o fimbrias tipo I42. En E. coli enteroagregativa (EAEC) la formación de biopelículas está notificada con la presencia del gen shf, yafK y fis. De igual manera se encuentra correspondencia con los genes set1A y el gen aggR y la presencia de Fimbria Adherente Agregativa43,51.
Streptococcus mutans: relacionadas 1501 con la formación de biopelículas por la presencia de adhesinas, proteínas de unión a glucano y factores de interacción con la matriz como SpaA (antígeno I I II), WapA (antígeno A) y mecanismos de quorum sensing 15. Utiliza el sistema de señalización de quorum sensing para regular la formación de la biopelícula. Dentro de este sistema de señalización se encuentran relacionados genes como ComCDE, ComAB y ComX. De igual manera se han observado otros genes relacionados como son VicR, VicK, HKll, RRII y COVR 44.
Yersinia enterocolitica: en varios estudios se ha observado que en esta bacteria la producción de biopelículas está relacionada con la expresión del gen waaE; sin embargo, en el estudio de Ioannidis et al. en 201440 no se encontró este gen asociado.
Vibrio cholerae: se ha observado en esta bacteria que para la formación de biopelículas dependiendo de la disponibilidad de oxigeno están presentes los genes VpsB y RbmA45.
Conclusiones
Un gran número de factores influyen en el proceso de la formación de biopelículas y su estructura, relacionándose estas tanto en ambientes animados como inanimados.
Debido a la presencia de biopelículas y su relación con el desarrollo de la enfermedad, se puede categorizar como un factor de virulencia de gran importancia para la salud humana.
Con el pasar del tiempo se observa que muchos más microorganismos tienen la capacidad de producir biopelículas, y por ende aseguran su patogenicidad y su establecimiento a través del tiempo.
El crecimiento de microorganismos patógenos en biopelículas genera una mayor capacidad de infección de tejidos y conlleva una resistencia a múltiples fármacos y el fracaso terapéutico, punto sobre el cual hoy en día se trabaja arduamente para desestabilizar la biopelícula.
Es necesario seguir trabajando en la detección oportuna de las biopelículas y determinar de manera aún más detallada su comportamiento, relación, formación y desarrollo dependiendo de los microorganismos que la conforman para poder actuar de manera eficaz en el uso de medicamentos y la erradicación total de la enfermedad.
Finalmente, como resultado de esta revisión sistemática de la literatura, se logran visibilizar los hallazgos de varias investigaciones, recopilando un número de estudios realizados de manera independiente, para sintetizar la información y dar valor a los resultados obtenidos respecto a las características relacionadas con biopelículas dependientes de procesos patológicos descritos en humanos, y de esta manera actualizar de forma rigurosa la información sobre este tema, dando mayor claridad al lector interesado en la información.
Entre mayor sea el número de factores de virulencia que tenga un microrganismo relacionado con la formación de biopelículas, mayor será su grado de patogenicidad.