Introducción
Los dientes son órganos anatómicos responsables de múltiples funciones vitales, como la masticación, fonación, deglución y estética facial. Ellos están integrados por una corona dental compuesta de varios tejidos, entre ellos, el esmalte dental. El desarrollo dental inicia muy temprano durante la embriogénesis, mediante la formación de la lámina dental a la sexta semana de vida intrauterina. Esta lámina es el resultado de interacciones epitelio-mesenquimatosas entre el epitelio dental, que deriva del ectodermo, y un mesénquima que proviene de crestas neurales cefálicas, de origen ectodérmico. La invaginación de esta lámina induce la formación del órgano del esmalte a través de diferentes etapas en las que los ameloblastos, células epiteliales formadoras del esmalte dental, experimentan un proceso de diferenciación celular 1,2.
El esmalte dental es una estructura no inervada, avascular y acelular cuya formación y organización es producto de la diferenciación terminal de los ameloblastos. En los humanos, este proceso fisiológico es limitado en el tiempo y único por cada diente. El esmalte dental está constituido mayoritariamente de una fase mineral (alrededor de 98 %) y de una fase orgánica que representa aproximadamente 2 %. La formación de su estructura, conocida también como la amelogénesis, puede ser estudiada detalladamente en modelos animales como los "incisivos de roedores". Este modelo ha sido utilizado desde la década de 1960, debido a la presencia de incisivos en crecimiento continuo que son capaces de modelizar las distintas etapas de los ameloblastos durante el proceso de la formación del esmalte dental 3,4.
La evidencia científica ha dado constancia de la similitud fundamental en la composición básica y la formación del esmalte dental entre los incisivos de roedores y la dentición humana 4. Durante la amelogénesis, la secreción de una matriz proteica y mantenimiento de un medioambiente extracelular que favorece la síntesis de mineral de los ameloblastos permite inicialmente la formación de un esmalte parcialmente mineralizado con un espesor completo. Seguidamente, una degradación del contenido orgánico del esmalte dental es reemplazado por minerales. En este proceso, los ameloblastos (células con un marcado dinamismo) sufren diferentes cambios que corresponden a su estado de diferenciación. En consecuencia, los ameloblastos existirán en tres formas principales correspondiente a una actividad específica: ameloblastos presecretores, ameloblastos secretores y ameloblastos de maduración 5,6.
El paso de los ameloblastos de secreción a ameloblastos de maduración implica cambios morfofuncionales importantes para la formación del esmalte dental. Los ameloblastos precursores de la matriz o secretores sintetizan las proteínas del esmalte a nivel del retículo endoplasmático y posteriormente llevan a cabo la secreción de estas proteínas al medio extracelular donde ellas finalmente formarán la matriz del esmalte 7. En la etapa de maduración, los ameloblastos cambian de función. Luego de haber sido responsables de producir la matriz del esmalte, los ameloblastos se convierten en transportadores de los efectores de la formación del esmalte, mientras que la matriz orgánica es destruida por proteólisis y, en consecuencia, las proteínas del esmalte son fragmentadas extracelularmente 8,9.
Los fragmentos de proteínas del esmalte son transportados por los ameloblastos para su posterior degradación en el aparato endosomallisosomal 10. La exploración estructural mediante biología computacional ha puesto de manifiesto la unión de las proteínas del esmalte con proteínas transmembranales involucradas en la endocitosis 11. Por lo tanto, se ha sugerido que la eliminación de las proteínas del esmalte, proceso clave en la formación del esmalte dental, es mediada a través de la vía endosómica/ lisosomal. Sin embargo, parte de los estudios realizados solo se han interesado en la difusión e internalización de las proteínas del esmalte en el espacio extracelular durante la formación del esmalte 11,12.
Aunque la información sobre el transporte de las proteínas del esmalte, luego de su degradación en el proceso de la formación dental, es objeto de dilucidación por la comunidad científica. Se ha sugerido que probablemente diversas organelas participan en la destrucción de las proteínas del esmalte, entre ellas los lisosomas. Por ello, inicialmente sería de gran interés identificar la distribución funcional de los lisosomas en los ameloblastos durante el proceso de la amelogénesis. De esta manera, haciendo uso de la inmunohistoquímica, el propósito del presente trabajo es visualizar la distribución específica de la proteína de membrana asociada a lisosomas en los ameloblastos.
Materiales y métodos
Preparación animales y tejidos
Se utilizaron ratones machos Swiss WT (Janvier, St Berthevin) de 7 y 14 días de edad. Los incisivos de los ratones fueron microdisecados bajo estereomicroscopio (Leica MZ FLIII, Leica Microscopy Systems, Ltd., Heerbrugg, Suiza). Durante la disección de las mandíbulas, los tejidos blandos fueron removidos delicadamente luego de la extracción de los dientes formados con una cureta Gracey (Hu-Friedy). La disección se inició en la parte posterior de la mandíbula aislando primeramente el hueso basal. A continuación, el hueso alveolar situado debajo de los dientes fue realizado seguido de la extracción de los incisivos en erupción continua. Para evitar la contaminación de los tejidos obtenidos, estos fueron cuidadosamente lavados en solución salina amortiguada por fosfatos -Dulbecco (DPBS, Invitrogen, Carlsbad, CA, EE. UU.).
Después de la disección, los incisivos fueron fijados durante 24 horas por inmersión en una solución de DPBS con paraformaldehído a 4 % (PFA, Sigma-Aldrich Co.) y 0,1 % de glutaraldehído (Sigma-Aldrich Co.) antes de ser lavadas en PBS durante 1 hora. Las muestras fueron deshidratadas e incluidas en parafina y posteriormente cortadas en secciones de 5-7 µm. Los ensayos fueron realizados en colaboración con el laboratorio de histología de ciencias de la salud de la Universidad de Cartagena.
Coloración hematoxilina-eosina
La hematoxilina de Mayer es una coloración clásica que colorea los núcleos en azul violeta, mientras que la eosina colorea el citoplasma y la matriz extracelular de color rosa. Luego de la fijación y deshidratación en baños de clearene (Leica Biosystems Richmond, Inc.), los cortes fueron rehidratados al ser sumergidos en alcohol absoluto. A continuación, los cortes fueron coloreados en hematoxilina de Mayer durante 1 minuto e inmediatamente lavados con agua destilada. Una diferenciación alcohol-ácido fue realizada en pocos segundos seguida de la coloración de la eosina durante 30 segundos. Los cortes fueron deshidratados nuevamente, lavados con clearene y después montados entre lamina y laminillas con un medio de montaje en resina DPX.
Preparación celular
Células epiteliales dentales originadas del asa cervical de incisivos de rata descritas por Kawano et al. 13 fueron cultivadas a 37°C en una atmósfera húmeda que contenía 5 % de CO2 en el medio de cultivo DMEM/F12 (Dulbecco's Modified Eagle Medium: Nutrient Mixture F-12) Gibco™, 10 °% de Suero Fetal Bovino-SFB (Gibco™), 1 % de penicilina-estreptomicina (10,000 U/mL) (Gibco™), 0,5 de Anfotericina B (Gibco™). El medio de cultivo fue reemplazado tres veces por semana hasta la obtención de células a una confluencia entre 80-90 %.
Inmunohistoquímica
En los cortes de incisivos de crecimiento continuo de ratones, luego de la desparafinación y rehidratación, se realizó una permeabilización durante 10 minutos en 1 % de Tritón X-100 (Thermo Fisher Scientific Inc). A continuación, los cortes fueron enjuagados tres veces en PBS durante 5 minutos bajo agitación. Los sitios de unión no específicos se bloquearon mediante incubación de los cortes de tejido durante 30 minutos en 1 % de albúmina de suero bovino (BSA, Euromedex) diluida en PBS.
En cuanto a las células epiteliales dentales de rata, una vez se hallaban cerca del 90 % de confluencia, fueron fijadas en una solución de PBS1X (Gibco™) a 4 % de paraformaldehído (Sigma-Aldrich®) durante 15 minutos. Acto seguido, las células fueron permeabilizadas con 0.5 % de Triton X-100 (Sigma-Aldrich®) y luego incubadas 20 minutos en PBS1X que contenía 1 % de BSA (Sigma-Aldrich®) / 1 % de glicina (Sigma-Aldrich®).
Los cortes de los incisivos y las células epiteliales dentales de rata fueron incubados durante una noche a 4°C con el anticuerpo anti-Lamp1 (Thermo Fisher Scientific). Después, estos fueron lavados con PBS y estuvieron en contacto con el anticuerpo secundarios Alexa Flúor 594 de cabra (Thermo Fisher Scientific Inc) durante 2 horas a temperatura ambiente.
Finalmente, se llevó a cabo la tinción nuclear con DAPI (Sigma-Aldrich Co) y se procedió al montaje de las secciones de cortes y de las células epiteliales utilizando un medio de montaje acuoso Immu-MountTM (Thermo Scientific). La observación y las fotografías fueron realizadas en un microscopio Fluorescente Zeiss AxioSkop.
Declaración de aspectos éticos
El protocolo de experimentación animal tuvo en cuenta los procedimientos de recolección de muestras científicas, administrativos y éticos contemplados en la Ley 84 de 1989. Los experimentos se realizaron siguiendo con absoluto rigor los principios internacionales de las 3R y guías para el cuidado y uso de animales de laboratorio inscritos en la Guide for the care and use of laboratory animals 14.
Resultados
El presente trabajo tuvo como propósito identificar la organela involucrada en la degradación de material intracelular y extracelular de los ameloblastos. Inicialmente, en incisivos de crecimiento continuo de ratones de 7 días de nacidos, se pudieron constatar morfológicamente las tres etapas principales de diferenciación de los ameloblastos: ameloblastos de presecreción, secreción y maduración (figura 1).
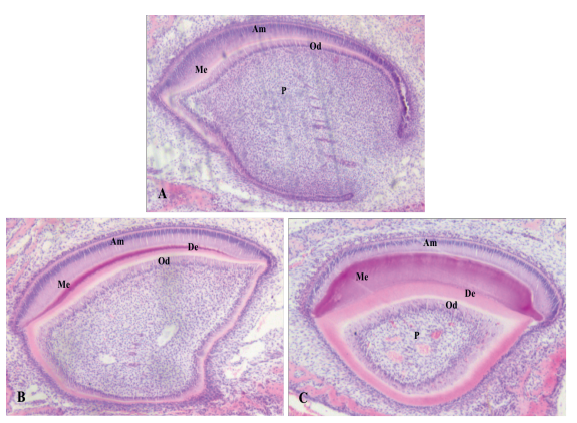
(A) Visualización de ameloblastos de presecreción. (B) Identificación de ameloblastos de secreción. (C) Observación de ameloblastos de maduración. Am: ameloblastos; Me: matriz del esmalte; Od: odontoblastos; De: dentina; P: pulpa. Coloración hematoxilina-eosina.
Figura 1 Cortes histológicos sagitales de incisivo en crecimiento continuo de ratón Swiss WT de 7 días
Los ameloblastos presecretores se distinguieron por ser alargados, con núcleos visibles proyectados hacia la zona del estrato intermedio mientras que en su extremo apical se observó una serie de prolongaciones en contacto con la zona de matriz del esmalte que inicia su formación (figura 1,A). Los ameloblastos de secreción fueron de gran tamaño, sus núcleos se encontraron ubicados en posición proximal y a un mismo nivel. Igualmente, se pudo constatar una zona distal en plena producción de la matriz amelar (figura 1,B). Por su parte, en los ameloblastos de maduración, fue evidente una reducción de tamaño y volumen de estas células. Sus núcleos fueron más reducidos y de forma ovalada, en comparación con los ameloblastos de secreción. Se identificó la pérdida de prolongaciones en la zona distal de los ameloblastos, pasando de un borde con prolongaciones plisadas a un borde completamente liso (figura 1,C).
La immunolocalización de la proteína de membrana asociada a lisosomas (Lamp1) fue evidente de manera clara y uniforme en el citoplasma de las células ameloblásticas durante todas las etapas del proceso de diferenciación de los ameloblastos. Independiente de la edad de los ratones, la expresión de Lamp1 siempre estuvo presente.
Sin embargo, una detección más importante fue observada en los ameloblastos de secreción de los ratones de 7 días y 14 días de vida posnatal. Este marcaje fue también evidente hacia la zona de la membrana citoplasmática de los ameloblastos. Igualmente, Lamp1(en rojo) fue observado en los odontoblastos y células sanguíneas (figura 2.A, B).
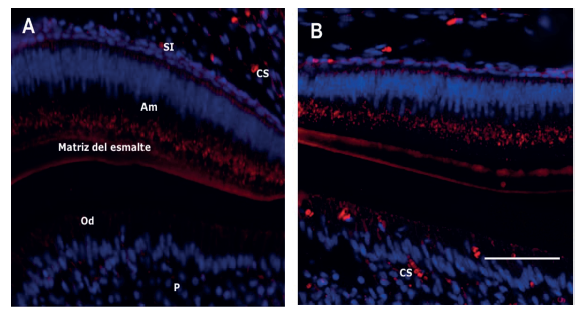
Expresión Lampl (en rojo) en ameloblastos ratones de 7 días (A) y ameloblastos de ratones de 14 días de vida posnatal (B). SI: estrato intermedio. Am: ameloblastos. Od: odontoblastos. P: pulpa dental. CS: células sanguíneas. Barra blanca: 200 µm.
Figura 2 Immunolocalización de Lamp1 en ameloblastos de presecreción y secretores
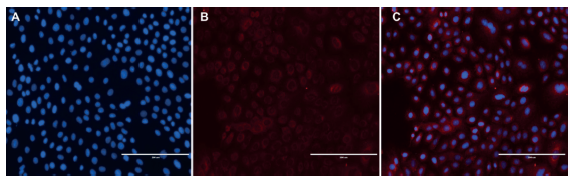
La inmunodetención de Lamp1 fue identificada en las células epiteliales dentales de rata. Los resultados revelaron la presencia de un marcaje lisosomal citoplasmático importante en las células cultivadas durante una semana. En algunas células fue notoria la presencia de Lamp1 cerca de la zona de la membrana citoplasmática (figura 3).
Discusión
Los lisosomas son organelas celulares vesiculares descritas por en 1955 por Christian de Duve mediante técnicas de centrifugación 15. Gracias a la presencia de enzimas hidrolíticas, los lisosomas hacen posible la degradación de varios sustratos, entre ellos, proteínas, lípidos, carbohidratos, ácidos nucleicos y macromoléculas provenientes del medio extracelular o del medio citoplasmático 16. Por su importante rol en el funcionamiento de cualquier célula, el presente trabajo pretendió identificar y conocer su distribución en los ameloblastos.
La identificación de las diferentes etapas del proceso de diferenciación de los ameloblastos nos permite constatar que el incisivo de crecimiento continuo es un modelo adecuado en el estudio de la amelogénesis tal como ha sido reportado anteriormente 17. Pudimos constatar como los ameloblastos presecretores van alargándose y su núcleo migra en posición del estrato intermedio.
Estos hallazgos, corresponden a los cambios iniciales que experimentan los ameloblastos y que luego los ayudará a convertirse en células polarizadas. Esta observación permite inferir que los ameloblastos presecretores han comenzado el proceso de secreción inicial de proteínas del esmalte. De acuerdo con Pérez 18, esas primeras proteínas de la matriz juegan un rol primordial en la morfogénesis y diferenciación de los ameloblastos.
Por su parte, la disposición bien alineada de los ameloblastos secretores suele indicar que su organización intracelular está apta para llevar a cabo la regulación funcional del esmalte en formación. En efecto, los ameloblastos cuentan en este periodo con un importante retículo endoplásmico, aparato de Golgi y lisosomas que contribuirán a las modificaciones necesarias para el ensamblaje de gránulos de secreción. Estos gránulos migrarán continuamente y serán secretados en la matriz extracelular donde van a dar lugar a la formación del esmalte dental. Así, el esmalte va a estar compuesto de una mezcla de cristales en formación y numerosas proteínas, entre ellas, la amelogenina 19.
Los ameloblastos de maduración, redujeron ostensiblemente su tamaño y volumen, haciendo prever que el proceso de formación del esmalte ha llegado a su final. Se estima que durante este periodo además de los cambios morfológicos, cerca del 25 % de los ameloblastos morirán. Se ha reportado que los ameloblastos de esta etapa eliminan la matriz orgánica y el agua con el objetivo de incrementar la densidad del mineral del esmalte dental con la llegada masiva de iones de calcio y fosfato 5,18. Esto indica que los ameloblastos presentaran una actividad endocítica muy importante con la presencia marcada de lisosomas, tal como se pudo constatar en nuestro trabajo.
La proteína de membrana asociada a lisosomas tipo 1 (Lamp1), una proteína con un dominio luminal, transmembranal y C-terminal citoplasmática, es altamente expresada en endosomas tardíos y lisosomas 20. Lamp1 fue plenamente identificada en todas las etapas de la diferenciación de los ameloblastos de manera independiente a la edad de los ratones y en las células epiteliales dentales de rata, estas últimas, concebidas como modelo celular de los ameloblastos 21. Lo anterior es indicativo de que los lisosomas están plenamente involucrados en el proceso de la amelogénesis dental y seguramente son muy activos en las funciones de degradación y señalización celular.
El presente trabajo también puso en evidencia la inmunodetección de Lamp1 en la membrana plasmática de los ameloblastos, en los odontoblastos y vasos sanguíneos. Estos resultados confirman la presencia de un dominio transmembranal de Lamp1 y sugieren su rol como intermediario de la superficie celular durante la endocitosis, como también su contribución en la deposición y mineralización del esmalte dental. Así mismo, nuestros resultados permiten constatar que la expresión de Lamp1 fue positiva en células sanguíneas. Estos resultados son acordes a los hallazgos publicados por Södergren et al. 22 y Lettau et al. 23, quienes identificaron Lamp1 en células sanguíneas circulantes como las plaquetas o linfocitos.
Si bien nuestro trabajo se limitó a la identificación de lisosomas en los ameloblastos, futuros estudios nos ayudarán a mejorar la comprensión espacial y funcional de estas organelas en la formación del esmalte dental. En efecto, resultaría interesante describir cómo los lisosomas realizan su función en los ameloblastos. Funciones que involucrarían la vía clásica que comprende la fusión de lisosomas entre ellos y con el material por degradar; la internalización por endocitosis de las moléculas extracelulares y el reciclaje de los componentes internos celulares cuando las organelas o componentes de las células se encuentran alterados o en condiciones de estrés nutritivo 24.
Adicional a la función conocida en la degradación de macromoléculas intracelulares y extracelulares de los lisosomas, sería prometedor dilucidar el papel de estas organelas en la regulación de vías de señalización en los ameloblastos. Este nuevo concepto funcional de los lisosomas ha sido estudiado recientemente y contempla que los lisosomas son un centro de señalización metabólico, clave en la dinámica de transporte de nutrientes y su regulación.
Por ejemplo, en condiciones normales el complejo mTORC1 (mammalian Target of Rapamycin complex 1) activo y localizado en la membrana citosólica de los lisosomas, es capaz de fosforilar el factor de transcripción TFEB (Transcription Factor EB), también presente en el citoplasma. Sin embargo, ante una disminución de los nutrientes en la célula, el complejo mTORC1 se inactiva y en consecuencia TFEB no es fosforilado. En este escenario, TFEB puede ingresar al núcleo y contribuir a la transcripción de genes codantes para proteínas implicadas en funciones de autofagia y funciones lisosomales 25,26.
En notorio que la consideración de los lisosomas como vesículas llenas de enzimas digestivas encargadas de degradar elementos celulares y extracelulares, así como el papel de estas organelas en el control transcripcional durante la amelogénesis, requiere ser estudiada. Estas investigaciones deberían aparecer luego de identificar las moléculas que trabajan con Lamp1 durante la amelogénesis y que tengan implicación en los mecanismos de señalización inductores de cambios fenotípicos y funcionales de los ameloblastos.
En conclusión, el presente trabajo dejo en evidencia la expresión de la proteína de membrana asociada a lisosomas en los ameloblastos en incisivos de crecimiento continuo y células epiteliales dentales de rata.