Introducción
La incidencia y prevalencia de alteraciones que involucran al sistema endocrino de animales y humanos ha experimentado un gran incremento en las últimas décadas 1. Cada vez hay más evidencia científica de que en la etiología de estas enfermedades se asocian con la exposición ambiental a diferentes productos de uso diario que se denominan disruptores endocrinos. Estos interfieren con la producción, liberación, transporte, metabolismo y eliminación de las hormonas naturales de los organismos; actúan a dosis muy bajas, presentan distintos mecanismos de acción e incluyen a un gran número de sustancias 2. El número de sustancias con la capacidad de alterar el sistema endocrino aumenta cada día, entre las cuales están los fitoestrógenos, que se localizan de manera natural en plantas como la soya, el trébol, las leguminosas, los granos enteros, en varias frutas y en otros vegetales 3. Es de particular interés el amplio consumo de soya, alimento al que se le ha atribuido una amplia gama de beneficios para la salud, incluido un menor riesgo de osteoporosis, de enfermedad cardíaca, cáncer de mama y síntomas de la menopausia 4.
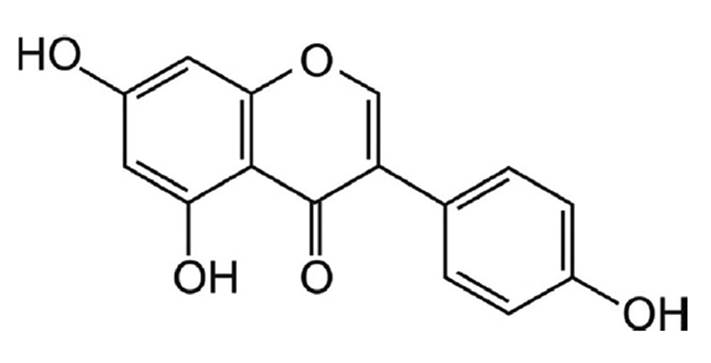
Sin embargo, la soya también puede producir alteraciones en el sistema endocrino, ya que contiene genisteína, una sustancia hormonalmente activa, lo que sugiere que su ingesta tiene el potencial de causar efectos adversos a la salud en ciertas circunstancias, particularmente, cuando la exposición ocurre durante el desarrollo 5. La genisteína o 4',5,7-trihidroxiisoflavona (figura 1) es un fitoestrógeno con una amplia variedad de efectos farmacológicos en las células animales, incluida la inhibición de la tirosina quinasa. A través de estudios epidemiológicos y de modelos animales, se ha relacionado la ingestión de genisteína en la dieta con una gama de posibles efectos beneficiosos para la salud 6. Sin embargo, estudios epidemiológicos sobre la relación entre el consumo de soya y el riesgo de presentar alteraciones a nivel del sistema endocrino no han arrojado asociación significativa.
Sin embargo, investigaciones realizadas en animales, han demostrado que la genisteína tiene la capacidad de alterar los niveles de estrógenos que potencialmente pueden provocar alteraciones a nivel del sistema endocrino de los animales y los humanos, entre los cuales tenemos: infertilidad, trastornos metabólicos, malformaciones del sistema reproductor femenino y masculino y algunos tipos de cáncer estrógeno dependientes, como el de mama, ovario, próstata, testículo y tiroides. En consecuencia, una dieta a base de leche de soya en los lactantes y niños pequeños podría alterar su sistema hormonal por el efecto disruptor de la genisteína 7. Debido a la discordancia de los resultados en los estudios realizados previamente, se plantea la necesidad de seguir indagando acerca de los efectos del consumo de genisteína en el sistema endocrino.
En este trabajo se usó el nematodo de suelo Caenorhabditis elegans como modelo biológico para determinar el potencial de disruptor endocrino de la genisteína debido a sus múltiples ventajas, tales como alta sensibilidad a tóxicos, versatilidad, dados los variados puntos finales de toxicidad que se pueden evaluar, tales como: reproducción por autofecundación, gran progenie, corto ciclo de vida y a la existencia de transgénicos con el gen reportero gfp que permite evaluar además la expresión de genes ortólogos a los del ser humano 8. Estas características permitieron evaluar parámetros relacionados con el efecto de disruptor endocrino como el crecimiento a través de la longitud del cuerpo, reproducción, obesidad por medio del depósito de lípidos a través de una tinción con q-oro 9 y la expresión de genes relacionados con el estrés celular como hsp-3 y genes relacionados con el estrés oxidativo como sod-4 y gpx-4.
Materiales y métodos
Nemátodos y bacterias
Cepa silvestre de Caenorhabditis elegans Bristol N2 y cepas transgénicas BC20308 (hsp-3::gfp), BC20333 (sod-4::gfp) y BC- 20305 (gpx-4::gfp). Bacteria E. coli OP50.
Reactivos
Genistein Analytical standard SIGMA de 10 mg (5,7-dihidroxi-3- (4-hidroxifenil) -4H-1-benzopiran-4-ona, número CAS 446-72-0 adquirida en Sigma-Aldrich, St. Louis, MO, USA.
Oil red O (1-([4-(Xylylazo)xylyl] azo)-2-naphthol) número CAS 1320-065 adquirido en Sigma-Aldrich, St. Louis, MO, USA.
Cultivo y sincronización de Caenor-habditis elegans
Los nematodos se mantuvieron a 20 °C en placas Petri con medio de crecimiento de nematodos (NGM) constituido de 3 g de NaCl, 17 g de agar, 2,5 g de peptona, 1 mL de colesterol en 1 L of agua ultrafiltrada y sembradas con E. coli OP50 (10). Los gusanos se sometieron a sincronización por edad a través de una solución de lejía con NaOH (0,25 M) y NaClO (1,26 %), que oxida cualquier organismo presente, dejando a salvo los huevos debido a la protección que les da su cutícula, y aproximadamente 14 h después, los huevos habían eclosionado y las larvas estaban en la etapa L1 11.
Ensayo de letalidad
Diez nematodos en edad larval L4, tres días después de la sincronización, fueron colocados en microplacas de 96 pozos con 200 μL de solución de genisteína (0,1 μm 1,0 μm, 10 μm, 100 μm en dimetil sulfóxido, DMSO al 1 %) usando medio K (KCl 0,02 M, NaCl 0,05 M) como solvente y DMSO al 1 % en medio K como control. Cuatro réplicas fueron realizadas para cada tratamiento. Las placas se incubaron a 20 °C, y el número de organismos muertos y vivos fue registrado a las 24 horas bajo observación en un microscopio de disección. Cada ensayo se realizó por triplicado. Los gusanos se calificaron como muertos cuando los estímulos físicos no generaron ninguna respuesta 10, 12.
Ensayo de crecimiento
Aproximadamente 50 individuos de la cepa silvestre Bristol N2 en edad larval L1 fueron expuestos a las soluciones de genisteína en placas de cultivo celular de 96 platos realizando cuatro réplicas por tratamiento. Como fuente de alimento se adicionó diariamente E. coli OP50 previamente muerta en autoclave. La medición de la longitud del cuerpo de los nemátodos fue realizada a las 72 horas de exposición analizando fotografías mediante el software ImageJ 13. Tres repeticiones del experimento fueron realizadas.
Ensayo de reproducción
Aproximadamente diez larvas de la cepa silvestre Bristol N2 en edad larval L4 fueron expuestas a la solución de genisteína. En placas de cultivo celular de 96 platos se inocularon los gusanos realizando cuatro réplicas por tratamiento. Se expusieron durante 24 horas, posteriormente, cada larva fue colocada en platos individuales y 24 horas más tarde, se examinó la postura de huevos usando el microscopio de disección Nikon smz 745T con un aumento de 100X y el software Image J 8. Tres repeticiones del experimento fueron realizadas.
Tinción de depósitos de lípidos
Previamente a la prueba de tinción, una solución madre de Oil red O al 0,5 % fue preparada con isopropanol de alta calidad al 100 %, incubado por un día y filtrado con una malla de 0,45 ^m. El día previo al uso de la solución se diluyó al 60 % en agua ultrafiltrada y se incubó durante toda la noche y se volvió a filtrar de la misma forma. Para el ensayo, se tomaron aproximadamente 20 larvas de la cepa silvestre Bristol N2 en edad larval L4 y fueron expuestas a las soluciones de genisteína preparadas durante 24 horas. Para la tinción, 200 μL de solución de isopropanol al 60 % fueron agregados a las larvas contenidas en las placas de 96 pozos, posteriormente 175 μL fueron aspirados y se agregó la solución de Oil red O en cada pozo. La tinción se dejó actuar por 24 horas a una temperatura de 25 °C, posteriormente, se eliminó el sobrenadante y se agregaron 100 μL de tritón X-100 al 0,01 % 8. Ver fotografías de los gusanos teñidos obtenidas con el uso del microscopio óptico (figura 6).
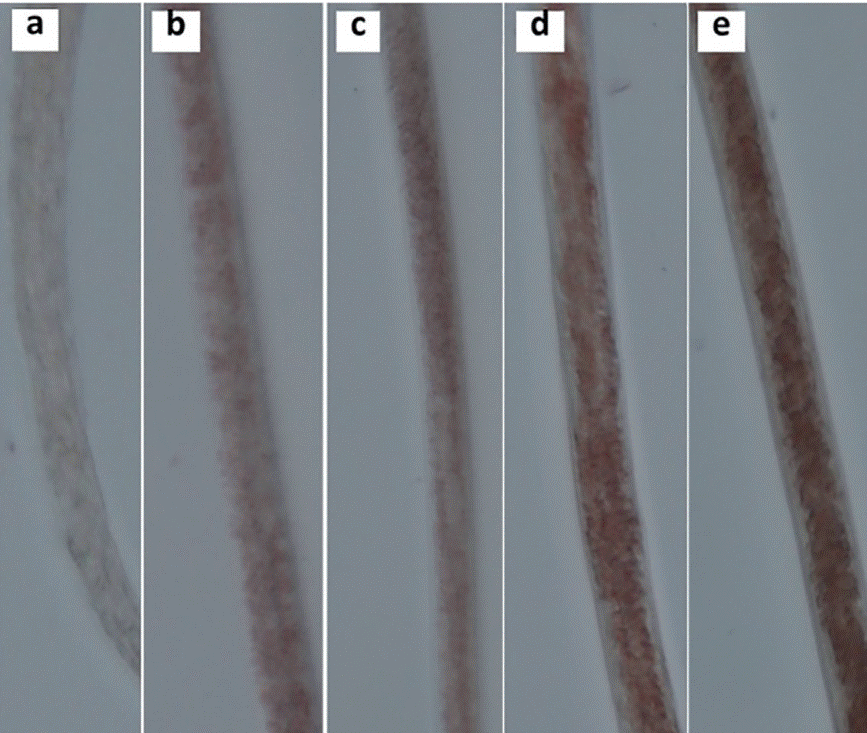
Microscopía óptica a 40X, coloración con q-ORO (a. Control, b. 0,1 μM, c. 1 μM, d. 10 μM, e. 100 μM). Fuente: elaboración propia.
Figura 6 Depósito de lípidos en Caenorhabditis elegans expuestos a genisteína
Medición de fluorescencia
La expresión de los genes de respuesta al estrés celular y estrés oxidativo fue monitoreada utilizando el gen reportero GFP (proteína fluorescente verde). Se utilizaron aproximadamente 100 gusanos en todas las etapas larvarias de las cepas transgénicas BC20308 (hsp-3::gfp), BC20333 (sod-4::gfp) y BC20305 (gpx-4::gfp). Los nematodos fueron colocados en microplatos negros de 96 pozos con las soluciones de genisteína y un control. Se incubaron a una temperatura de 15 °C y por 24 horas, después se registró la fluorescencia por medio del fluorskan Perkin-Elmer Victor 1420. Se obtuvo la fluorescencia relativa dividiendo el valor de fluorescencia entre la fluorescencia registrada para el control 11, 14.
Resultados
Letalidad
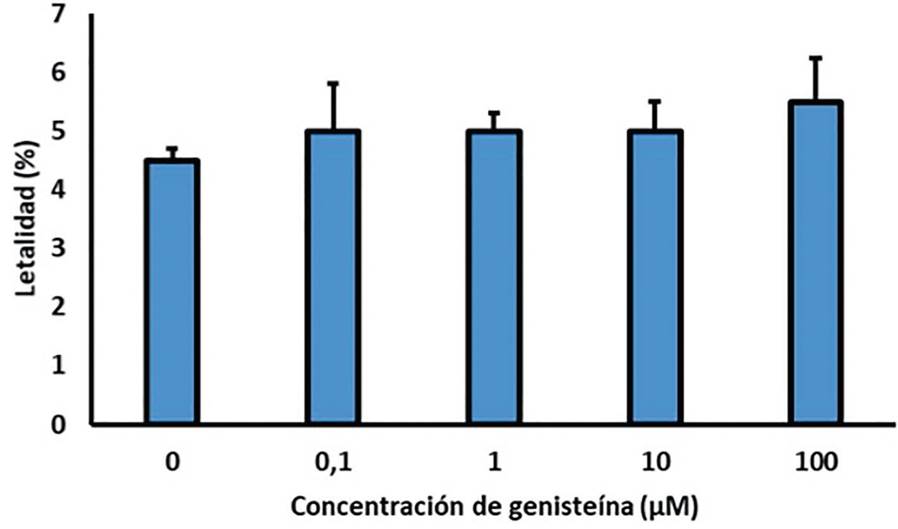
Los resultados del ensayo de letalidad se muestran en la figura 2. Los diagramas de barras muestran la letalidad de los nematodos expresada en porcentaje, después de la administración de genisteína en diferentes concentraciones comparada en relación con el control. La exposición durante 24 horas de los especímenes de Caenorhabditis elegans a las diferentes concentraciones de genisteína, no fue significativamente diferente a la del control.
Crecimiento
Los promedios de la longitud del cuerpo expresada en pm son presentados en la figura 3. Los diagramas de barras muestran el comportamiento de la longitud del cuerpo de los nematodos después de 72 horas de exposición a genisteína en diferentes concentraciones comparada con el control. La muestra de nematodos expuesta al control tiene en promedio una longitud de 380 pm, mientras que la longitud de los nemátodos expuestos a genisteína aumentó considerablemente sobrepasando los 500 pm, validado por la existencia de diferencias estadísticamente significativas (p > 0,05) entre las concentraciones de la muestra y el control.
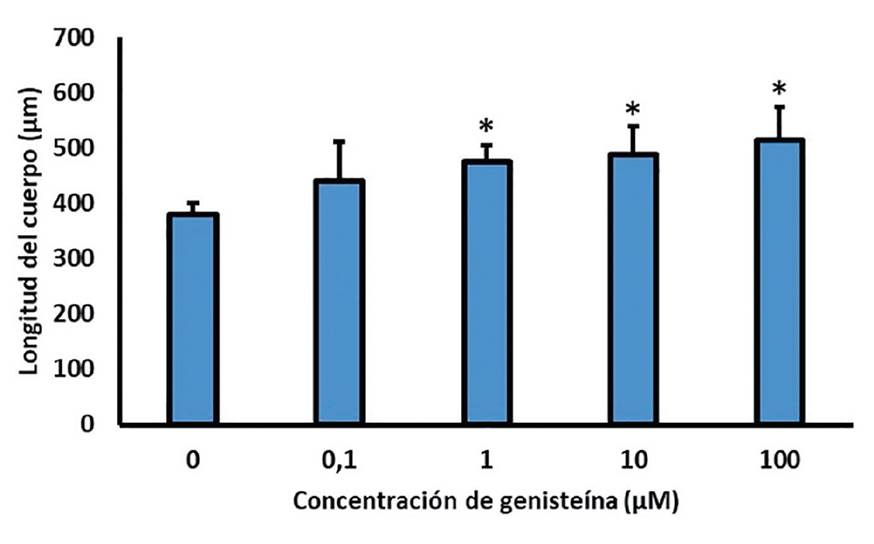
*. Diferencias significativas con el control (p<0,05, Prueba Dunnet). Fuente: elaboración propia.
Figura 3 Efecto en el crecimiento de Caenorhabditis elegans por exposición a genisteína
De igual forma, se observa que a mayor concentración mayor fue la longitud promedio de los gusanos, lo que sugiere que la genisteína afecta de manera creciente el desarrollo de las larvas desde su etapa L1 hasta la etapa L4, en la cual se realizó la medición. Este es un efecto típico de los disruptores endocrinos.
Reproducción
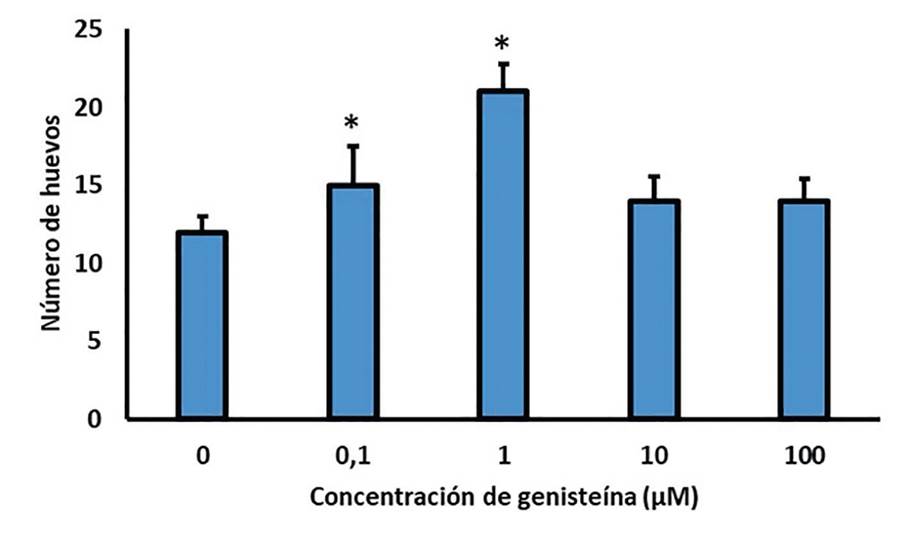
El efecto en la reproducción de los nematodos se muestra en la figura 4. Los diagramas de barras presentan el promedio de huevos producidos después de la exposición a genisteína en diferentes concentraciones en comparación con el control. El análisis comparativo por la prueba de Dunnet mostró diferencias significativas con respecto al control para las concentraciones de 10 y 100 μM (p-valor > 0,05). Adicionalmente, se observa una ligera curva no monotónica en forma de U invertida, característica de los disruptores endocrinos, lo cual sugiere que la genisteína interfiere con el desarrollo normal y el funcionamiento del sistema endocrino causando alteraciones en las funciones reproductivas del modelo animal objeto de estudio.
Cambios en la expresión génica
La fluorescencia relativa obtenida como el cociente entre la fluorescencia emitida por los nematodos expuestos a las soluciones de genisteína y la fluorescencia emitida por los individuos expuestos al control se presenta en la figura 5. Los diagramas de barras muestran los niveles de expresión de los genes sod-4, gpx-4 y hsp-3 representada como fluorescencia relativa después de la exposición durante 24 horas a genisteína en diferentes concentraciones.
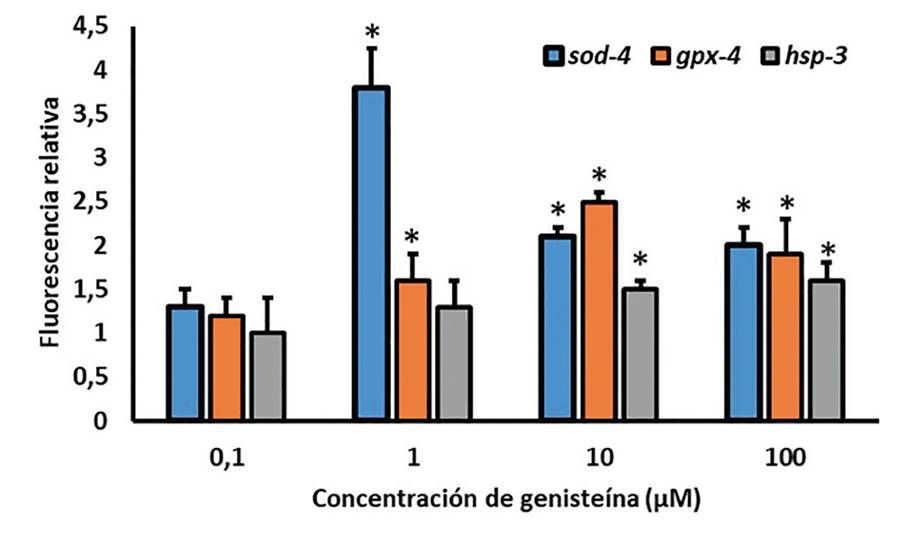
*. Diferencias significativas con el control (p<0,05, Prueba Dunnet). Fuente: elaboración propia.
Figura 5 Efectos en la expresión de genes de respuesta al estrés en Caenorhabditis elegans por exposición
Se evidenció que la genisteína fue capaz de elevar significativamente las actividades de los tres genes analizados. El gen más sobreexpresado fue sod-4 a las concentraciones de 1 y 10 μM, y alcanzó 3,8 veces la expresión del control.
Le siguió en orden el gen gpx-4, con una expresión de hasta 2,5 veces la del control a 10 μM. Estos dos genes mostraron además un comportamiento no monotónico en forma de U invertida, característico de los disruptores endocrinos. El gen hsp-3 mostró una sobreexpresión baja, pero estadísticamente significativa en relación con el control para 10 y 100 μM.
Acumulación de lípidos
Las imágenes registradas de los gusanos expuestos a concentraciones de genisteína se presentan en la figura 6; así se evidenció que el aumento en la concentración de genisteína incrementó la acumulación de lípidos en Caenorhabditis elegans, en una forma dependiente de la concentración, corroborando el potencial de disrupción endocrina a través de un efecto obesogénico.
Discusión
La genisteína no indujo mortalidad en los gusanos, sin embargo, este ensayo es necesario para establecer que las concentraciones de exposición para los demás puntos finales son subletales. Hasta ahora no ha sido reportada mortalidad aguda causada por la genisteína en ningún organismo. Por el contrario, ratones transgénicos con una grave enfermedad intestinal, aumentaron su supervivencia al ser alimentados con una dieta alta en genisteína 15. En ensayos con ratones con presencia de cáncer de colón irradiados, la genisteína presentó un efecto protector 16. En otro estudio con Caenorhabditis elegans, se encontró que la genisteína tiene efectos beneficiosos sobre la esperanza de vida del nematodo a través de la expresión elevada de proteínas de resistencia al estrés 17.
En relación con el efecto en el crecimiento de Caenorhabditis elegans, la genisteína aumentó el crecimiento del gusano en una forma concentración-dependiente, indicando un posible efecto de disrupción a nivel del sistema endocrino. En estudios con ratas Sprague Dawley (Rattus norvegicus domesticus), se observó una reducción de la ganancia semanal promedio de peso corporal y el peso de los órganos por exposición a bajas dosis de genisteína y un aumento en los expuestos a altas dosis, mostrando un efecto tóxico en el desarrollo de los animales 18. En contraste, la longitud corporal de embriones de pez cebra (Danio rerio) tratados con genisteína a las 37 h después del tratamiento disminuyó de forma dosis dependiente 19. Estos resultados muestran que, aunque el efecto puede variar de una especie a otra, la genisteína afecta el desarrollo de los animales expuestos al generarles cambios en el crecimiento, lo cual es un efecto relacionado con la disrupción endocrina.
El resultado en la reproducción en el nematodo después de su exposición a genisteína presentó incremento significativo en todas las concentraciones, principalmente a 1 μM y 100 μM, disminuyendo con las concentraciones de 10 μM arrojando curva dosis respuesta no - monotónica, donde los efectos de concentraciones crecientes del compuesto parecen aumentar hasta un pico y luego disminuir sugiriendo respuesta por disrupción endocrina 20.
En otro estudio con Caenorhabditis elegans, no se evidenciaron cambios en la reproducción a las concentraciones de 50 y 100 μM 17, lo que está en concordancia con los resultados del presente trabajo, en el cual los cambios significativos se observaron a las concentraciones más bajas. En estudios con ratones, la genisteína (6,0 y 36 μM) aumentó los niveles de progesterona, testosterona y dehidroepiandrosterona, pero disminuyó los niveles de estrona y estradiol en ratones al mostrar efectos en el desarrollo reproductivo 21. Adicionalmente, los estudios en ratas concluyeron que la genisteína produce toxicidad reproductiva y de desarrollo en tres generaciones de padres expuestos a 500 ppm de administración oral, manifestada en la disminución de la distancia anogenital y el peso corporal en cachorros machos y hembras y disminución de la edad en la abertura vaginal en cachorros hembras, y aumento de la edad en el descenso testicular en cachorros machos 22.
El arsenal de Caenorhabditis elegans para la desintoxicación incluye varias familias de proteínas como glutatión peroxidasa (GPX), superóxido dismutasa (SOD) y proteínas de choque térmico (HSPs), entre otras. La familia GPX pertenece a la primera línea de defensa contra los peróxidos, los aniones superóxido y el peróxido de hidrógeno 23. La familia SOD protege a las células del daño oxidativo. Caenorhabditis elegans tiene cinco genes que codifican SOD: sod-1 a sod-5, siendo sod-1 y sod-4 los más usados para ensayos con Caenorhabditis elegans24. Las HSPs funcionan como chaperonas moleculares, ya que apoyan el replegamiento y restauración de proteínas desnaturalizadas y ayudan a la síntesis de proteínas 14, 25. En este estudio se comprobó que la genisteína afecta las expresiones génicas de sod-4, gpx-4 y hsp-3 por medio de la emisión de fluorescencia por el gen reportero gfp. El gen sod-4, que fue el que más se sobreexpresó (casi 4 veces la expresión del control a 1 μM), responde cuando las células están en condiciones de estrés oxidativo. Este resultado confirmó lo encontrado en otro estudio con Caenor-habditis elegans, en el que demostraron que la genisteína incrementó la expresión de proteínas antiestrés como SOD- 3 y HSP-16.2 17. Por otro lado, ensayos con ratones albinos suizos machos (Mus musculus) alimentados con dieta alta en genisteína presentaron estrés oxidativo significativo determinado por el incremento de la peroxidación lipídica y la disminución del glutatión total 26.
Por otro lado, la genisteína aumentó los depósitos de lípidos en Caenorhabditis elegans, lo cual puede estar relacionado con la activación de varios receptores nucleares como PPAR (Receptor Activado por el Factor Proliferador de Peroxisomas), involucrado con el metabolismo de grasas y del colesterol, que ya han sido reportados como blancos moleculares de la genisteína en Caenorhabditis elegans27, 28. Sin embargo, serán necesarias más investigaciones para entender mejor los mecanismos moleculares sobre los que subyace el efecto de la genisteína en el metabolismo de los lípidos.
A manera de conclusión, se puede afirmar que la exposición a genisteína altera la fisiología de Caenorhabditis elegans en términos de crecimiento, reproducción, y acumulación de lípidos, probablemente por un efecto de disrupción endocrina.
La expresión de genes glutatión peroxidasa (GPX), superóxido dismutasa (SOD) y proteínas de choque térmico (HSPs) están asociados a mecanismos de protección celular a estrés oxidativo; síntesis y restauración de proteínas. La genisteína produjo una mayor fluorescencia de las cepas transgénicas utilizadas, lo que implica una mayor expresión de los genes correspondientes y determina una injuria a los nematodos a nivel celular.