Introducción
La planta Cannabis sativa presenta una composición química diversa. Dentro de los compuestos más importantes se encuentran terpenos/terpenoides y los fitocannabinoides [1], que son los meta-bolitos que más se han aislado y estudiado, tanto su estructura como su actividad biológica. Usualmente se hallan en mayor concentración en las variedades de cannabis. Los más estudiados son el tetrahidrocannabinol (THC), ácido tetrahidro-cannabinólico (THCA), cannabidiol (CBD), ácido cannabidiólico (CBDA) cannabigerol (CBG), ácido cannabigerólico (CBGA), cannabinol (CBN) y ácido cannabinólico (CBNA) [2-5]. La demanda de preparaciones o extractos de cannabis con altas concentraciones de cannabinoides, para el tratamiento de múltiples afecciones, va en aumento. Por otro lado, la preparación de cosméticos a base de can-nabis (cosmética cannábica) también se ha incrementado. Según las proyecciones, en Colombia y en el mundo se registrará en 2025 un crecimiento acelerado del mercado [6], [7].
El tetrahidrocannabinol ha sido el cannabinoide psicoactivo más estudiado debido a sus efectos terapéuticos; sin embargo, presenta un inconveniente: su actividad psicoactiva. Por otro lado, el cannabidiol es el principal cannabinoide no-psicoactivo. El CBD es hoy, sin duda, el cannabinoide más estudiado debido a sus propiedades farmacológicas y al ser no psicoactivo, se emplea para el tratamiento de diferentes enfermedades inflamatorias dentro de las que se encuentran la enfermedad de Crohn y la colitis ulcerosa y trastornos neuronales como Parkinson y Alzheimer [8]. También tiene propiedades antiproliferativas y proapoptóticas, útiles para la modulación de la tumorigénesis en diferentes tipos de cáncer, incluidos los de mama, pulmón, colon, cerebro, piel y otros [8]. También existen evidencias de que el CBD exhibe actividades antiinflamatorias (neuroinflamación), antimicrobianas y analgésicas [4], [5], [9], [10], [11].
Debido a la importancia de los fitocannabinoides, se han reportado algunas metodologías de extracción, desde las convencionales como soxhlet y maceración dinámica, hasta alternativas como la extracción asistida por ultrasonido (EAU), extracción asistida por microondas (EAM), extracción con etanol criogénico, extracción hidrodinámica de cannabis, extracción de líquidos a presión (PLE) y extracción de fluidos supercríticos [12]. La técnica de ultrasonido es ampliamente empleada en las industrias química y alimentaria por su capacidad para influir significativamente en la velocidad de sustracción.
La principal característica que diferencia a la EAU de otras técnicas es el uso de ondas con frecuencias comprendidas entre 20 y 100 kHz, que permiten la ruptura de estructuras celulares y la penetración del solvente en la matriz vegetal para sacar los compuestos de interés. A esto se le denomina cavitación, es decir, la formación, expansión y colapso de burbujas dentro de la solución que permite una intensa transferencia de masa y un acceso acelerado del solvente al material celular [12], [13]. En EAU deben considerarse y optimizarse [13] factores como el porcentaje de humedad, el tipo de solvente, el tamaño de la partícula, la temperatura, la potencia y el tiempo de sonicación.
El método más comúnmente empleado en la actualidad para la extracción de metabolitos del cannabis es el uso de solventes orgánicos volátiles; sin embargo, debido a que no son renovables y en algunos casos tóxicos, se requiere mayor investigación para el desarrollo de alternativas renovables que involucren ingeniería para el desarrollo de extractos, derivados o cosméticos de cannabis. Estas metodologías deben estar enmarcadas en la química verde y la economía circular [12].
Abbott y colaboradores describieron en 2003 los disolventes eutécticos profundos o Deep Eutectic Solvents (DES), como mezclas eutécticas, es decir, una mezcla líquida de bajo punto de fusión formada por dos o más compuestos [14], en la que se cumple que la mezcla presenta menor punto de fusión si se compara con los compuestos aislados. Los DES formados a partir de compuestos de origen vegetal se denominan disolventes eutécticos profundos naturales (NADES), que se consideran renovables y, dependiendo de sus componentes, pueden ser no tóxicos, poco volátiles, no inflamables, de fácil preparación, presentar alta capacidad de solubilización y facilidad de diseño desde su preparación, para cumplir una aplicación específica [15-17].
Se han reportado algunos estudios en los que se emplean DES y NADES con extracción asistida por ultrasonido para obtener cannabinoides. Kfízek y colaboradores [18] desarrollaron una serie de solventes eutécticos profundos hidrofóbicos (HDES) basados en terpenos y ácidos orgánicos naturales para conseguir tetrahidrocannabinol, cannabidiol y sus homólogos carboxilados, empleando la técnica de ultrasonido. Los resultados muestran que el DES compuesto por una mezcla de Mentol: Ácido acético (proporción molar 1:1) reveló la mayor eficiencia de extracción, con rendimientos que oscilaron entre 5.00 mg/g; y este DES presentó más eficiencia que solventes como etanol, metanol y cloroformo. En un estudio más reciente, Cai y colaboradores [19] desarrollaron diversos DES como medios para la extracción asistida por ultrasonido de cannabidiol (CBD) del cáñamo industrial.
El DES cloruro de colina: L-tartrato de dietilo 1:1 se seleccionó como el extractante óptimo y las condiciones optimizadas de extracción fueron: temperatura de 48 °C, 55 min, concentración de DES del 68 % en peso (en etanol) y relación sólido-líquido de 1:24; el rendimiento de la extracción fue de 12.22 mg/g y fue mayor que el alcanzado por solventes convencionales. En ambos trabajos se concluye que la extracción con DES es eficiente, no tóxica y biodegradable, tiene aplicaciones dentro de la industria farmacéutica y representa un solvente orgánico alternativo más ecológico para la extracción de fitocannabinoides.
Con lo descrito anteriormente, los objetivos de esta investigación fueron usar como base mentol, ácidos grasos y β-sitosterol para preparar disolventes eutécticos profundos naturales, usar como solventes de extracción verdes de fitocannabinoides de Cannabis sativa y evaluar el rendimiento en la obtención de fitocannabinoides empleando extracción asistida por ultrasonido con los disolventes eutécticos profundos basados en mentol.
Materiales y métodos
Material vegetal
Las muestras de Cannabis sativa fueron recolectadas en la empresa Natura Pharma Cauca S. A. S. Zomac, ubicada en el Cauca, Colombia; se siguió el muestreo recomendado por la Unodc [20]. La muestra se descarboxiló en un horno a 110 °C durante 50 min [21] en un recipiente cerrado buscando la menor pérdida de terpenos y terpenoides. Se utilizó un molino comercial para obtener un tamaño de partícula menor a 1 mm. Finalmente, las muestras se almacenaron a menos de 10 °C y se mantuvieron protegidas de la luz.
Reactivos
Para la preparación de los eutécticos profundos se utilizaron los siguientes compuestos: DL-mentol (95 %, Nusci), (β-sitosterol (95 %, Nusci), ácido dodecanoico (95 %, Nusci), ácido octanoico (95 %, Nusci), ácido decanoico (99 %, Nusci) y ácido láctico (95 %, Nusci). Como patrones para CG-MS se utilizaron cannabidiol (CBD) (13956-29-1, Restek), cannabinol (CBN) (521-35-7, Restek), Δ 9-tetra-hidrocannabinol (Δ9-9-THC) (1972-08-3, Restek), cannabigerol (CBG) (25654-31-3, Restek) y Δ 8-tetrahidrocannabinol (Δ 8-THC) (5957-75-5, Restek).
Preparación de disolventes eutécticos profundos basados en mentol
Los DES basados en mentol se prepararon por método de calentamiento y agitación a partir de DL-Mentol, ácidos grasos naturales y β-sitosterol, en las proporciones molares que produjeron DES líquidos por debajo de 25 °C. El procedimiento fue el siguiente: la mezcla se preparó pesando cada componente, se calentó entre 50 °C y 80 °C con agitación constante hasta obtener un líquido homogéneo; luego se enfrió a temperatura ambiente [22] (tabla 1). La formación del DES se comprobó visualmente y por espectroscopía infrarroja transformada de Fourier; además, se midió la densidad y viscosidad para evaluar estabilidad y posibles aplicaciones.
Tabla 1 Disolventes eutécticos profundos basados en mentol preparados
| Nombre | Aceptor de enlace de hidrógeno | Donor de enlace de hidrógeno | Relación molar | Apariencia |
|---|---|---|---|---|
| DES-1 | Mentol | Ácido acético | 2:1 | Líquido transparente |
| DES-2 | Mentol | Ácido láctico | 2:1 | Líquido transparente |
| DES-3 | Mentol | Ácido octanoico | 3:1 | Líquido amarillo claro |
| DES-4 | Mentol | Ácido octanoico | 2:1 | Líquido amarillo claro |
| DES-5 | Mentol | Ácido octanoico | 1:1 | Líquido amarillo claro |
| DES-6 | Mentol | Ácido octanoico | 1:2 | Líquido amarillo claro |
| DES-7 | Mentol | Ácido octanoico | 1:3 | Líquido amarillo claro |
| DES-8 | Mentol y β-sitosterol | Ácido octanoico | 2:1:0,15 | Líquido amarillo claro |
| DES-9 | Mentol | Ácido decanoico | 2:1 | Líquido transparente |
| DES-10 | Mentol | Ácido decanoico | 1:1 | Líquido transparente |
| DES-11 | Mentol | Ácido decanoico | 1:2 | Líquido transparente |
| DES-12 | Mentol y β -sitosterol | Ácido decanoico | 2:1:0,15 | Líquido amarillo claro |
| DES-13 | Mentol | Ácido dodecanoico | 2:1 | Líquido transparente |
| DES-14 | Mentol | Ácido dodecanoico | 3:1 | Líquido transparente |
| DES-15 | Mentol | Ácido dodecanoico | 4:1 | Líquido transparente |
| DES-16 | Mentol y β -sitosterol | Ácido dodecanoico | 2:1:0,15 | Líquido amarillo claro |
| DES-17 | Mentol | Ácido dodecanoico y Ácido octanoico | 2:0,5:0,5 | Líquido transparente |
| DES-18 | Mentol | Ácido dodecanoico y Ácido decanoico | 2:0,5:0,5 | Líquido transparente |
| DES-19 | Mentol | Ácido decanoico y Ácido octanoico | 2:0,5:0,5 | Líquido transparente |
Fuente: elaboración propia.
Extracción de titocannabinoides
Para comprobar la capacidad de los NADES para extraer fitocannabinoides por ultrasonido, se pesaron 100 mg de muestra molida, se agregaron 5,00 mL del NADES para obtener una relación cannabis: DES 1:20, se empleó un equipo Branson 1510 sonicando por 40 min y se centrifugó a 10000 rpm por 5 min. Una alícuota del sobrenadante se diluyó en etanol y se inyectó para cuantificar por cromatografía de gases. El mismo procedimiento se repitió para cada NADES preparado y se comparó con etanol (figura 7).
Con el NADES que presentó mejor rendimiento de extracción se realizó la optimización por un diseño factorial 23 donde se tomaron como factores el tiempo (20 y 60 min), %DES en etanol (70 y 100 %) y la relación Cannabis:DES (1:20 y 1:50) (tabla 2). Como variable respuesta se calculó el porcentaje de extracción de los fitocannabinoides. Los datos se analizaron en el programa Minitab v19 en su versión de prueba.
Tabla 2 Diseño experimental factorial 23 para la extracción de fitocannabinoides por extracción asistida por ultrasonido
| Orden | Tiempo | %DES | Cannabis: DES (g/mL) | % CBD | % ∆9-THC | % CBG | % CBN | % ∆8-THC |
|---|---|---|---|---|---|---|---|---|
| 3 | 20 | 100 | 0.020 | 22.83 | 4.579 | 0.744 | 1.717 | 0.254 |
| 9 | 40 | 85 | 0.035 | 21.26 | 4.115 | 0.171 | 1,443 | 0.217 |
| 1 | 20 | 70 | 0.020 | 18.84 | 3.983 | 0.065 | 1.120 | 0.209 |
| 2 | 60 | 70 | 0.020 | 21.56 | 4.597 | 0.181 | 1.739 | 0.252 |
| 8 | 60 | 100 | 0.050 | 21.86 | 4.111 | 0.142 | 1.395 | 0.207 |
| 6 | 60 | 70 | 0.050 | 21.20 | 4.284 | 0.177 | 1.158 | 0.220 |
| 4 | 60 | 100 | 0.020 | 29.28 | 6.270 | 0.407 | 3.070 | 0.273 |
| 11 | 40 | 85 | 0.035 | 22.42 | 4.950 | 0.103 | 1.312 | 0.233 |
| 10 | 40 | 85 | 0.035 | 23.70 | 5.210 | 0.131 | 1.671 | 0.240 |
| 5 | 20 | 70 | 0.050 | 21.11 | 4.416 | 0.035 | 1.821 | 0.171 |
| 7 | 20 | 100 | 0.050 | 25.85 | 5.681 | 0.244 | 1.908 | 0.240 |
Fuente: elaboración propia.
Cuantificación de fitocannabinoides por cromatografía de gases acoplado a masas
La cuantificación de los fitocannabinoides se realizó por cromatografía de gases acoplado a masas, se usó un cromatógrafo de gases serie Trace 1300 acoplado a espectrómetro de masas ISQ LT marca Thermo Scientific con automuestreador HTA, operando en modo de impacto electrónico. Se empleó una columna TG-5MS 30m x 0.25mm x 0.25μm. Se inyectaron 0.5 μL del extracto diluido en etanol, la temperatura del inyector se fijó en 270 °C, el flujo de He en 1 mL/min y un Split de 50 mL/min. Se trabajó con una rampa de temperatura, desde 240 °C por 1 min, subió a 290 °C a 20 °C/min, y 290 °C por 2 min, para un tiempo de análisis de 6 min. La temperatura de línea de transferencia y surco de iones se fijó en 230 °C y el detector MS en modo impacto electrónico en un rango de masas de 35-450 m/z. Por último, la cuantificación se realizó por estándar externo.
Resultados y discusión
Se obtuvieron 19 disolventes NADES resultantes de diferentes combinaciones entre el mentol (M) y ácidos naturales como acético (A.A), láctico (A.L), octanoico (A.Oct), decanoico (A.Dec) y dodecanoico (A.Dodec) (tabla 1) en distintas relaciones molares. Además, se logró incluir el β-sitosterol (b-S) en tres DES con mentol y ácidos grasos, de lo cual no se encontraron reportes en la literatura. Todos los NADES preparados resultaron estables por encima de 20 °C, insolubles en agua (disolventes eutécticos profundos naturales hidrofóbicos) y solubles en etanol, metanol y solventes orgánicos. Los disolventes eutécticos se forman por interacciones moleculares entre sus componentes que hacen que disminuya el punto de fusión de la mezcla si se compara con el de sus componentes individuales. En esta investigación se usó como aceptor de enlaces de hidrógeno al mentol y al β-sitosterol, y como donor de enlaces de hidrógeno a los ácidos acético, láctico, octanoico, decanoico y dodecanoico.
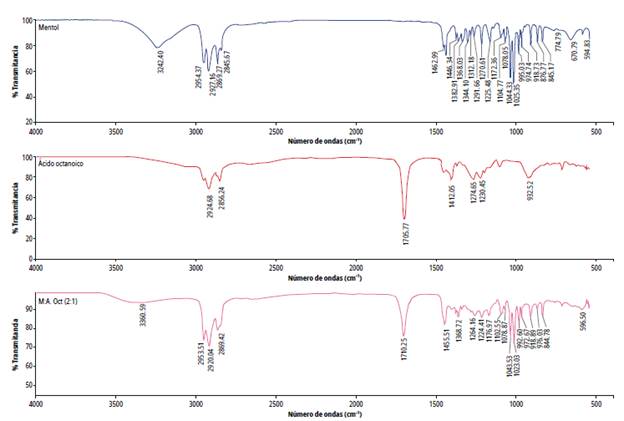
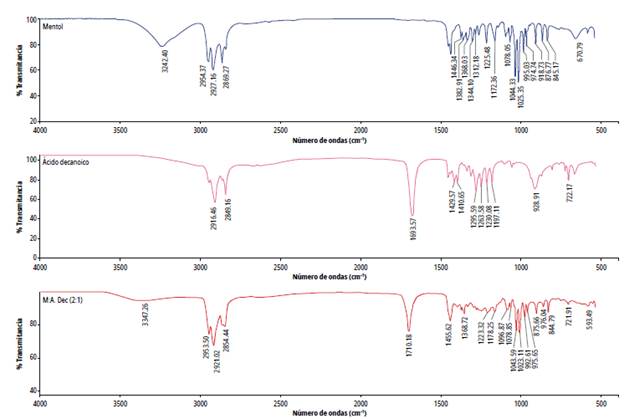
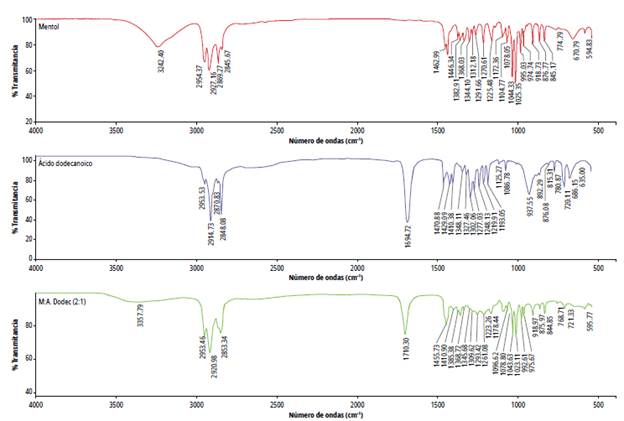
Se ha reportado que el mentol interactúa tanto con las cadenas de alquilo de los ácidos, como por formación de enlaces de hidrógeno con el grupo carboxilo. Para observar estas interacciones se realizó análisis de los disolventes por IR-ATR. El espectro de Mentol:Ácido octanoico 2:1 se muestra en la figura 2. En el mentol la elongación del enlace O-H aparece a 3242,40 cm-1, en la mezcla se desplaza a 3360,59 cm-1; en el espectro del ácido octanoico la banda correspondiente al grupo carbonilo se forma en 1705,77 cm-1 y en la mezcla eutéctica esta se desplaza a 1710,25 cm-1. Estos desplazamientos y ensanchamientos indican la formación de enlaces de hidrógeno entre el mentol y el ácido octanoico. El mismo comportamiento se evidenció para los demás DES preparados (figuras 2-4); la información de los espectros FTIR y la evidencia visual comprueban la formación de los disolventes eutécticos profundos basados en mentol.
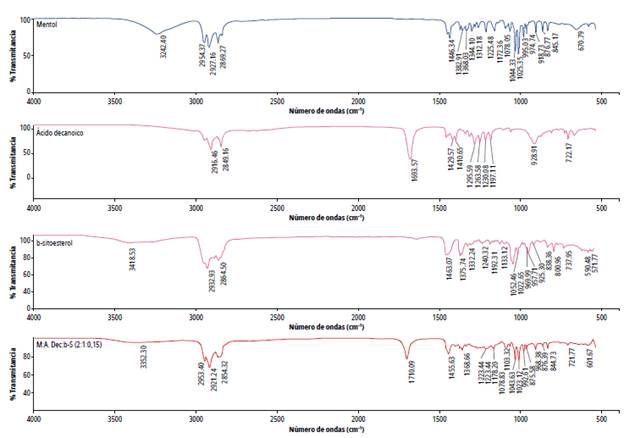
Fuente: elaboración propia.
Figura 4 Espectro FTIR del disolvente Mentol:Ácido Decanoico: ꞵ-sitosterol 2:1:0.15
Los DES preparados registraron una densidad entre 0,8915 g/mL y 0,9966 g/mL, el disolvente MentoLÁcido láctico 2:1 mostró la menor densidad y el MentoLÁcido acético 2:1 el mayor valor de densidad. En los disolventes formados entre ácidos grasos y mentol no se advirtió una diferencia significativa en su valor de densidad a un nivel de confianza del 95 %. En las mezclas de mentol y ácido octanoico, al aumentar la proporción de mentol con la del ácido octanoico constante se observó una disminución de la densidad. Al incrementar la proporción del ácido octanoico también aumentó la densidad; respecto a los disolventes conformados por mentol y ácido decanoico, al variar la concentración de mentol o ácido decanoico disminuyó la densidad si se compara con la densidad del DES MentoLÁcido decanoico 1:1. Las mezclas de mentol y ácido dodecanoico fueron estables con una baja proporción de ácido dodecanoico. El aumento de la proporción de mentol acrecentó la densidad del DES. Finalmente, las mezclas de tres componentes resultaron en DES de mayor densidad cuando se incluyó el (β-sitosterol, al igual que los DES que contienen dos tipos de ácidos grasos (figuras 5 y 6).
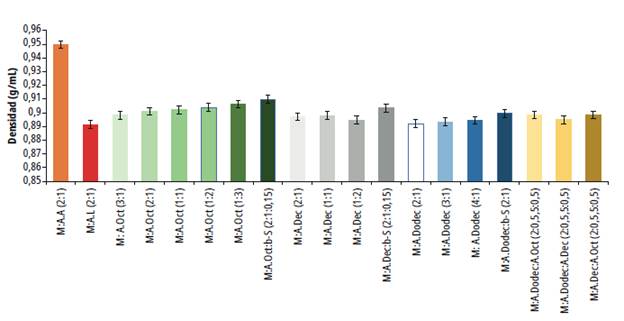
Fuente: elaboración propia.
Figura 5 Densidad de los disolventes eutécticos profundos basados en mentol
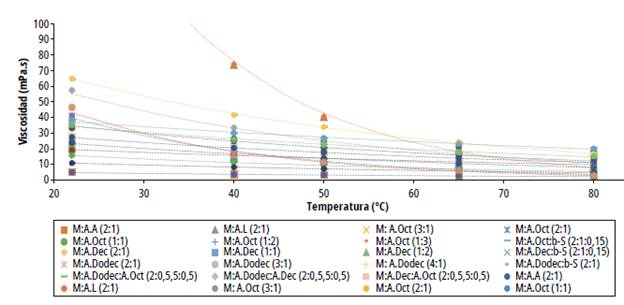
Fuente: elaboración propia.
Figura 6 Viscosidad dinámica de los disolventes eutécticos profundos basados en mentol
Por otro lado, los disolventes que se componen de mentol y ácidos grasos presentaron bajos valores de viscosidad, lo que resulta ser beneficioso para el transporte de masa durante el proceso de extracción. Se determinó una reducción exponencial de la viscosidad dinámica de los DES en un intervalo de temperatura de 22 a 80 °C. El DES de menor viscosidad dinámica fue el MentoLÁcido acético 2:1 y el de mayor viscosidad MentoLÁcido láctico 2:1. Se determinaron diferencias significativas en los valores de viscosidad entre los DES preparados. En general, los eutécticos que contienen ácido octanoico exbibieron menor viscosidad que los que contienen ácidos decanoico y dodecanoico; la viscosidad aumenta si también lo Lace la proporción molar de mentol en el eutéctico y disminuye al incrementar la proporción de ácido carboxílico.
Adicionalmente, la inclusión de (β -sitosterol acrecienta significativamente el valor de la viscosidad dinámica en comparación con la mezcla sin el β-sitosterol debido a su alto peso molecular. Finalmente, los valores de densidad y viscosidad obtenidos en este estudio se pueden clasificar como DES de baja viscosidad considerando los resultados de Ribeiro y colaboradores que prepararon DES similares a los aquí descritos [22].
Es importante resaltar que el (β -sitosterol solo se logró incluir Lasta una proporción de 0.15 molar respecto a la del mentol; por encima de esta relación el disolvente resultante no es estable a temperatura ambiente (20-22 °C). La formación de DES con este compuesto tiene importancia farmacológica porque ostenta propiedades anticancerígenas reportadas contra el cáncer de mama, próstata, colon, pulmón, estómago y leucemia [23].
Para evaluar la capacidad de extracción se usó ultrasonido empleando los DES y se calculó el porcentaje de extracción. Los resultados se presentan en la figura 7 y la tabla 3. Todos los NADES de este estudio presentaron mayores rendimientos de extracción de CBD, THC, CBG y CBN si se comparan con etanol. Este resultado es importante ya que el etanol es el solvente más empleado para la sustracción de fitocannabinoides, por lo que los NADES aquí descritos pueden usarse como solventes alternativos al etanol con los que se pueden obtener extractos y derivados de cannabis para las industrias farmacéutica y cosmética.
Tabla 3 Rendimientos de extracción de fitocannabinoides
| Extracción | Cannabis (mg) | DES(mL) | Rendimiento de extracción (%) | ||||
|---|---|---|---|---|---|---|---|
| CBD | Δ8-THC | Δ 9 -THC | CBG | CBN | |||
| DES-1 | 100.0 | 5.00 | 29.939 | 0.361 | 6.987 | 0.753 | 1.924 |
| DES-2 | 101.0 | 5.00 | 23.390 | 0.333 | 6.183 | 0.424 | 1.489 |
| DES-3 | 100.9 | 5.00 | 32.416 | 0.425 | 8.603 | 0.425 | 2.147 |
| DES-4 | 100.3 | 5.00 | 28.065 | 0.332 | 6.327 | 0.354 | 1.867 |
| DES-5 | 100.1 | 5.00 | 30.773 | 0.349 | 7.070 | 0.408 | 1.998 |
| DES-6 | 100.8 | 5.00 | 23.822 | 0.282 | 5.340 | 0.406 | 1.126 |
| DES-7 | 100.5 | 5.00 | 21.033 | 0.267 | 4.920 | 0.448 | 1.282 |
| DES-8 | 101.1 | 5.00 | 24.064 | 0.279 | 5.263 | 0.546 | 1.610 |
| DES-9 | 100.7 | 5.00 | 26.002 | 0.325 | 5.939 | 0.483 | 1.478 |
| DES-10 | 100.7 | 5.00 | 22.863 | 0.271 | 5.290 | 0.000 | 0.000 |
| DES-11 | 100.7 | 5.00 | 22.718 | 0.000 | 8.641 | 0.240 | 0.651 |
| DES-12 | 100.6 | 5.00 | 27.457 | 0.000 | 6.661 | 0.641 | 1.630 |
| DES-13 | 100.5 | 5.00 | 23.918 | 0.625 | 11.038 | 0.484 | 1.092 |
| DES-14 | 100.7 | 5.00 | 24.440 | 0.277 | 9.052 | 0.000 | 0.000 |
| DES-15 | 100.7 | 5.00 | 23.197 | 0.000 | 5.577 | 0.214 | 0.720 |
| DES-16 | 100.1 | 5.00 | 26.731 | 0.444 | 6.830 | 0.448 | 1.474 |
| DES-17 | 100.1 | 5.00 | 26.500 | 0.338 | 6.091 | 0.594 | 1.857 |
| DES-18 | 100.0 | 5.00 | 27.082 | 0.282 | 6.409 | 0.363 | 1.322 |
| DES-19 | 100.0 | 5.00 | 26.927 | 0.313 | 6.733 | 0.582 | 1.532 |
| Etanol | 100.3 | 5.00 | 18.157 | 0.282 | 4.210 | 0.000 | 0.984 |
Fuente: elaboración propia.
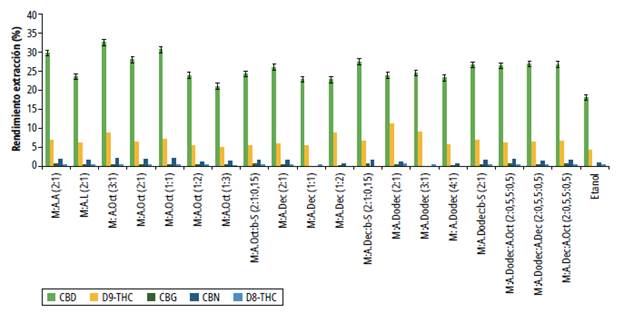
Fuente: elaboración propia.
Figura 7 Rendimiento de extracción de fitocannabinoides usando los disolventes eutécticos basados en mentol
Con el NADES M:A.Oct 3:1 se logró un rendimiento de extracción del 32.416% de CBD, que difiere de lo reportado por Křižek y colaboradores [18], porque, según su estudio, el DES más eficiente fue M:A.A 2:1 por encima de M:A.Oct 1:1, lo que indica que el aumento en la proporción molar del mentol en este último produjo un incremento en el rendimiento de extracción de los fitocannabinoides. En el mismo sentido, el M:A.Dodec 2:1 fue el NADES que presentó mayor rendimiento para Δ9-THC, seguido de M:A Oct 3:1; el mayor rendimiento para CBG se logró con M:A.A 2:1, seguido de M:A.Dec: β-S 2:1:0,15. Por último, el mayor rendimiento de extracción de CBN se logró con M:A.ct 3:1 y M:A.Oct 1:1.
Al usar el disolvente sin diluir se identificaron dos características propias de los DES que afectan la extracción, la polaridad y la viscosidad. Los disolventes basados en mentol pueden extraer cannabinoides al establecer amplias interacciones intermoleculares con estos, como interacciones Lidrofóbicas y enlaces de Lidrógeno. El valor de log P para el THC es 6.97 y para el CBD es 5.79 por lo que se pueden obtener con disolventes de baja polaridad como los DES usados en este estudio.
Cuando se aumenta la longitud de la cadena del ácido disminuye la polaridad del NADES; sin embargo, se acentúa su viscosidad y, por tanto, se limita el transporte de masa de los cannabinoides desde las estructuras celulares Lasta el disolvente para ser sacados. Esto se evidencia al comparar M:A. Octa 2.1, M:A. Dec 2:1 y M:A. Dodec 2:1: el mayor rendimiento se presenta con el DES del ácido graso de menor longitud (C8). En cuanto a los DES que contenían (β-sitosterol, M:A.Oct:b-S 2:1:0,15 muestra menor rendimiento que M:A.Oct 2:1 ya que en el primero el (β-sitosterol acrecienta la viscosidad. El caso contrario se observa en los DES M:A.Dec:b-S 2:1:0,15 y M:A.Dodec:b-S 2:1 porque se incrementa el rendimiento de extracción si se compara con los DES sin el (β -sitosterol, ya que al ser estos últimos más viscosos el (β -Sitos-terol agranda la afinidad de los fitocannabinoides. Finalmente, al formar los resultados obtenidos con los DES formados con mentol y dos ácidos grasos no se logró establecer una diferencia significativa en el rendimiento de extracción (DES 17-19).
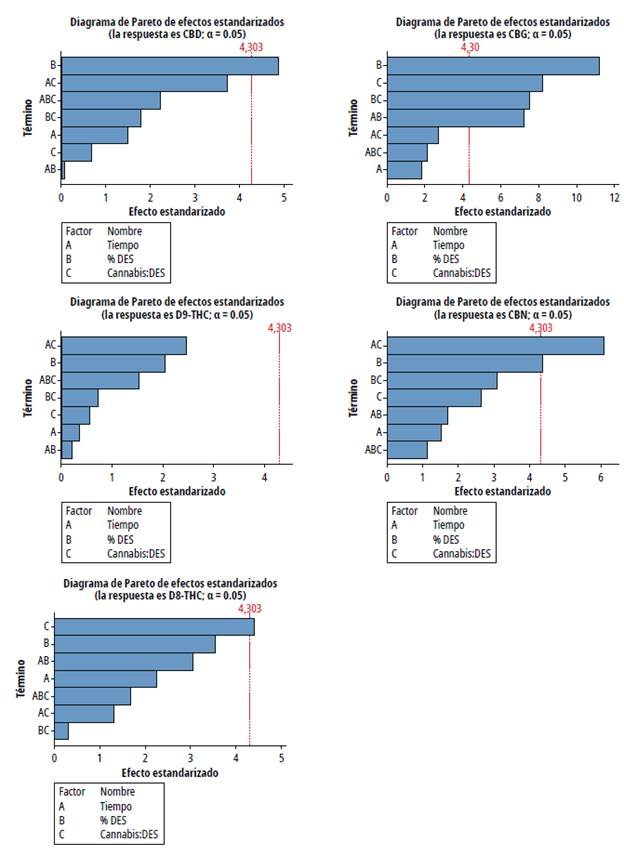
Para evaluar el efecto del porcentaje en peso del DES, la relación Cannabis:DES y el tiempo de sonicación sobre el rendimiento de extracción de cada cannabinoide se realizó un diseño factorial 23 con tres repeticiones en el punto central, cuyo resumen se muestra en la tabla 2. En la figura 8 se aprecian los diagramas de Pareto obtenidos. Para la extracción de CBD el efecto significativo es el %DES, la extracción de Δ 9-THC no presentó efectos significativos y en la de Δ8-THC solo es significativa la relación Cannabis:DES, el %DES y la relación Cannabis:DES tiene un efecto significativo en la extracción de CBG así como las interacciones %DES*Cannabis:DES y %DES*Tiempo, finalmente, el %DES y la interacción Tiempo*Cannabis:DES tienen un efecto significativo en la extracción de CBN (figura 8).
El análisis de varianza (Anova), resultante del análisis del diseño, indicó que el modelo de regresión es significativo y la falta de ajuste no significativo; los coeficientes de determinación (R2) de todos los modelos de rendimientos de extracción de los fitocannabinoides estuvieron por encima de 0.7000 por lo que resultaron adecuados y dan confianza para la predicción de respuestas. A continuación, se presentan los modelos de extracción para cada fitocannabinoide:
Solo el modelo CBG presentó una curvatura significativa, contrario a lo que sucedió con los demás fitocannabinoides. Esto podría variar si se considera en el diseño el factor de la temperatura. Para la optimización solo se consideran interacciones lineales, de lo cual se derivan como condiciones óptimas 60 min de sonicación, 100 % del DES y una relación de Cannabis:DES de 0.020 g/mL (1:50) para un objetivo de 29.28% de CBD, 3.98 % de Δ 9-THC, 0.27 % de Δ8-THC, 0.74 % de CBG y 3.07 % de CBN. Las condiciones óptimas obtenidas son relevantes porque, aunque resultó en el mayor tiempo de extracción, la relación cannabis:DES es la más baja y la viscosidad no es una limitante en el proceso, ya que para el 100 % del DES dio el mayor rendimiento. Se probaron las condiciones óptimas y se obtuvo un rendimiento de 29.22 % de CBD, 3.90 % de Δ 9-THC, 0.29 % de Δ 8-THC, 0.71 % de CBG y 3.07 % de CBN, cercanos a la utilidad estimada por el modelo, por lo que este es apropiado para predecir el porcentaje de extracción de los fitocannabinoides.
De acuerdo con lo obtenido en este estudio, se determinó que los rendimientos de extracción son superiores a los reportados por Cai y colaboradores: 12 mg/g de CBD empleando DES basados en cloruro de colina y betaína [19]; también los resultados obtenidos son mayores a los rendimientos reportados por Křižek y colaboradores quienes emplearon DES hidrófobos basados en terpenos y ácidos grasos que alcanzaron un rendimiento de extracción de 5,00 mg/g para CBD [18].
Conclusiones
Se prepararon y caracterizaron NADES de baja viscosidad basados en mentol, (β-sitosterol y ácidos grasos, que muestran mayores rendimientos de extracción de fitocannabinoides como CBD, THC, CBN y CBG si se comparan con etanol y se emplea ultrasonido. Se determinó que la proporción molar, la viscosidad y la polaridad de los DES afecta la extracción de los fitocannabinoides. El disolvente MentoLÁcido octanoico 3:1 presentó el mayor porcentaje de extracción y con este se optimizó la obtención por ultrasonido, para la cual se encontraron como condiciones óptimas, tiempo de 60 min, %DES de 100 % y una relación Cannabis:DES 1:20.
En este estudio se logró una extracción verde y eficiente de fitocannabinoides en la industria del cannabis medicinal o cosmética, que implica una alternativa a las técnicas convencionales para la preparación de derivados del cannabis. La metodología es novedosa, optimizable y tiene potencial para implementarse a gran escala.