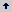Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Facultad Nacional de Agronomía Medellín
Print version ISSN 0304-2847
Rev. Fac. Nac. Agron. Medellín vol.57 no.1 Medellín Jan./June 2004
ALGUNAS OBSERVACIONES SOBRE LA ESTRUCTURA DEL NIDO Y COMPOSICIÓN DE COLONIAS DE Pseudomyrmex termitarius (HYMENOPTERA: FORMICIDAE) EN UNA LOCALIDAD DE BELLO (ANTIOQUIA, COLOMBIA)
SOME OBSERVATIONS ON THE NEST STRUCTURE AND COLONY COMPOSITION OF Pseudomyrmex termitarius (HYMENOPTERA: FORMICIDAE) IN A BELLO ( ANTIOQUIA, COLOMBIA ) LOCALITY
John Alexander Pulgarín Díaz1
1 Estudiante de Ingeniería Forestal. Universidad Nacional de Colombia, Sede Medellín. Facultad de Ciencias Agropecuarias. A.A. 1779, Medellín, Colombia. <japulga0@unalmed.edu.co>
Recibido: Octubre 7 de 2003; aceptado; Febrero 26 de 2004.
RESUMEN
Se han realizado pocos estudios sobre la composición de las colonias y arquitectura del nido, no solo de especies del género Pseudomyrmex si no en general de la familia Formicidae. P. termitarius es una de las dos especies del género que nidifica en el suelo. Ésta ha sido objeto de pocas investigaciones ecológicas y etológicas. En este trabajo se estudió la composición de colonias de P. termitarius, la arquitectura de su nido en una localidad de Bello (Antioquia, Colombia) y se realizaron observaciones sobre el establecimiento in vitro de colonias de la especie.
Se excavaron 27 nidos, cada uno contenido, dentro de bloques cilíndricos de suelo de 35 cm de profundidad y 20 cm de diámetro aproximadamente. Quince de estos nidos se utilizaron para estudiar la composición de las colonias, en los cuales se contaron los individuos contenidos. Ocho nidos se establecieron en condiciones in vitro y se les proporcionó diferentes dietas. Para estudiar la estructura de los nidos se vació yeso con agua en 12 de los 27 nidos, se excavaron y se separó la estructura del nido formada por el yeso. Se realizaron observaciones sobre su arquitectura.
Una colonia típica de P. termitarius posee un máximo de 297 individuos; el máximo número de obreras es de 102. Se discute la causa de la ausencia de reina en la mayoría de los nidos excavados y la hipótesis de que la especie sea polidómica y/o posea obreras gamergadas. La estructura de los nidos de la especie posee la forma típica de nidos subterráneos de hormigas, con máximo 22 cm profundidad y 5 cámaras de 1.63 cm3 aproximadamente. La estructura externa de los nidos es bien conocida, pero no la interna. De los ocho nidos in vitro sobrevivieron cuatro por 14 meses, con una dieta de Cryptotermes brevis e imagos de Drosophilidae congelados y solución de agua-miel.
Palabras claves: cría in vitro, obreras gamergadas, poliginia, nido subterráneo, polidomía. Pseudomyrmex termitarius
ABSTRACT
Few studies have been conducted on colony composition and nest architecture of Pseudomyrmex species or even in general for the family Formicidae. P. termitarius is one of the two species in this genus that nests in the soil. It has been the subject of few ecological and ethological investigations. In this investigation, the colony composition and nest architecture of P. termitarius was studied in a locality in Bello ( Antioquia, Colombia ) and observations were conducted on the in vitro establishment of colonies of the species.
Twenty seven nests were excavated, each one inside cylindrical soil blocks of approximately 35 cm depth and 20 cm diameter. Fifteen of these nests were used to study colony composition; in which all individuals were counted. Eight nests were established under in vitro conditions and were provided different diets. To study the nests structure plaster with water was poured into 12 of the 27 nests, then each nest was dug and the nest structure formed by the plaster separated. Observations were made on the nest architecture.
A typical colony of P. termitarius possess a maximum of 297 individuals; the maximum number of workers was 102. The causes for the absence of a queen in the majority of the nests are discussed and the hypothesis is advanced that the species is polydomous and/or possesses gamergates. The nest structure for this species is typical of subterranean ant nests, with a maximum of 22 cm in depth and five chambers of approximately 63 cm3. External nest structure is well known, but internal structure is not. Of the eight in vitro nests, four survived for 14 months on a diet of Cryptotermes brevis, frozen Drosophilidae imagos, and a water-honey solution.
Key words: in vitro rearing, gamergates workers, poligynous, underground nest structure, polydomous.
 INTRODUCCIÓN
INTRODUCCIÓN
 MATERIALES Y MÉTODOS
MATERIALES Y MÉTODOS
 RESULTADOS
RESULTADOS
 DISCUSIÓN
DISCUSIÓN
 AGRADECIMIENTOS
AGRADECIMIENTOS
 BIBLIOGRAFÍA
BIBLIOGRAFÍA
Según Tschinkel (2003), la información concerniente a la arquitectura de nidos de hormigas de algunas especies se ha obtenido de forma indirecta; algunas veces son solo descripciones verbales o dibujos de pocas especies, exceptuando algunos casos como los de Cassill; Tschinkel y Vinson (2002), Jaffe; López y Aragot (1986), Tschinkel (1987), Talbot (1945) entre otros. Aún con tal falta de información es claro que estos son altamente estructurados y específicos para cada especie, tanto en tamaño como en forma (Tschinkel, 2003). Este mismo autor sugiere que aumentar el conocimiento de la estructura, función y los mecanismos de formación de nidos de hormigas modernas, será de ayuda para detectar y entender los nidos fósiles.
Por otro lado, Hölldobler y Wilson (1990) reportan el número representativo de individuos adultos en colonias de hormigas de las subfamilias Ponerinae, Nothomyrmeciinae, Myrmeciinae, Dorylinae, Ecitoninae, Leptanillinae, Myrmicinae, Dolichoderinae y Formicinae; pero no de Pseudomyrmecinae ya que la información disponible al respecto es escasa.
Adicional a lo anterior, la mayoría de especies del género Pseudomyrmex nidifican en material leñoso en descomposición y una minoría viven en cavidades especiales de plantas vivas (Ward, 1991). Pero Mann (1916) y Luederwaldt (1926) (citados por Kempf, 1960), reportaron los hábitos discrepantes de Pseudomyrmex termitarius (Frederick Smith, 1855), ya que esta especie nidifica en el suelo. Según Kempf (1960) son dos las especies del género que nidifican en el suelo; Pseudomyrmex denticollis (Emery) es la otra especie del género que nidifica en el suelo.
A las especies del género mencionado se les han realizado relativamente pocos estudios, entre ellos están los siguientes: Janzen (1967), desarrolló un estudio detallado de la interacción entre Acacia cornigera y Pseudomyrmex ferruginea; en este estudio el autor presentó datos sobre la morfología de las colonias y su desarrollo, el comportamiento de los individuos, los factores de mortalidad, entre otros. Janzen (1975) describió como la estructura de la colonia de Pseudomyrmex nigropilosa se ajusta para parasitar el mutualismo entre hormigas del género Pseudomyrmex y arbustos del género Acacia; y comparó la información obtenida con tres especies de hormigas obligadas al mutualismo mencionado.
Pseudomyrmex termitarius es una hormiga bastante conspicua que ha sido objeto de pocos estudios ecológicos y etológicos. Estas hormigas de hábitos diurnos (Jaffe; López y Aragot; 1986; Mill, 1981), anida dentro de colonias de termitas (Cornitermes cumulans (Collar)), pudiendo alimentarse de ellas; en ausencia de termiteros habita nidos subterráneos excavados por si misma, constituyéndose en una de las dos especies del género que nidifica en el subsuelo (Mill, 1981). Esta especie se distribuye en varios tipos de vegetación en el neotrópico (Mill, 1981). Según Kempf (1960) se encuentra en Argentina, Brasil, Perú, Venezuela, Trinidad, Grenada y Guayana Inglesa. Aunque esta especie se conoce científicamente hace 149 años, es poco lo que se conoce acerca de la composición de su colonia y la estructura de su nido.
Agregando a estos estudios, Kempf (1960), con la intención de mejorar el conocimiento sistemático del género Pseudomyrmex, revisó la morfología, distribución geográfica, y algunas anotaciones sobre la biología de P. termitarius. Mill (1981) realizó observaciones sobre la ecología de Pseudomyrmex termitarius, específicamente sobre la densidad de los nidos y su distribución con respecto a termiteros de Cornitermes cumulans (Collar), la apariencia externa de los nidos, el comportamiento de forrajeo de las obreras y la selección de presas. Jaffe, López y Aragot (1986) realizaron observaciones sobre el ritmo de actividad, comportamiento territorial, feromonas de alarma y otras observaciones sobre el nido, la colonia y su cría en laboratorio, dentro de un trabajo sobre el sistema de comunicación de P. termitarius y P. triplarinus.
El propósito de este estudio fue obtener información básica acerca de la biológica de P. termitarius. Se estudiaron aspectos como: composición de la colonia y arquitectura de su nido; además se reportan algunas observaciones del establecimiento in vitro de ocho colonias de la especie.
Área de estudio. El muestreo se realizó en el municipio de Bello (Antioquia, Colombia), en un lote de expansión urbana a 1558 msnm, en zona de vida bosque húmedo premontano con suelo erosionado (Departamento Administrativo de Planeación, 2002). La vegetación predominante en la zona son pastos y pequeños arbustos (altura ≤ 1,5 m) persistentes después de quemas frecuentes. Composición de las colonias. Para estudiar este tópico y la estructura de los nidos (ver mas abajo), se localizaron estos últimos ubicando en campo algunas hormigas de la especie, y siguiéndolas hasta que entraran a algún orificio, el cual se marcaba para su posterior excavación. Otra forma en la que se localizaron los nidos, fue observando agujeros con las características que tienen los de la especie (ver resultados de la estructura de los nidos), esperando ver hormigas entrando o saliendo de éstos. Para la selección de éstos agujeros, se introdujo un objeto delgado en el orificio con el que se estimó su profundidad, si ésta era mayor a 4 cm aproximadamente, eran descartados.
La excavación de los nidos se realizó en las horas de menor actividad de la colonia (11:00 a 15:00), previa observación de éstos en las horas de mayor actividad (09:00 a 11:00 y 15:00 a 17:00) (Mill, 1981).
Una vez encontrada la entrada al nido se taponó ésta con suelo humedecido; luego se excavó un bloque cilíndrico de suelo de aproximadamente 35 cm de altura y 20 cm de diámetro en su base, con la entrada del nido en el centro. El terrón así obtenido se llevó al laboratorio dentro de bolsas plásticas donde se excavó lentamente desde el fondo hacia arriba hasta encontrar la cámara más profunda, a la que se le registró su distancia a la superficie del suelo. Luego se destruyó el terrón lateralmente, observando el número de cámaras y colectando los individuos contenidos, los que se clasificaron en huevo y larva, pupa, obrera, reina y alado macho o hembra. Para esta parte del estudio se excavaron 15 nidos.
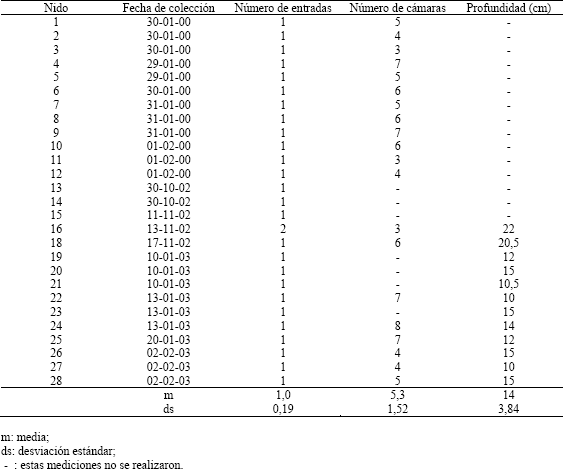
Estructura del nido. Para estudiar el volumen de las cámaras de los nidos, se vació yeso con agua por la entrada de 12 nidos, previa insuflación de yeso en polvo dentro de los nidos; luego se excavó un bloque de suelo con las mismas características que se usaron para estudiar la composición de las colonias; por último, se transportaron al laboratorio dentro de bolsas plásticas. Después de dejar secar el terrón al aire por dos días se desmenuzó lentamente en el laboratorio colectando las cámaras formadas por el yeso vaciado, y reconstruyendo las que no quedaron totalmente definidas según la forma del nido.De los 27 nidos colectados (12 para estudiar la estructura de los nidos y 15 para estudiar la composición de las colonias) se hicieron observaciones sobre la arquitectura del nido, el número de entradas y la forma y disposición de las cámaras.
Establecimiento in vitro. De los 15 nidos excavados para el estudio de la composición de las colonias, a ocho se les extrajeron sus individuos, los que se conservaron en laboratorio dentro de terrarios de tamaños y materiales diferentes. Dos de los terrarios fueron fabricados en vidrio y dos en plástico; su volumen mínimo fue 18.500 cm3 y máximo de 35.000 cm3. Dentro de cada terrario se dispuso suelo del lugar de origen de los nidos y dos tubos de ensayo de vidrio de 7 cm3 cada uno. Uno de los tubos se modificó con 1,6 cm3 de agua, 0,5 cm3 de aire y un tapón de algodón compacto de aproximadamente 1,57 cm3 (Figura 1). Jaffe, López y Aragot (1986) proporcionaron a esta especie tubos de vidrio con un tapón de algodón separando 10 cm3 de agua en el fondo.
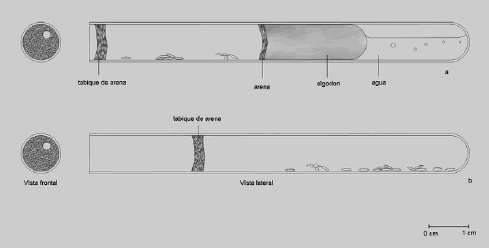
Figura 1. Tubos de ensayo de vidrio usados por las hormigas. a- tubo modificado con aproximadamente 1,6 cm3 de agua y 0,5 cm3 de aire, separados por un tapón de algodón compacto. b- tubo sin modificar. Las hormigas adicionaron a los tubos de ensayo las estructuras de arena.
A las hormigas se les proporcionó una variante de la dieta Bhatkar (remplazando el agar por gelatina sin sabor), miel con agua (50%), larvas, soldados y alados de Cryptotermes brevis (Walker) (Isoptera: Kalotermitidae) congelados y adultos de Drosophilidae también congelados. Permanentemente se proporcionó agua suficiente. A estas colonias se les registró su longevidad en laboratorio.
El laboratorio está ubicado en el perímetro urbano del municipio de Bello a 1.538 msnm. y con temperatura de 20ºC aproximadamente.
Composición de la colonia. De los 15 nidos excavados (Tabla 1) se obtuvo que su composición no supera los 297 individuos entre obreras, alados y progenie. La máxima cantidad de obreras encontrada por nido fue 102, de larvas y huevos 174, de pupas 76 y de alados 7.
Tabla 1. Composición de 15 nidos de Pseudomyrmex termitarius.
Los individuos alados se encontraron en nidos con cuatro o mas obreras (ver nido 13, Tabla 1), pero no se encontraron en todos los nidos. El número máximo de alados fue de siete (nido 22, Tabla 1) y en promedio se obtuvo 1,1 machos y 0,5 hembras aladas por nido (Tabla 1). Solo se encontró una reina en dos de los 15 nidos excavados.
Estructura del nido. A la gran mayoría de los nidos excavados se les encontró una única salida de 2-3 mm de diámetro, la cual se localiza en la base de pequeños manojos de pastos o en áreas de suelo desnudo con inclinación leve. En ningún momento se observó chimenea o montículos de material en la entrada de los nidos, ni en su periferia.Los nidos poseen un túnel sinuoso de 3 a 4 mm de diámetro, sin ramificaciones, que conecta una a una las cámaras del nido (Figura 2). Este túnel en su parte terminal siempre se encontró conectado a una cámara, la que puede estar localizada a una profundidad máxima de 22 cm (Tabla 2). La orientación de los túneles es predominantemente vertical. No fue posible encontrar el volumen de los túneles ya que sus partes vaciadas, con el método usado, son muy difíciles de reconstruir.
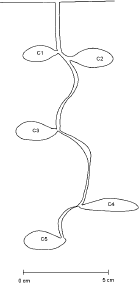
Figura 2. Estructura de un nido de Pseudomyrmex termitarius con cinco cámaras en promedio (Tabla 3), a una profundidad media de 15 cm. Cámaras de cría C1, C2, C3, C4 y C5.
Tabla 2. Volumen de las cámaras de 12 nidos de Pseudomyrmex termitarius.
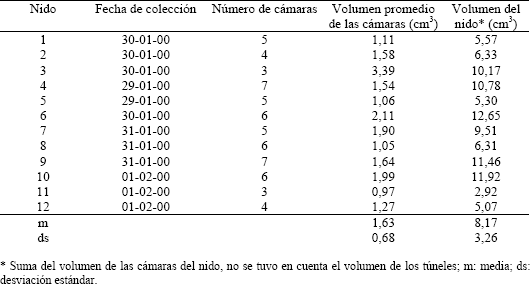
Tabla 3. Observaciones sobre la arquitectura de 27 nidos de Pseudomyrmex termitarius.
Durante el proceso de excavación de los nidos, se destruyeron tres de éstos los cuales se excavaron rápidamente para detallar la distribución de los individuos en su interior. Como resultado, se encontró que gran cantidad de progenie era mantenida en las dos cámaras superiores (Figura 2; C1 y C2), aproximadamente a 3 cm de profundidad.
Las cámaras son generalmente de forma oval (Figura 2; C1, C2, C3 y C5), aunque también hay algunas de forma aplanada (Figura 2; C4); en uno de sus extremos se unen al túnel por medio de una extensión de la cámara. De los 27 nidos excavados se obtuvo en promedio 5,3 cámaras por nido (Tabla 3), cada una de estas cámaras posee un volumen promedio de 1,6 cm3 (Tabla 2) y el nido completo posee un volumen de 8,2 cm3, en promedio. La mayor cantidad de cámaras que se encontró en un nido fue de 8 y la mínima de 3 (Tabla 3).
No se encontraron nidos comunicados subterráneamente, ni otros artrópodos dentro de estos. Tampoco se observaron termiteros en el área de estudio.
Observaciones de los nidos mantenidos in vitro. De los ocho nidos mantenidos en laboratorio, cuatro escogieron el vial modificado (Figura 1a), y los cuatro restantes el vial sin modificar (Figura 1b); ningún nido ocupó los dos tipos de viales simultáneamente. Las hormigas llevaron a los viales su progenie el mismo día en el que fueron puestas dentro del terrario. El agua contenida en los viales modificados se secó en 60 días aproximadamente.Dentro de los viales en los cuales las hormigas se establecieron, éstas mantuvieron su progenie y alimento. A estos viales las hormigas les construyeron un tabique delgado de arena, formando una cámara de 3,14 cm3 en el vial modificado y de 6,28 cm3 en el vial no modificado. Al tabique las hormigas le construyeron un orificio de 2 mm de diámetro aproximadamente (Figura 1).
A los primeros nidos llevados al laboratorio (nidos 13, 14, 15 y 16) se les proporcionó la dieta Bhatkar descrita antes. Esta dieta se llenaba de hongos a los pocos días después de servirla, por tanto, fue cambiada por insectos congelados y la solución de miel mencionada; tales insectos son llevados por las hormigas al vial ocupado. De las moscas y las termitas aladas, las hormigas dejan las alas y de las termitas soldado las partes más exclerotizadas; estos desperdicios, además de los cadáveres de las hormigas, son dejados en diferentes lugares del terrario fuera del nido.
Es necesario anotar que durante el transporte del terrón al laboratorio, conteo de los individuos habitantes del nido, el transporte de éstos al terrario y su establecimiento, murieron muchos individuos los cuales no se cuantificaron, por tanto, la composición actual de éstos nidos no es relevante. Jaffe, López y Aragot (1986) no reportan este tipo de problemas pero tampoco la forma de transplantar los nidos al laboratorio.
Composición de la colonia. La Tabla 4 muestra el máximo número de obreras, reportadas en la literatura, de colonias de seis especies del género Pseudomyrmex; estos datos hacen ver las colonias de P. termitarius pequeñas (si se toma esta especie como monodómica), ya que la cantidad de obreras de la colonia mas grande que se capturó representa el 8,5 % del número de obreras de la colonia menor en la lista. Dentro de este género, Pseudomyrmex venefica posee el reporte del mayor número de obreras, y según lo encontrado en este estudio, P. termitarius es la especie que posee menor cantidad de obreras en sus colonias de mayor tamaño.
Tabla 4. Máximo número en la colonia de 6 especies de Pseudomyrmex.
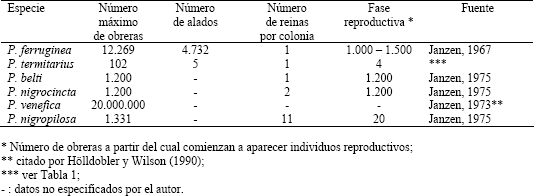
Según Hölldobler y Wilson (1990), las colonias de especies que viven en hábitats menos restrictivos (como el subsuelo), tienden a poseer mayor cantidad de adultos que las que habitan lugares temporales o sitios de condiciones más limitantes (como plantas y material leñoso en descomposición). Adicional a esto, como fue mencionado en la introducción, gran parte de las hormigas pseudomirmecinas construyen sus nidos en material leñoso en descomposición, una minoría de éstas habitan cavidades especializadas de plantas vivas, y dos especies nidifican en el suelo (Ward, 1991); por tanto, se esperaría que las colonias de P. termitarius llegaran a tener mayor cantidad de obreras que las demás especies mencionadas en la Tabla 4 que no habitan el subsuelo.
Según Jaffe, López y Aragot (1986), el máximo tamaño de las colonias de P. termitarius es de 200 individuos (información no desglosada en fracción de progenie, reproductivos y obreras). Con el presente estudio, se reporta un nuevo valor para este parámetro. La variación la cantidad de individuos de las colonias, se debe a diferentes factores como los reportados para Pseudomyrmex ferruginea (Janzen, 1967), a saber: edad de la colonia, disponibilidad de alimento, historia de la colonia y época del año; esto explica la variación en el tamaño de las colonias capturadas para este estudio.
Según Hölldobler y Wilson (1990), la producción de individuos reproductivos es una función creciente del tamaño de la colonia, que comienza cerca al máximo tamaño que puede alcanzar la colonia. Por tanto un número bajo de obreras significa que la colonia todavía es juvenil, no es un organismo reproductivo. Las especies de Pseudomyrmex reportadas en la tabla 4, comienzan a producir individuos alados a partir de un alto número de obreras, excepto P. termitarius y P. nigropilosa. Aún así, algunos de los nidos excavados de P. termitarius con alto número de obreras no poseían individuos reproductivos (nidos 18, 21, 25 y 26). No obstante, el máximo número de alados coincide con el nido más poblado (nido 22), mientras que el nido 18, con igual número de obreras que el 22, no posee alados.
El número máximo de individuos alados de un nido de P. termitarius es bajo al comparar este parámetro con P. ferruginea (única especie del género a la cual se le encontraron reportes sobre éste tópico. Ver Tabla 4). Es necesario hacer notar los nidos 13, 16, 23 y 20 (Tabla 1). En los tres primeros, la cantidad de obreras y en general la cantidad de individuos es pobre, y aún así se presentan individuos alados. En el cuarto, no se encontró progenie ni individuos reproductivos, a pesar de que para menos de esta cantidad de obreras se encontró progenie y alados en otros nidos (13 y 15).
Lo discutido en los párrafos anteriores hace pensar que en el muestreo de las colonias de P. termitarius no se obtuvieron colonias completas, se muestreó solo parte de éstas - un nido de una colonia, de una especie polidómica, es solo un fragmento de la colonia.
El número de reinas por nido que se encontró (Tabla 1), indica que las colonias de P. termitarius son monogínicas al igual las colonias de P. ferruginea y P. belti (Tabla 4). En contraste, las colonias de P. nigrocincta y P. nigropilosa son poligínicas. De P. venefica no se encontró información al respecto.
La presencia de progenie en nidos de P. termitarius sin reina (todos excepto los nidos 18, 20 y 22) puede ser explicada por dos mecanismos: 1- que las colonias de P. termitarius sean polidómicas; 2- que existan obreras que se puedan aparear y reproducir.
La primer forma de explicar este hecho, se soporta por la hipótesis de que el muestreo de las colonias de P. termitarius no fue completo (como se explicó antes, en una especie polidómica un nido es solo un fragmento de la colonia); en otras palabras se supondría que las colonias de P. termitarius fueran de mayor tamaño. A esto se le puede adicionar que según Klaus Jaffe (com. pers.) P. termitarius posiblemente es una especie polidómica.
Este género no es totalmente extraño al fenómeno del polidomismo; Pseudomyrmex ferruginea es una especie que tiene un comportamiento similar al polidomismo. Sus colonias normalmente ocupan un arbusto de Acacia cornigera (L.) Willd, pudiéndose expandir y ocupar otros arbustos vecinos de la misma especie, donde la colonia establece una unidad con progenie y obreras llamada "unidad auxiliar"(Janzen, 1967). Estas unidades auxiliares no poseen reina.
Si P. termitarius es polidómica, no se puede descartar la posibilidad de que también sea poligínica, como algunos de sus congéneres (Tabla 4); ya que posiblemente algunas de las colonias satélite no muestreadas sean ocupadas por reinas, como ocurre en Polyrhachis dives (Yamauchi et al., 1987 citados por Hölldobler y Wilson, 1990) y en Cataglyphis iberica (Dahbi y Lenoir, 1998).
La segunda forma de explicar la presencia de progenie en nidos sin reina, es por la presencia de obreras gamergadas (obreras que se pueden aparear y reproducir); sea por que la reina ha muerto o porque ocurrió una partición del nido en la cual solo quedaron obreras, entre las cuales está la obrera fértil.
Las obreras gamergadas son conocidas en especies de Ponerinae y Myrmicinae, y no se les ha encontrado diferencia morfológica externa con otras obreras no fértiles (Hölldobler y Wilson 1990; Hölldobler, Liebing y Alpert, 2002). Hölldobler, Liebing y Alpert (2002) reportan que colonias de Metapone madagascarica y Metapone sp. (especie no descrita) se propagan por fisión, y la mayoría de estas nuevas colonias poseen obreras gamergadas como individuos reproductivos.
La ausencia de reina en algunos nidos de Myrmica schencki ssp. emeryana Forel fue explicada por Talbot (1945), argumentando que la colonia era decadente. Headley (1943) explicó la ausencia de reina en 34 de 97 colonias excavadas de Leptothorax longispinosus Roger de la siguiente forma: 14 estaban parasitadas por Harpagoxenus americanus quien posiblemente mató la reina; cuatro mas se encontraron evidentemente decadentes; y las restantes colonias debieron haber sido despojadas de sus reinas o estas salieron del nido en el momento de la excavación.
El hecho de que las colonias de mayor tamaño de P. termitarius sean las mas pequeñas del género no es definitivo, ya que se han estudiado pocas especies – el género Pseudomyrmex cuenta con 112 especies (Kempf, 1960) – además, no es claro si la especie es monodómica y/o posee obreras gamergadas. Al descartar la hipótesis de que la especie es monodómica, se descartaría también la de que algunas de las colonias aquí capturadas fueran decadentes, que estuvieran parasitadas, o que por alguna u otra razón no se hubiera encontrado reina.
No se puede asegurar cual es la explicación de la presencia de progenie en nidos de P. termitarius sin reina, según los datos obtenidos en este estudio, las opciones para explicar este fenómeno son variadas, por tanto, es necesario realizar investigaciones posteriores con esta especie para aclarar este aspecto.
Estructura del nido. Exceptuando la presencia de construcciones similares a chimeneas en la entrada de los nidos, las características dadas por Mill (1981) de los nidos de Pseudomyrmex termitarius concuerdan con las encontradas en este estudio; al igual que coincide el número de entradas y el diámetro de éstas con el reportado por Jaffe, López y Aragot (1986). La estructura de los nidos de la especie que se estudió, posee la forma típica de nidos subterráneos de hormigas (Tschinkel, 2003).La presencia de dos entradas en el nido 16 es explicada porque una de ellas había sido bloqueada por una piedra la que la inutilizó, por lo cual las hormigas construyeron una nueva entrada con las características típicas que éstas poseen. Este hecho es aislado y representa la respuesta de la colonia a los cambios en el ambiente.
El número de cámaras (4-5) reportado por Jaffe, López y Aragot (1986) no discrepa sustancialmente del encontrado aquí; pero si es diferente la profundidad a la cual se encuentran éstas. Estos autores reportan que esta profundidad puede llegar a ser de 80 cm, casi cuatro veces la encontrada aquí. Esta disparidad podría ser explicada por diferencias en el suelo, tales como densidad, disponibilidad de humedad, y otras diferencias como disponibilidad de alimento y temperatura del aire.
Headley (1949) explicó la variación en la profundidad de nidos de Aphaenogaster fulva ssp. aquia Buckley entre junio y agosto, siendo 2.6 veces mayor en agosto por cambios en la humedad del suelo que fue menor en el último mes indicado. Talbot (1951) encontró variación estacional en la profundidad de nidos de Aphaenogaster rudis Emery siendo menor entre marzo y abril y mayor en octubre 6.33 veces; según este autor no se sabe si es la temperatura o la humedad, la principal responsable de estas diferencias. Talbot (1943) explicó diferencias en la profundidad de nidos de Prenolepis imparis Say, posiblemente por la proximidad a un río (los que tenían menor profundidad).
La presencia de los individuos inmaduros en las dos cámaras más superficiales, se puede explicar por la tendencia de las obreras de la mayoría de las especies, de llevar la progenie a las cámaras de mayor temperatura del nido, y a medida que disminuye la temperatura durante el día, las obreras llevan la progenie a cámaras donde la temperatura aún es alta (Hölldobler y Wilson, 1990).
Para trabajos posteriores con la especie, en lo que concierne a la estructura del nido, independiente de la replicación del presente trabajo, se recomienda vaciar dentro de los nidos yeso de dentista para obtener de mejor forma y mayor durabilidad el molde del nido y así poder obtener todo el volumen de éste.
La estructura externa de nidos de P. termitarius parece ser bien conocida, no siendo así su estructura interna, por tanto es necesario determinar la fuente de variación de las diferencias encontradas. Falta obtener información sobre el funcionamiento del nido y la interacción de las hormigas con éste (disposición de las hormigas, movimiento, uso de las cámaras, etc.), para esto no se recomienda usar el método aquí reportado para la excavación de los nidos, pues perturba altamente sus inquilinos.
Observaciones de los nidos mantenidos in vitro. Bajo las condiciones manejadas en este trabajo, fue posible mantener en laboratorio colonias de Pseudomyrmex termitarius por un periodo mayor de 14 meses.Jaffe, López y Aragot (1986), reportan la construcción por parte de las hormigas de un tabique para sellar la entrada de los viales con arena dejando una entrada de 3 mm; construcción similar a la aquí reportada. Además, estos autores informan que estas hormigas mantienen la progenie en pilas separadas dentro del nido. Este comportamiento no fue registrado en esta investigación, pero si fue observada la disposición de desperdicios fuera del nido como lo apreciaron aquellos.
Al parecer el volumen proporcionado por un vial es suficiente para el establecimiento de las colonias, ya que éstas no usaron el vial adicional independiente de si este fuera modificado o no.
Es posible mantener colonias de P. termitarius en cautiverio con la dieta aquí usada por mas de un año, la que podrá ser usada para obtener información sobre estas hormigas en cautiverio. Se descarta el uso de la dieta Bhatkar a la cual se le cambió el agar por gelatina sin sabor. Sería interesante estudiar la capacidad que poseen estas hormigas de alimentarse de las termitas que se les proporcionó y su desarrollo in vitro. Es necesario estudiar las diferencias de las dietas proporcionadas y establecer una cantidad mínima para suplir las necesidades de las hormigas in vitro. También es necesario hacer un seguimiento al desarrollo de estas colonias in vitro según la dieta.
Hacer un buen transplante al laboratorio de los nidos capturados sin causar muerte a sus inquilinas es bastante difícil. Es importante desarrollar una buena técnica para disminuir la mortalidad y poder realizar estudios de desarrollo y comportamiento de las colonias in vitro.
A Santiago García por su colaboración en la obtención de los datos de campo y su apoyo. A Katalina González por su colaboración en la elaboración de las figuras. A John Alveiro Quiroz por su ayuda en la identificación de las termitas y por las sugerencias dadas en la elaboración del manuscrito. A Gilberto Morales por sus sugerencias y revisión del manuscrito.
ANTIOQUIA. DEPARTAMENTO ADMINISTRATIVO DE PLANEACIÓN. Plan de Ordenamiento Territorial del Municipio de Bello 2000-2006: Documento técnico de soporte. diagnóstico. Medellín: Planeación, 2000. 173 p. [ Links ]
CASSILL, D.; TSCHINKEL, W. R. and VINSON, S. B. Nest complexity, ground size and brood rearing in the fire ant, Solenopsis invicta. En: Insects Society. Vol.49 (2002); p.158-163. [ Links ]
DAHBI, A. and. LENOIR, A. Nest separation and the dynamics of the Gesaltodor in the polydomous ant Cataglyphis iberica (Hymenoptera, Formicidae). En: Behavior Ecology and Sociobiology. Vol. 42 (1998); p. 349-355. [ Links ]
HEADLEY, A. E. A population study of the ant Aphaenogaster fulva spp. aquia Buckley (Hymenoptera: Formicidae). En: Annals of the Entomological Society of America . Vol.42 (1949); p. 265-272. [ Links ]
HEADLEY, A. E. Population studies of two species of ants, Leptothorax longispinosus roger and Leptothorax curvispinosus Mayr. En: Annals of the Entomological Society of America . Vol 36 (1943); p. 743-753. [ Links ]
HÖLLDOBLER, B. and WILSON, E. O. The ants. Cambridge, Massachusetts: Belknap Press of Harvard University, 1990. 750 p. [ Links ]
________; LIEBIG, J. and ALPERT, G. D. Gamergates in the Myrmicinae genus Metapone (Hymenoptera: Formicidae). En: Naturwissenschaften. Vol. 89 (2002); p. 305-307. [ Links ]
JAFFE, K.; LÓPEZ, M. E. and ARAGOT, W. On the communication systems of the ants Pseudomyrmex termitarius and P. triplarinus. En: Insectes Sociaux. Vol. 33, No. 2 (1986); p. 105-117. [ Links ]
JANZEN, D. H. Evolution of polygynous obligate acacia-ant in western Mexico. En: Journal of Animal Ecology. Vol. 42, No. 3 (1973); p. 727-750. [ Links ]
________; Interactions of the bulls-horn acacia (Acacia cornigera L.) with an ant inhabitant (Pseudomyrmex ferruginea F. Smith) in eastern Mexico . En: The University of Kansas Science Bulletin. Vol 47, No 6 (1967); p. 315-558. [ Links ]
________; Pseudomyrmex nigropilosa: a parasite of a mutualism. En: Sicence. Vol. 188 (1975); p. 936-937. [ Links ]
KEMPF, W. W. Estudo sobre Pseudomyrmex I. (Hymenoptera: Formicidae). En: Revista Brasileira de Entomología. Vol. 9 (1960); p. 5-32. [ Links ]
LUEDERWALDT, H. Observações biológicas sobre forigas brasileiras, especialmente do estado de Sao Paulo. En: Revista Museum Paulista. Vol. 14 (1926); p.185-304. Citado por KEMPF, W.W. Estudo sobre Pseudomyrmex I. (Hymenoptera: Formicidae). En: Revista Brasileira de Entomología. Vol. 9 (1960); p. 5-32. [ Links ]
MANN, W. M. The ants of Brazil (The Stanford Expedition to Brazil, 1911). En: Bulletin Museum Comp. Zoology. Harvard. Vol. 60, no. 11 (1916); p. 399-490. Citado por KEMPF, W.W. Estudo sobre Pseudomyrmex I. (Hymenoptera: Formicidae). En: Revista Brasileira de Entomología. Vol. 9 (1960); p. 5-32. [ Links ]
MILL, A. E. Observations on the ecology of Pseudomyrmex termitarius (F. Smith) (Hymenoptera, Formicidae) in Brazilian Savannas. En: Revista Brasileira de Entomologia. Vol. 25 (1981); p. 271-274. [ Links ]
TALBOT, M. Population studies of the ant Myrmica schencki ssp. emeryana Forel. En: Annals of the Entomological Society of America . Vol. 38 (1945); p. 365-372. [ Links ]
TALBOT, M. Population studies of the ant, Prenolepis imparis Say. En: Ecology. Vol. 24 (1943); p. 31-44. [ Links ]
________. Population studies of the ant, Prenolepis imparis Say. En: Ecology. Vol. 24 (1943); p. 31-44. Populations and hibernating conditions of the ant Aphaenogaster (Attomyrma) rudis Emery (Hymenoptera: Formicidae). En: Annals of the Entomological Society of America . Vol. 44 (1951); 302-307. [ Links ]
TSCHINKEL, W. R. Seasonal life history and nest architecture of a winter-active ant, Prenolepis imparis. En: Insectes Sociaux. Vol.34 (1987); p. 143-164. [ Links ]
________; Population studies of the ant, Prenolepis imparis Say. En: Ecology. Vol. 24 (1943); p. 31-44. Subterranean ant nests: trace fossils past and future? En: Palaeogeography, Palaeoclimatology, Palaeoecology. Vol.192, No.1/4 (2003); p. 321-333. [ Links ]
WARD, P. S. Phylogenetic analysis of pseudomyrmecine ants associated with domatia-bearing plants. En: HUXLEY, C.R. and CUTTER, D.F., eds. Ant-plant interactions. Inglaterra: Oxford University, 1991. ISBN 0-19854639-4. [ Links ]
YAMAUCHI, K. et al. Polycalic colonies of the weaver ant Polyrhachis dives. En: Kontyu, Tokyo. Vol. 55, No. 3 (1987); p. 410-420. Citados por HÖLLDOBLER, B. and WILSON, E. O. The ants. Cambridge, Massachusetts: Belknap Press of Harvard University, 1990. p. 279-289. [ Links ]