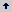Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Facultad Nacional de Agronomía Medellín
Print version ISSN 0304-2847
Rev. Fac. Nac. Agron. Medellín vol.57 no.1 Medellín Jan./June 2004
POTENCIAL SIMBIOTICO Y EFECTIVIDAD DE HONGOS MICORRIZO ARBUSCULARES DE TRES SUELOS SOMETIDOS A DIFERENTES USOS
MYCORRHIZAL SYMBIOTIC POTENTIAL AND EFFECTIVENESS OF THREE SOILS UNDER DIFFERENT USES
Sandra Patricia Jaramillo Padilla1; Jhon Mauricio Silva Benjumea2 y NelsonWalter Osorio Vega3
1 Estudiante del Postgrado en Biotecnología. Universidad Nacional de Colombia, Sede Medellín, Facultad de Ciencias. A.A. 3840 Medellín, Colombia. <spjarami@unalmed.edu.co>
2 Estudiante de Zootecnia. Universidad Nacional de Colombia, Sede Medellín, Facultad de Ciencias Agropecuarias. A.A. 1779. Medellín, Colombia. <jmsilva@unalmed.edu.co>
3 Profesor Asociado. Universidad Nacional de Colombia, Sede Medellín, Facultad de Ciencias. A.A. 3840 Medellín, Colombia. <nwosorio@unalmed.edu.co>
Recibido: Marzo 29 de 2004; aceptado: Agosto 13 de 2004.
RESUMEN
Se realizó un experimento bajo condiciones de invernadero para evaluar el potencial simbiótico y la efectividad de hongos micorrizo-arbusculares (HMA) en tres suelos de Colombia sometidos a diferentes usos (plantación de palma de aceite con altos insumos, bosque secundario de reforestación y suelo degradado por minería de aluvión). Tal efectividad se refiere al potencial que tienen los HMA nativos de un suelo para desarrollar la simbiosis micorrizal e incrementar el crecimiento y la concentración de P en los tejidos del hospedero. Semillas germinadas de Leucaena leucocephala se sembraron en macetas que contenían una mezcla de suelo y cuarzo como sustrato de crecimiento. El sustrato fue inoculado con alícuotas de cada suelo y un HMA de reconocida efectividad (Glomus aggregatum). Las plantas crecieron durante 49 días. La efectividad simbiótica micorrizal de los suelos se evaluó a través de mediciones frecuentes del contenido foliar de fósforo (P), y al final del período de crecimiento se determinó la masa seca aérea, el contenido total de P en la parte aérea y la colonización micorrizal. La inoculación con G. aggregatum incrementó significativamente el crecimiento de las plantas y la absorción de P con respecto a las plantas inoculadas con alícuotas de los suelos y aquellas no inoculadas. Así mismo, la colonización micorrizal fue muy alta en las raíces inoculadas con G. aggregatum y ausente en los otros tratamientos. Esto significa que en los suelos estudiados hay una muy baja efectividad micorrizal de los HMA y/o bajo contenido de propágulos micorrizales infectivos, lo cual fue corroborado con la técnica del número más probable y el conteo de esporas.
Palabras claves: Efectividad micorrizal, micorriza arbuscular, Leucaena leucocephala, Glomus aggreggatum.
ABSTRACT
An experiment was conducted under greenhouse conditions to evaluate the mycorrizal symbiotic potential and mycorrizal effectiveness of three soils of Colombia exposed to different uses. Germinated seeds of Leucaena leucocephala were transplanted in a growth substrate consisting of a soil-quartz (1:1 ratio) mixture. The substrate was inoculated with a crude inoculum of Glomus aggregatum, a mycorrhizal fungus of known effectiveness. Mycorrhizal effectiveness was evaluated by monitoring P pinnule content of the leucaena seedlings at regular intervals of time during the growth period of 49 days. At harvest, shoot dry mass, shoot P content, and mycorrhizal colonization were determined. Plant growth and P uptake were significantly higher in plants growing in the substrate inoculated with G. aggregatum than those plants grown in either non-inoculated substrate or substrate inoculated with aliquots of tested soils. Mycorrhizal colonization was very high in the G. aggregtaum inoculated-substrate and virtually absent in the other treatments. Results suggest that in the tested soils there were a low mycorrhizal effectiveness and/or low content of mycorrizal infective propagules, which was confirmed by the most-probable-number method and mycorrhizal spore counting.
Key words: Mycorrizal effectiveness, mycorrhizal fungi, Leucaena leucocephala, Glomus aggreggatum.
 INTRODUCCIÓN
INTRODUCCIÓN
 MATERIALES Y MÉTODOS
MATERIALES Y MÉTODOS
 RESULTADOS
RESULTADOS
 DISCUSIÓN
DISCUSIÓN
 RECONOCIMIENTOS
RECONOCIMIENTOS
 BIBLIOGRAFÍA
BIBLIOGRAFÍA
Una de las estrategias más exitosas de las plantas para superar el estrés durante la colonización de ecosistemas terrestres es la capacidad de sus raíces para establecer simbiosis benéficas con microorganismos del suelo (Allen, 1996). Un ejemplo de esto son las micorrizas, las cuales consisten en la simbiosis mutualista entre ciertos hongos del suelo y las raíces de aproximadamente el 95% de las especies vegetales (Sánchez, 1999). El tipo de micorriza más estudiado se establece entre hongos de la clase Zigomicete, orden Glomales, y muchas especies vegetales, incluyendo algunas de interés agrícola, hortícola y forestal; tal asociación es llamada endomicorriza o micorriza arbuscular (Harrier, 2001; Abbott y Robson, 1982). Las hifas extraradicales de estos hongos micorrizo– arbusculares (HMA) se constituyen en extensiones de las raíces, incrementando así la capacidad de absorción de agua y nutrientes, particularmente fósforo (P) (Bolan, 1991; Habte y Manjunath, 1987). La tarea de captar P recae en buena parte en las hifas de los HMA (Schachtman; Reid y Ayling, 1998).
El estudio de la asociación micorrizal es bastante importante en los suelos del trópico que usualmente exhiben baja disponibilidad de P (Sieverding, 1991). Por ejemplo, el 80 % de los suelos de Colombia son ácidos y presentan baja concentración de P en la solución del suelo (Malagón et al., 1995).
La respuesta a la inoculación micorrizal depende de múltiples factores tales como (i) la dependencia micorrizal de las plantas, (ii) la concentración de P en la solución del suelo, (iii) el número de propágulos micorrizales infectivos y (iv) la efectividad de los HMA para incrementar la absorción de P. Hay factores abióticos que afectan negativamente la asociación micorrizal como el uso excesivo de fertilizantes fosfóricos y pesticidas que inhiben el establecimiento y la efectividad de la simbiosis micorrizal (Kjoller y Rosendahl, 2000; Abdel-Fattah y Mankarious, 1997). Adicionalmente, períodos prolongados de lluvia, la excesiva mecanización agrícola, la ausencia de cobertura vegetal y las actividades mineras favorecen la erosión del suelo y, en consecuencia, reducen el número de propágulos, la biodiversidad y la actividad de los HMA (Barea y Jeffries, 1995).
Dodd et al. (1990) evaluaron los cambios en el número de esporas de diferentes especies nativas de HMA en ecosistemas expuestos a diferentes prácticas de manejo. Ellos indican que el número de esporas refleja la abundancia relativa de múltiples poblaciones de HMA en sistemas agrícolas. Sin embargo, éste no se correlaciona con la infectividad y efectividad micorrizal.
Los métodos comúnmente utilizados para evaluar el potencial simbiótico micorrizal de suelos e inóculos incluyen el conteo de esporas, de hifas extraradicales, de propágulos infectivos y de sitios de colonización en las raíces. Estas metodologías son dispendiosas, imprecisas y/o no se correlacionan con la efectividad simbiótica micorrizal (Habte; Fox y Huang, 1987). Es ampliamente aceptado que el número de esporas no es un buen indicador del potencial simbiotico micorrizal de un suelo o un inóculo, ni tampoco pueden dar cuenta de la efectividad que puedan tener estos hongos micorrizales para mejorar el crecimiento y la nutrición vegetal. De ahí que sea necesario buscar otras pruebas adecuadas que nos permitan conocer esto.
Es lógico pensar que si el aspecto más importante de la asociación micorrizal es el incremento en la absorción de P, la cuantificación del P absorbido puede constituirse en una medida de la efectividad micorrizal. Con base en esto, Habte; Fox y Huang, (1987) desarrollaron una técnica para medir la efectividad simbiótica de HMA mediante un monitoreo no destructivo de la concentración de P en los pínulos de plantas de leucaena inoculadas en función del tiempo. Los métodos convencionales requieren cantidades mayores de muestra foliar, por lo que es necesario tomar muchas hojas (20-30) por tratamiento, algo no disponible en algunos experimentos controlados de invernadero ó hacer muestreos destructivos de toda una planta, lo cual acarrea limitaciones de costo y del control del error experimental. A pesar de la sencillez y utilidad de la técnica del pinulo este método, no ha sido empleado en los estudios de la asociación micorrizal en el país. El objetivo fue determinar la efectividad simbiótica-micorrizal de las poblaciones de hongos micorrizo-arbusculares de tres suelos de Colombia expuestos a diferentes manejos aplicando el método mencionado.
La investigación se realizó en el invernadero de la Universidad Nacional de Colombia, Sede Medellín (6° 15´ N, 75° 35´ W y 1495 m de altitud). El suelo utilizado fue una muestra del horizonte B de un Ultisol franco arcilloso de Niquía, (Bello, Antioquia), con un pH 5,3 y un nivel de P en la solución del suelo de 0,001 mg L-1. El suelo se secó al aire, se tamizó a 4 mm y se mezcló con cuarzo en una proporción 1:1 (m:m) y esta mezcla se utilizó como sustrato de crecimiento. El pH de este sustrato se ajustó a 6,7 con CaCO3. Los resultados del análisis del sustrato fueron: carbono orgánico (C.O.) 3,5 g kg-1 (Walkey & Black); P 1 mg kg-1 (Bray II); Ca, Mg y K 1,73; 0,26 cmolc kg-1 y no detectable, respectivamente (acetato de amonio 1 M, pH 7,0); Fe, Mn, Cu y Zn 8, 2, <0,5 y <0,5 mg kg-1 (Olsen–EDTA), respectivamente; B 0,1 mg kg-1 (agua caliente); NO3 no detectable (sulfato de aluminio 0,025 M) y NH4 7 mg kg-1 (KCl 1M). El sustrato de crecimiento se esterilizó dos veces en autoclave a 120°C y 0,1 MPa durante 1 hora, con un período de 24 horas entre cada esterilización. Con el fin de establecer un nivel de P en la solución del sustrato, adecuado para la actividad micorrizal (0,02 mg L-1, Habte y Manjunath, 1987), se aplicó P a razón de 350 mg kg-1 según los resultados de una isoterma de adsorción de P (Fox y Kamprath, 1970) (Figura 1). El P se aplicó al momento de la siembra usando como fuente KH2PO4.
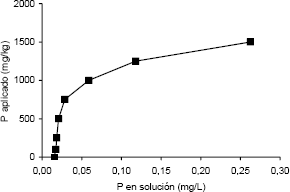
Figura 1. Isoterma de adsorción de P para el suelo de Niquía (Bello, Antioquia).
El sustrato se transfirió a 20 macetas plásticas (15,5 x 8,5 cm) a razón de 600 g/maceta. El sustrato de cada maceta se inoculó y mezclo uniformemente con 15 g de una de los siguientes fuentes de inoculo micorrizal: (i) horizonte A (0- 15 cm) de un suelo de Urabá (Antioquia), proveniente de un terreno reforestado por 5 años; (ii) horizonte A (0- 15 cm) de un suelo de Acacías (Meta) tomado de una plantación de palma africana (Elaeis guineensis) que frecuentemente ha recibido pesticidas y fertilizantes fosfóricos durante 30 años; (iii) muestras superficiales (0- 15 cm) de un suelo degradado del municipio de Tarazá (Antioquia), correspondiente a un material espólico fino de minería de aluvión de una zona alta erosionado por minería de aluvión, (iv) inóculo crudo de Glomus aggregatum constituido por esporas, fragmentos de hifas y raíces colonizadas en una matriz de basalto triturado (< 2 mm) (inoculo proporcionado por el Dr. M. Habte de la Universidad de Hawaii). Como tratamiento testigo se utilizó sustrato sin inocular, el cual recibió 15 g de cuarzo estéril y filtrados del inóculo crudo luego de remover las estructuras de G. aggregatum con papel filtro Schleicher & Schueler (tamaño de poro: 2 µm). Los análisis químicos de estas fuentes de inóculo, el contenido de esporas de HMA (The International Culture Collection of Arbuscular and Vesicular Arbuscular Mycorrhizal Fungi (INVAM). INVAM (2003) y el número más probable (NMP) de propágulos infectivos de HMA (Porter, 1979; Alexander, 1982) aparecen en la Tabla 1. Se incluye la determinación de P soluble según el método de Olsen y Sommers (1982).
Tabla 1. Propiedades químicas de los suelos utilizados como fuente de inóculo micorrizal, cantidad de esporas de HMA y número más probable de propágulos micorrizales infectivos (ND: No determinado).
Como planta indicadora se utilizó Leucaena leucocephala var. K11 por ser altamente dependiente de la asociación micorrizal y de rápido crecimiento (Habte y Osorio, 2001). Las semillas de L. leucocephala fueron escarificadas con H2SO4 por 20 min, lavadas 6 veces con agua desionizada (Habte y Manjunath, 1991) y colocadas en cámara húmeda estéril para su germinación; en cada maceta se sembró una semilla germinada. Una semana después de la siembra se aplicó una solución que contenía N, K y Mg a razón de 100, 150 y 100 mg kg-1, utilizando como fuentes NH4NO3, KNO3 y MgSO4.7H2O. Además, se aplicó 0,5 cm3 kg-1 de una solución de micronutrientes que contenía Cu, Mo, B y Zn (Habte y Osorio, 2001). A partir del día 26 después de la siembra, se aplico vía foliar KNO3 (4%) y NH4FeSO4 (1%). Las plantas crecieron por 49 días y se regaron periódicamente para mantener un 60% de la máxima capacidad de retención de agua.
Para evaluar la efectividad micorrizal se monitoreó frecuentemente el contenido de P del cuarto pínulo (contando desde la base de la pina) de la hoja más joven completamente expandida (Habte; Fox y Huang, 1987; Aziz y Habte, 1987) (Figura 2). El contenido de P se determinó por el método del azul de molibdato (espectrofotómetro Perkin Elmer modelo Lambda 1, l= 660 nm) después de reducir los pinulos a cenizas en mufla a 500°C por 2 h (Habte y Osorio, 2001). Al momento de la cosecha se determinó la masa seca de la parte aérea luego de secar las muestras vegetales a 60°C por 72 horas. Así mismo, se determinó la cantidad de P absorbida en la parte aérea utilizando el mismo método descrito anteriormente. La colonización micorrizal se midió por el método del intercepto de la cuadrícula (Giovannetti y Mosse, 1980), para esto las raíces fueron previamente clarificadas con KOH (Phillips y Hayman, 1970) y teñidas con fucsina ácida (Kormanik; Bryan y Schultz, 1980).
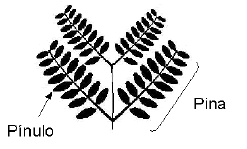
Figura 2. Representación de una hoja joven de leucaena indicando la ubicación del pínulo a muestrear.
Se empleó un diseño experimental completamente al azar con cuatro repeticiones por tratamiento. Los datos fueron analizados estadísticamente a través de un análisis de varianza y la prueba de los rangos múltiples (nivel de significancia, (P, £ 0,05) con el programa estadístico STATGRAPHICS versión 4.0.
En los días 15, 18, 20 y 23 después de la siembra, el contenido de P en los pinulos no presentó diferencias significativas según la fuente de inoculo (Figura 3). Sin embargo, después del día 28 las plantas que crecieron en el sustrato inoculado con G. aggregatum exhibieron contenidos de P en los pinulos significativamente mayores que los otros tratamientos. Estos pinulos alcanzaron un nivel máximo de P de 8,9 µg/pinulo al día 49 después de la siembra. El contenido de P de los pinulos de plantas que crecieron en el sustrato inoculado con los suelos y las no-inoculadas no exhibieron diferencias significativas en los días de muestreo, éstos valores decrecieron con el tiempo. En el día 49, llegaron a ser extremadamente bajos (1,5 µg/pinulo) e inclusive tales plantas exhibieron clorosis y posterior defoliación de los pinulos más viejos.
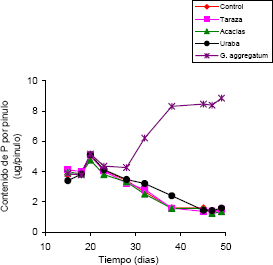
Figura 3. Contenido de P en pinulos de leucaena en función de la fuente de inóculo, de un sustrato no inoculado y del tiempo, expresado en días después de la siembra. Cada punto corresponde a la media de cuatro mediciones.
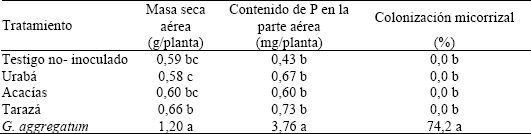
La masa aérea seca de plantas de leucaena que crecieron en el sustrato inoculado con G. aggregatum fue significativamente superior que aquellas que crecieron en el sustrato no inoculado o inoculado con los suelos (Tabla 2); estas últimas no presentaron diferencias significativas con el tratamiento testigo. Un comportamiento similar exhibió la cantidad de P absorbido por la parte aérea (Tabla 2). La colonización micorrizal fue significativamente diferente en función de los tratamientos. Cuando G. aggregatum fue inoculado, la colonización micorrizal fue muy alta (74.2 %) y nula en las raíces que crecieron en el sustrato no-inoculado e inoculado con los suelos (Tabla 2).
Tabla 2. Efecto de la fuente de inóculo micorrizal sobre la masa seca aérea de leucaena, el contenido de P de la parte aérea y la colonización micorrizal.
La progresiva disminución del contenido de P de los pinulos en las plantas que crecieron en el sustrato no-inoculado e inoculado con los suelos estudiados sugiere un agotamiento paulatino de la concentración de P en los tejidos vegetales. Inicialmente la semilla cuenta con una concentración de P relativamente alta, pero con la demanda de nutrientes para el crecimiento el P se diluye en los tejidos en expansión. Si no hay un sistema de raíces adecuado para abastecer a la planta del P requerido, la falta de este nutriente restringe el desarrollo de la planta. En caso tal que el P esté en bajas concentraciones en los tejidos, la planta exhibirá síntomas de deficiencia. En este trabajo tales síntomas fueron similares a los reportados por Habte y Manjunath (1987) y Smith et al. (1992).
La inoculación con los suelos de Urabá, Acacias y Taraza, no tuvo efectos benéficos sobre la absorción de P y el crecimiento vegetal debido a la ausencia o al bajo número de propágulos micorrizales infectivos (Tabla 1). Esto fue corroborado por la ausencia de colonización micorrizal (Tabla 2). El bajo potencial simbiótico micorrizal hallado en este suelos puede ser el resultado de practicas de uso y manejo que disminuyen el número de propágulos micorrizales infectivos (Kjoller y Rosendahl, 2000; Abdel-Fattah y Mankarious, 1997; Sukarno et al., 1996; Barea y Jeffries, 1995). El comportamiento con los suelos de Acacías y Taraza era esperado debido al uso y manejo de estos suelos (intensas prácticas agrícolas y mineras, respectivamente) . Sin embargo, con el suelo de Urabá se presumía una mejor efectividad micorrizal ya que el suelo provenía de un bosque secundario establecido hace 5 años. Al parecer, en estos suelos no hay un aumento de propágulos micorrizales porque algunas especies forestales secundarias exhiben baja dependencia micorrizal (Zangaro; Bononi y Trufen, 2000), lo cual ha sido observado por Francisco Hernando Orozco (comunicación personal) en programas de rehabilitación de suelos. En caso tal que se establezcan en estos suelos plantas altamente dependientes de la asociación micorrizal, la aplicación de inóculo se puede sustentar debido a las bajas concentraciones de P disponible (P-Bray II: 1-9 mg kg-1; P-CaCl2: 0.005-0.011 mg L-1) (Fox, 1981) y en la baja densidad de propágulos micorrizales infectivos (Tabla 1). Estas concentraciones de P son tan bajas que podrían restringir las actividad de la asociación; Habte y Manjunath (1991) reportaron que una concentración de P de 0,02 mg L-1 de solución es optima para la actividad micorrizal. Por tal razón, se podrían hacer aplicaciones de P moderadas a estos suelos que permitan alcanzar esta concentración.
Por otro lado, con la aplicación del inóculo crudo de G. aggregatum se observó una alta colonización micorrizal y, consecuentemente, el contenido de P en los pinulos incrementó significativamente. Por lo tanto, las plantas inoculadas con este HMA desarrollaron el doble de masa seca en la parte aérea. Este inoculo crudo exhibió un alto número de propágulos infectivos 1,7 x 104 kg-1 (Tabla 1). Según Habte y Osorio (2001) para obtener una alta colonización micorrizal, es suficiente tener 520 propágulos infectivos por kg de inóculo, por encima de este nivel no se incrementa el índice de colonización micorrizal. Se considera que el método del NMP fue mejor que el conteo de esporas para determinar el alto potencial simbiótico micorrizal del inóculo crudo y la baja efectividad micorrizal de los suelos estudiados. Uno de los limitantes del conteo de esporas es que solo se tienen en cuenta estas estructuras como propágulos; además, este método no contempla la viabilidad de la esporas. Las esporas de HMA encontradas en un suelo pueden ser no-viables y como tal no deberían ser contabilizadas como propágulos micorrizales. En contraste, el método del NMP permite detectar simultáneamente un número de propágulos infectivos en el que se incluyen fragmentos de micelio extraradical, esporas viables y fragmentos de raíces infectadas.
Se desea resaltar las diferencias entre suelos en relación al número de propágulos infectivos, ya que estas diferencias son el producto del uso y manejo al que se han sometido los suelos, y, consecuentemente, determinan el potencial simbiótico micorrizal y la efectividad de los hongos micorrizales para mejorar el crecimiento y la nutrición vegetal. Es claro que en algunos suelos el potencial simbiótico micorrizal es bajo o nulo, a pesar de la presencia de esporas micorrizales; por eso cobra validez la determinación de propágulos infectivos a través de la técnica de número más probable. A pesar de que esta prueba biológica toma más tiempo que la determinación del número de esporas (30 días versus 1 día, respectivamente), es más exacta para mostrar el potencial simbiótico de un suelo o un inoculo. Una desventaja es que toma mucho tiempo, pero que importancia puede tener una prueba rápida cuando no es válida, cuando los resultados de tal prueba-rápida no hablan del potencial simbiótico micorrizal y ni de la efectividad de tales hongos para mejorar el crecimiento y nutrición vegetal.
Por otro lado, una de las ventajas que se encuentran con el método del pinulo para medir la efectividad micorrizal es su capacidad para detectar el momento en el cual la asociación micorrizal empieza a ser efectiva. Es decir, el momento en el cual aumenta significativamente la concentración de P en los tejidos, esto sucedió a partir del día 23. En otros trabajos con la asociación leucaena - G. aggregatum se han observado resultados comparables (Habte; Fox y Huang, 1987; Habte y Fox, 1989; Osorio y Habte, 2001). De la misma manera, el método del pinulo fue útil para identificar las plantas que no establecieron la asociación micorrizal (cero colonización micorrizal) y desarrollaron síntomas típicos de deficiencia de P. Hasta donde se sabe, éste es el primer trabajo en Colombia en el que se determina la efectividad micorrizal mediante el monitoreo del contenido de P en plantas usando la técnica del pinulo en función del tiempo. Con esta técnica se pueden hacer monitoreos no destructivos de la concentración foliar de P en plantas de leucaena en función del tiempo. De tal manera que se puede hacer un seguimiento de la evolución de la simbiosis en muestras tan pequeñas como 10 mg de masa seca vegetal. Bajo los métodos convencionales existentes en el país se requieren cantidades mayores de muestra foliar, por lo que es necesario tomar muchas hojas (20-30) por tratamiento (algo no disponible en algunos experimentos de invernadero) o realizar muestreos destructivos de toda una planta, lo cual acarrea limitaciones de costo y del control del error experimental.
Este trabajo se realizo con el apoyo financiero de la Dirección de Investigación (DIME) de la Universidad Nacional de Colombia, Sede Medellín, Proyecto "030802657-Glomalina como indicador de micorrización y efectos sobre la agregación de suelos degradados por minería de aluvión. Los autores realizaron este trabajo en el Laboratorio de Microbiología del Suelo de la Universidad Nacional de Colombia, Sede Medellín, como parte de las actividades del Grupo de Investigación Microbiología del Suelo registrado ante COLCIENCIAS.
ABBOTT, L. and ROBSON, A. The role of vesicular-arbuscular micorrizal fungi in agriculture and selection of fungi for inoculation. En: Australian Journal of Agricultural Research. Vol.33 (1982); p. 389-408. [ Links ]
ABDEL-FATTAH, G. M. and MANKARIOUS, A. T. Differential effects of fungicides on VAM fungal viability and efficiency. En: Journal of Union of Arab Biologists. Vol. 4 (1997); p. 237-262. [ Links ]
ALEXANDER, M. Most probable number method for microbial populations. En: PAGE, A.L. (ed). Methods of soil analysis, part 2: chemical and microbiological properties. Madison, Wisconsin: American Society of Agronomy, 1982. p. 815-820. [ Links ]
ALLEN, M. The ecology of arbuscular mycorrhizas: a look back into the 20th century and a peek into the 21th. En: Mycological Research. Vol. 100, No.7 (1996); p. 769-782. [ Links ]
AZIZ, T. and HABTE, M.. Determining vesicular-arbuscular micorrizal effectiveness by monitoring P status of leaf disk. En: Canadian Journal of Microbiology. Vol. 33 (1987); p. 1097-1101. [ Links ]
BAREA, J. M. and JEFFRIES, P. Arbuscular mycorrhizas in sustainable soil-plant systems. En: VARMA, A. and HOCK, B., ed. Mycorrhiza, structure, function, molecular biology and biotechnology. New York: Wiley, 1995. p.521-550. [ Links ]
BOLAN, N. A critical review on the role of mycorrhizal fungi in the uptake of phosphorus by plants. En: Plant and Soil. Vol. 134 (1991); p. 189 – 293. [ Links ]
DODD, J. C. et al. The management of populations of vesicular arbuscular mycorrhizal fungi in acid-fertil soils of savanna ecosystems II: the effect of pre-cropping on the spore populations of native and introduced VAM fungi. En: Plant and Soil. Vol.122 (1990); p. 241-247. [ Links ]
FOX, R. External phosphorus requirements of crops. En: DOWDY, R.H. et al. (eds.) Chemistry in the soil environment. Madison, Wisconsin: American Society of Agronomy, 1981. p. 223-239. [ Links ]
FOX, R. L and KAMPRATH, E. J. Phosphate sorption isotherms for evaluating the phosphate requirements of soils. En: Soil Science Society of American Proceedings. Vol.34 (1970); p. 902-907. [ Links ]
GIOVANNETTI, M. and MOSSE, B. An evaluation of techniques for measuring vesicular-arbuscular mycorrhizal infection in roots. En: New Phytologist. Vol. 84 (1980); p. 489-500. [ Links ]
HABTE, M. and FOX, R. L. Leucaena leucocephala seedling response to vesicular-arbuscular mycorrhizal inoculation in soils with varying levels of inherent mycorrhizal effectiveness. En: Biology and Fertility of Soils. Vol. 8 (1989); p. 111-115. [ Links ]
________ ; ________ and HUANG, R. S. Determining vesicular-arbuscular mycorrhizal effectiveness by monitoring P status of subleaflets of an indicator plant. En: Communications in Soil Science and Plant Analysis. Vol.18 (1987); p. 1403-1420. [ Links ]
______ and MANJUNATH, A. Soil solution phosphorus status and mycorrhizal dependency in Leucaena leucocephala. En: Applied and Environmental Microbiology. Vol. 53 (1987); p. 797-801. [ Links ]
______ and ________. Categories of vesicular-arbuscular mycorrhizal dependency of host species. En: Mycorrhiza. Vol. 1 (1991); p. 3-12. [ Links ]
______ and OSORIO, N. W. Arbuscular mycorrhizas: Producing and applying arbuscular mycorrhizal inoculum. Honolulu: University of Hawaii, 2001. 47 p. [ Links ]
HARRIER, L. The arbuscular mycorrhizal symbiosis: a molecular review of the fungal dimension. En: Journal of Experimental Botany. Vol. 52 (2001); p. 469-478. [ Links ]
KJOLLER, R. and ROSENDAHL, S. Effects of fungicides on arbuscular mycorrhizal fungi: Differential reponses in alkaline phosphatase activity of external and internal hyphae. En: Biology and Fertility of Soils. Vol. 31 (2000); p.361-365. [ Links ]
KORMANIK, P.; BRYAN, W. and SCHULTZ, R. Procedures and equipment for staining large numbers of plant roots for endomycorrhizal assay. En: Canadian Journal of Microbiology. Vol. 26 (1980); p. 536-538. [ Links ]
MALAGON, D. et al. Suelos de Colombia. Santafé de Bogotá: IGAC, 1995. 632 p. [ Links ]
OLSEN, S. R. and SOMMERS, L. E. Phosphorus. En: PAGE, A. L., MILLER, R. H. and KEENEY, D. R., ed. Methods of soil analysis. part 2: chemical and microbiological properties. Madison, WI.: American Society of Agronomy, 1982. p. 403-430. [ Links ]
OSORIO, N. W. and HABTE, M. Synergistic influence of an arbuscular mycorrhizal fungus and a P solubilizing fungus on growth and P uptake of Leucaena leucocephala in a Oxisol. En: Arid Land Research and Management. Vol. 15 (2001); p. 263-274. [ Links ]
PHILLIPS, J. M and HAYMANN, D. S. Improved procedures for clearing and staining parasitic and vesicular arbuscular mycorrhizal fungi for rapid assessment of infection. En: Transactions of the British Mycological Society. Vol. 55 (1970); p. 158-161. [ Links ]
PORTER, W. The "Most Probable Number"method for ennumerating infective propagules of vesicular arbuscular micorrizal fungi in soil. En: Australian Journal of Soil Research. Vol. 17 (1979); p. 515-519. [ Links ]
SÁNCHEZ, M. Endomicorrizas en agroecosistemas colombianos. Palmira: Ex–Libris, 1999. 227 p. [ Links ]
SCHACHTMAN, D.; REID, R. and AYLING, S. M. Phosphorus uptake by plants: from soil to cell. En: Plant Physiology. Vol. 116 (1998); p. 447-453. [ Links ]
SIEVERDING, E. Vesicular-Arbuscular mycorrhiza management in tropical agrosystems. Eschborn: Technical Cooperation – Federal Republic of Germany (GTZ), 1991. 371 p. [ Links ]
SMITH, F. W. et al. Foliar symptoms of nutrient disorders in the tropical shrub legume Leucaena leucocephala. St. Lucia, Queensland, Australia : CSIRO, Division of Tropical Crops and Pastures, 1992. 43 p. (Technical Paper; No. 32). [ Links ]
SUKARNO, N. et al. Effect of fungicides on vesicular arbuscular mycorrhizal symbiosis. The effects on area of interface and efficiency of P uptake and transfer to plant. En: New Phytologist. Vol. 132 (1996); p. 583-592. [ Links ]
THE INTERNATIONAL CULTURE COLLECTION OF ARBUSCULAR AND VESICULAR ARBUSCULAR MYCORRHIZAL FUNGI (INVAM). Disponible en Internet: http://www.invam.caf.wvu.edu/methods/spores/extraction.htm (consulta en Septiembre, 2003). [ Links ]
ZANGARO, W.; BONONI, V. and TRUFEN, S. Mycorrhizal dependency, inoculum potential and habitat preference of native woody species in South Brazil. En: Journal of Tropical Ecology. Vol. 16 (2000); p. 603-622. [ Links ]