Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Facultad Nacional de Agronomía Medellín
Print version ISSN 0304-2847
Rev. Fac. Nac. Agron. Medellín vol.57 no.2 Medellín July/Dec. 2004
CRECIMIENTO, ABSORCIÓN DE FÓSFORO Y MORFOLOGÍA DE LA RAÍZ EN ESPÁRRAGOS INOCULADOS CON HONGOS MICORRIZALES Y PSEUDOMONAS FLUORESCENTES
GROWTH, PHOSPHORUS ABSORPTION AND ROOT MORPHOLOGY OF ASPARAGUS INOCCULATED WITH MYCORRHIZAL FUNGI AND FLUORESCENT PSEUDOMONAS
Juan Carlos Pérez Naranjo1; Nelson Walter Osorio Vega2 y Claudia Lucia Álvarez López2
1 Profesor Asistente. Universidad Nacional de Colombia, Sede Medellín. Facultad de Ciencias. A.A. 3840, Medellín, Colombia. <jcperez@unalmed.edu.co>
2 Profesor Asociado. Universidad Nacional de Colombia, Sede Medellín. Facultad de Ciencias. A.A. 3840, Medellín. <nwosorio@unalmed.edu.co>
3 Ingeniera Agrónoma. Calle 45 F No. 70A 45. Medellín, Colombia. <dalvarez@epm. net.co>
Recibido: Abril 14 de 2004; aceptado: Agosto 17 de 2004
RESUMEN
En un experimento bajo invernadero se evaluaron los efectos de la aplicación de fósforo (P) y la inoculación con Glomus fistulosum y Pseudomonas aeruginosa sobre el crecimiento, la longitud de la raíz y la absorción de P por plantas de espárrago sembradas en un Alic Melanudand. La inoculación con G. fistulosum incrementó significativamente la masa seca de la parte aérea y de raíces, la longitud de raíces primarias y secundarias y la absorción de P por las plantas. La aplicación de P aumentó significativamente el P disponible en el suelo (Bray II); sin embargo, a pesar de tal incremento no hubo aumento significativo del crecimiento de las plantas. La inoculación con P. aeruginosa no tuvo efecto significativo sobre las variables estudiadas, ni se encontraron interacciones significativas entre los factores.
Palabras claves: micorriza, Glomus fistulosum, Pseudomonas aeruginosa, Asparagus officinalis, fósforo.
ABSTRACT
A greenhouse experiment evaluated the effects of phosphorus (P) application and inoculation with Glomus fistulosum and Pseudomonas aeruginosa on growth, root length, and P uptake of Asparagus officinalis grown on Alic Melanudand. Inoculation with G. fistulosum significantly increased shoot and root dry weight, primary and secondary root lengths, and plant P uptake. Phosphorus application significantly increased extractable P in the soil (Bray II), but despite this increase, there was no significant increase in plant growth. Inoculation with P. aeruginosa had no significant effect on the variables studied, nor were there significant interactions among the factors.
Key words: mycorrhiza, Glomus fistulosum, Pseudomonas aeruginosa, Asparagus officinalis, phosphorus.
 INTRODUCCIÓN
INTRODUCCIÓN
 MATERIALES Y MÉTODOS
MATERIALES Y MÉTODOS
 RESULTADOS Y DISCUSIÓN
RESULTADOS Y DISCUSIÓN
 RECONOCIMIENTOS
RECONOCIMIENTOS
 BIBLIOGRAFÍA
BIBLIOGRAFÍA
Los andisoles se caracterizan por su alta capacidad para fijar fósforo (P) (Zunino, 1983; Shoji; Manzyo y Dahlgren, 1993; Soil Survey Staff (SSS), 1994; Jaramillo, 1995). La principal alternativa para manejar la alta fijación de P consiste en la aplicación de cantidades elevadas de fertilizantes fosfóricos. Esta práctica, con la cual se pretende alcanzar niveles adecuados de P en la solución del suelo, es altamente costosa e ineficiente (Sánchez y Uehara, 1980).
Una alternativa para mejorar el uso de P y obtener un buen desarrollo de los cultivos consiste en introducir microorganismos al suelo con el propósito de incrementar el suministro de P (Marschner, 1997; Azcón y Barea, 1996; Havlin et al., 1999). El uso de hongos micorriza arbusculares (HMA) y de microorganismos solubilizadores de fósforo (MSP) son frecuentemente citados en la literatura para tal fin (Kucey y Leggett, 1989; Rao, 1992; Rokade y Patil, 1993; Premono et al., 1994; Toro; Azcon y Herrera, 1996; Whitelaw, 2000).
El uso de mezclas de microorganismos como una alternativa para mejorar la absorción de P ha sido poco explorada, en comparación con el gran volumen de información que se puede encontrar acerca del uso de especies individuales, aunque esto ha sido sugerido durante varios años por Barea y Azcón (1983) y Azcón y Barea (1996). Kim; Jordan y McDonald (1998) encontraron un efecto sinérgico entre Enterobacter agglomerans (MSP) y Glomus etunicatum (HMA) sobre el crecimiento de plantas de tomate. Similares hallazgos han sido reportados en otras especies vegetales por Gaur et al. (1990); Sreenivasa y Krishnaraj (1992); Premono et al. (1994) y Gururaj y Mallikarjunaiah (1995).
El objetivo de esta investigación fue evaluar los efectos de la aplicación de P y la inoculación con Glomus fistulosum y Pseudomonas aeruginosa sobre el crecimiento, la longitud de la raíz y la absorción de P por plantas de espárrago sembradas en un Andisol.
El experimento se realizó en el invernadero de la Universidad Nacional de Colombia, Sede Medellín (6o 15' N, 75o 35' W y 1495 m de altitud). El suelo utilizado se tomó del horizonte superficial Ap de un Alic Melanudand (SSS, 1994). Los resultados del análisis físicoquímico del suelo fueron los siguientes: densidad aparente 0,5 mg m-3 (cilindro), pH 5,1 (agua, 1:1), materia orgánica 261 g kg–1 (Walkley y Black), P 3,0 mg kg–1 (Bray II); Al 2,9 cmolc kg–1 (KCl 1M); Ca, Mg, K y Na 0,2, 0,2, 0,2 y 0,04 cmolc kg–1 (acetato de amonio 1 M pH 7), respectivamente; CIC efectiva y total 3,54 y 52,37 cmolc kg–1. Fe, Mn, Cu y Zn 243, 2, 1,0 y 2,0 mg kg–1 (Olsen-EDTA), respectivamente; B 0,1 mg kg–1 (agua caliente); NO3 y NH4 9,0 y 38 mg kg–1 (sulfato de aluminio 0,025 M y KCl 1M, respectivamente). El suelo se fertilizó a razón de 1,5 g CaCO3, 1.0 g MgSO4, 112 mg KCl, 114 mg NH4NO3, 28,6 mg H3BO3 y 11,5 mg MnCl2 por kg, luego se esterilizó en autoclave (121°C, 60 min. y 0,1 Pa) y se transfirió a vasos y materos plásticos de 250 y 2500 cm3 de capacidad.
Al momento de la siembra, y en los tratamientos correspondientes, 100 g de suelo (base seca) de los vasos plásticos se mezclaron uniformemente con 50 g de inóculo crudo del hongo G. fistulosum Skou & Jakobsen (Schenck y Pérez, 1990). El inoculo estuvo conformado por 90 esporas g-1, fragmentos de micelio, raíces y sustrato (mezcla suelo-arena 2:1) en el que crecieron durante 60 días las plantas empleadas para el incremento del hongo (Sorghum halapense (Pers.) y Pueraria phaseoloides Roxb (Benth). En los vaso plásticos con suelo no inoculado se aplicaron 50 g de la mezcla suelo-arena previamente esterilizada y filtrados del inóculo crudo.
En cada vaso se sembró una semilla germinada de espárrago (A. officinalis) cv. UC 157. Las semillas fueron obtenidas de un cultivo del municipio de Anserma (Caldas) con polinización libre y fermentadas en su propia pulpa durante 24 horas, luego estas se lavaron con agua corriente e inmediatamente se sumergieron en una solución de hipoclorito de sodio al 1% durante un minuto. Las semillas se mantuvieron cinco minutos en agua caliente (55°C) y finalmente se dejaron nueve días sobre papel húmedo en platos de Petri hasta su germinación.
Siete días después de la siembra, se aplicaron al suelo cuatro niveles de P (0, 110, 220 y 330 mg kg-1) con una solución de ácido fosfórico a una concentración de P de 5,0 mg cm3. Trece días después de la siembra, el suelo alrededor de las raíces se inoculó con 10 cm3 de una suspensión de P. aeruginosa (1010 células cm3) con carboximetil celulosa (CMC, Merck 2280) al 1%. Previamente, P. aeruginosa fue aislada del rizoplano de fragmentos (1,0 cm) de raíces finas de espárrago mediante lavados sucesivos con agua desionizada, destilada y esterilizada (DDE); luego los fragmentos de raíces se transfirieron asépticamente a Cetrimide-Agar (Merck 5284) durante 18 horas. Las colonias fluorescentes se incrementaron en caldo nutritivo (CM1-Oxoid) con agitación orbital constante durante 18 horas de crecimiento. Las bacterias se colectaron con agua DDE, se sometieron a centrifugación por 6 minutos (5000 x g a 7oC) y se mezclaron con la suspensión de CMC. El pH de la suspensión se ajustó a 6,0 con gotas de KOH. El suelo no inoculado con P. aeruginosa recibió solamente la suspensión de CMC al 1%.
Veintitrés días después de la siembra, las plántulas con el suelo (100 g) de los vasos plásticos se trasplantaron a materos plásticos que contenían 1,0 kg de suelo (base seca). Setenta y cinco días después de este transplante las plantas se cosecharon y se determinaron la masa seca aérea y de raíces (48 horas a 60oC), la longitud de raíces primarias y secundarias (método de línea-intercepto) (Tennant, 1975), la concentración de P en el tejido seco (combustión en mufla a 500°C por 6 horas y luego suspensión en HCl 1,0 M) y el P extractable del suelo (método de Bray II). La concentración de P se determinó con el método del azul de molibdato (Murphy y Riley, 1962) en un espectrofotómetro (Perkin-Elmer, C632-001) a 660 nm.
Se utilizó un diseño experimental completamente al azar con cuatro repeticiones. Los tratamientos tuvieron un arreglo factorial 4 x 2 x 2, con cuatro niveles de aplicación de P, inoculación o no con G. fistulosum e inoculación o no con P. aeruginosa. Los datos se sometieron a la prueba F para el análisis de varianza y la prueba de Duncan para la separación de promedios con el software Statgraphics versión 5.0 (P £ 0,05).
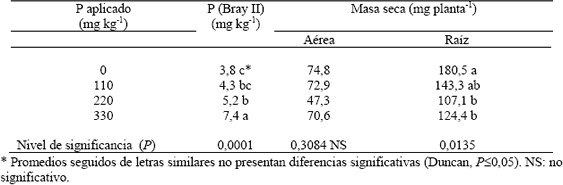
La aplicación de P incrementó significativamente la concentración del P-Bray II del suelo (Tabla 1). Sin embargo, este incremento fue muy leve si se consideran las cantidades aplicadas, lo que sugiere que buena parte del P aplicado fue fijado en el suelo. La fijación de P fue de al menos el 99%, un comportamiento similar ha sido reportado por Montoya (1996) y Carmona; Gutiérrez y Zapata (1997) para Andisoles del Oriente Antioqueño. Así mismo, no hubo incremento significativo en el crecimiento de las plantas de espárrago con la aplicación de P a pesar del aumento en el P (Bray II); por el contrario, la masa seca de las raíces se redujo significativamente con la aplicación de P (Tabla 1). Douglas y Follet (1996) tampoco encontraron respuesta del espárrago con la aplicación de P en un Andisoll de Nueva Zelanda.
Tabla 1. Efecto de la aplicación de P sobre la concentración de P (Bray II) en el suelo y la masa seca de plantas de espárrago.
La inoculación con G. fistulosum incrementó significativamente la masa seca aérea y de raíces, la longitud de las raíces primarias y secundarias y la cantidad de P absorbido por las plantas de espárrago (Tabla 2). Nótese que la masa seca aérea y de raíces es 6.5 y 4,9 veces mayor en plantas del suelo inoculado con G. fistulosum que en aquellos no inoculados. Así mismo, las plantas de suelos inoculados con G. fistulosum presentaron 3,2 y 7,1 veces mayor longitud de raíces primarias y secundarias, respectivamente. Hetrick (1991); Azcón-Aguilar et al. (1996); Barea; Tobar y Azcón-Aguilar (1996); Berta; Fusconi y Trotta (1993) y Berta et al (1990, 1995) hallaron que uno de los efectos benéficos de los HMA consiste en incrementar la proporción de raíces secundarias con respecto a las primarias. Con un sistema de raíces más fino y elongado la absorción de nutrientes es más efectiva (McCully, 1999), particularmente para absorber P del suelo (Barber, 1995). Los beneficios de la asociación micorrizal son más evidentes cuando la planta posee un sistema de raíces gruesas, pocas raíces secundarias y con pocos pelos radicales (Manjunath, 1989; Bolan, 1991), tal como ocurre con espárrago.
Tabla 2. Efecto de la inoculación con G. fistulosum sobre el crecimiento, la longitud de raíces y el P absorbido por plantas de espárrago.
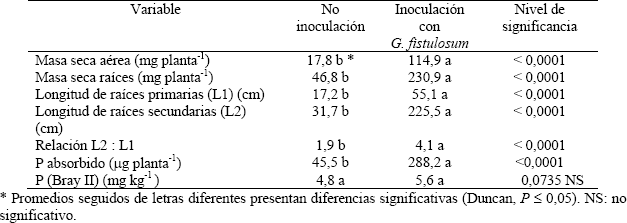
La relación entre la longitud de raíces secundarias y primarias se duplicó con la inoculación micorrizal (Tabla 2). Se supone que con un sistema de raíces, más largo y ramificado, se puede incrementar la toma de nutrientes por el mecanismo de intercepción de raíces, particularmente P. Las plantas del suelo inoculado con G. fistulosum absorbieron 6,3 veces más P que aquellas del suelo no inoculado, esto es un incremento proporcional al aumento en la masa seca aérea. Incrementos en la absorción de P por plantas de espárrago debido a la inoculación micorrizal han sido también reportados por Hussey; Peterson y Tressen (1984); Burrows Pfleger y Waters (1990); Wacker; Safir y Stephens (1990) y Pedersen et al. (1991).
Aunque algunos autores (Patgiri y Bezbaruah, 1990; Mohod; Gupta y Chavan, 1991; Reyes et al., 1995; Prathibha; Alagawadi y Serenivasa, 1995) reportan que bacterias del género Pseudomonas tienen la habilidad para solubilizar P, en este experimento no se observaron efectos significativos con la inoculación de P. aeruginosa sobre la absorción de P y el crecimiento de las plantas (datos no mostrados). La actividad solubilizadora de P de estas bacterias quizás no se expresó debido posiblemente a: (i) la alta disponibilidad de P en el caldo nutritivo (CM1- Oxoid) usado para la multiplicación bacterial que quizá inhibió la actividad solubilizadora (Kucey y Leggett, 1989; Naseby et al., 1998; Whitelaw, 2000), (ii) la fuerte acidez del suelo que inhibe la actividad de muchas bacterias (Prescott; Harley y Klein, 1999), (iii) las dificultades para establecerse en la rizósfera (Domey y Lipman, 1988), y (iv) la baja disponibilidad de fuentes de carbono de fácil metabolismo (Bolan, 1991). En los Andisoles se espera un bajo suministro de carbono dada la baja tasa de mineralización de la materia orgánica (Zunino, 1983). Desafortunadamente no se evaluó la actividad solubilizadora de P por P. aeruginosa antes del experimento, para lo cual podría utilizarse un método como el desarrollado recientemente por Osorio y Habte (2001).
En este trabajo no se determinaron niveles de infección por el hongo, número de esporas ni poblaciones de la bacteria al final del experimento, pero estos aspectos deberán considerarse en estudios posteriores, especialmente si se tiene en cuenta que la interacción entre tres organismos que se desarrollan en escalas de tiempo diferente, no puede ser explicada sin registros de persistencia de cada uno. Estos aspectos indudablemente ayudarán a entender mejor este tipo de interacciones entre microorganismos y plantas.
Los autores realizaron este trabajo como parte de las actividades del Grupo de Investigación en Biotecnología del Suelo (número de protocolo 2953126596637356).
AZCÓN, C. y BAREA, J. Interacciones de las micorrizas arbusculares con microorganismos de la rizosfera. En: GUERRERO, E., ed. Micorrizas: recurso biológico del suelo. Bogotá: Fondo FEN, 1996. p. 47-68. [ Links ]
AZCÓN-AGUILAR, C. et al. Arbuscular mycorrhizal inoculation enhances plant growth and changes root system morphology in micropropagated Annona cherimola Mill. En: Agronomie. Vol. 16 (1996); p. 647-652. [ Links ]
BARBER, S. A. Soil nutrient bioavailability. New York: John Wiley, 1995. 414 p. [ Links ]
BAREA, J. and AZCON, C. Mycorrhizas and their significance in nodulating nitrogen-fixing plants. En: Advances in Agronomy. Vol. 3 (1983), p. 1-54. [ Links ]
________; TOBAR, R. M. and AZCÓN-AGUILAR, C. Effect of a genetically modified Rhizobium meliloti inoculant on the development of arbuscular mycorrhizas, root morphology, nutrient uptake and biomass accumulation in Medicago sativa. En: New Phytologist. Vol. 134, No. 2 (1996); p. 1201-1207. [ Links ]
BERTA, G.; FUSCONI, A. and TROTTA, A. VA mycorrhizal infection and the morphology and function of root systems. En: Environmental and Experimental Botany. Vol. 33, No.1 (1993); p. 159-173. [ Links ]
BERTA, G. et al. Morphogenetic modifications induced by the mycorrhizal fungus Glomus strain E3 in the root system of Allium porrum L. En: New Phytologist. Vol. 114, No. 2 (1990); p. 207-215. [ Links ]
________ et al. Arbuscular mycorrhizal induced changes to plant growth and root system morphology in Prunus cerasifera. En: Tree Physiology. Vol. 15, No. 5 (1995); p. 281-293. [ Links ]
BOLAN, N. S. A critical review on the role of mycorrhizal fungi in the uptake of phosphorus by plants. En: Plant and Soil. Vol. 134 (1991); p. 189-207. [ Links ]
BURROWS, R.; PFLEGER, F. L. and WATERS Junior, L. Growth of seedling asparagus inoculated with Glomus fasciculatum and phosphorus suplementation. En: Hortscience. Vol. 25, No. 5 (1990); p. 519-521. [ Links ]
CARMONA, D.; GUTIERREZ F. y ZAPATA, R. Especiación del fósforo en la solución de tres Andisoles del Oriente Antioqueño bajo fertirrigación. En: Suelos Ecuatoriales. Vol. 27 (1997); p. 117-122. [ Links ]
DOMEY, S. and LIPMAN, G. Stimulation of plant growth by phosphate solu-bilizing bacteria. En: VANCURA, V. and KUNC, F., eds. Interrelationships between microorganisms and plant in soil. En: Developments in Agricultural and Managed-Forest Ecology. Vol. 17 1988. p. 457-461. [ Links ]
DOUGLAS, J. A. and FOLLET, J. M. The fertilizer requirement of asparagus on an allophanic clay based volcanic ash soil. En: Acta Horticulturae. Vol. 415 (1996); p. 355-364. [ Links ]
GAUR, A. et al. Role of VA mycorrhizae, phosphate solubilizing bacteria, and their interactions on growth and uptake of nutrients by wheat crops. Trends in mycorrhizal research. En: THE NATIONAL CONFERENCE ON MYCORRHIZAE (1990: Hisar, India ). Proceedings of The National Conference on Mycorrhizae. Hisar, India , 1990. p. 105-106. [ Links ]
GURURAJ, R. and MALLIKARJUNAIAH, R. Interactions among Azotobacter chroococcum, Penicillium glaucum and Glomus fasciculatum and their effect on the growth and yield of sunflower. En: Helia. Vol. 18, No. 23 (1995); p. 73-84. [ Links ]
HAVLIN, J. et al. Soil fertility and fertilizers. Upper SaddleRiver: Prentice Hall, 1990. 499 p. [ Links ]
HETRICK, B. A. D. Mycorrhizas and root architecture. En: Experientia. Vol. 47, No.4 (1991); p. 355-362. [ Links ]
HUSSEY, B.; PETERSON, R. and TRESSEN, H. Interactions between vesicular-arbuscular mycorrhizal fungi and asparagus. En: Plant and Soil. Vol. 79, No. 3 (1984), p. 403-416. [ Links ]
JARAMILLO, D. F. Andisoles del Oriente Antioqueño: caracterización química y fertilidad. Medellín: Universidad Nacional de Colombia, 1995. 35 p. [ Links ]
KIM, K.Y., JORDAN, D. and MCDONALD, G. A. Effect of phosphate solubilizing bacteria and vesicular-arbuscular mycorrhizae on tomato growth and soil microbial activity. En: Biology and Fertility of Soils. Vol. 26 (1998); p. 79-87. [ Links ]
KUCEY, R. M. N. and LEGGETT, M. E. Microbial mediated increases in plant available phosphorus. En: Advances in Agronomy. Vol. 42 (1989); p. 199-228. [ Links ]
MANJUNATH, A. R. Host related determinants of vesicular-arbuscular mycorrhizal dependency in selected species of Leucaena and Sesbania. Honolulu, 1989. 199 p. Dissertation (Ph.D.) University of Hawaii. [ Links ]
MARSCHNER, H. Mineral nutrition of higher plants. London: Academic Press, 1997. 889 p. [ Links ]
MCCULLY, M. Roots in soil: unearthing the complexities of roots and their rhizosphere. En: Annual Review of Plant Physiology and Plant Molecular Biology. Vol. 50 (1999); p. 695-718. [ Links ]
MOHOD, S.; GUPTA, D. N. and CHAVAN, A. S. Effects of P solubilizing organisms on yield and N uptake by rice. En: Journal of Maharashtra Agricultural Universities. Vol. 16, No. 2 (1991); p. 229-231. [ Links ]
MONTOYA, M. Lixiviación de iones de N, P, K, Mg, Ca y B en un suelo con características ándicas bajo cobertura natural. Estudio en columnas. Medellín, 1996, 80 p. Trabajo de grado (Ingeniero Agrónomo). Universidad Nacional de Colombia. Facultad de Ciencias Agropecuarias. [ Links ]
MURPHY, J. and RILEY, J. P. A modified single solution method for the determination of phosphate in natural waters. En: Analytica Chimica Acta. Vol. 27 (1962); p. 31-35. [ Links ]
NASEBY, D. C. et al. Soil enzyme activities in the rhizosphere of field grown sugar beet inoculated with the biocontrol agent Pseudomonas fluorescens F-113. En: Biology and Fertility of Soils. Vol. 27 (1998); p. 39-43. [ Links ]
OSORIO, N. W. and HABTE, M. Synergistic influence of an arbuscular mycorrhizal fungus and a P solubilizing fungus on growth and P uptake of Leucaena leucocephala in an Oxisol. En: Arid Land Research and Management. Vol. 15 (2001); p. 263-274. [ Links ]
PATGIRI, I. and BEZBARUAH, B. Strains contributing to phosphorus mobilization in acid soils. En: Indian Journal of Agricultural Sciences. Vol. 60, No. 3 (1990); p. 197-200. [ Links ]
PEDERSEN, C. T. et al. Growth of asparagus in a commercial peat mix containing vesicular-arbuscular mycorrhizal (VAM) fungi and the effects of applied phosphorus. En: Plant and Soil. Vol. 135, No. 1 (1991); p. 75-82. [ Links ]
PRATHIBHA, C. K.; ALAGAWADI, A. and SREENIVASA, M. Establishment of inoculated organisms in rhizosphere and their influence on nutrient uptake and yield cotton. Karnataka. En: Journal of Agricultural Sciences. Vol. 8, No. 1 (1995); p. 22-27. [ Links ]
PREMONO, E. et al. Isolation and selection of phosphate-solubilizing microorganims from a sugar cane plantation. En: Majalah Perusahaan Gula. Vol. 30, Nos. 3/4 (1994); p. 25-29. [ Links ]
PRESCOTT, L.; HARLEY, J. and KLEIN, D. A. Microbiology. Boston: McGraw-Hill, 1999. 962 p. [ Links ]
RAO, S. Biofertilizers in agriculture. Rotterdam: AA Balkema, 1992. 188 p. [ Links ]
REYES, A. et al. The influence of mycorrhizae and phosphate solubilizing bacteria on the growth and development of banana vitroplants. En: Infomusa. Vol. 4, No. 2 (1995); p. 9-10. [ Links ]
ROKADE, S. M. and PATIL, P. Phosphate solubilizing microorganisms. A review. En: Journal of Maharashtra Agricultural Universities. Vol. 18, No. 1 (1993); p. 93-101. [ Links ]
SÁNCHEZ, P. and UEHARA, G. Management considerations for acid soils with high phosphorus fixation capacity. En: KHASAWNEH, F. E., ed. The role of phosphorus in agriculture. En: Soil Science Society of America . (1980); p. 471-514. [ Links ]
SCHENCK, N. C. and PÉREZ, Y. Manual for the identification of VA mycorrhizal fungi. Gainesville: Synergistic Publications, 1990. 286 p. [ Links ]
SHOJI, S.; NANZYO, M. and DAHLGREN, R. Volcanic ash soils. Amsterdam: Elsevier, 1993. 288 p. [ Links ]
SOIL SURVEY STAFF. Keys to soil taxonomy. Blacksburg: SSS, 1994. 422 p. (SSS Technicall Monograph; No 19). [ Links ]
SREENIVASA, M. and KRISHNARAJ, M. Synergistic interaction between VA mycorrhizal fungi and a phosphate solubilizing bacterium in chili. En: Zentralblatt fur mikrobiologie. Vol. 147, No. 1/2 (1992); p. 126-130. [ Links ]
TENNANT, D. A test of a modified line intersect method of estimating root length. En: Journal of Ecology. Vol. 63 (1975); p. 995-1001. [ Links ]
TORO, M.; AZCON, R. and HERRERA, R. Effects on yield and nutrition of mycorrhizal and nodulated Pueraria phaseoloides exerted by P-solubilizing rhizobacteria. En: Biology and Fertility of Soils. Vol. 21, No. 1/2 (1996); p. 23-29. [ Links ]
WACKER, T. L.; SAFIR, G. R. and STEPHENS, C. T. Effects of ferulic acid on Glomus fasciculatum and associated effects on phosphorus uptake and growth of asparagus (Asparagus officinalis L.). En: Journal of Chemical Ecology. Vol. 16, No. 3 (1990); p. 901-909. [ Links ]
WHITELAW, M. A. Growth promotion of plants inoculated with phosphate-solubilizing fungi. En: Advances in Agronomy. Vol. 69 (2000); p. 99-151. [ Links ]
ZUNINO, H. Ecología microbiana, acumulación de humus y fertilidad de los suelos alofanicos. En: Suelos Ecuatoriales. Vol. 13, No. 1 (1983); p. 23-35. [ Links ]