Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Facultad Nacional de Agronomía Medellín
Print version ISSN 0304-2847
Rev. Fac. Nac. Agron. Medellín vol.59 no.1 Medellín Jan./June 2006
COMPORTAMIENTO BIOQUIMICO Y DEL INTERCAMBIO GASEOSO DEL LULO (Solanum quitoense Lam.) A PLENA EXPOSICIÓN SOLAR EN EL BOSQUE HÚMEDO MONTANO BAJO DEL ORIENTE ANTIOQUEÑO COLOMBIANO
BIOCHEMICAL BEHAVIOR AND GASS EXCHANGE OF LULO (Solanum quitoense LAM.) UNDER FULL SUNSHINE CONDITIONS IN THE LOW MOUNTAIN RAIN FORESTS OF EASTERN ANTIOQUIA, COLOMBIA
Clara Inés Medina Cano1; Enrique Martínez Bustamante2; Mario Lobo Arias3; Juan Carlos López Núñez4 y Néstor Miguel Riaño Herrera5
1 Investigadora Asistente. CORPOICA, Centro de Investigación La Selva. Km 7 Vía las Palmas. Rionegro, Antioquia, Colombia. <clara.medina.@gmail.com>
2 Profesor Asociado. Universidad Nacional de Colombia Sede Medellín, Facultad de Ciencias Agropecuarias. A.A. 3840. Medellín, Colombia. <enmartin@unalmed.edu.co>
3 Investigador Titular. CORPOICA, Centro de Investigación La Selva. Km 7 Vía las Palmas. Rionegro, Antioquia, Colombia y Profesor Asociado. Universidad Nacional de Colombia, Sede Medellín. Facultad de Ciencias Agropecuarias. A.A. 3840. Medellín, Colombia. <pnrgvlas@gmail.com>
4 Asistente de Investigación. Fisiología Vegetal. Centro Nacional de Investigaciones de Café. CENICAFÉ, Chinchiná, Caldas, Colombia. <juanc.lopez@cafedecolombia.com>
5 Investigador Científico II. Fisiología Vegetal. Centro Nacional de Investigaciones de Café. CENICAFÉ, Chinchiná, Caldas, Colombia. <nestorm.riano@cafedecolombia.com>
Recibido: Septiembre 14 de 2005; aceptado: Febrero 6 de 2006.
RESUMEN
En el estudio se incluyeron las accesiones de lulo NM, con espinas (CE) de la forma botánica septentrionale (adaptado al sotobosque) y; SV80, sin espinas (SE), del taxón quitoense (con selección antrópica para adaptación a mayor exposición solar). El lulo CE presentó mayores contenidos de proteína total y actividad de Rubisco y PEPcarboxilasa, en comparación con el material SE. Las cantidades de clorofila a, b, total y a/b, al transplante (fase vegetativa, V), fueron superiores respecto a las del período productivo (P: desde los 252 días después del transplante); pero, en la etapa P se apreció mayor concentración de las clorofilas a y total en el ecotipo SE para los estratos superior y medio del dosel, aunque con igual cantidad de la a al del genotipo CE en el tercio inferior. Sin embargo, en la clorofila b la población CE superó a la SE en la fase V. Durante la etapa P, el mayor tenor se obtuvo en la capa inferior del clon CE; en tanto que en el ecotipo SE, no hubo diferencias entre los estratos. Esta respuesta fue similar en la relación clorofila a/b. En el período V, los genotipos presentaron altos valores de fotosíntesis (F), lo cual es consecuencia del comportamiento de lo anteriormente analizado. Al inicio de la etapa R, la F decayó significativamente, para ambos ecotipos sin mostrar diferencias entre estratos; pero al final, tanto en septentrionale como en quitoense, las dos capas superiores del dosel presentaron F, mientras que la franja inferior estaba en proceso respiratorio. La transpiración (T) reveló una tendencia a la baja en la época V y comienzos de la R, sin diferencias entre estratos en el material CE, pero el genotipo SE expresó una mayor T en los estratos medio e inferior. En la etapa R, se pudo observar en el material CE aumento en la T, con diferencias significativas entre el estrato medio y los otros; el lulo SE mostró mayores valores de T en los estratos medio e inferior. El alto tenor de clorofila a y b y de la relación clorofila a/b al transplante, indica que las plantas de ambos ecotipos, con un área fotosintética relativamente reducida, presentaron alta densidad de pigmentos, comportamiento consecuente con la actividad fotosintética medida. Con el desarrollo de una mayor área fotosintética, los pigmentos se distribuyeron en el follaje, de manera diferencial, por lo cual las concentraciones de las clorofilas se redujeron. Se observaron variaciones en la F entre los estratos medio y superior del dosel en diversas etapas; en las hojas bajeras se apreció respiración, lo cual es característico de hojas senescentes. Las tasas de fotosíntesis neta apoyan el hecho de que el lulo es una planta del sotobosque, con comportamiento C3.
Palabras claves: Lulo, rubisco, PEPcarboxilasa, clorofila, fotosíntesis, transpiración.
ABSTRACT
The study was carried out with two lulo, Solanum quitoense, accessions, namely NM, with spines (CE), botanical variety septentrionale (adapted to understory) and SV80, spineless (SE), botanical variety quitoense (selected for tolerance to certain sunlight adaptation). Population CE exhibited higher contents of total protein and Rubisco and PEP carboxilase activity than population SE. Chlorophyll a, b, total and a/b levels were higher in the vegetative phase (V) in comparison with those obtained in the productive period (P: 252 days after transplanting); but, in the stage P a greater chlorophyll a and total concentration was noted in ecotype SE than in genotype CE at the middle and top canopy strata without significant differences between genotypes in the bottom canopy strata. Population CE exhibited greater chlorophyll b than ecotype SE genotype during the V stage. During the P stage, there was differential content between strata at the population CE, with higher profiles in the bottom strata, in contrast with the accession SE in which no differences were detected between canopy strata. This also was true for the chlorophyll ratio a/b. In the V period both genotypes presented high photosynthesis values (F), but at the beginning of the R stage, F decayed significantly for both ecotypes without differences between strata; but at the end of this period the botanical varieties septentrionale and quitoense exhibited photosynthetic activity at the top and middle canopy strata while the bottom canopy was only respiring. For transpiration there was a declining tendency throughout phase V and at the beginning of stage R, without differences among strata in the material CE, but in the genotype SE a bigger T was expressed in the middle and bottom strata. During the phase R, an increase in T was observed in material CE, with significant differences between the medium stratum and the bottom and top canopy portions; in this phase the material SE exhibited maximum values for T in the middle and bottom canopy strata. The high profile for a and b chlorophyll as well as for the ratio a/b at planting time indicates that the plants of both ecotypes, with a relatively reduced photosynthetic area at that time, presented high pigment density which agrees with the obtained photosynthetic activity. With the development of a larger photosynthetic area, the pigments were distributed in the foliage, with a decrease in the concentration for the different types of chlorophylls. Photosynthetic variability was observed between the medium and top canopy strata along the different ontogenetic stages; and it was noted that the bottom canopy was only respiring which characterizes senescent foliage. Based on the net photosynthesis rates it was concluded that lulo is an underestory plant with C3 behavior.
Key words: Lulo, rubisco, PEP carboxilase, chlorophyll, photosynthesis, transpiration.
 MATERIALES Y MÉTODOS
MATERIALES Y MÉTODOS
 RESULTADOS Y DISCUSIÓN
RESULTADOS Y DISCUSIÓN
 CONCLUSIONES
CONCLUSIONES
 AGRADECIMIENTOS
AGRADECIMIENTOS
 BIBLIOGRAFÍA
BIBLIOGRAFÍA
Larcher 1995 expresa que, el metabolismo del carbono en la célula está ligado con la atmósfera por el intercambio de CO2, H2O y O2, entre la planta y su medio circundante; elementos que están relacionados con fotosíntesis, respiración y transpiración. El mismo autor manifiesta que, en el intercambio de gas respiratorio la planta libera CO2 y captura O2; mientras que en el intercambio de gas fotosintético, la dirección del transporte de estos dos gases es inversa, captación de CO2 y emisión de O2. La transpiración es importante porque el flujo de agua a través de la planta, transporta los minerales absorbidos por las raíces; además, esta corriente refrigera las hojas (Hernández 2001). A su vez, Larcher 1995 manifiesta que el agua es una sustancia necesaria para la fotosíntesis, ya que una disminución en el potencial hídrico de las hojas causa inmediata inhibición de ella, debido a su efecto sobre el transporte de electrones y la fosforilación.
La fotosíntesis es el proceso por medio del cual la energía lumínica se convierte en energía química por parte de las plantas, las algas y las bacterias fotosintéticas (Vermaas 1998 y Farabee 2002). Esta cubre un conjunto amplio de reacciones fotoquímicas y bioquímicas, que van desde la captura de la energía solar por pigmentos fotosintéticos, fase lumínica, hasta la fijación y conversión del carbono en compuestos orgánicos en la llamada fase oscura, y un proceso de difusión que causa un intercambio de CO2 y O2 entre los cloroplastos y el aire externo (Larcher 1995). Kaufmann y Linder 1996, incluyeron como factores exógenos importantes para el intercambio gaseoso: La energía radiante, la humedad, la temperatura y el estrés de agua. La fotosíntesis depende de la radiación solar, en tanto que la transpiración, además de la radiación, es condicionada por la temperatura y la humedad del aire. La transpiración es inducida por la demanda evaporativa que resulta de la radiación neta absorbida por las hojas y el poder de secado de la atmósfera; esto a su vez, se relaciona con la velocidad del viento y la humedad relativa (Giuliani et al. 1997). Loomis 1997 anotó que la alta demanda evaporativa de la atmósfera, acoplada con una carga elevada de energía, derivada de la radiación absorbida, resulta en una pérdida significativa de vapor de agua durante la toma del CO2.
La forma en la cual los procesos fisiológicos varían en el interior del follaje de las plantas y la relación que existe entre las medidas tomadas en hojas individuales y la planta, se han considerado inquietudes importantes para clarificar dentro de la ecofisiología vegetal (Ishida et al. 1999). En el sentido anterior, Loomis et al. 1968 indicaron que, en comunidades de plantas superiores el análisis del follaje es complicado, ya que, aun en poblaciones que aparentemente son uniformes, estas muestran variaciones en cuanto a forma de la hoja, tamaño, curvatura y dispersión en espacio y tiempo, al igual que en respuestas de plasticidad al viento, la luz y otros factores.
Las plantas, en este conjunto de condiciones, exhiben una alta asociación tipo micorrizas y deben realizar una fotosíntesis reducida (Lobo 1991). En la especie se reconocen dos variedades botánicas: Solanum quitoense var. septentrionale, con espinas, y Solanum quitoense var. quitoense, sin espinas (Whalen, Costish y Heiser 1981 y Morton, 1987). La variedad septentrionale es más primitiva, ya que el carácter presencia de espinas es ancestral sobre la ausencia de éstas (Whalen, Costish y Heiser 1981). El atributo es condicionado por un gene dominante (Vivar1968), y la eliminación de esta característica, con fines de cultivo, es consecuencia de procesos de selección antrópica durante la domesticación (Lobo 1991). El lulo se siembra bajo sombrío, y a plena exposición solar (Lobo 2000). En el primer sistema, el cultivo es colonizador de zonas montañosas (Bernal, Lobo y Londoño 1998). Para la plantación, se socola el bosque y se siembra el cultivo bajo el dosel de los árboles remanentes (Lobo 2000). Se ha observado que la siembra bajo plena exposición solar, reduce el período productivo, lo cual se piensa que es el efecto de la actividad fotosintética acelerada, de una planta que crece espontáneamente en el sotobosque, lo que lleva al debilitamiento de la planta y a un ataque subsiguiente de plagas y enfermedades (Lobo 2000).
La investigación en tópicos fisiológicos, en el país con el lulo (Solanum quitoense Lam.) es insuficiente, ya que el mayor esfuerzo se ha canalizado a cultivos de seguridad alimentaria, cultivos industriales y productos de exportación. Igualmente, no se encontró bibliografía internacional al respecto, al menos en publicaciones arbitradas. Es de anotar que la revisión realizada no pretende ser exhaustiva. La literatura consultada está relacionada con semillas (Lobo 1988 y Cárdenas, Zuluaga y Lobo 2004); ecofisiología (Fischer 2000); poscosecha (Arango, Vélez y Vaillant, 1998 y Galvis y Herrera 1999); relación fuente-vertedero (Gordillo y Rengifo 2002 y Cabezas y Novoa, 2000); acumulación de iones en los tejidos del lulo en condiciones de salinidad (Casierra, Ebert y Lüdders 2000); efecto de arvenses en el crecimiento y productividad (Gómez, Torres y Franco 2002); modelos de crecimiento para el fruto de lulo (Gómez, Franco y Gallego, 2003 y Hernández y Martínez 2001) y modelos agroforestales (Franco et al. 1998, Velásquez y Robles 1991 y Bernal, Lobo y Londoño 1998).
El lulo es un frutal andino no completamente domesticado, el cual crece, en forma espontánea en el sotobosque, cerca de corrientes de agua (Lobo 2000). Por otra parte, se encuentra, espontáneamente, en los bordes del bosque, debajo del dosel y cerca a corrientes de agua (Lobo 2000). En consideración a lo anterior, se presume que es una planta de semipenumbra, con ruta fotosintética C3, la cual se ha ido acondicionando a mayor intensidad lumínica, en especial en los materiales sin espinas, por selección antrópica. Con el fin de comprobar lo anterior, y aportar información sobre el comportamiento de la especie, se llevó a cabo esta investigación relacionada el comportamiento bioquímico y el intercambio gaseoso, en poblaciones con espinas y sin éstas, en las explotaciones comerciales del cultivo, las que se están llevando a cabo bajo condiciones de plena exposición solar.
La investigación se adelantó entre la Universidad Nacional de Colombia Sede Medellín, la Corporación Colombiana de Investigación Agropecuaria (CORPOICA, Rionegro, Antioquia), y el programa de Fisiología Vegetal del Centro Nacional de Investigación en Café (CENICAFÉ, Chinchiná, Caldas).
El trabajo de campo se realizó en el Centro de Investigación, La Selva de CORPOICA, localizado en Rionegro, Antioquia, a 2.120 msnm, con temperatura promedia de 17 °C y humedad relativa media del 78 %. El lugar experimental pertenece a la zona de vida bosque húmedo Montano Bajo (bh-MB) y está ubicado a 06° 08´ 06´´ de latitud norte y 75° 25´ 03´´ de longitud oeste, condiciones que se encuentran dentro del rango considerado como ambiente propicio para el cultivo del lulo. Así se tiene que, Fischer 2000, anota como requerimientos ecofisiológicos para la explotación del lulo en Colombia los siguientes: 16 a 20 °C de temperatura, 1.400 a 2.200 msnm, precipitación entre 1.500 y 2.000 mm y humedad relativa del 70 y al 80%.
Se incluyeron dos genotipos de lulo, los cuales pertenecen a la colección colombiana de Solanum quitoense Lam., manejada por CORPOICA. Estos corresponden a las accesiones NM, con espinas (CE), de la forma botánica septentrionaley SV80, sin espinas (SE), de la forma botánica quitoense. El material CE proviene de la zona de Murrí, municipio de Urrao, Departamento de Antioquia, Colombia; la forma botánica SE corresponde a una accesión colectada en el municipio de Popayán, Departamento de Cauca, Colombia, vereda las Juntas. Estos son genotipos contrastantes; así, la accesión CE es un material con un grado bajo de domesticación, adaptado a condiciones de sotobosque, en tanto que el SE tiene mayor aclimatación a condiciones de exposición solar, a través de acciones de selección antrópica.
La semilla de cada uno de los materiales se sembró en vasos plásticos con un sustrato de materia orgánica, suelo y arena, 1:1:1; a los dos meses se transplantó a bolsa cafetera, y se sembró, en el sitio definitivo, 3,5 meses más tarde. La plantación se distribuyó a 2 m entre individuos y 2,5 m entre surcos. Al momento de la siembra se aplicó, por planta, 300 g de cal dolomítica, 2 kg de gallinaza y 300 g de 10 20 20, fertilización que se repitió cada 3 meses. El riego se realizó diariamente, después del transplante hasta el establecimiento completo en campo; en la época seca se aplicó riego con mangueras, tres veces por semana, dependiendo de la precipitación, en el resto del período de conducción de la investigación. Las aspersiones de fungicidas se realizaron con carácter preventivo, en la época de lluvias y el manejo se los insectos plagas se adelantó de acuerdo a su presencia y las recomendaciones existentes de manejo integrado. El lote se mantuvo libre de malezas mediante control manual.
Se empleó un diseño de bloques al azar y cuatro repeticiones por genotipo, las cuales se jerarquizaron en cada uno de los genotipos. El lote experimental se rodeó de plantas bordes para uniformizar las condiciones del ensayo. Cada repetición, por genotipo, estuvo integrada por 75 plantas, para un total de 300 individuos por accesión. En cada repetición se marcaron 24 plantas, de tal forma que al hacer los muestreos, las unidades remanentes, identificadas para tal fin, permanecían en plena competencia. Para los muestreos mensuales se sortearon los ejemplares a utilizar y se extrajo una planta, en cada repetición, por material estudiado.
La medición de fotosíntesis se hizo en los meses de marzo, mayo, agosto y octubre, de acuerdo con la precipitación (estaciones seca y lluviosa). Para ello se empleó el equipo medidor de gases infrarrojos tipo LCA-4 (Analytical Development Company Limited, Halma Group Company), el cual es un sistema abierto que registra los intercambios de CO2 y vapor de H2O asociados con una porción de hoja encerrada en la cámara del instrumento, tipo PLC (Analytical Development Company 1994). Con el analizador de gases infrarrojos (IRGA) se registró la fotosíntesis instantánea en cuatro plantas por genotipo, una por repetición, en los tres estratos del dosel (superior, medio e inferior), con tres lecturas, en una hoja madura por estrato, representativa del mismo y sin problemas patológicos aparentes. También se determinó la evolución diaria de la fotosíntesis, con observaciones de información cada dos horas. Además, se tomaron lecturas puntuales de: radiación fotosintéticamente activa (RFA), humedad relativa y déficit de presión de vapor de agua (DPV) entre la hoja y su capa limítrofe.
Para la determinación de la clorofila se siguió la metodología propuesta por Wintermans y de Mots 1965, registrándose en hojas maduras, en dos momentos: al transplante y en la etapa productiva. La identificación de la actividad de la Rubisco y de la PEP-carboxilasa se realizó, en el laboratorio de Fisiología Vegetal de CENICAFE, Chinchina, Caldas, con las técnicas descritas por López et al. 2000. Para las dos enzimas, la actividad se siguió a través de oxidación de NADH a 340 nm, con un coeficiente de extinción de 6,22 mM (Segel1976 citado por López et al., 2000). La cinética para PEP carboxilasa se determinó usando PEP como sustrato y la de Rubisco con CO2 y RuBP, mediante el empleo de un espectrofotómetro Perkin - Elmer Lambda 3B (López et al. 2000)
Se identificaron tres períodos en la ontogenia del cultivo, similares en duración, para los dos materiales estudiados: Vegetativo (V), desde la siembra en el campo hasta los 100 días después del transplante (DDT), reproductivo (R) que inicia con la floración y culmina con la primera cosecha de frutos maduros (252 DDT) y, la etapa productiva (P), que se observó hasta los 364 DDT que se llevó la investigación.
Proteína total y actividad enzimática. El genotipo con espinas, septentrionale, presentó mayores contenidos de proteína total y actividad de las enzimas Rubisco y PEP-carboxilasa, en comparación con el material sin espinas, quitoense(Tabla 1). Lo cual es contrario a lo expresado por Reyes-Santamaría et al. 2000, en el sentido de que las plantas de sombra, como es el caso del genotipo CE, tienen menor contenido de proteína soluble y de Rubisco, comparadas con las de luz, correspondiendo el material SE a un ecotipo con mayor adaptación a condiciones de plena exposición solar.
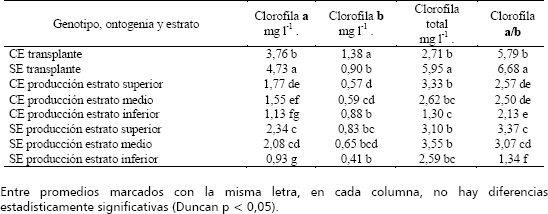
Tabla 1. Contenido de proteína total, Rubisco y PEP-carboxilasa en dos genotipos de lulo, Solanum quitoense var. septentrionale y Solanum quitoense var. quitoense, en el bh-MB del oriente antioqueño colombiano.

Lo anterior podría explicarse como una respuesta plástica del material CE, al ser trasladado del sotobosque a plena exposición solar. Bajo el nuevo conjunto de condiciones, el material cambia su metabolismo y trata de fabricar más fotoasimilados; lo cual se refleja en períodos de productividad más concentrada y de menor duración (Lobo 2000). Adicionalmente, el material SE, pese a tener mayor acondicionamiento a la luz, no necesariamente ha alcanzado adaptación a plena exposición solar. En este último caso, también, podría existir un componente de variabilidad genotípica intraespecífica. Se ha indicado que esta es enorme y que para la tasa de crecimiento, fotosíntesis, respiración, duración de las hojas, contenido de nitrógeno foliar y área específica foliar, la variación dentro de especies puede ser entre 10 y 100 veces, para los valores de estos atributos (Reich, Walters y Ellsworth 1997).
Clorofila. Como se mencionó previamente, esta fue determinada, únicamente, en dos momentos del cultivo, al transplante y en la etapa productiva (P); por lo cual no se pudo conocer la dinámica del contenido de clorofila en los dos clones y, solamente, se analizó la concentración presente en los muestreos mencionados. Los contenidos de clorofila a observados (Tabla 2) al momento del transplante, fueron superiores, significativamente, a los apreciados en el muestreo realizado en la fase P, en ambos materiales, con una mayor concentración del pigmento en el material SE con relación al CE, al momento del transplante, lo cual fue evidente también en la fase P en los estratos superior y medio, lo que no ocurrió en la porción inferior. Al respecto, se ha indicado que cuando las plantas de sombrío se transfieren a condiciones de alta intensidad lumínica, la cantidad de clorofila a decrece (Ohtsuka, Ito y Tanaka 1997). Al respecto, se ha señalado que las plantas tienen la habilidad de responder a las fluctuaciones de luz para minimizar el daño del aparato fotosintético (Yang et al. 1998). El mayor contenido de clorofila a en el material SE que en CE, apoya la idea de que el segundo material tiene una mayor adaptación a condiciones de sotobosque.
Tabla 2. Contenido de clorofilas a, b, total y relación clorofila a/b, en dos ecotipos de lulo de las variedades botánicas septentrionale y quitoense, con espinas (CE) y sin espinas (SE), respectivamente, en diferentes estratos y épocas ontogénicas (transplante, y producción), en el bh-MB del oriente antioqueño colombiano.
Con relación al contenido de la clorofila b, la población CE superó a la SE en el transplante, lo cual no se apreció durante la fase P. En ésta se obtuvo un mayor contenido del pigmento en el estrato superior, en el material SE, y no se identificaron diferencias, entre los dos materiales, en las porciones media e inferior de las plantas. En relación con lo anterior, parece que hay una reconversión de clorofila a en b, en el material CE, al estar sometido a estrés de luz. Esto confirma que el material CE es de sombrío y al encontrarse a plena exposición solar ocurre un estrés en los cloroplastos y reconversión de las clorofilas. Se ha postulado que la conversión de las clorofila a en b parece ser parte de un ciclo de interconversión, la cual se considera que juega un papel importante para la adaptación de las plantas a condiciones de alta y baja luz, mediante ajustes de la proporción clorofila a/b (Folly y Engel 1999).
Durante el desarrollo de las plantas el contenido de pigmentos es controlado por un equilibrio dinámico de su síntesis y degradación (Gaponenko 1976; citado por Pshybytko et al. 2004), con indicación de que, en las plantas jóvenes, la formación de novo de clorofilas es prevalente (Gapo-nenko 1976, He et al. 1994 citados por Pshybytko et al. 2004), lo cual, de acuerdo con Pshybytko et al. 2004, indica que las plantas en diferentes edades, son afectadas por factores que inciden en el contenido de pigmentos clorofílicos.
En cuanto a clorofila total, el material SE, en el transplante, exhibió el máximo valor, con diferencias significativas con CE y además, presentó un mayor contenido de las clorofilas en el transplante que en el período productivo, lo cual no se apreció en el lulo CE.
Para la relación clorofila a/b, se percibieron valores superiores al momento del transplante que en la etapa productiva, en los dos lulos estudiados, con una mayor relación en la población SE. Al respecto, se ha encontrado que la relación decrece significativamente con la vida de las hojas, aún en condiciones de plena exposición solar (Kitajima y Hogan 2003). Los valores registrados al transplante, superan los intervalos postulados por Richardson, Duigan y Berlín 2002, quienes señalaron que éstos, normalmente, se encuentran entre 2,5 y 4,0. Lo anterior indica que las plántulas al transplante, con un área fotosintética reducida, tienen una alta concentración de cloroplastos, la cual es superior en las plantas SE, por una mayor adaptación a las condiciones de luz que las CE.
En la etapa P se apreció, en el genotipo SE, una menor relación a/b en el estrato inferior, con relación a las porciones superior y media de los individuos, lo cual no ocurrió en el material CE. Esto se halla en relación directa con lo postulado por Medina 2003, al expresar que las plantas SE, en la etapa productiva, exhibieron la fase de estabilización en sus funciones de crecimiento, lo que no fue evidente en los individuos CE, en los cuales no se apreció la estabilidad y por ende, es de esperarse, una mayor manifestación de la senescencia, la que está asociada con disminución en la relación registrada (Kitajima y Hogan 2003).
Un hecho destacable con los resultados obtenidos es que, la relación clorofila a/b, obtenida al transplante, se aproxima al de una planta C4, pero luego en el período P, los valores están más cercanos a los encontrados para las plantas C3, los cuales se acercan a 3 (Larcher 1995, 2003).
Tomando en consideración los resultados presentados, el material CE con una mayor adaptación a la sombra, presentó un comportamiento diferencial con el SE, lo cual se pudo ver, tanto al transplante como durante la fase P. Así, al instalarse las plantas en el campo, el genotipo SE, con mejor adaptación a plena exposición solar, exhibió mayor contenido de clorofila a y menor de clorofila b y superior relación clorofila a/b, que el material CE, lo cual es concordante con diferentes investigadores (Larcher 2003 y Lambers, Stuart Chapin III y Pons 1998), quienes han señalado una mayor relación clorofila a/b, en las hojas adaptadas a plena exposición solar y, también, parece indicar que los más bajos contenidos de clorofila a, total y la relación a/b, del material CE, son una expresión de condiciones de estrés, al estar sometido a plena exposición solar.
Radiación fotosintéticamente activa (RFA). En la etapa V, a los 32 y 84 DDT se presentó una RFA entre intermedia (800 – 900 μmol m-2 s-1) y alta (alrededor de 1.200 μmol m-2 s-1). Durante la etapa R, cuando el dosel ya estaba estratificado (175 DDT), se comenzaron a observar diferencias en la RFA entre estos, ya que sus intensidades fueron intermedias (800-900 μmol m-2 s-1) para los dos genotipos, sin grandes divergencias entre las capas superior y media; pero, en el inferior se observaron diferencias significativas con los tercios anteriores, pues recibió radiaciones de solo 600 μmol m-2 s-1. A los 188 DDT (final de la fase R), por las divergencias apreciadas en la estructura del dosel, entre las dos taxa, la distribución de la RFA exhibió variabilidad entre estratos (Figura 1).
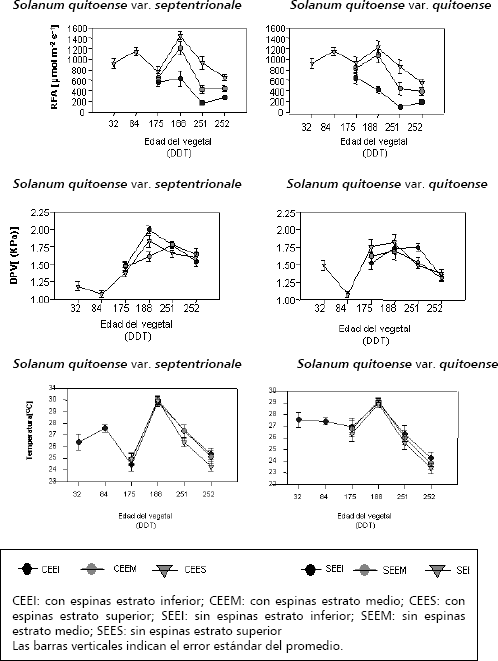
Figura 1. Registros ambientales de la radiación fotosintéticamente activa (RFA), del déficit de presión de vapor (DPV) y de la temperatura diaria durante las evaluaciones puntuales de fotosíntesis en lulo Solanum quitoense var. sepentrionale y Solanum quitoense var. quitoense, durante el ciclo de vida en el bh-MB del oriente antioqueño colombiano.
En el caso del genotipo quitoense, al final del período R, no hubo diferencias estadísticas entre los segmentos superior y medio, con RFA de 1.000 – 1.200 μmol m-2 s-1, la cual es retenida en mayor proporción en ellos; ya que el inferior recibe 400 – 500 μmol m-2 s-1. En septentrionale las diferencias en la distribución de la RFA entre estratos fueron estadísticamente significativas con intensidades de 1.400, 1.200 y 600 μmol m-2 s-1, con una reducción del 42 % entre el ápice y la base del dosel.
En la etapa P, la RFA disminuyó drásticamente, pues sólo se recibió en la capa superior entre 800 y 1.000 μmol m-2 s-1, con diferencias estadísticas entre los segmentos del dosel, pues en el centro del dosel incidió alrededor de 400 μmol m-2 s-1 y en la base arribaron aproximadamente 100–250 μmol m-2 s-1, con fuerte reducción (90 %) en la RFA.
Déficit de presión de vapor (DPV). A los 32 DDT se apreciaron diferencias significativas entre los dos materiales, ya que el ecotipo SE tuvo un DPV de 1,5 KPa y el CE de 1,25 KPa. En la etapa V, a los 84 DDT, se observó una disminución en esta variable, la cual fue más drástica en quitoense que en septentrionale, pues se lograron valores de 0,6 KPa y 0,2 KPa, respectivamente (Figura 1).
Cuando se presentó la estratificación del dosel, se pudo advertir, a los 175 DDT, en la etapa R, un aumento significativo en la DPV de las dos poblaciones, con 1,75 KPa en el estrato superior, para el material SE. En la capa media se observó que, en septentrionale, no hubo diferencias significativas entre ésta y el superior, 1,6 KPa; pero en quitoense, en el estrato inferior se apreciaron divergencias con la porción media del dosel donde se percibió 1,5 KPa.
A los 188 DDT, etapa R, se observaron diferencias entre los dos materiales. En SE, el DPV se mantuvo casi constante, y no se visualizaron diferencias significativas entre estratos. En el lulo CE se obtuvo una divergencia significativa entre las capas del dosel. En la inferior, se dieron los valores más altos, con alrededor de 2 KPa, teniendo diferencias significativas con la capa superior (1,75 KPa) y con el estrato medio (alrededor de 1,5 KPa).
Los registros a los 251 DDT muestran que en el material CE los estratos medio e inferior tuvieron mayores DPV, pero sin diferencias significativas (1,75 KPa). En el estrato superior, se presentó un DPV más bajo (1,6 KPa), con divergencias estadísticas. En el ecotipo SE, el mayor DPV se midió en el estrato inferior (1,75 KPa); este exhibió desigualdades significativas con las capas media y superior del dosel (1,5 KPa). A los 252 DDT, etapa P, se percibió que en los tres estratos no hubo diferencia significativa para esta condición ambiental, en los dos genotipos: 1,3 KPa en el material SE y 1,5 KPa en el ecotipo CE (Figura 1).
Temperatura. Al inicio de la etapa V, la temperatura promedia de la hoja para septentrionale, fue de casi 26,5 ºC y en quitoensede 27,7ºC. A los 84 DDT se dio un aumento, en el primer material, a casi 28 ºC y en el segundo se mantuvo casi constante 27 ºC. Al respecto, se ha indicado que la temperatura óptima para la fotosíntesis en plantas C3, como es el caso del lulo, se ubica en el intervalo de 15 a 25 ºC (Salisbury y Ross 1994).
En la fase V se presentaron diferencias significativas entre genotipos, pero no entre los estratos de cada uno. A los 175 DDT, período reproductivo, la temperatura en el material CE bajó significativamente a 24 ºC y en el ecotipo SE se mantuvo casi constante, 27 ºC aproximadamente. A los 188 DDT, las dos variedades manifestaron su máxima temperatura, casi 30 ºC.
Fotosíntesis y transpiración en las diversas fases del ciclo de vida. En la Figura 2 se aprecia que, en la etapa V, los dos genotipos presentaron alta fotosíntesis (F) puntual, cercana a los 8 μmol de CO2 m-2s-1, lo cual concuerda con las altas concentraciones de clorofila a, b, total y de la relación clorofila a/b, superiores a las obtenidas con plantas en el período R.
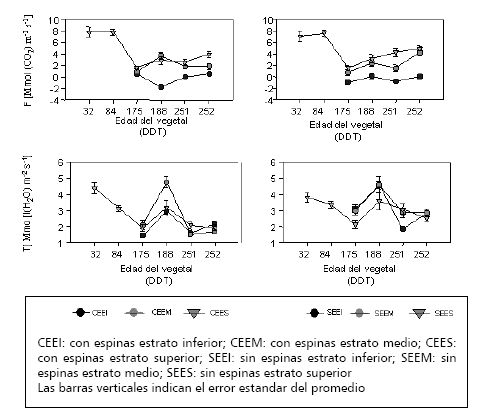
Figura 2. Comportamiento de la fotosíntesis neta (F) y la transpiración (E) de plantas de lulo Solanum quítoense var. septentrionale (CE) Solanum quítoense var. quitoense sembradas bajo las condiciones del bh-MB del oriente antioqueño colombiano.
Al inicio de la etapa R (175 DDT), la F puntual decayó significativamente a 2 μmol de CO2 m-2s-1, para ambos ecotipos, sin diferencias entre estratos; pero, a los 188 DDT, en la variedad botánica septentrionale, las dos primeras capas presentaron F de 3 μmol de CO2 m-2 s-1, y en la franja inferior de – 2 μmol de CO2 m-2 s-1, lo que indicó que esta porción del vegetal estaba en un proceso de respiración, característico de las hojas en la etapa de senescencia, propias de este tercio del dosel.
La taxa quitoenseexpresó intensidades fotosintéticas semejantes a la anterior, en los estratos superior y medio del dosel, 3 μmol de CO2 m-2 s-1; y en el inferior de – 1 μmol de CO2 m-2 s-1, lo que también señaló que predominaban las actividades respiratorias; así mismo, la F fue intermedia, alrededor de 4 μmol de CO2 m-2 s-1, al final de la fase R.
Para Ishida et al. 1999, la capacidad fotosintética declina con el envejecimiento de las hojas; pero, debido a que el follaje está sometido, generalmente, a autosombrío, la variación en la capacidad fotosintética entre hojas podría estar influida no solo por la edad de éstas, sino también por la reducción de la irradiación recibida. El autosombrío se ha considerado importante en árboles no deciduos con períodos de vida prolongados (Schoettle y Smith 1991) y en plantas que desarrollan un follaje denso (Ishida et al. 1999), como es el caso del lulo.
La caída significativa de la F puntual, al inicio de la etapa R (175 DDT), para ambas taxa, sin diferencias entre estratos, coincidió con una disminución, tanto en la RFA entre 800 a 900 µmol m-2 s-1, como en la temperatura promedia de la hoja, de 24 ºC para el lulo CE, y 26,5 ºC para el SE y un mayor DPV (aproximadamente 1,5 KPa), para los dos ecotipos.
Niinemets et al. 1999, encontraron que a lo largo de los gradientes de luz en el follaje de las plantas, existe una relación positiva entre la radiación y la temperatura del aire, e inversa entre aquella y la humedad, por lo cual afirmaron que el DPV está directamente relacionado con la irradiación.
Los incrementos fotosintéticos que se alcanzaron a los 188 DDT, fueron concomitantes con las altas intensidades de la RFA (1.200 – 1.400 μmol m-2 s-1), para las franjas superior y media de los ecotipos; cuando para el estrato inferior sólo fue de 400 y 600 μmol de fotones m-2 s-1 para SE y CE, respectivamente. Además, en forma concordante con el aumento de la F se logró el mayor DPV, en ambos genotipos, 2 y 1,75 KPa; y se registraron las temperaturas más altas internas del follaje, cercanas a 30 ºC. Se ha señalado que la luz es un factor determinante del funcionamiento de las plantas, relacionado con fijación fotosintética del dióxido de carbono y que la maquinaria de los vegetales responde a los cambios en irradiación y calidad de la luz, dadas las fluctuaciones que ocurren inevitablemente en este factor durante el crecimiento y el desarrollo (Bukhov 2004).
Es necesario considerar que las hojas de muchas especies C3 son incapaces de aprovechar luz adicional por encima de un flujo fotónico fotosintético (FFF) de 500 μmol m-2 s-1, lo que representa, aproximadamente, el 25 % de la exposición total. Por ello, la tasa máxima de asimilación se puede considerar como una medida de la capacidad fotosintética de la hoja (Moreno 1997).
En la etapa P, se apreció en el lulo CE una F diferencial entre estratos, sin divergencias entre el medio y el superior (2 μmol de CO2 m-2 s-1); mientras que, la parte inferior del dosel mostró una F cercana a cero μmol de CO2 m-2 s-1, la cual indica que se encuentra en senescencia. El genotipo SE exhibió una tendencia incremental en la F, en el estrato superior (4 μmol de CO2 m-2 s-1), con diferencias estadísticas entre el estrato medio (1 μmol de CO2. m-2 s-1) y el inferior (-2 μmol de CO2 m-2 s-1).
En concordancia con lo anterior, Raulier, Bernier y Ung 1999, en un estudio sobre la fotosíntesis del follaje de la especie Acer saccharum, encontraron diferencias en cuanto a la capacidad fotosintética entre las hojas de la parte superior del dosel (12 μmol m-2 s-1) y las de la parte inferior (3,5 μmol m-2 s-1), lo cual tiene relación con la intensidad de radiación en las dos posiciones.
Al tomar como referente las tasas de fotosíntesis neta obtenidas durante el estudio, se puede apoyar la afirmación de que el lulo es una planta originaria del sotobosque. Cabe señalar que las dos poblaciones evaluadas estuvieron sometidas a un ambiente diferente al de su adaptación, en especial el ecotipo CE, lo cual debió reflejarse en el comportamiento exhibido en los valores de F. Al respecto, Walters 2005 postuló que los cambios en el ambiente tienen un impacto importante en el aparato fotosintético, ya que no sólo este es la fuente de energía de la planta y el sitio de fijación del carbono, sino también el lugar donde se presenta el mayor daño bajo condiciones de estrés.
Por otra parte, en consideración a la evolución de la F, en el estudio actual, cabe señalar que los cambios en ella, coinciden con los encontrados por Marín 1989, quien, halló, en estudio realizado con diferentes cultivares de Canavalia ensiformis, que la tasa fotosintética se reducía con la edad de los foliolos de las plantas, lo cual también se había observado en algodón.
Los cambios en F entre los estratos del dosel en diversas etapas indican que, a partir de cierto momento, las hojas de la parte bajera de la planta no realizaban fotosíntesis, sino respiración, lo cual es un indicio de senescencia en esta parte del follaje, a la cual, de acuerdo con el modelo dinámico de formación de nuevas hojas y desplazamiento de estas entre estratos, se van vinculando hojas más viejas (Medina 2003).
La transpiración (T) reveló un comportamiento con tendencia a la baja en la época V y comienzos de la R, donde se apreció un descenso desde 4 μmol de H2O m-2 s-1 hasta 2 μmol de H2O m-2 s-1, sin diferencias entre estratos en el material CE; y con cambios desde 3 a 2,5 μmol de H2O m-2 s-1 en el SE, con mayor T en los estratos medio e inferior, respuesta que estuvo asociada con una disminución en la temperatura del follaje, evidente en este período, y con el aumento en el DPV, luego de los 84 DDT.
En la R, se pudo observar un comportamiento diferencial entre ambos genotipos, ya que el material CE presentó un aumento notorio en la T, con diferencias significativas entre el estrato medio (4,5 μmol de H2O m-2 s-1) y el superior e inferior (3 μmol de H2O m-2 s-1); el material SE mostró un aumento menos pronunciado, con mayor T en los estratos medio e inferior. Dicha respuesta fue consecuencia de incrementos en la RFA, el DPV y la temperatura, los cuales alcanzaron los mayores valores registrados durante la experimentación.
La alta transpiración estuvo asociada con una mayor tasa fotosintética. Al respecto, Salisbury y Ross 1994 expresan que las temperaturas elevadas están relacionadas con una mayor transpiración, para el control de la temperatura interna; por lo tanto, al estar el estoma más abierto permite un incremento en el flujo de CO2 y mayor tasa fotosintética, que es el comportamiento que se observó en la F de estas taxa.
Así mismo, en la fase R se detectaron incrementos en la RFA y la temperatura foliar, lo que condujo a un aumento en la T de los dos ecotipos, la cual llegó a una tasa cercana a los 5 μmol de H2O m-2 s-1, principalmente en el estrato medio del genotipo CE y en el medio e inferior del SE. En este último, la respuesta estuvo asociada, directamente, con la densidad estomática la cual es máxima en los estratos indicados; aunque en el CE, hubo relación con la cantidad de estomas del tercio medio, correlación que no fue evidente para el superior, lo cual era de esperarse ya que el follaje del ápice del dosel no presentó diferencias de densidad estomática con el del medio (Medina 2003).
El resultado puede explicarse por el énfasis que plantea Medina 2003, respecto al material CE, el cual por provenir de condiciones de mayor penumbra, al estar sometido a completa irradiación, reacciona cerrando estomas en las hojas que tienen mayor exposición a la luz, las cuales corresponden al segmento superior del dosel.
En la etapa P en el ecotipo CE la T descendió de 5 μmol de H2O m-2 s-1 a 2 μmol de H2O m-2 s-1, sin que se observaran diferencias estadísticas entre estratos. En el SE se apreció mayor disminución en el estrato inferior, donde la T bajó a 1,5 μmol de H2O m-2 s-1, sin que se percibieran diferencias entre los estratos medio y superior.
Brooks et al.1997 enunciaron que la dinámica temporal y espacial de intercambio de gases en el follaje es influida por factores ambientales, aspecto sobre el cual diversos autores señalaron que los gradientes verticales en F eran condicionados por la disponibilidad de luz. Igualmente, afirmaron que los patrones de variación en la conductancia estomática y la T eran más complejos, ya que estos eran afectados por la luz, la conductancia de la capa limítrofe y el DPV en el aire.
Integración de la fotosíntesis puntual en los dos genotipos de lulo. En la Figura 3 se aprecia que la F exhibió una evolución similar en los dos genotipos, la que fue intensa luego del transplante, con un área foliar reducida, para formar las estructuras necesarias en el crecimiento y desarrollo del individuo. Posteriormente, con el aumento del área fotosintética, se apreció una disminución de la F, al final de la etapa V, con reactivación al final de la etapa R e inicio de la P. Este comportamiento puede indicar que el vegetal adquirió mayor estabilidad en cuanto a fraccionamiento de fotoasimilados, precisándose de una mayor F para soportar los nuevos vertederos constituidos por los frutos.
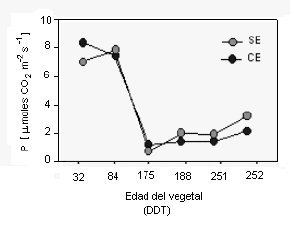
Figura 3. Valor integrado de la fotosíntesis neta (F) para dos genotipos de Solanum quítoense Lam (SE: sin espinas; CE: con espinas), sembrados bajo las condiciones del bh-MB del oriente antioqueño colombiano
Los valores obtenidos para la fotosíntesis corroboran el hecho de que el lulo es una planta C3, lo cual fue apoyado por los resultados obtenidos con relación a la concentración de las clorofilas a, b total y la relación clorofila a/b. Además, las cifras de fotosíntesis estuvieron en concordancia con las logradas con plantas provenientes del sotobosque, hábitat en el cual el lulo se encuentra en forma espontánea.
Los mayores contenidos de proteína total y actividad de las enzimas fotosintéticas, Rubisco y PEP-carbo-xilasa, del genotipo CE (septen-trionale) en comparación con el taxon SE (quitoense), parecen una respuesta plástica del CE, al trasladarlo del sotobosque a plena exposición solar, con modificaciones en el metabolismo. Adicionalmente, pese al mayor acondicionamiento a la luz, el SE no se ha adaptado a plena exposición solar, por lo que podría existir una variabilidad genotípica intraespecífica, con reacción diferente a ambientes de estrés.
La mayor concentración de cloroplastos y contenido de clorofila a y de la relación clorofila a/b, en el material SE con respecto al CE, apoya la idea de que este último material tiene una mayor adaptación a condiciones de sotobosque.
La alta tasa fotosintética en la etapa V es consecuencia del comportamiento bioquímico, con altos niveles de clorofila a, b, total y a/b, superiores a los obtenidos en el período P. Además, al tomar como referente las tasas de fotosíntesis neta alcanzadas durante el estudio, se apoya la información de que el lulo es originario del sotobosque; igualmente, se apreciaron variaciones en la F entre los estratos del dosel en diversas etapas y que, a partir de cierta edad, las hojas bajeras no realizaban F, sino respiración, lo cual es un índice de senescencia en esta parte del follaje.
La F neta observada y el comportamiento bioquímico identificado corroboran el hecho de que el lulo es una planta C3, lo que estuvo en concordancia con las logradas en plantas provenientes del sotobosque, hábitat espontáneo del lulo.
Los autores expresan sus agradecimientos a la Dirección de Investigaciones de Medellín - DIME - de la Universidad Nacional de Colombia, por el aporte financiero; a la Corporación Colombiana de Investigación Agropecuaria – CORPOICA - por las facilidades humanas, físicas y financieras proporcionadas en el C.I. La Selva, en especial el apoyo de María Orfilia. Vargas Arcila, Mónica Sánchez Tabares, Oscar Arturo Delgado Paz y Rodrigo Mejía; al Posgrado en Ciencias Agrarias y su Director profesor José Régulo Cartagena Valenzuela, adscrito al Departamento de Ciencias Agronómicas, de la Facultad de Ciencias Agropecuarias, Universidad Nacional de Colombia – Sede Medellín y al Centro Nacional de Investigación del Café – CENICAFE.
Analytical Development Company Limited. 1994. Operating manual of leaf chamber analyses type LCA-4. London : A Halma Group. 95 p. [ Links ]
Arango, H., Vélez, C. y Vaillant, F. 1998. Estudio sobre el comportamiento postcosecha del lulo (Solanum quitoense Lam.). p. 197-204. En: Seminario Frutales de Clima Frío Moderado (2: 1998: Manizales, Colombia). Memorias. Manizales: Centro de Desarrollo Tecnológico de Frutales. [ Links ]
Bernal, Jorge, Lobo, Mario y Londoño, Mauricio. 1998. Documento de presentación del material Lulo La Selva. Rionegro: Corpoica. 77p. [ Links ]
Brooks, J. Renée, Flanagan, Lawrence B., Varney, Gregory T. and Ehleringer, James R. 1997. Vertical gradients in photosynthetic gas exchange characteristics and refixation of respired CO2 whithin boreal forest canopies. En: Tree Physiology. Vol. 17, no. 1; p. 1-12. [ Links ]
Bukhov, N. G. 2004. Dynamic light regulation of phtososynthesis (A review). En: Russian Journal of Plant Physiology. Vol.51, No. 6; p. 825-837. [ Links ]
Cabezas, M. y Novoa, D. L. 2000. Efecto de la remoción de hojas y frutos en la relación fuente demanda en lulo (Solanum quitoense Lam.). p. 69-75. En: Seminario Frutales de Clima Frío Moderado (3: 2000: Manizales, Colombia). Memorias. Manizales: Centro de Desarrollo Tecnológico de Frutales. [ Links ]
Cárdenas, Wilson, Zuluaga, Marta Luz y Lobo, Mario. 2004. Latencia en semillas de lulo (Solanum quítoense Lam) y tomate de árbol (Cyphomandra betacea (Solanum betacum) Cav. Sendt) como aspecto básico para la conservación y el monitoreo de viabilidad de las colecciones En: Plant Genetic Resources Newsletter. no. 139; p. 31-41. [ Links ]
Casierra, F.; Ebert, G. and Lüdders, P. 2000. Acumulación y distribución de iones en tejidos de lulo (Solanum quitoense Lam.) en condiciones de salinidad por cloruro de sodio. p. 76-80. En: Seminario Frutales de Clima Frío Moderado (3: 2000: Manizales, Colombia). Memorias. Manizales: Centro de Desarrollo Tecnológico de Frutales. [ Links ]
Farabee, M. J. 2002. Photosynthesis. Disponible en Internet: http:/gened. emc.maricopa.edu/bio bio181/BIOBK /BiobookPS.html. [Consultada: 21 Ene. 2002]. [ Links ]
Fischer, Gerhard. 2000. Ecofisiología en frutales de clima frío moderado. p. 51-59. En: Seminario Frutales de Clima Frío Moderado (3: 2000: Manizales, Colombia). Memorias. Manizales: Centro de Desarrollo Tecnológico de Frutales. [ Links ]
Folly P. and Engels, M.1999. Chlorophyll b to chlorophyll a conversion precedes chlorophyll degradation in Hordeum vulgare L. En: The Journal of Biological Chemistry. Vol. 274, no. 47; p. 21811-21816. [ Links ]
Franco, G., Gallego, J. L., Rodríguez, J. E., Guevara, N. y Morales, J. E. 1998. Evaluación de clones de lulo bajo dos sistemas de producción. p. 190-196. En: Seminario Frutales de Clima Frío Moderado (2: 1998: Manizales, Colombia). Memorias. Manizales: Centro de Desarrollo Tecnológico de Frutales. [ Links ]
Galvis, J. A. y Herrera, A. 1999. El lulo (Solanum quitoense Lam.): manejo postcosecha. Convenio SENA-Universidad Nacional, Instituto Colombiano de Ciencia y Tecnología de Alimentos ICTA. Bogotá: SENA. 59 p. [ Links ]
Gaponenko, S. V. 1976. Optical properties of semiconductor nanocrystals. New York: Elsevier. 1976. 245 p. citado por: Pshybytko, N. L. Kalitukho, L. N., Zhavoronkova, N. B. and Kabashnikova, L 2004. The pool of chlorohyllous pigments in barley seedlings of different ages under heat shock and water deficit. En: Russian Journal of Plant Physiology. Vol. 51, no. 3; p. 15-20. [ Links ]
Giuliani, R., Nerozzi, F., Magnanini, E. and Corelli-Grappadelli L. 1997. Influence of environmental and plant factors on canopy photosynthesis and tranpiration of apple trees. En: Tree Physiology. Vol. 17, no.10; p. 637-645. [ Links ]
Gómez, C.; Franco, G. y Gallego, J. L. 2003. Análisis de crecimiento del lulo La Selva (Solanum quitoense Lam.), en condiciones del departamento de Caldas p. 57. En: Congreso Sociedad Colombiana de Fitomejoramiento y Producción de Cultivos (8: 2003: Bogotá, Colombia). Memorias. Bogotá: Centro de Convenciones Alfonso López Pumarejo, Universidad Nacional de Colombia. [ Links ]
Gómez, L. M.; Torres, W. A. y Franco, F. 2002. Efecto de las arvenses en los parámetros de crecimiento y producción de lulo. 209-215. En: Seminario Frutales de Clima Frío Moderado (4: 2002: Manizales, Colombia). Memorias. Manizales: Centro de Desarrollo Tecnológico de Frutales. [ Links ]
Gordillo, O. A. y Rengifo, J. A. 2002. Caracterización fenotípica de cultivares de lulo. Palmira. 127 h. Trabajo de grado Ingeniero Agrónomo. Universidad Nacional de Colombia. Facultad de Ciencias Agropecuarias. [ Links ]
Hernández, María Soledad y Martínez, Orlando. 2001. Modelos de crecimiento para el fruto del lulo (Solanum quitoense Lsam). En: Agricultura Tropical. Vol. 30, No. 3; p. 85-97. [ Links ]
________, Rubén. 2001. Transpiración. Libro botánica on line. Disponible en Internet: http//:www.forest.ula.ve/~ rubenhg/transpiración/ [Consultada: 17 Abr. 2002]. [ Links ]
Ishida, A., Uemura A., Koike, N., Matsumoto, Y. and Hoe, A. L. 1999. Interactive effects of leaf age and selfshading on leaf structure, photosynthetic capacity and chlorophyll fluorescence in the rain forest tree, Dryobalanops aromatica. En: Tree Physiology. Vol. 19, no. 11; p. 741-747. [ Links ]
Kaufmann, Merrill R. and Linder, Sune. 1996. Tree physiology research in a changing world. En: Tree Physiology. Vol.16, no. 1/2; p. 1-4. [ Links ]
Kitajima, K. and Hogan, K. P. 2003. Increases of chlorophyll a/b ratios during acclimatation of tropical woody seedlings to nitrogen limitation and high light. En: Plant, Cell and Environment. Vol. 26, no. 6; p, 857-865. [ Links ]
Lambers, Hans, Chapin III, F. Stuart, and Pons, Thijs L. 1998. Plant physiological ecology. New York: Springer-Verlag. 540p. [ Links ]
Larcher, Walter. 2003. Physiological plant ecology: ecophysiology and stress physiology of functional groups. 4ed. New York: Springer. 513p. [ Links ]
________. 1995. Physiological plant ecology. 3 ed. New York: Springer. 506p. [ Links ]
Lobo, Mario. 2000. Papel de la variabiabilidad genética en el desarrollo de los frutales andinos como alternativa productiva p. 27-36. En: Seminario Frutales de Clima Frío Moderado (3: 2000: Manizales, Colombia). Memorias. Manizales: Centro de Desarrollo Tecnológico de Frutales. [ Links ]
________.1991. Perspectivas de siembra del lulo o naranjilla (Solanum quitoense Lam.). En: Boletín Técnico. Universidad Nacional de Colombia. Facultad de Ciencias Agropecuarias, Palmira. Vol. 2, no.2; p. 125-132. [ Links ]
Lobo, Mario. 1988. Investigaciones con semillas de lulo (Solanum quitoense Lam.). En: Semillas. Vol. 13, no. 2; p. 17-20. [ Links ]
Loomis, R. S. 1997. On the utility of nitrogen in leaves. En: Proceedings of the National Academy of Sciences. Vol. 94, No. 25; p. 3378-13379. [ Links ]
________, Williams, W. A., Duncan, W. G., Dovrat, A. and Nunez, A. F. 1968. Quantitative description of foliage display and ligth absortion in field communities of corn plants. En: Crop Science. Vol. 8, No. 1; p. 352-356. [ Links ]
López, Y., Riaño, N., Mosquera, P., Cadavid, A. y Arcila, J. 2000. Activities of phosphoenopyruvate carboxylase and ribulose-1,5-biphosphate carboxylase/oxygenase in leaves and fruit pericarp tissue of different coffee (Coffea sp.) genotypes. En: Photosynthetica. Vol. 38, No. 2; p. 215-220. [ Links ]
Marin Ch., Douglas. 1989. Análisis de crecimiento en Canavalia ensiformis L. DC, bajo condiciones de campo. En: Revista de la Facultad de Agronomía, Venezuela. Vol.15; p, 1-16, [ Links ]
Medina, Clara Inés. 2003. Estudio de algunos aspectos fisiológicos del lulo (Solanum quitoense Lam.) en el bosque húmedo montano bajo del Oriente Antioqueño. Medellín. 249 h. Tesis Magíster en Ciencias Agrarias. Universidad Nacional de Colombia. Facultad de Ciencias Agropecuarias. [ Links ]
Moreno, Flavio. 1997. Fotosíntesis en plántulas de sajo (Campnosperma panamensis) y cuangare (Otoba gracilipes) bajo diferentes ambientes lumínicos. En: Crónica Forestal y del Medio Ambiente. no. 12; p. 47-62. [ Links ]
Morton, J. F. 1987. Naranjilla (Solanum quitoense Lam., Solanum angulatum Lam.). p. 425-428. En: Fruits of warm climates. Miami, Fl.: Julia F. Morton. [ Links ]
Niinemets, Ülo, Bilger, Wolfgang, Kull, Olevi and Tenhunen, John D. 1999. Responses of foliar photosynthetic electron transport, pigment stoichiometry, and stomatal conductance to interacting environmental factors in a mixed species forest canopy. En: Tree Physiology. Vol. 19, no. 13; p. 839-852. [ Links ]
Ohtsuka, T., Ito, H. and Tanaka, A. 1997. Conversion of chlorophyll b to chlorophyll a and the assembly of chlorophyll with apoproteins by isolated chloroplasts. En: Plant Physiology. Vol. 113, no. 1; p. 137-147. [ Links ]
Pshybytko, N. L., Kalitukho, L. N., Zhavoronkova, N. B. and Kabashnikova, L. 2004. The pool of chlorohyllous pigments in barley seedlings of different ages under heat shock and water deficit. En: Russian Journal of Plant Physiology. Vol. 51, no. 3; p. 15-20. [ Links ]
Raulier, Frédéric, Bernier, Pierre and Ung, Chhun-Huor. 1999. Canopy photosynthesis of sugar maple (Acer saccharum): comparing big-leaf and multilayer extrapolations of leaf-level measurements. En: Tree Physiology. Vol.19, no. 7; p. 407-420. [ Links ]
Reich, Peter B., Walters, Michael B. and Ellsworth, David S. 1997. From tropics to tundra. Global convergence in plant functioning. En: Proceedings of the National Academy of Sciences. Vol. 94, No. 25; p. 13730-13734. [ Links ]
Reyes-Santamaría, M. Isabel, Villegas-Monter, Ángel, Colinas-León, María Teresa y Calderón Zavala, Guillermo. 2000. Peso específico, contenido de proteína y de clorofila en hojas de naranjo y tangerino. En: Agrociencia. Vol. 34, no. 1; p. 49-55. [ Links ]
Richardson, A. D., Duigan, S. P. and Berlyn, G. P. 2002. An evaluation of noninvasive methods to estimate foliar chlorophyll content. En: New Phytologist. Vol. 153; p. 185-194. [ Links ]
Salisbury, F. B. y Ross, C. W. 1994. Fisiología vegetal. México D.F.: Grupo Editorial Iberoamericana. 759p. [ Links ]
Schoettle, A. W. and Smith, WW. K. 1991. Interrelation between shoot characteristics and solar irradiance in the crown of Pinus contorta ssp. Latifolia. En: Tree Physiology. Vol. 9, no.1/2; p. 245-254. [ Links ]
Velásquez, M. O. y Robles, H. 1991. Modelo de sistema agroforestal de lulo (Solanum quitoense) asociado con Pinus patula, Eucalyptus globulus y bajo malla polisombra. Bogotá. 170 h. Trabajo de grado Ingeniero Forestal. Universidad Distrital Francisco José de Caldas. Facultad de Ingeniería Forestal. [ Links ]
Vermaas, Wim. 1998. An introduction to photosynthesis and its applications. Washington: The World & I. p. 158-165 p. [ Links ]
Vivar, H. E. 1968. Algunos estudios citogenéticos y genéticos sobre la naranjilla (Solanum quitoense Lam.). Tesis M.Sc. IICA, Turrialba, Costa Rica. 115 p. [ Links ]
Walters, R. G. 2005. Toward an understanding of photosynthetic acclimation. En: Journal of Experimental Botany. Vol. 56, no. 411; p. 435-447. [ Links ]
Whalen, M. D., Costich, D. E. and Heiser, C. B. 1981. Taxonomy of Solanum section lasiocarpa. En: Gentes Herbarium. Vol. 12, no. 2; p. 41-129. [ Links ]
Yang, D., Webster, J., Adam, Z., Lindhal, M. and Anderson, B. 1998. Induction of acclimative proteolysis of the lightharvesting chlorophyll a/b protein of photystem II in response to elevated light intensities. En: Plant Physiology. Vol. 118, no. 3; p. 827-834. [ Links ]