Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Facultad Nacional de Agronomía Medellín
Print version ISSN 0304-2847
Rev. Fac. Nac. Agron. Medellín vol.59 no.2 Medellín July/Dec. 2006
AISLAMIENTO Y CARACTERIZACIÓN MORFOLÓGICA DE Rosellinia pepo Pat. EN PLANTAS DE MACADAMIA
ISOLATION AND MORPHOLOGICAL CHARACTERIZATION OF Rosellinia pepo Pat. IN MACADAMIA PLANTS
Carmen Eliana Realpe Ortiz1, Clemencia Villegas García2, Néstor Miguel Riaño Herrera3
1 Fitopatóloga. Universidad de Caldas. A.A. 275, Manizales, Colombia. <fitotecnia@ucaldas.edu.co>
2 Investigador Científico I. ETIA. Centro Nacional de Investigaciones de Café. CENICAFÉ. Chinchiná, Caldas, Colombia. <clemencia.villegas@cafedecolombia.com>
3 Investigador Científico II. Fisiología Vegetal. Centro Nacional de Investigaciones de Café. CENICAFÉ, Chinchiná, Caldas, Colombia. <nestorm.riano@cafedecolombia.com>
Recibido: Junio 1 de 2005; aceptado: Marzo 15 de 2006.
RESUMEN
El hongo Rosellinia pepo Pat., causante de la llaga estrellada, se considera uno de los principales problemas fitosanitarios de la macadamia por ocasionar la muerte de la planta en su etapa productiva. Debido a que no existe una metodología de aislamiento confiable que asegure la recuperación del hongo con un porcentaje mínimo de contaminación y los estudios relacionados con este patógeno son escasos se planteó una investigación con el fin de perfeccionar una metodología de aislamiento y realizar algunas caracterizaciones morfológicas de este patógeno. La nueva metodología permitió obtener aislamientos con un 91,26% de pureza del hongo. La tasa de crecimiento fue de 4,68 mm día-1. Las colonias son de color blanco y apariencia algodonosa en su inicio, pero a medida que envejece el micelio toma un color café o negro y su apariencia se torna quebradiza. La observación de micelio blanco en forma de estrella en el lado interior del medio sintético permite diferenciarlo de otras especies como R. bunodes. Las mediciones microscópicas de los hinchamientos piriformes presentaron en promedio 106,4mm de largo y 75,3mm de ancho. Este trabajo también permitió determinar el nivel de inóculo infectivo.
Palabras claves: Rosellinia pepo, llaga estrellada, macadamia, aislamiento, caracterización.
ABSTRACT
The fungus Rosellinia pepo Pat, the causal agent of star gall, is considered to be a main phytosanitary problem to the Macademia tree by causing the death of the tree while in its productive stage. Because no reliable isolation method exists that assures recovery of the mushroom with a minimum percentage of contamination and studies of this pathogen are scarce. This study was conducted to perfect an isolation methodology and permit some morphological characterizations of this pathogen. The new methodology allowed isolations with 91,26% purity of mushroom to be obtained. The rate of growth was 4,68 mm day-1. The colonies were of white color and cottony appearance in the beginning, but as the micelio aged it assumed a brown or black color and a brittle appearance. The observation of white star-shaped micelio in the interior side of the synthetic medium allowed differentiation of it from other species like R. bunodes. The microscopic measurements of the swollen peryform yielded 106,4μm longitude on average and 75,3 μm width. This work also allowed determination of the level of infective inocule.
Key words: Rosellinia pepo, star gall, macadamia, isolation, characterization.
 MATERIALES Y MÉTODOS
MATERIALES Y MÉTODOS
 RESULTADOS Y DISCUSIÓN
RESULTADOS Y DISCUSIÓN
 AGRADECIMIENTOS
AGRADECIMIENTOS
 BIBLIOGRAFÍA
BIBLIOGRAFÍA
El hongo Rosellinia pepo Pat. causante de la llaga estrellada, constituye uno de los principales problemas fitosanitarios en cultivos perennes, como maderables y de sombrío, ya que causa la muerte de los árboles en su etapa productiva, ocasionando pérdidas económicas para el productor y dejando áreas improductivas por largo tiempo. Entre estos cultivos se encuentra la macadamia, en la cual se ha medido una incidencia entre el 5 y el 70%, comprometiendo anualmente áreas nuevas de siembra (Villegas 1996).
La enfermedad se desarrolla en forma de focos, tomando primero un pequeño número de árboles. El hongo se establece inicialmente en las raíces secundarias, razón por la cual la invasión del sistema radical es lenta pero progresiva. Una vez el hongo se establece en los tejidos del cuello del árbol, se presenta un debilitamiento y posterior amarillamiento del follaje y una ausencia de emisión de brotes nuevos; después de algunas semanas el árbol muere. Las hojas se tornan de un color rojizo y quedan adheridas por varias semanas (Villegas 1996).
El diagnóstico de la enfermedad se basa en las características de los signos del hongo en las raíces que corresponden a cordones miceliales o rizomorfos.
Las características conocidas del patógeno, tales como, fácil diseminación, el amplio rango de hospedantes, y el escaso conocimiento acerca de las características biológicas y bioquímicas, hacen que esta enfermedad sea difícil de manejar. Por tanto, es necesario generar información acerca de algunos aspectos biológicos y morfológicos que permitan de una forma acertada y confiable diseñar estrategias para un control y en este caso específico, en el cultivo de la macadamia.
El primer paso para generar dichos conocimientos sobre este patógeno es su aislamiento.
Debido a que las metodologías existentes para el aislamiento de R.. pepo no aseguran una recuperación importante del patógeno con una mínima contaminación, este estudio tuvo como finalidad ajustar una nueva metodología de aislamientos y crecimiento en medio sintético, que permitiera en primera instancia la caracterización microscópica y macroscópica, de R. pepo, estos estudios fueron corroborados con los postulados de Koch y la determinación de la concentración de inóculo infectivo.
MATERIALES Y MÉTODOS
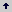
Localización. En la hacienda La Selva, corregimiento la Esmeralda, Municipio de Chinchiná localizada en el Departamento de Caldas (Colombia), a una altitud de 1.179 m, con un promedio de temperatura anual de 24 °C, precipitación acumulada anual de 1.500 mm y humedad relativa promedio del 80 % (Federación Nacional de Cafeteros, 2000), se tomaron las muestras de raíces infectadas de plantas de macadamia con R. pepo.
En los laboratorios de Fitopatología y Fisiología Vegetal del Centro Nacional de Investigación del Café (Cenicafé), se realizó el aislamiento, purificación y caracterización de R. pepo.
Aislamiento y purificación de R. pepo En árboles de la especie Macadamia integrifolia Maiden & Betche, de 8 años de transplantados al campo y que presentaban síntomas de la enfermedad, se extrajeron raíces que tenían los signos característicos del hongo (estrellas). Las raíces infectadas, se colocaron en bolsas plásticas que contenían toallas de papel humedecidas y se llevaron al laboratorio. Se utilizaron las metodologías descritas por Salazar y Aránzazu 1998 y Valencia 1996, para aislar y purificar el hongo.
Metodología de Salazar y Aranzazu (1998)[4]. Las raíces infectadas se lavaron externamente con agua corriente y jabón comercial, eliminando el exceso de humedad con toallas de papel. Paso seguido, se descortezaron y se cortaron trozos de la endodermis de 3 a 5 mm donde se presentaban los signos de la enfermedad (micelio blanco con forma de estrella). Los trozos se sumergieron en etanol del 90 % por 30 s, luego en hipoclorito de sodio al 2 % por 30 s y finalmente en agua destilada estéril por 30 s. Se secaron con papel filtro estéril y luego se sembraron cuatro trozos bajo las condiciones de cámara de flujo laminar por caja petri que contenía el medio de cultivo previamente esterilizado, extracto de malta – agar (EMA), pH 5,4 o maíz tierno – agar (MTA). En total se sembraron 60 cajas por medio de cultivo, las cuales se incubaron a temperatura ambiente, en condiciones de oscuridad permanente.
Metodología de Valencia (1996). Una vez las raíces infectadas se lavaron, descortezaron y cortaron los trozos de endodermis de 3 a 5 mm, estos se sumergieron en agua jabonosa (Teepol 1:10) por 5 min, lavando con agua corriente, luego se colocaron en hipoclorito de sodio al 1% por 5 min, peróxido de hidrógeno (H2O2) al 3 % por 5 min, y se lavaron con agua estéril. Posteriormente, se sembraron cuatro trozos por caja petri y en 60 cajas con el medio EMA pH 5,4. Las cajas se incubaron a temperatura ambiente, en condiciones de oscuridad permanente. Los tratamientos probados en este experimento se describen en la Tabla 1.
Tabla 1. Descripción de los tratamientos empleados en el aislamiento y purificación de Rosellinia pepo Pat. en raíces de macadamia.

Se utilizó un diseño experimental completamente al azar con 60 repeticiones por tratamiento; la unidad experimental consistió de una caja petri con cuatro trozos de raíz por caja. Las variables de respuesta medidas fueron: crecimiento o ausencia del micelio del hongo, a partir de cada trozo en la caja y la contaminación presente. Todas las variables para su estudio se sometieron al análisis de varianza de acuerdo con el modelo experimental especificado. La comparación de los valores promedio de las variables de respuesta a los tratamientos se hizo con la prueba múltiple de Duncan con un nivel de probabilidad del 0,05.
Caracterización morfológica del aislamiento de R. pepo.
Crecimiento radial. En el centro de una caja petri de 9 cm de diámetro con EMA, se sembró un trozo de 0,5 cm2 del mismo medio, que contenía micelio puro del hongo. Se incubó a temperatura ambiente (25–27 °C) y oscuridad permanente. Diariamente, se midió el crecimiento radial del micelio, con la ayuda de un calibrador digital (Kanon), hasta que este cubrió en su totalidad el medio; con la información del crecimiento del hongo se encontró el modelo asociado a su crecimiento a través del tiempo. Simultáneamente se determinó el color de la colonia, de acuerdo con la tabla de colores de Maerz y Paul, 1930 y la apariencia de las mismas.
Caracterización microscópica. Cuando las colonias cumplieron 30 días de sembradas, se tomaron muestras del micelio y se montaron en láminas porta objetos se midieron el largo y ancho (400X) de los hinchamientos piriformes del micelio, en micras, bajo un microscopio óptico marca Zeiss modelo Axioplan 2.
Determinación del nivel de inóculo infectivo. El hongo puro (1 cm2 de crecimiento micelial en EMA) se sembró en botellas de 370 ml de capacidad que contenían 80 g de semillas de sorgo y 20 ml de agua destilada, debidamente esterilizadas a 15 PSI, 121 °C y 15 min.
Las botellas se colocaron verticalmente y se dejaron a temperatura ambiente (25 °C – 27 °C) en la oscuridad. A los 30 días cuando el hongo cubrió completamente el sorgo, se aplicó en el suelo que contenía las plantas de macadamia de 6 meses de edad, de acuerdo con los tratamientos que se presentan en la Tabla 2.
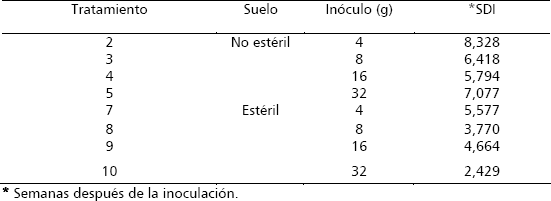
Tabla 2. Tratamientos probados en la determinación del nivel de inóculo infectivo en plantas de macadamia de 6 meses de edad.

Los sustratos utilizados en el transcurso del experimento consistieron en suelo estéril y suelo sin esterilizar. El primero se obtuvo en las instalaciones de Cenicafé y fue esterilizado en el Centro Internacional de Agricultura Tropical (CIAT, Palmira) donde se sometió a tratamiento térmico con vapor a 15 PSI, 80 °C, durante 4 horas.
Para el proceso de inoculación, se extrajeron 250 plantas de macadamia de su sustrato original (Suelo de la estación experimental Paraguaicito) y se transplantaron a raíz desnuda en bolsas plásticas con 6 kg de suelo estéril, a las cuales se adicionó 1 kg del mismo suelo mezclado con 4, 8, 16 ó 32 g de semillas de sorgo infestadas con el hongo.
Para el segundo sustrato (suelo sin esterilizar), a 250 plantas de macadamia, se les extrajo 1 kg de suelo de la parte superior, el cual se mezcló con los 4, 8, 16 ó 32 g de semillas de sorgo infestadas con el hongo, y se adicionó de nuevo a la bolsa. A la totalidad de las plantas, durante el primer mes, les fue adicionado semanalmente 500 ml de solución completa de Hoagland (Tabla 3), con el fin de contrarrestar la disminución en el suministro de los nutrimentos, ocasionado por el proceso de esterilización del suelo en la mitad de la población Se utilizó un diseño experimental completamente al azar con un arreglo factorial aumentado de 2 x 4 + 2; 2 tipos de suelo (estéril y sin esterilizar), 4 niveles de inóculo (4, 8, 16 y 32 g de semilla de sorgo infestado con el hongo), y un testigo para cada sustrato, con un total de 10 tratamientos. La unidad experimental consistió de 10 plantas de macadamia de 6 meses de edad y 5 repeticiones.
Tabla 3. Concentración de las soluciones madre y volúmenes adicionados por litro de agua, para obtener la solución completa de Hoagland, utilizada para la nutrición de plántulas de macadamia.
Durante 11 semanas se registró el número de plantas muertas en cada tratamiento y repetición. Con estos datos se calculó el área bajo la curva del desarrollo de la enfermedad (ABCDE), para cada tratamiento y repetición, utilizando la subrutina Area XFM de Sigma Plot (SPSS, Inc.), logrando incluir el tiempo transcurrido en el análisis. Para realizar el análisis de varianza, los datos se transformaron elevando al cuadrado cada valor (Área2) lo cual asegura que se cumpla el supuesto de distribución normal de cada variable medida. La comparación de respuesta media a los tratamientos se hizo con la prueba de diferencia mínima significativa (DMS) con un nivel de probabilidad del 0,05 y así mismo para determinar el efecto en la interacción suelo x inóculo. La determinación del nivel de inóculo infectivo, estuvo relacionado con la cantidad de hongo capaz de ocasionar el 80% de mortalidad en la población.
Con el fin de validar el cuarto postulado de Koch, en los tratamientos en que se presentó una mortalidad por encima del 80%, se procedió a verificar la presencia del patógeno con sus signos característicos al aislarlo nuevamente en el medio sintético seleccionado.
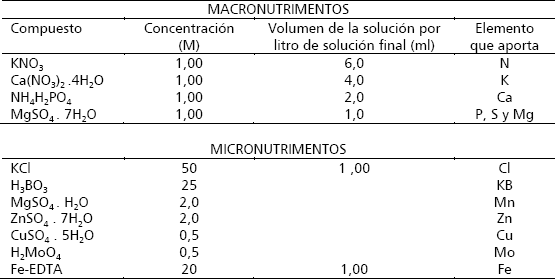
Aislamiento y purificación de R. pepo Al evaluar los métodos de aislamiento probados por Salazar y Aranzazu (1998) y Valencia (1996), se encontró que estos no permitieron purificar el hongo a causa de la proliferación de organismos contaminantes que interfieren competitivamente en el crecimiento de este. Tres días después del aislamiento y siembra en los medios de crecimiento EMA y MTA, se observó crecimiento de R. pepo del 15 %, 12 % y 0 %, presentándose contaminación con otros microorganismos del orden de 20 %, 23 % y 30 % respectivamente (Figura 1).
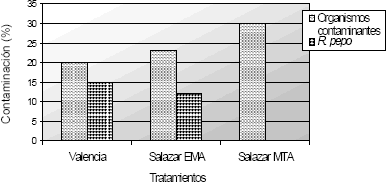
Figura 1. Desarrollo de microorganismos contaminantes con relación al crecimiento de Rosellinia pepo Pat. a los 3 días de evaluación de raíces de macadamia con los métodos de aislamiento.
A los cinco días se presentó contaminación del 100% en todos los medios de cultivo, impidiendo el crecimiento normal del hongo de interés (Figura 2). Cabe anotar que en la metodología de Salazar (MTA) el porcentaje de contaminación es menor (73,3 %), debido a que el 26,7% restante corresponde a cajas donde no hubo ningún tipo de crecimiento. La presencia de bacterias principalmente del tipo gram negativas, ocasionaron la mayor competencia, impidiendo el crecimiento adecuado del hongo.
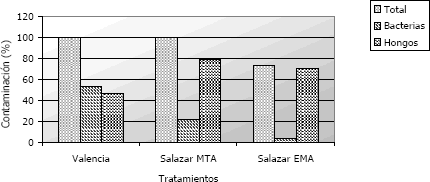
Figura 2. Desarrollo de microorganismos contaminantes para las metodologías empleadas en el aislamiento de Rosellina pepo Pat. a los 5 días de evaluación.
Tal como se presenta en la Figura 2, la contaminación con este tipo de microorganismos fue 53,33 %, 21,25 % y 3,33 %. Naturalmente se ha encontrado que las bacterias del tipo Pseudomona fluorescentes, presentan gran antagonismo con este patógeno, siendo un controlador biológico con alto potencial contra este hongo.
Los hongos contaminantes que se identificaron a nivel de género fueron Aspergillus sp., Fusarium sp., Penicillium sp., Rhizopus sp. y Trichoderma sp. (Figura 3). Es de interés anotar que los hongos de los géneros Fusarium sp., Penicillium sp. y Rhizopus sp., se encontraron en los dos medios, independiente de la metodología de aislamiento aplicada, mientras Trichoderma sp. únicamente se presentó en el medio EMA bajo el método de aislamiento de Salazar.
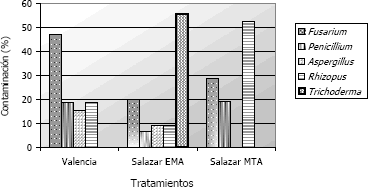
Figura 3. Géneros de hongos contaminantes encontrados de acuerdo con los métodos empleados para el aislamiento de Rosellinia pepo Pat. en raíces de macadamia.
Para el caso particular de esta investigación, los resultados iniciales muestran que al utilizar los métodos probados por Salazar y Aranzazu 1998 y Valencia 1996, para el aislamiento y purificación de R. pepo no lo permiten, a causa de la proliferación de microorganismos contaminantes que interfieren competitivamente con el crecimiento de éste, dado que el suelo de forma natural es un medio propicio para el crecimiento de diversos microorganismos, el aislamiento de uno de ellos no siempre se realiza con éxito.
La presencia de los microorganismos habituales del suelo Aspergillus sp., Fusarium sp., Penicillium sp., Rhizopus sp. y Trichoderma sp., como contaminantes en diversas proporciones, es concordante con los resultados obtenidos por otros investigadores al tratar de aislar Rosellinia sp. (Cienfuegos et al. 1997). La presencia de Trichoderma sp. como contaminante y en el cual ha sido demostrada su capacidad antagónica con Rosellinia bunodes (Castro 1994, Esquivel 1991, Ruiz 1993), indica que en posteriores investigaciones se podría dilucidar si su papel como antagonista se extiende a R. pepo.
Al considerar la gran contaminación que se presentó al utilizar los métodos anteriores, se procedió a desarrollar una metodología que permitiera el aislamiento del hongo, con el mínimo de contaminantes, la cual se describe a continuación:
- Una vez se ubica el árbol con los síntomas y signos de la enfermedad se extraen y escogen las raíces secundarias y terciarias que presenten micelio joven en rizomorfo (signos del hongo), el cual se caracteriza por formar estrellas o abanicos de color blanco. En la medida que el rizomorfo envejece, la estrella es de color amarillento y hay mayor probabilidad de tener contaminantes bacterianos al momento de su aislamiento y cultivo en medio sintético.
- Las muestras se guardan en bolsas plásticas con toallas de papel humedecidas con agua destilada.
- De forma rápida se llevan al laboratorio y se procesan para evitar el crecimiento de organismo contaminantes.
- Las raíces se lavan externamente con agua corriente y jabón comercial (Joyasal XT) procurando eliminar todo el suelo adherido a ellas.
- Se colocan en Hipoclorito de Sodio al 2 % por 5 min.
- Se colocan en agua jabonosa (Joyasal XT), en proporción 1:10, por 5 min.
- Se lavan con abundante agua destilada.
- La raíz se descorteza cuidadosamente en la cámara de flujo laminar y se cortan trozos de la endodermis que presentan el micelio de color blanco en forma de estrella.
- Se siembran cuatro trozos en el medio de crecimiento extracto de malta agar EMA (Oxip, CM59); 50 g l-1, Cloranfenicol 0,03 % y se titula a pH 6,0 con HCl 1N.
- Las cajas petri, se colocan en la oscuridad y a temperatura ambiente.
Con el método desarrollado se encontró que el 8,75% de los trozos sembrados, presentaron contaminación a los 5 días de evaluación (Figura 4), de tal manera que en el 91,25 % de los casos el hongo creció en estado puro.
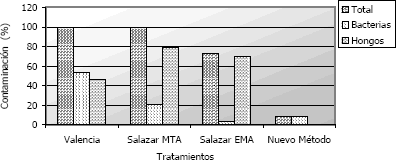
Figura 4. Contaminación por microorganismos utilizando la nueva metodología en comparación con los métodos evaluados para el aislamiento de Rosellinia pepo Pat. en raíces de macadamia.
El desarrollo de la nueva metodología para el aislamiento y purificación de R. pepo, ampliamente probada en el transcurso del experimento, permitió lograr este propósito debido a la eliminación de los agentes contaminantes que se encuentran presentes principalmente en el exterior de la corteza y en combinación con el suelo adherido a las raíces. De otra parte, se aprovechó la característica relacionada con su hábitat natural de crecimiento, entre la corteza y la endodermis, que le brinda condiciones de aislamiento y le permiten crecer sin la interferencia de otros microorganismos (Aranzazu 1996), lo cual se utilizó en la nueva metodología.
El método fue utilizado en varias oportunidades durante el desarrollo de la investigación, e incluso se empleó en el aislamiento y purificación de Rosellinia bunodes, obteniendo resultados similares a los de Castro y Esquivel 1991.
Caracterización macroscópica y microscópica de R. pepo.
Crecimiento radial del hongo. El crecimiento radial de R. pepo en EMA fue de 4,68 mm dia-1, de tal forma que transcurrieron 9,6 días aproximadamente para el cubrimiento total de la superficie del medio. El modelo que mejor explica el crecimiento del hongo a través del tiempo es de tipo lineal (p < 0,0001) (Figura 5), el cual es característico cuando se dispone de una base alimenticia abundante y suficiente en carbohidratos. El crecimiento radial de R. pepo fue superior al de otros hongos estudiados como: Cercospora coffeicola (1,74 mm día-1) (Rengifo y Leguizamón 2000) e inferior a Rhizoctonia solani (38,4 mm día-1) (Gaitán y Leguizamón 1992) y Trichoderma sp. (27,8 mm día-1) (Ruíz 1993). Sin embargo, se observa que es similar a la encontrada por Cárdenas 1997, para R. bunodes (5,7 mm dia-1).
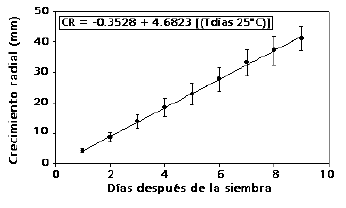
Figura 5. Tasa de crecimiento radial de Rosellinia pepo Pat. en raíces de macadamia. CR = Crecimiento Radial (mm), T = tiempo en días después de la siembra. r2 = 0.99 p <0.0001.
Caracterización de la colonia. En el medio de crecimiento EMA, inicialmente el micelio de las colonias de R. pepo, fue de color blanco, a medida que éste micelio crecía y cubría la mayor parte de la superficie del medio, se tornaba de color gris ahumado a café o negro al final. El micelio de las colonias desde su inicio fue de aspecto algodonoso, pero a medida que envejecía se volvió de consistencia quebradiza (Figuras 6 y 7). También se observó la presencia de sectores que se diferenciaban unos de otros en el color y la apariencia, formando halos concéntricos blancos sobrepuestos al micelio negro igual a las descripciones realizadas por Fernández y López 1964 (Figura 8 A), y a los 20 y 25 días se observó la presencia de micelio blanco en forma de estrellas en el lado interior del medio sintético (Figura 8 B), lo cual permite confirmar que efectivamente es R. pepo, al coincidir esta misma característica con la observada in situ.
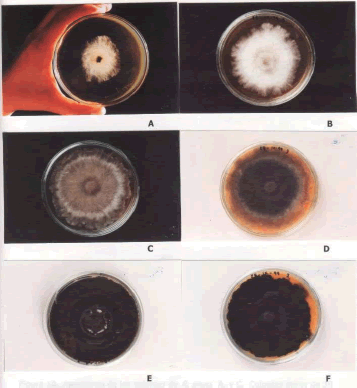
Figura 6. Apariencia y color de las colonias de Rosellinia pepo Pat. a través del tiempo. en raíces de macadamia. A. 3 días; B. 5 días; C. 7 días; D. 9 días; E. 15 días; F. 25 días.

Figura 7. Apariencia de las colonias de R. pepo obtenidas en raíces de macadamia. A y C colonias puras a los 30 días de siembra con apariencia algodonosa. B. Colonias puras a los 5 días de la siembra.
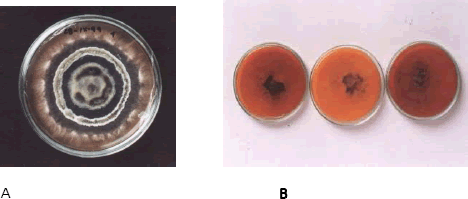
Figura 8. Crecimiento de Rosellinia pepo Pat. en raíces de macadamia. A. Colonia con halos concéntricos de micelio de color blanco. B. Estrellas de color blanco (características del hongo) formados en el lado interno del medio sintético EMA.
Además permite diferenciarlo de otros miembros del género como es el caso de R. bunodes.
Caracterización microscópica. La observación microscópica permitió determinar la presencia de los hinchamientos piriformes característicos del patógeno en colonias de 30 días de la siembra.
Los hinchamientos presentan varios tamaños que van de 72 mm a 360 mm, con un promedio de 106,4 mm de largo y de 53 mm a 112 mm, con 75,3 mm de promedio de ancho, así la proporción Ancho: Largo (A:L) promedia fue de 1:1,5. Los hinchamientos piriformes coinciden con los descritos por Sarasola (1975). Con la medición de estos hinchamientos se hace un aporte al conocimiento de la morfología del estado vegetativo de esta especie, complementando lo realizado por Bermúdez y Carranza 1992, quienes escribieron en forma detallada los sinemas formados por Dematophora sp.
Pruebas de patogenicidad. En la primera semana de evaluación las plantas no presentaron síntomas aéreos en algún tratamiento, sin embargo, en los tratamientos E + 8 g, E + 16 g y E + 32 g se observó el micelio del hongo de color gris ahumado, invadiendo el cuello de las plantas.
Para la segunda semana, en los tratamientos E + 4 g, E + 8 g; E + 16 g y E + 32g se presentó sobre la superficie del suelo un micelio muy escaso, casi imperceptible con hifas entrelazadas entre sí; de igual forma para está semana se observaron los primeros síntomas aéreos de la enfermedad en los tratamientos antes mencionados con un número de plantas muertas en promedio de 0,2; 2,4; 3,6; y 6,6, respectivamente (Tabla 4).
Tabla 4. Progreso de la llaga estrellada en plantas de macadamia. Promedio de plantas muertas ± el error estándar, causada por Rosellinia pepo Pat.
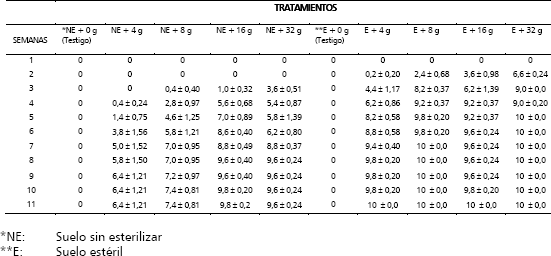
En la tercera semana, todas las plantas infectadas con el hongo mostraban micelio de color gris ahumado sobre la superficie a la altura del cuello; en esta semana, se presentaron los primeros síntomas de la enfermedad para los tratamientos NE + 8 g (0,4); NE + 16 g (1,0) y NE + 32 g (3,6) y a la cuarta semana en el tratamiento NE + 4 g (0,4) (Tabla 4). Al cabo de 11 semanas de evaluación, la totalidad de las plantas (10) de cada uno de los tratamientos que se encontraban en suelo estéril, independiente de la cantidad de inóculo utilizado, murieron, mientras que en el suelo sin esterilizar, se encontraban plantas vivas en diferentes proporciones de acuerdo con la cantidad de inóculo aplicado, así para NE + 4 g, NE + 8 g, NE + 16 g y NE + 32 g el número promedio de plantas muertas fue de 6,4; 7,4; 9,8 y 9,6 respectivamente (Tabla 4, Figura 9).
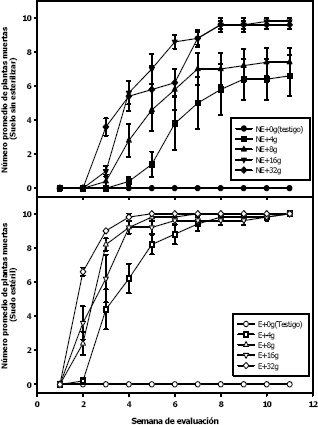
Figura 9. Curvas del progreso de la llaga estrellada causada por Rosellinia pepo Pat. en plantas de macadamia en los diferentes tratamientos hasta las 11 semanas de evaluación.
En la semana 12, se procedió a reaislar el patógeno con el fin de verificar el último postulado de Koch. En general, todas las plantas muertas presentaban micelio en su sistema radical. Las plantas inoculadas con 4, 8 y 16 g de semillas de sorgo infectado con R. pepo presentaban micelio de color gris ahumado y algunas hifas de color blanco brillante mientras que las plantas inoculadas con 32 g de semillas de sorgo infectadas, presentaban una capa espesa de micelio y suelo adherida a la corteza.
Debajo de la corteza de la raíz primaria y del cuello, se observaron arreglos miceliales de color blanco, los cuales surgen de un punto central y se abren en forma radial a manera de estrella en diferentes tamaños. Al hacer un corte transversal a la raíz primaria, se observaron líneas de color blanco (hifas) penetrando el tejido interno a lo largo de los radios medulares y los cuales contrastaban con el color negro del tejido.
Al aislar nuevamente el hongo de las plantas inoculadas e infectas con R. pepo, se observó que la colonia presentaba las mismas características morfológicas encontradas anteriormente, lo que determinó que R. pepo es la causa de la llaga estrellada en la macadamia.
Determinación del nivel de inóculo infectivo. La muerte de la planta, determinada cuando el 80 % de la población presentaba secamiento por la enfermedad en el transcurso del tiempo, independiente del tipo de suelo (estéril ó sin esterilizar) y de la cantidad de inóculo adicionado, presentó una curva de crecimiento clásica de tipo sigmoidal representada en la siguiente ecuación:

en donde,
A=Asíntota
B=Pendiente
T=Tiempo
Xo= Parámetro
Los parámetros del modelo de mejor ajuste se presentan en la Tabla 6.
Tabla 6. Parámetros del modelo que describen el comportamiento de la enfermedad llaga estrellada, mediante la variable número de plantas muertas de macadamia, a través del tiempo.
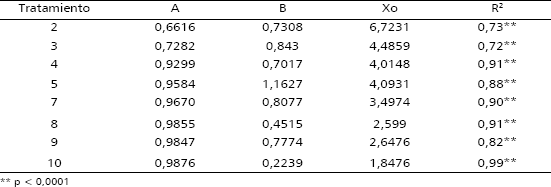
Tabla 7. Tiempo en semanas asociado al 80% de plantas de macadamia muertas para cada nivel de inóculo de Rosellinia pepo Pat. y condición del suelo.
El análisis estadístico mostró diferencias significativas entre los sustratos estudiados, independiente del tratamiento, lo cual se observa en los valores superiores del Área bajo la Curva de Desarrollo (ABCDE) en el suelo sin esterilizar (Figura 10). Así, el ABCDE aumentó en la medida que se incrementó la cantidad de inóculo, de tal forma que 32 g de inóculo no solo causaron la mayor mortalidad de las plantas sino que además lo hicieron en el menor tiempo.
La interacción inóculo x suelo no fue significativa, lo que indica que independiente de la concentración de inóculo que se utilice, la mortalidad de las plantas siempre va a ser mayor en el suelo estéril que en el suelo sin esterilizar.
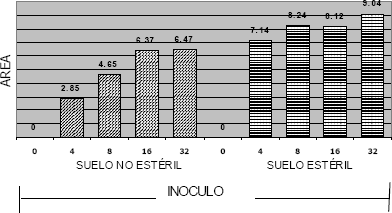
Figura 10. Área bajo la curva de desarrollo de la enfermedad (ABCDE) en los diferentes tratamientos empleados para evaluar la llaga estrellada en macadamia.
Los modelos obtenidos, también permitieron determinar para cada nivel de inóculo y condición de suelo, el tiempo asociado con el 80% de muerte de las plantas (Tabla 7).
El resultado indica que hay una relación directamente proporcional entre la cantidad de inóculo adicionado y el tiempo que transcurre para obtener el 80% de las plantas muertas, es decir, que al aplicar 32 g de inóculo en plantas sembradas en suelo estéril, aproximadamente a las 2 semanas se obtiene una mortalidad del 80 %, de igual forma al adicionar la misma cantidad de inóculo en plantas sembradas en suelo sin esterilizar, se alcanzó el mismo porcentaje pero a las 7 semanas.
AGRADECIMIENTOS
Al señor José Fernando Gutiérrez, propietario de la hacienda La Selva, lugar donde se tomaron las muestras del hongo. A Dariel Vallejo por su valiosa colaboración en el campo.
Aranzazu, H. F. 1996. Comportamiento de la llaga estrellada Rosellinia pepo Pat. sobre raíces vivas y muertas. En: Fitopatología Colombiana. Vol. 20, no. 1-2; p. 7-10. [ Links ]
Bermúdez, M. y Carranza, M. J. 1992. Estado anamórfico de Rosellinia bunodes (Berk. y Br.) Sacc. y Rosellinia pepo Pat. (Ascomycotina: Xylariaceae). En: Revista de Biología Tropical. Vol. 40, no.1; p. 43-46. [ Links ]
Cárdenas, J. 1997. Efecto de pseudomonas fluorescentes sobre Rosellinia bunodes (Berk y Br.) Sacc. en plantas de café. Turrialba, Costa Rica. 86 h. Tesis: Magister en Fitopatología. Centro Agronómico Tropical de Investigación y Enseñanza (CATIE). [ Links ]
Castro, C. B .L. 1994. Control biológico de patógenos del suelo. Chinchiná: CENICAFÉ, 1 p. [ Links ]
Castro, C. B. L. y Esquivel, R. V. H. 1991. Las llagas radicales del cafeto. En: Avances Técnicos Cenicafé. No. 163; p. 1- 4. [ Links ]
Cienfuegos, R. E. y Ramírez, A. R. 1997. Características de la problemática de los hongos del suelo en condiciones de campo en cafetales establecidos. p. 281-286. En: XVIII Simposio Latinoamericano sobre Caficultura (18: 1997: San José, (Costa Rica) Memorias. San José: ICAFE-IICA-PROMECAFE. [ Links ]
Esquivel, R. V. H. 1991. Búsqueda y evaluación de aislamientos de Trichoderma para el control biológico de la llaga negra radicular del café. Bogotá. 83 h. Trabajo de grado Ingeniero Agrónomo. Universidad Nacional de Colombia. Facultad de Ciencias Agropecuarias. [ Links ]
Federación Nacional de Cafeteros de Colombia. 2000. Anuario Meteorológico Cafetero 2000. Chinchiná: CENICAFÉ. 524 p. [ Links ]
Fernández, B. O. y López, S. 1964. Llagas radiculares negras (Rosellinia bunodes) y estrellada (Rosellinia pepo) del cafeto. Parte I. Patogenicidad e influencias de la clase de inóculo en la infección. En: Revista Cenicafé. Vol. 15, no. 3; p. 126-144. [ Links ]
Gaitán, B. A. L. y Leguizamón, C. J. E. 1992. Biología y patogénesis de Rhizoctonia solani en café. En: Revista Cenicafé. Vol. 45, no. 1; p. 14-24. [ Links ]
Maerz, A. y Paul, M. R. 1930. Dictionary of color. New York: McGraw-Hill, 207 p. [ Links ]
Rengifo, G. A. G. y Leguizamón, C. J. E. 2000. Algunos aspectos biológicos de Cercospora coffeicola Berk y Cooke. p. 6-7. En: XXI Congreso de la Asociación Colombiana de Fitopatología y Ciencias Afines (21: 2000: Palmira, Colombia). Memorias. Palmira: ASCOLFI-CIAT. [ Links ]
Ruíz, S. L. L. 1993. Estudios de la biología de cepas de Trichoderma spp. y su posibilidad de utilización en el control integrado de la llaga negra radical del café [Rosellinia bunodes Berk y Br. (Sacc)]. En: XIV Congreso de la Sociedad Colombiana de Fitopatología y Ciencias Afines (14: Santa Marta, Colombia). Memorias. Santa Marta: ASCOLFI. [ Links ]
Salazar, M. y Aranzazu, F. 1998. Metodología empleada para aislar Rosellinia pepo. Manizales: Corpoica, (Comunicación personal). [ Links ]
Sarasola, A. 1975. Fitopatología micosis. Buenos Aires: Hemisferio Sur. v. 2. p. 229 –242. [ Links ]
Valencia, C. M. 1996. Estudios del antagonismo de Pseudomona spp. fluorescentes a Rosellinia bunodes (Berk y Br.) Sacc. Manizales. 62 h. Trabajo de grado Bacteriología. Universidad Católica. Facultad de Bacteriología. [ Links ]
Villegas, G. C. 1996. Enfermedades de la macadamia en la zona cafetera central. En: Avances Técnicos Cenicafé. No. 228; p. 1-7. [ Links ]














