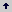Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Facultad Nacional de Agronomía Medellín
Print version ISSN 0304-2847
Rev. Fac. Nac. Agron. Medellín vol.60 no.1 Medellín Jan./June 2007
EFECTO ANTIALIMENTARIO DE LOS EXTRACTOS DE SUSPENSIONES CELULARES DE Azadirachta indica SOBRE Spodoptera frugiperda J. E. Smith EN CONDICIONES DE LABORATORIO
ANTIFEEDANT EFFECT OF CELL SUSPENSION EXTRACTS OF Azadirachta indica ON Spodoptera frugiperda J. E. Smith UNDER LABORATORY CONDITIONS
Jacqueline Capataz Tafur1; Fernando Orozco Sánchez2; Rodrigo Vergara Ruiz3 y Rodrigo Hoyos Sánchez4
1 Ingeniera Química. Auxiliar de Investigación. Universidad Nacional de Colombia, Sede Medellín. Facultad de Ciencias. A.A. 3840, Medellín, Colombia. <jcapata@ unalmed.edu.co>
2 Profesor Asistente. Universidad Nacional de Colombia, Sede Medellín. Facultad de Ciencias. A.A. 3840, Medellín, Colombia.<feorozco@unal.edu.co>
3 Profesor Asociado. Universidad Nacional de Colombia, Sede Medelín, Facultad de Ciencias Agropecuarias. A.A. 1779, Medellín, Colombia. <rvergara@unalmed.edu.co>
4 Profesor Asociado. Universidad Nacional de Colombia, Sede Medelín, Facultad de Ciencias Agropecuarias. A.A. 1779, Medellín, Colombia. <rhoyos@unalmed.edu.co>
Recibido: Junio 20 de 2006; aceptado: Febrero 28 de 2007.
RESUMEN
Los extractos de neem (Azadirachta indica) y sus ingredientes activos como la azadiractina, presentan acción antialimentaria e inhibición del desarrollo de muchos insectos. El objetivo de este estudio fue examinar el efecto antialimentario de los extractos de suspensiones celulares de neem elicitadas a diferentes condiciones de luz y temperatura. Los extractos fueron aplicados en discos de hojas de maíz y sometidas a bioensayos en larvas de segundo instar de Spodoptera frugiperda J. E. Smith (Lepidptera: Noctuidae). Los extractos intracelulares y del medio de cultivo de las suspensiones celulares de A. indica mostraron efecto biológico sobre larvas de S. frugiperda L2, con valores del 100 % de índice antialimentario para los extractos intracelulares de suspensiones de A. indica elicitadas a 15 °C y oscuridad, y del 39,3% para extractos extracelulares (medio de cultivo) de suspensiones elicitadas a 35 °C y oscuridad.
Palabras claves: Azadirachta indica, azadirachtina luz, temperatura, Spodoptera frugiperda.
ABSTRACT
Extracts of neem (Azadirachta indica) and their active ingredients as azadirachtin, present an action and inhibition of the development of many insects. In this study, the antifeedant effect of cell suspension extracts elicited to different conditions of light and temperature was examined. The extracts were applied in corn leaves disks and submitted to bioassays in larvae of second instar of Spodoptera frugiperda J. E. Smith (Lepidoptera: Noctuidae). The intracellular extracts and the culture media (supernatant) of the cell suspensions of A. indica showed a biological effect on larvae of S. frugiperda L2, with values of the 100 % of antifeeding index for the intracellular extracts of cells elicited to 15 °C and darkness, and 39,3% of antifeeding index for extracellular extracts (medium of cultivation) of elicited suspensions to 35°C, and darkness.
Key words: Azadirachta indica, azadirachtin, light, temperature, Spodoptera frugiperda.
 MATERIALES Y MÉTODOS
MATERIALES Y MÉTODOS
 RESULTADOS Y DISCUSIÓN
RESULTADOS Y DISCUSIÓN
 CONCLUSIONES
CONCLUSIONES
 PERSPECTIVAS
PERSPECTIVAS
 AGRADECIMIENTOS
AGRADECIMIENTOS
 BIBLIOGRAFÍA
BIBLIOGRAFÍA
El gusano cogollero del maíz Spodoptera frugiperda J. E. Smith (Lepidóptera: Noctuidae), es una especie polifitófaga nativa del trópico con amplia distribución geográfica, desde Argentina y Chile hasta el sur de Estados Unidos. Prefiere hojas y brotes tiernos, especialmente los cogollos (Sosa 2002). Entre los cultivos atacados se encuentran arroz, maíz, algodón, sorgo, trigo, avena, caña de azúcar, pastos, ajonjolí, soya, tabaco, plantas hortícolas, ciprés, papa, berenjena, crisantemo, y muchas más (Gallego 1946, Vélez 1997). Es la plaga de mayor importancia económica en muchos cultivos de Colombia, que muestra mayor preferencia por el cultivo del maíz, actuando como gusano tierrero trozador de plántulas, perforador de fruto y como cogollero que es su hábito más característico (Negrete y Morales 2003), alcanzando poblaciones tan altas que pueden causar daños con un índice del 10% de plantas trozadas (García 1996).
La aplicación de insecticidas contra el estado larval del gusano cogollero es el principal método de control, pero la alta tolerancia a la mayoría de insecticidas y problemas ambientales asociados pueden comprometer su uso continuado (Greenberg, Showler y Liu 2005). Los productos botánicos son herramientas alternativas útiles y deseables en la mayoría de los programas de manejo de plagas porque pueden ser eficaces y complementar a menudo las acciones de los enemigos naturales (Schmutterer 1990).
Los extractos del neem (Azadirachta indica A. Juss, familia Meliaceae) son ampliamente explotados para su uso contra una amplia variedad de insectos. En particular el triterpeno azadiractina y sus derivados, presentan efecto antialimentario, repelente, insecticida, regulador del crecimiento y son causantes de esterilidad en hembras adultas (Allan et al. 2002, Schmutterer 1990). Sin embargo, su compleja estructura química hace difícil su producción comercial mediante síntesis química. Así, el suministro de insecticidas elaborados a partir de neem depende de la extracción de las semillas, las cuales son difíciles de obtener en la cantidad y calidad necesarias para asegurar el alto contenido de azadiractina. Las técnicas del cultivo de tejidos vegetales in vitro y de suspensiones celulares de neem, han sido desarrolladas y estudiadas como métodos alternativos para la síntesis del producto (Zounos, Allan y Mordue 1999).
El objetivo de este estudio fue el de investigar y determinar la capacidad de las suspensiones celulares de A. indica para la producción de azadiractina sometidas a condiciones de elicitación de régimen de luz y temperatura. Para esto se realizó el análisis químico de los extractos de las suspensiones y se evaluó su actividad biológica mediante bioensayos de escogencia en larvas de segundo instar de S. frugiperda.
Suspensiones celulares de A. indica. Las suspensiones fueron iniciadas a partir de callos friables de ocho (8) semanas de edad provenientes de explantes de hojas juveniles, suministrados por el Laboratorio de Crecimiento y Desarrollo de las Plantas (Universidad Nacional de Colombia, Sede Medellín). 500 mg de callos friables fueron transferidos en forma aséptica a erlenmeyers de 250 mL con 50 mL del mismo medio utilizado para la inducción de los callos pero sin agente gelificante. El medio de cultivo consistió de sales básicas Murashige & Skoog 962, con orgánicos mínimos (MSMO, Sigma M6899), suplementado con 4 mg/L de ácido indol butírico (IBA), 1 mg/L de 6-benzil amino purina (BAP) y 3 % (p/v) de sacarosa, ajustado a un pH de 5,8 (Kearney et al. 1994). Los cultivos fueron incubados en un agitador orbital a 25 °C ± 1 °C y 120 rpm en condiciones de oscuridad. El subcultivo fue realizado cada 21 días en el mismo medio descrito anteriormente.
Diseño experimental. Se adoptó un diseño experimental multinivel factorial 3 x 2 completamente al azar para estudiar los efectos de temperatura ( 15 °C y 35 °C) y del régimen de luz (luz continua, 12 h luz / 12 h oscuridad y oscuridad completa) en las suspensiones se A. indica. Los experimentos fueron realizados en enlemenyer de 100 mL con 20 mL de medio de cultivo y utilizando un inóculo del 20 % v/v a 120 rpm durante 15 días. Se tomaron muestras cada tercer día para evaluar el crecimiento celular (datos no mostrados) y el efecto antialimentario de los extractos intra y extracelulares del cultivo. El efecto de los diferentes tratamientos se analizó estadísticamente mediante análisis de varianza (ANAVA). Los experimentos fueron realizados por duplicado.
Obtención de los extractos intra y extracelulares de la suspensiones de A. indica. La extracción de los metabolitos intra y extracelulares de los cultivos de A indica en medio líquido se realizó con disolventes orgánicos polares a partir de la biomasa celular y del medio de cultivo (sobrenadante), los cuales fueron separados mediante filtración al vacío. Para la obtención de los extractos intracelulares, 5 g de biomasa seca fue macerada y extraída con metanol, CH3OH (3 x 10 mL); los extractos fueron combinados y concentrados al vacío en un rotoevaporador R-3000 Büchi por debajo de 45 °C hasta sequedad; se adicionaron 10 mL de agua destilada más 1 mL de cloruro de sodio (NaCl 5 % p/v) y se extrajo con diclorometano, CH2Cl2 (3 x 10 mL).
Las fases acuosas fueron descartadas y las capas de diclorometano se combinaron y se secaron con sulfato de magnesio (MgSO4) para retirar el exceso de agua. Los extractos intracelulares se rotoevaporaron nuevamente hasta sequedad y fueron redisueltos en 2 mL de metanol HPLC y almacenados a -4 °C (Balaji et al. 2003, Dai et al. 1999, Giraldo et al. 2002, Mordüe y Blackwell 1993, Schaaf et al. 2000).
El volumen del medio de cultivo libre de células fue medido y una parte de medio fue mezclado con 0,25 partes de diclorometano en un embudo de separación y agitado por un minuto. Después la fase de diclorometano fue removida. Este procedimiento se realizó 3 veces y todas las fracciones de diclorometano fueron combinadas y el exceso de agua fue removido utilizando MgSO4 el cual fue retirado por filtración. Los extractos extracelulares fueron rotoevaporados al vacío por debajo de 45°C y resuspendidos en 2 mL de metanol HPLC y almacenados a -4 °C (Mordüe y Blackwell, 1993).
Cromatografía líquida de alta resolución (HPLC). Los extractos fueron analizados en una columna Supelcosil LC-18 RP-HPLC ( 10 cm. x 4,6 mm D.I, diámetro de poro 5 mm, Merck, Alemania). Se utilizó como fase móvil acetonitrilo-agua (40:60) a una velocidad de flujo de 0,7-mL min.-1, inyectando 10 mL de cada solución estándar de azadiractina y de los extractos. La cuantificación de azadiractina fue realizada a 218 nm utilizando un detector de arreglo de diodos UV visible Agilent G1315B (Giraldo et al. 2002, Schaaf et al. 2000).
Insectos. Para los bioensayos, las larvas de S. frugiperda fueron suministradas por el Laboratorio de Control Biológico de la Universidad Nacional de Colombia, Sede Medellín, las cuales fueron alimentadas con hojas de maíz (Zea mays). Las larvas fueron mantenidas a 27 ± 2 °C, condiciones de fotoperíodo de 12 h : 12 h – luz : oscuridad y 65 % humedad relativa promedio.
Bioensayos de escogencia. Las evaluaciones de los extractos intra y extracelulares se realizaron de acuerdo con la metodología reportada por Blaney et al. 1990. Se utilizaron larvas de S. frugiperda de segundo instar (L2) las cuales fueron dejadas sin alimentación durante 3 horas antes del bioensayo. Luego se colocaron individualmente dentro de cajas de Petri de 8,5 cm. de diámetro con una capa de agar 1,0 % p/v, en la que habían dos discos de hojas de maíz con un área de 2,25 cm2. Uno de los discos no fue inoculado con los extractos, actuando como control y el disco del tratamiento recibió 50 µL de los extractos. Previamente se evaluó el efecto del disolvente para descartar su efecto en la alimentación de los insectos y de 50 µL de azadiractina 1,5 ppm en metanol como control positivo de los ensayos. El efecto antialimentario de los bioactivos (E.A.A) se calculó mediante la fórmula propuesta por Kearney et al. 1994 y Blaney et al. 1990.
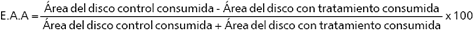
Los bioensayos fueron finalizados a las 24 h. El área consumida fue cuantificada con un medidor de área foliar LI-3000A Portable Leaf Area Meter (Li-Cor, USA),
Efecto antialimentario de los extractos intra y extracelulares a condiciones de 25 °C y oscuridad (control). El efecto antialimentario producido por los extractos es altamente variable en las distintas especies de plagas; aún para aquéllas donde la supresión de la alimentación aparece como una contribución principal para la protección de los cultivos, la respuesta puede ser alcanzada a partir del efecto tóxico postingestivo en vez de un comportamiento directo (Isman 2002). En el caso de larvas de S. frugiperda L2, los bioensayos realizados con extractos intracelulares de A. indica cultivados a 25 °C y oscuridad, mostraron un alto porcentaje de efecto antialimentario (Figura 1), sugiriendo que compuestos antialimentarios son producidos durante el crecimiento celular. Entre el día 3 se obtuvo un E.A.A del 70 % incrementándose hasta 99 % el día 15 de cultivo. Mordüe y Blackwell 1993, reportaron que el efecto antialimentario de extractos etanólicos de suspensiones celulares de A. indica cultivadas a 25 °C y oscuridad, en ninfas de S. gregaria se incrementó significativamente entre los días 7 y 10 de 26,7 % a 55,1 %. Extractos de líneas celulares de callos y de suspensiones celulares de A. indica presentaron un alto E.A.A sobre Schistocerca gregaria, utilizando el mismo medio de cultivo de esta investigación (Kearney et al. 1994). En su estudio, el E.A.A de los extractos de las suspensiones celulares de A. indica se incrementó significativamente entre los días 14 y 24 del cultivo.
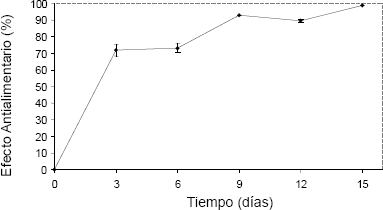
Figura 1. Índice antialimentario de los extractos celulares de Azadirachta indica a 25°C oscuridad, sobre larvas de Spodoptera frugiperda.
En este estudio, los extractos de los días 9 y 12 de incubación obtenidos del medio de cultivo, mostraron un efecto sobre las larvas de S. frugiperda (Figura 2), a pesar de las pequeñas concentraciones de azadiractina detectada (0,03 mg/L – 0,56 mg/L) y alcanzándose un máximo de 35 % de dicho efecto en el día 9. Los extractos extracelulares obtenidos por Mordüe y Blackwell 1993, tuvieron efecto un efecto antialimentario en ninfas de S. gregaria incrementándose 20 veces entra los días 5 y 10 del cultivo. En esta investigación se observó un incremento en el E.A.A entre los días 6 y 9 de cultivo.
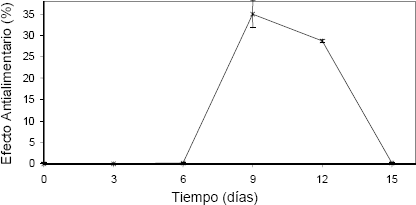
Figura 2. Índice antialimentario del medio de cultivo de Azadirachta. indica a 25°C y oscuridad, sobre larvas de Spódoptera frugiperda.
Efecto antialimentario de los extractos intra y extracelulares de suspensiones de A. indica obtenidos bajo diferentes condiciones de luz y temperatura. Los extractos intra y extra celulares de las suspensiones de A. indica bajo las condiciones de elicitación abiótica fueron evaluados en larvas de S. frugiperda L2 (Figura 3). La evaluación antialimentaria de los extractos se realizó después de haber transcurrido una hora de ser aplicado el extracto. El efecto observado varió en los tratamientos, desde una alta preferencia de los lepidópteros a aposentarse sobre los discos de hojas control hasta un total rechazo de los discos con extractos. En general, el efecto repelente prevaleció durante todo el ensayo aunque en algunos casos se notó una mayor ingesta al comienzo de los bioensayos disminuyendo hacia el final del experimento, a pesar de que sólo se realizó una aplicación del extracto previo a la exposición de las larvas al material.
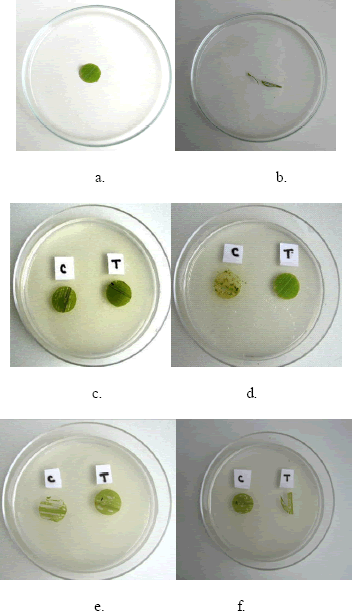
Figura 3. Respuesta antialimentaria de los extractos de Azadirachta indica en larvas de Spodoptera frugiperda L2, a. Control azadirachtina grado reactivo (1.5 ppm). b. Control hoja de maíz sin extracto c. Biomasa a 15 °C - oscuridad, día 9. d. Medio de cultivo a 35°C - oscuridad, día 6. e. Biomasa a 35°C - fotoperíodo, día 6. f. Medio de cultivo a 15 °C - oscuridad, día 6. C: control y T: tratamiento.
Los extractos intracelulares de las suspensiones de A. indica bajo los efectos de luz y temperatura mostraron un alto porcentaje de E.A.A en larvas de segundo instar (L2) de S. frugiperda, alcanzándose un valor del 100 % con extractos obtenidos a condiciones de 15 °C - oscuridad en el día 9 de cultivo (Figura 4). En este mismo día de cultivo, los tratamientos de 15 ºC - luz continua, 25 ºC - oscuridad, 35 ºC - luz continua y 35 ºC - oscuridad obtuvieron valores de 99,1; 93,0; 98,6 y 99,1 % de E.A.A respectivamente. Las suspensiones celulares de A. indica presentaron un contenido intracelular de azadiractina entre 0,15 mg/l - 27,31 mg/l; con valores promedio de 4,99 mg/l de azadiractina a 15 ºC, 1,64 mg/l a 35 ºC y de 4,25 mg/l y 3,58 mg/l de azadiractina a condiciones de oscuridad total y luz continua respectivamente.
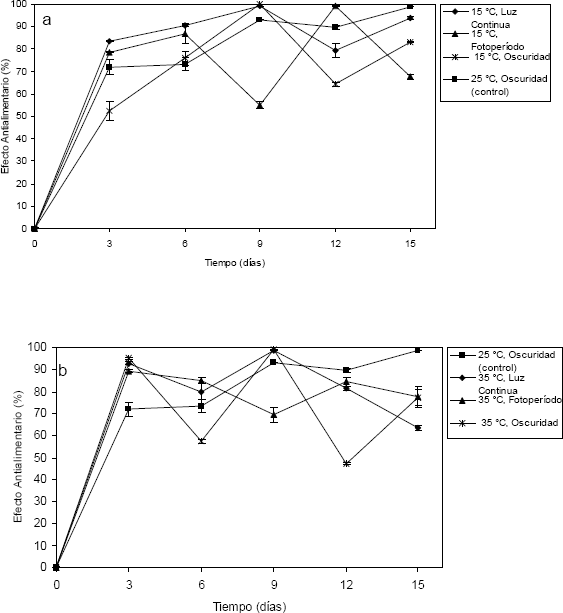
Figura 4. Efecto antialimentario de los extractos de las células de Azadirachta. indica. a. 15 ºC; b. 35 ºC, sobre larvas de Spodoptera frugiperda.
Los extractos extracelulares de A. indica (Figura 5) exhibieron un E.A.A < 40 % sobre larvas de S. frugiperda, a pesar de que se detectó poca cantidad de azadiractina en el medio de cultivo (0,02 mg/l – 5,28 mg/l de azadiractina). Por lo tanto, el efecto antialimentario encontrado se podría atribuir a la presencia de otros compuestos que actúan en forma independiente o sinérgica con la azadiractina tales como nimbina, 3-tigloilazadiractina, salanina y otros, de los cuales también se ha reportado que producen efectos antialimentarios (Simmonds et al., 2004). A 15 ºC - oscuridad el E.A.A de estos extractos no superó al 7% y los tratamientos que produjeron mayores compuestos antialimentarios extracelulares fueron 15 ºC - luz continua, 15 ºC - fotoperiodo, 35 ºC - fotoperiodo y 35 ºC - oscuridad con valores de E.A.A mayores al 35 %.
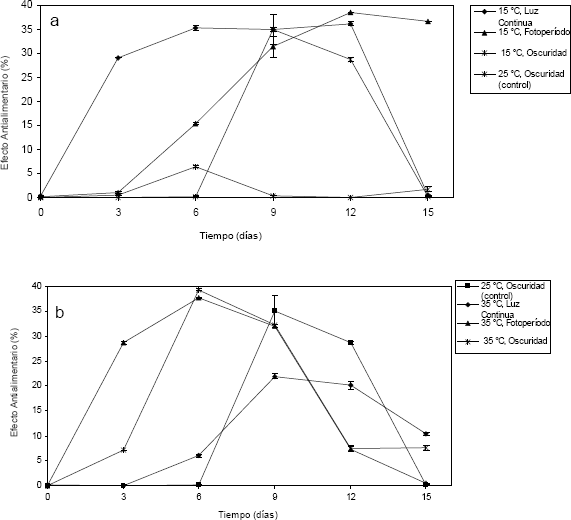
Figura 5. Efecto antialimentario de los extractos del medio de cultivo de Azadirachta. indica. a. 15 ºC; b. 35 ºC, sobre larvas de Spodoptera frugiperda.
El análisis de varianza (Tabla 1) indica que la interacción luz – temperatura (valor p = 0,4458) no tiene un efecto significativo sobre el índice antialimentario de los extractos de A. indica. Por el contrario, la temperatura y la luz son significativas ejerciendo efectos negativos. Los valores óptimos del índice antialimentario se obtuvieron mediante un gráfico de superficie de respuesta estimada, los cuales fueron 15 °C y oscuridad (Figura 6). El comportamiento del E.A.A máximo se puede describir mediante la siguiente ecuación:

Tabla 1. Análisis de varianza del efecto antialimentario de los extractos de Azadirachta indica sobre larvas de Spodoptera frugiperda.
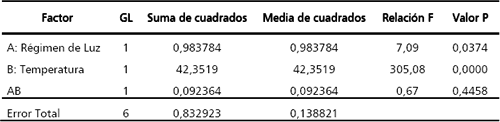
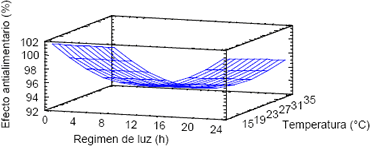
Figura 6. Superficie de respuesta estimada para el efecto antialimentario máximo de azadiractina de las suspensiones celulares de Azadirachta indica.
Las hojas de maíz tratadas con extracto de neem fueron ingeridas por las larvas de S. frugiperda hasta llegar a cierto punto de ingestión donde empezaron a comer cada vez menos, hasta que dejaron de ingerir y murieron. Esto significa que la reducción en la toma de alimento por las larvas no es solo gustativa (regulada por los órganos sensoriales de las partes de la boca) sino también no gustativa (Schmutterer 1990).
Blaney et al. 1990, reportaron que bioensayos realizados con azadiractina pura a 1 ppm en larvas de S. frugiperda mostraron un 90 % de E.A.A en ensayos de escogencia y un consumo del 5 % del disco tratado en ensayo de no escogencia mostrando una alta susceptibilidad al metabolito. Simmonds et al. 2004 reportaron que una concentración de 3,6 × 10−7 M de azadiractina es suficiente para causar un 50 % de efecto antialimentario en larvas L3 de S. frugiperda. En el presente estudio, la azadiractina aplicada tuvo un E.A.A. de 100 %. En las condiciones de temperatura y régimen de luz estudiados, el efecto antialimentario en larvas de Spodoptera fue mayor con los extractos celulares de A. indica que los extractos del medio de cultivo libre de células. El 13 % de la azadiractina producida fue excretada al medio de cultivo, confirmando esto que la mayor producción de azadiractina es a nivel intracelular y que la actividad antialimentaria de los extractos extracelulares puede ser debida a la presencia de otros metabolitos como 3-tigloilazadiractina y 3-acetil-1-tigloilazadiractina que son compuestos resultantes del rearreglo de la azadiractina (Ley et al. 1989) y que pudieron haberse formado a partir de la azadiractina antes de ser secretados al medio.
Los extractos intra y extracelulares de las suspensiones de A. indica elicitadas bajo régimen de luz y temperatura tuvieron un alto efecto antialimentario sobre las larvas de S. frugiperda, alcanzándose un 100 % de E.A.A. para los extractos intracelulares producidos a 15 ºC y oscuridad. Esto indica el potencial de las suspensiones celulares como una herramienta biotecnológica para la producción de productos con efecto antialimentario sobre lepidópteros.
Para investigaciones futuras sería importante analizar la robustez del efecto antialimentario de los extractos mediante bioensayos de no escogencia y su efecto en la inhibición del crecimiento en larvas de S. frugiperda así como la dosis letal mínima LC50 para asegurar el potencial comercial de las suspensiones celulares de A. indica generadoras de metabolitos.
Los autores agradecen a la Dirección de Investigaciones de la Universidad Nacional de Colombia, Sede Medellín, DIME, por el financiamiento de este proyecto Código 030802664 y al Laboratorio de Control Biológico, de la Universidad Nacional de Colombia, Sede Medellín, por el suministro de los insectos para los bioensayos.
Allan, E. J.; Easwara, J. P.; Mordue, A. J.; Mogan, E. D. and Stuchbury, T. 1994. The production of azadirachtin by in vitro tissue culture of neem, Azadirachta indica. En: Pesticide Science. Vol. 42; p. 147–152. [ Links ]
Allan, E. J.; Eeswara, J. P.; Jarvis, A.; Mordue (Luntz), A.; Morgan, E. and Stuchbury, T. 2002. Induction of hairy root cultures of Azadirachta indica A. Juss and their production of azadirachtin and other important insect bioactive metabolites. Plant Cell Reports. Vol. 21, no. 4; p. 374-379. [ Links ]
Balaji, K.; Veeresham, C.; Srisilam, K. and Kokate, C. 2003. Azadirachtin, a novel biopesticide from cell cultures of Azadirachta indica. En: Journal of Plant Biotechnology -Daejeon-. Vol 5, no. 2; p. 121-129. [ Links ]
Blaney, W. M.; Simmonds, M. S. J.; Ley, S. V.; Anderson, J. C. and Toogood, P. L. 1990. Antifeedant effects of azadirachtin and structurally related compounds on lepidopterous larvae. En: Entomologia Experimentalis et Applicata. Vol. 55, no. 2; p. 149-160. [ Links ]
Dai, J.; Yaylayan, V. A.; Raghavan, G. S. and Parè, J. R. 1999. Extraction and colorimetric determination of azadi-rachtin-related limonoids in neem seed kernel. En: Journal of Agricultural and Food Chemistry. Vol. 47, no. 9; p. 59-63. [ Links ]
Ermel, K.; Pahlich, E. and Schmutterer, H. 1984. Comparison of neem seeds from ecotypes of Asian and African origin. p. 91-94. En: Procceedings of the 2nd International Neem Conference. (1984: Ravischholzhausen, Federal Republic of Germany ). Germany: German Agency for Technical Cooperation Eschborn. [ Links ]
Gallego, F. L. 1946. Plagas del maíz Laphygma frugiperda S. and A.: Estudio fundamental No. 5. Medellín: Universidad Nacional de Colombia. 60 p. [ Links ]
García, F. 1996. Integración de métodos para el manejo de Spodoptera frugiperda (J. E. Smith). En: Manejo Integrado de Plagas y Enfermedades en Maíz y Sorgo. Palmira: Instituto Colombiano Agropecuario ICA. 171 p. (Boletín Sanidad Vegetal, no. 13). [ Links ]
Giraldo, F.; Cataño, C.; Morales, G.; López, C. y Galeano, E. 2002. Determinación de azadiracthina por cromatografía liquida de alta eficiencia (HPLC) en semillas de árbol de neem (A. indica) cultivados en Colombia. En: Vitae. Vol 9, no. 1; p. 59-63. [ Links ]
Greenberg, S. M.; Showler, A. T. and Liu, T. X. 2005. Effects of neem based insecticides on beet armyworm (Lepidoptera: Noctuidae). En: Insect Science. Vol.12, no. 1; p. 17-23. [ Links ]
Isman, M. B. 2002. Insect antifeedants. En: Pesticide Outlook. Vol. 13, no. 4; p. 152-157. [ Links ]
Kearney, M. L.; Allan, E. J.; Hooker, J. E. and Mordue (Luntz), J. 1994. Anti- feedant effects of in vitro culture extracts of neem tree, Azadirachta indica against the desert locus (Schitocerca gregaria Fosskal). En: Plant Cell Tissue and Organ Culture. Vol. 37; p. 67–71. [ Links ]
Ley, S. V.; Anderson, J. C.; Blaney, W. M.; Jones, P. S, Lidert, Z., David Morgan, E.; Robinson, N. G.; Santafianos, D.; Simmonds, M. S. J. and Toogood, P. L. 1989. Insect antifeedant from Azadirachta indica. Part V. Chemical modification and structure activity relationship of azadirachtin and some related limonoids. En: Tetrahedron. Vol. 45, no. 16; p. 5175-5192. [ Links ]
Mordüe (Luntz), A. J. and Blackwell, A. 1993. Azadirachtin: An Update.. En: Journal of Insect Physiology. Vol. 39, no. 11. p. 903-942. [ Links ]
Murashige, T. and Skoog, F. 1962. A revised medium for rapid growth and bioassays with tobacco tissue cultures. Physiologia Plantarum. Vol. 15; p. 473- 497. [ Links ]
Negrete, F. y Morales, J. 2003. Manejo del gusano cogollero del maíz utilizando extractos de plantas. Disponible en Internet. http://www.turipana.org.co/ InvestAgricola.php?pageNum_rsAgricola=7&buscar=/gusano_cogollero. html. [Consultada: 9 Dic. 2006]. [ Links ]
Sosa, M. A. 2002. Daño producido por Spodoptera frugiperda J. E. Smith (Lepidoptera: Noctuidae) sobre el rendimiento del cultivo de maíz en siembra directa, según tiempos de exposición a la plaga. Provincia de Santa Fé, Argentina: INTA, Centro Regional Santa Fé. p. 39–45. (Información para Extensión, no. 70). [ Links ]
Schaaf, O; Jarvis, A. P.; van der Esch, S. A.; Giagnacovo, G. and Oldham, N. J. 2000. Rapid and sensitive analysis of azadirachtin and related triterpenoids from neem (Azadirachta indica) by high performance liquid cromatography atmospheric pressure chemical ionization mass spectrometry. En: Journal of Chromatography A. Vol. 886, no. 1-2; p. 89-97. [ Links ]
Schmutterer, H. 1990. Properties and potential of natural pesticides from the neem tree. En: Annual Review of Entomology. Vol 35; p. 271-298. [ Links ]
Simmonds, M. S. J.; Jarvis, A. P.; Johnson, S.; Jones, G. R.; and Morgan, E. D. 2004. Comparison of antifeedant and insecticidal activity of nimbin and salannin photooxidation products with neem (Azadirachta indica) limonoids. En: Pest Management Science. Vol. 60, no. 5; p. 459–464. [ Links ]
Vélez, R. 1997. Plagas agrícolas de impacto económico en Colombia: biología y manejo integrado. Medellín Universidad de Antioquia. 428 p. [ Links ]
Zounos, A. K. Allan, E. J.; and Mordüe (Luntz), A. J. 1999. Bioactive compounds from neem tissue cultures and screening against insects. En: Pesticide-Science. Vol. 55, no. 4; p. 486-503. [ Links ]