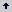Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Facultad Nacional de Agronomía Medellín
Print version ISSN 0304-2847
Rev. Fac. Nac. Agron. Medellín vol.60 no.2 Medellín July/Dec. 2007
INTEGRACIÓN DE INDUCCIÓN DE RESISTENCIA CON BACTERIAS QUITINOLÍTICAS EN EL CONTROL DE LA SIGATOKA NEGRA (Mycosphaerella fijiensis Morelet) EN BANANO
INTEGRATION OF INDUCED RESISTANCE WITH CHITINOLYTIC BACTERIA IN BLACK SIGATOKA CONTROL (Mycosphaerella fijiensis Morelet) IN BANANA
Catalina María Zuluaga Amaya1; Luis Fernando Patiño Hoyos2 y Juan Carlos Collazos Villa3
1 Ingeniera Agrónoma. Universidad Nacional de Colombia, Sede Medellín. Facultad de Ciencias Agropecuarias. A.A. 1027, Medellín, Colombia. <catazuluaga81@yahoo.es>
2 Profesor Asociado. Politécnico Colombiano Jaime Isaza Cadavid. Facultad de Ciencias Agrarias A.A. 4932, Medellín, Colombia. <luisferph@gmail.com>
3 Auxiliar de Investigación. Augura-Cenibanano. Programa Monitoreo de Resistencia a Fungicidas. Calle 3 sur No. 41-65. Edificio Banco de Occidente. Medellín, Colombia. <jcollazos@augura.com.co>
Recibido: Noviembre 22 de 2006; aceptado: Octubre 10 de 2007.
RESUMEN
Se evaluó en condiciones de campo en la zona bananera de Urabá-Colombia, el efecto de inductores de resistencia y bacterias quitinolíticas sobre el desarrollo de la Sigatoka Negra en plantas de banano del cultivar Gran Enano. Como inductores de resistencia se utilizaron acibenzolar-s-metil (ASM) (20 cm3 · ha-1 i.a.) y ácido salicílico (AS) (20 cm3 · ha-1 i.a) cada uno en rotación y en mezcla con fungicidas utilizados en el control convencional de la enfermedad; se evaluó también la mezcla de estos inductores con bacterias quitinolíticas aisladas de la filosfera de banano; así como el efecto del fungicida biológico Biofun® ( 1,5 L · ha-1 de p.c. en rotación con fungicidas y en mezcla con ASM. La aplicación de ASM en rotación y en mezcla con fungicidas convencionales presentó un control de la enfermedad hasta un 50% mayor al obtenido con el control convencional, evidenciado esto en los valores más bajos del área bajo la curva del índice de severidad de la enfermedad (IS) y más altos de hojas sanas (HS) al momento de la floración. Los tratamientos, que incluyeron AS en rotación y mezcla con fungicidas convencionales, al igual que el producto Biofun® en rotación y en mezcla con ASM, mostraron un control de la enfermedad estadísticamente igual al obtenido con el control convencional, lo cual reveló una reducción de 46 - 100% de la cantidad de fungicidas convencionales usados en el control de la Sigatoka Negra.
Palabras claves: Control biológico, ácido salicílico, acibenzolar-s-metil, bacterias líticas, Biofun®
ABSTRACT
The effect of resistance elicitors and chitinolytic bacteria was evaluated on Black Sigatoka control in banana plants, in field conditions in Urabá-Colombia. Acibenzolar-s-metil (ASM) (20 cm3 · ha- 1 a.i.) and salicilyc acid (SA) (20 cm3 a.i.ha-1) were used in rotation and mixture with conventional fungicides, and in mixture with chitinolytic bacteria isolated from banana phyllosphere. Biological fungicide Biofun® ( 1,5 L · ha-1) de p.c. was also tested in rotation and mixture with ASM. When fungicides were in rotation and in mixture with ASM, an increase of 50% of disease control was obtained, represented by lower levels of area under curve of variables severity index (IS) and higher of healthy leaves at flowering. The treatments based on SA in rotation and mixture with conventional fungicides, as well as Biofun® in rotation and mixture with ASM, resulted statistically similar to control showed by conventional system control, which disclosed a reduction from 46 -100% of quantity of conventional fungicides used in black Sigatoka control.
Key words: Biological control, salicylic acid,acibenzolar-s-metil; lytic bacteria; Biofun®
 MATERIALES Y MÉTODOS
MATERIALES Y MÉTODOS
 RESULTADOS Y DISCUSIÓN
RESULTADOS Y DISCUSIÓN
 AGRADECIMIENTOS
AGRADECIMIENTOS
 BIBLIOGRAFÍA
BIBLIOGRAFÍA
La Sigatoka Negra, causada por el hongo Mycosphaerella fijiensis Morelet, se constituye en la principal enfermedad foliar en términos económicos de la producción de banano y plátano en Colombia y el mundo (Marín et al., 2003). Bajo condiciones de control deficiente, el principal efecto de la enfermedad es la prolongación del periodo floración-cosecha y la reducción de la vida verde de la fruta cosechada. En plantaciones comerciales de banano Cavendish, las pérdidas de mayor magnitud se relacionan con la eliminación de racimos en el campo, provenientes de plantas con poca cantidad de hojas (menos de 4 hojas sanas), debido al riesgo que presentan de maduración prematura de la fruta ocasionada por la enfermedad (Guzmán 2006). Su control en Colombia representa un costo que oscila entre US $700-800 ha/año, representando cerca del 13,8% de los costos totales de producción del cultivo y el 46% de los costos de los agroquímicos (Chica et al., 2004). El control de la enfermedad se basa principalmente en la aplicación de fungicidas químicos, los cuales están siendo vulnerados por el hongo, a causa del surgimiento de poblaciones con pérdida de sensibilidad al modo de acción de los fungicidas sistémicos (Marín et al., 2003; Patiño, 2003). Debido a esta situación se viene presentando un número creciente de ciclos de fungicidas por año para proteger la fruta a exportar (Chica et al., 2004), lo cual implica un incremento en los costos de producción y en efectos negativos de los fungicidas convencionales sobre el ambiente, siendo prioritario la búsqueda de alternativas que permitan complementar el manejo integrado de la enfermedad.
La inducción de resistencia a través de la aplicación de sustancias químicas sintéticas puede ser una alternativa de manejo, la cual desencadena señales que activan respuestas de defensa en la planta (Kessmann et al., 1994). Esta estrategia ha sido reportada con reducciones significativas de enfermedades en varios cultivos como trigo, repollo, tomate, banano, tabaco y melón para un amplio espectro de patógenos como Erysiphe graminis f.sp. tritici, Tomato spotted wilt virus (TSWV), Clavibacter michiganensis subsp. michiganensis II, Xanthomonas axonopodis pv. vesicatoria, Mycosphaerella fijiensis, Peronospora hyoscyami f.sp. tabacina, Didymella bryoniae y Botrytis cinerea, entre otros (Görlach et al., 1996; Sticher, Mauch-Mani y Métraux, 1997; Madrigal, Ruess y Staehle-Csech, 1998; Pappu et al., 2000; Griesbach et al., 2000; Romero, Kousik y Ritchie, 2001; CorralesKnight y Madrigal, 2002; Patiño, 2002; Pérez et al., 2003; Rizzo, Ferreira y Braz, 2003; Małolepsza, 2006). La resistencia inducida en plantas también puede obtenerse a través de microorganismos y factores físicos, pero hasta ahora los inductores químicos han sido los más efectivos, sobresaliendo las moléculas ácido salicílico (AS) y sus análogos funcionales ácido 2,6-dicloroisonicotinico (INA) y Benzo (1,2,3) tiadiazole-7-carbotionico ácido-s-metil ester (BTH) (Kessmann et al. 1994, Sticher, Mauch-Mani y Métraux, 1997; Vallad y Goodman, 2004). La aplicación de AS ha mostrado disminución de los síntomas causados por los virus del Mosaico y Necrosis del Tabaco TMV y TNV (White, 1979; Maurhofer, et al. 1998). En arroz el AS redujo la incidencia de Pyricularia oryzae en un 33 – 38% (Manandhar et al., 1998), y en plantas de tomate tratadas con AS e inoculadas con Alternaria solani, se encontró un 83% menos de lesiones por hoja y una reducción del 77% en el área foliar afectada (Spletzer y Enyedi 1999). También se ha demostrado la capacidad inductora de resistencia del AS en otras plantas como pepino hacia Colletotrichum lagenarium y cebada hacia Erysiphe graminis. f.sp. tritici (Manandhar et al., 1998). Hincapié (2003) encontró en condiciones de invernadero, que la combinación de fungicidas convencionales en el control de la Sigatoka Negra con AS, presentó un aumento significativo en el control; mientras que bajo condiciones de campo, este mismo tratamiento mostró un 30% más de control en una época de baja a moderada presión de enfermedad. BTH e INA son los inductores químicos disponibles comercialmente más estudiados, donde de 37 ejemplos de enfermedades en cultivos examinadas por Vallad y Goodman (2004), 32 correspondieron a ejemplos donde se usó BTH cubriendo 12 cultivos diferentes, mientras que los restantes cinco ejemplos usaron INA. El BTH conocido también como acibenzolar-s-metil (ASM), simula el modo de acción del AS e induce el promotor PR-1a, compitiendo muy exitosamente con el AS para unirse a la proteína de enlace con el AS (SABP2), lo cual está correlacionado con la habilidad de activar la expresión de los genes de defensa e incrementar la resistencia en las plantas (Du y Klessig, 1997). Se reporta además que esta molécula puede reducir el grado de colonización fungal en tejidos radicales, así como el grado de penetración a nivel foliar (Benhamou, 1996; Görlach et al., 1996).
Con relación al control biológico de patógenos foliares, se plantea que el éxito del antagonista depende de su capacidad para establecerse como miembro de la microbiota epifita; por lo cual el uso de antagonistas microbianos aislados de dicha microbiota debería preferirse al uso de antagonistas aislados de otros ambientes, pues los primeros se encuentran adaptados a las condiciones que determinan el hábitat en la superficie de la hoja (Blakeman y Fokkema, 1982; Andrews, 1992). Una de las estrategias utilizadas para el control biológico a nivel foliar, consiste en la aplicación de microorganismos antagonistas productores de sustancias antibióticas y/o enzimas líticas que actúen sobre sus esporas o tubos germinativos, en su fase epifita de crecimiento (Sahai y Manocha, 1993; Mahadevan y Crawford, 1997). El uso de microorganismos productores de quitinasas y/o glucanasas en la regulación de hongos pertenecientes a las clases Basidiomycetes y Ascomycetes ha demostrado ser una estrategia promisoria en el control de las enfermedades causadas por éstos, pues su pared celular está constituida principalmente por microfibrillas de quitina y b-glucanos, hecho que los hace sensibles al ataque de estas enzimas (Sahai y Manocha, 1993; Mahadevan y Crawford, 1997). Bacterias quitinolíticas y glucanolíticas con potencial para degradar la pared celular de M. fijiensis, han sido evaluadas por su capacidad de control de la Sigatoka Negra (Gonzalez et al., 1996; Ruíz et al., 1997), reportando reducción significativa en el uso de fungicidas convencionales (Arango 2002; Osorio et al., 2004). En la producción certificada de banano orgánico en la zona bananera del Magdalena en Colombia, es utilizado para el control de Sigatoka Negra el fungicida biológico Biofun®, el cual está compuesto de metabolitos de extractos vegetales de Urtica ureas, Eucalipto globulus y Allium sativum con acción sobre la inhibición o reducción de tubo germinativo de M. fijiensis y estímulo de sustancias de defensa que restringen el avance de la lesión (Green Label, 2006). La inclusión de este producto en rotación con fungicidas convencionales ha registrado un control similar al exhibido por el control convencional (Chica et al., 2004). Con base en lo anterior, el objetivo de esta investigación fue determinar el efecto de inductores de resistencia en combinación con bacterias quitinolíticas y el producto Biofun® en el control de Sigatoka Negra, buscando integrar una protección interna a través de la inducción de resistencia con una externa como el control biológico, con el fin de ofrecer alternativas de manejo que permitan oxigenar el limitado y costoso control químico de la enfermedad.
La investigación se llevó a cabo en condiciones de campo en la zona bananera de Urabá-Colombia, ubicada a una altura de 27 msnm, con temperatura promedia de 28°C, precipitación promedio anual de 3500 mm y humedad relativa promedio del 88%. El estudio se llevó a cabo durante 23 semanas, iniciando las aplicaciones de los tratamientos cuando las plantas tenían aproximadamente 1,0 m de altura, lo cual ocurrió en la semana 39 de 2004, mientras que las evaluaciones de los tratamientos se iniciaron cuatro semanas después de iniciadas las aplicaciones y hasta que aproximadamente el 80% de las plantas había florecido, lo cual ocurrió en la semana ocho de 2005. Se utilizó el cultivar de banano Gran Enano, clasificado como altamente susceptible a la Sigatoka Negra (Marín et al., 2003).
Los tratamientos evaluados fueron los siguientes:
T1: Fungicida (F) en rotación con la mezcla de ASM con bacterias quitinolíticas [F–(ASM+B)]: este tratamiento consistía en la aplicación de los fungicidas convencionales (F) indicados en la Tabla 1, seguida (en rotación) por la aplicación de Acibenzolar-s-metil (ASM) Syngenta® (20 cm3 · ha-1 i.a.) en mezcla con solución de bacterias quitinolíticas (cepas C12, C71 y C97) a una concentración aproximada de 109 UFC·mL, formuladas en sustrato foliar de acuerdo a Salazar, Patiño y Bustamante 2006; dichas cepas habían sido reportadas con alta capacidad quitinolítica y aisladas de la filosfera de banano y plátano en la zona de Urabá (Osorio et al., 2004). La frecuencia de aplicación del inductor fue cada 20 días, mientras que la solución de bacterias fue aplicada cada 7-9 días.
Tabla 1. Programa de aplicaciones de fungicidas (F) utilizados por el sistema convencional de control de Sigatoka Negra en Urabá, Colombia para el período semana 39 de 2004 a semana 08 de 2005.
T2: Fungicida (F) en mezcla con ASM y bacterias quitinolíticas (F+ASM+B): para este caso se realizó una aplicación continua de fungicidas convencionales (F) en mezcla con el inductor de resistencia ASM (20 cm3 · ha-1 i.a.) y la solución de bacterias (cepas y concentración igual a T1). La frecuencia de aplicación la determinó el programa de fungicidas convencionales, descrito en la Tabla 1.
T3: Mezcla de ASM y bacterias quitinolíticas (ASM+B): aplicación de la solución de bacterias en forma igual a T1 con una frecuencia de cada 7-9 días, mezclando cada 20 días dicha solución con ASM (20 cm3 · ha-1 i.a.).
T4: Fungicida en rotación con la mezcla de AS con bacterias quitinolíticas [F–(AS+B)].
T5: Fungicida en mezcla con AS y bacterias quitinolíticas (F+AS+B).
T6: Mezcla de AS y bacterias quitininolíticas (AS+B). Los tratamientos 4, 5 y 6 fueron similares a los tratamientos 1, 2 y 3 respectivamente, variando únicamente el inductor de resistencia aplicado, siendo en este caso ácido salicílico (AS), Químicos JM®, a una dosis de 20 cm3 · ha-1 i.a.
T7: Fungicida en rotación con Biofunâ (F–Biofun): para este tratamiento se aplicaba el fungicida convencional de acuerdo a la Tabla 1, mientras que el producto Biofun®, Green Label® ( 1,5 L · ha-1 de p.c.) se aplicaba cada 10 días en rotación con los fungicidas.
T8: ASM en mezcla con Biofunâ (ASM+Biofun): consistía en aplicaciones de la mezcla de ASM a una dosis de 20 cm3 · ha-1 i.a. con el fungicida biológico a razón de 1,5 L · ha-1 de p.c. aplicado cada 10 días y el inductor de resistencia cada 20 días.
T9: Testigo convencional: se aplicaba el fungicida convencional (F), de acuerdo a la Tabla 1, según el programa comercial de aplicaciones de fungicidas determinado por la compañía Sanvel S.A., encargada del control en fincas bananeras aledañas al sitio del experimento.
T10: Testigo sin control químico: en este tratamiento no se realizaba control químico de la enfermedad, sólo se practicaba semanalmente control cultural mediante deshoje y despunte, practicando también este mismo control cultural en todos los tratamientos. Las aplicaciones de los tratamientos fueron hechas en forma terrestre utilizando una bomba de espalda marca STIHL SR 420, Andreas Stihl AG y Co; calibrada para descargar un volumen de 40 L · ha-1.
Las variables de respuesta fueron el índice de severidad (IS) y el número de hojas sanas (HS) medidas cada dos semanas; la primera variable fue obtenida a partir de la severidad de la enfermedad, según los grados establecidos en la escala de Stover modificada por Gaulh (1989), la cual va desde un grado 0 = hoja sin síntomas, hasta un grado 6 = > 50% área foliar afectada; este índice de severidad considera además del grado de severidad en la hoja, la posición que la mancha foliar ocupa en la planta, siendo mayor la valoración del daño en las hojas superiores y menor en las hojas inferiores, de acuerdo a Marín y Romero (1992). La variable hojas sanas (HS) se registró como el número total de hojas sin síntomas presentes en cada planta al momento de la evaluación. Para la estimación de estas variables se utilizó el área bajo la curva (ABC) de su desarrollo en el tiempo de evaluación. El arreglo experimental adoptado fue un diseño completamente al azar de medidas repetidas en el tiempo, con 10 tratamientos y 3 repeticiones (parcelas lineales). Cada parcela lineal, constaba de 12 plantas de la variedad Gran Enano, pero sólo las cuatro centrales eran efectivas para la evaluación, esto con el fin de reducir el efecto borde en las parcelas; además éstas estuvieron separadas por dos hileras de pasto King-grass (Pennisetum purpureum Kunth) a 4,0 m de distancia de la línea de plantas de banano, esto con el fin de evitar el efecto deriva al momento de las aplicaciones. Las plantas fueron sometidas a infección natural de la enfermedad, ya que el área experimental se encontraba rodeada de fincas comerciales de banano todas ellas afectadas por Sigatoka Negra. La información obtenida se sometió a un análisis de varianza y se usó la prueba de agrupamiento Tukey (P £ 0,05) para determinar la significancia entre las medias de los tratamientos; se usó el programa estadístico SAS (versión 8).
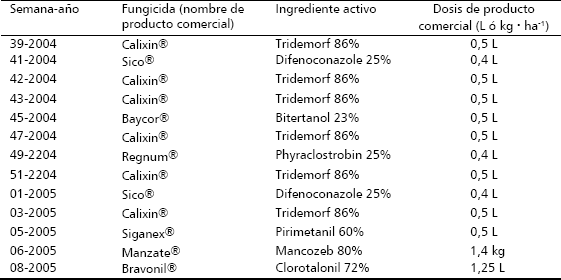
Todos los tratamientos mostraron efecto sobre las variables índice de severidad (IS) y hojas sanas (HS), resultando estadísticamente diferentes al testigo sin control químico (Figuras 1 y 2). El índice de severidad mostró diferencias estadísticamente significativas de los tratamientos con el testigo sin control químico, el cual presentó el mayor valor de área bajo la curva para esta variable (Figura 1).
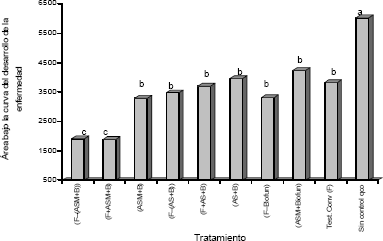
Figura 1. Área bajo la curva del desarrollo de la enfermedad del índice de severidad (IS) luego de las aplicaciones de inductores de resistencia, bacterias quitinolíticas y el fungicida biológico Biofun® en rotación y mezcla con fungicidas convencionales para el control de Sigatoka Negra en banano. Medias seguidas con letras distintas difieren significativamente entre sí de acuerdo a la prueba de Tukey a un nivel 5% de probabilidad. CV = 23,50%
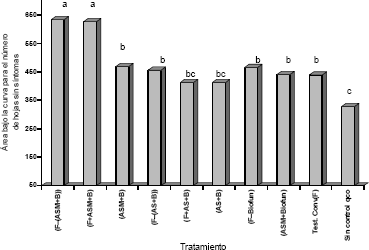
Figura 2. Área bajo la curva para el número de hojas sin síntomas de la enfermedad (Hojas Sanas) durante el tiempo de las aplicaciones de inductores de resistencia, bacterias quitinolíticas y el fungicida biológico Biofun® en rotación y mezcla con fungicidas convencionales para el control de Sigatoka Negra en banano. Medias seguidas con letras distintas difieren significativamente entre sí de acuerdo a la prueba de Tukey a un nivel 5% de probabilidad. CV = 14,47%.
Respecto al testigo convencional con fungicidas, solo mostraron diferencias estadísticamente significativas los tratamientos donde se aplicó el ASM en rotación y en mezcla con fungicidas convencionales, teniendo estos tratamientos un control hasta un 50% mayor que el testigo convencional, evidenciado en los valores más bajos de índice de severidad (Figura 1). A pesar de no existir diferencias significativas entre la rotación y mezcla de fungicidas con ASM, los menores valores de IS se obtuvieron para la mezcla (Figura 1). Rizzo, Ferreira y Braz (2003), obtuvieron el mejor control del Chancro del melón (Didymella bryoniae) cuando se aplicó ASM en combinación con el fungicida difenoconazole. Resultados similares también fueron encontrados por Romero, Kousik y Ritchie (2001), en donde la inducción de resistencia a través de ASM en combinación con cobre en plantas de pimentón (Capsicum annum L.) bajo condiciones de campo, mostró un control de la mancha bacterial (Xanthomonas axonopodis pv. vesicatoria) similar al tratamiento estándar de cobre más maneb.
Los tratamientos (ASM+B), [F–(AS+B)], (F+AS+B) y (AS+B) mostraron un nivel de control similar al control convencional, sin hallar diferencias estadísticamente significativas, como resultado de su respuesta durante las 23 semanas de evaluación (Figura 1), periodo que incluyó la época de mayor presión de la enfermedad en la zona (semanas 42 - 05) (Chica et al., 2004), lo cual da un mayor solidez a los resultados obtenidos. Con la inclusión del ASM y el AS en el sistema convencional de control de la enfermedad, resulta altamente significativo que aquellos tratamientos que consistían de la rotación de los fungicidas convencionales, con la mezcla de los inductores y solución de bacterias quitinolíticas ofrecieran un control estadísticamente superior para ASM e igual para AS, con relación al control convencional, lo cual implica que con estos tratamientos se pudo lograr una reducción de 46% en la cantidad de los fungicidas convencionales, ya que en el sistema convencional se requirió de la aplicación de 13 ciclos de fungicidas (datos no mostrados), mientras que con los tratamientos que incluían la rotación, se aplicaron 7 ciclos de fungicidas convencionales. Aún mucho más significativo resultó el comportamiento de los tratamientos mezcla de los inductores con las bacterias quitinolíticas, los cuales no incluyeron la aplicación de fungicidas convencionales, donde la aplicación continua de esta mezcla mostró un control estadísticamente igual al control ofrecido por el sistema convencional, siendo un resultado no esperado y el cual requiere mayor evaluación para confirmar los resultados encontrados en la presente investigación. Aunque no se tiene conocimiento de estudios publicados que expliquen a nivel bioquímico o molecular la expresión de resistencia inducida por ASM y AS en banano, se infiere que los mecanismos de acción deben ser similares a los reportados por estas moléculas en otros patosistemas, donde la expresión de PR`s es uno de los mecanismos principales (Görlach et al., 1996; Sticher, Mauch-Mani y Métraux, 1997; Spletzer y Enyedi, 1999; Vallad y Goodman, 2004); no obstante también se ha observado efecto directo de ASM sobre la capacidad de elongación de tubo germinativo de M. fijiensis (Patiño, 2002). Se reporta además para el caso de M. fijiensis en banano, que la reducción en la severidad de la enfermedad encontrada al aplicar ASM puede asociarse con alteraciones a nivel de la estructura de la hoja, mostrando una mayor densidad en el mesófilo esponjoso, reflejada a nivel externo como una textura coriácea de la hoja tratada, que podría dificultar el establecimiento y la penetración del hongo (Patiño, 2002).
Se destaca además que el nivel de control exhibido por AS haya sido estadísticamente igual al control convencional y en un caso igual a ASM, lo cual proyecta una reducción en el costo de control ya que el AS es un inductor de menor costo económico que el ASM (Boost®). Resultados similares fueron reportados también por Hincapié (2003), donde la aplicación de AS mostró un nivel de control de Sigatoka Negra similar al mostrado por ASM en una época de baja a moderada presión de enfermedad.
Los tratamientos Biofun® en rotación con fungicidas convencionales y ASM+ Biofun®, no mostraron diferencias estadísticamente significativas con el testigo convencional (Figura 1), lo cual coincide con lo reportado por Chica et al. (2004), para la zona bananera del Magdalena donde en condiciones de campo el sistema de rotación de este producto con fungicidas convencionales mostró un control similar al sistema convencional. Productos a base de extractos vegetales como el Biofun®, han mostrado reducción en los índices de infección de la Sigatoka Negra, extractos de Matricaria sp., Annona muricata, Melaleuca alternifolia y de semillas de cítricos ha sido usados en producción de banano orgánico en República Dominicana (Jiménez et al., 2006); no obstante no se conocen resultados sistemáticos publicados que expliquen los modos de acción de este tipo de productos sobre el control de la enfermedad. Es necesario continuar investigando el efecto de extractos vegetales para el control de Sigatoka Negra, ya que en sistemas de producción certificada de banano orgánico en países como República Dominicana y Colombia, este tipo de productos son la base fungicida para el control de la enfermedad.
Se resalta al igual que para el caso de los inductores de resistencia el tratamiento que comprendía la rotación del fungicida convencional con el Biofun®, el cual permitió reducir en un 46% el uso de fungicidas, ya que en dicho tratamiento se aplicaron 7 ciclos de fungicida en comparación con 13 ciclos aplicados en el tratamiento convencional. A pesar de tener un comportamiento similar y de no mostrar una diferencia estadísticamente significativa, la aplicación de Biofun® en rotación con fungicidas, muestra valores de IS menores y un mejor control de la Sigatoka Negra que el tratamiento convencional (Figura 1). Al igual que en el caso de la aplicación de la mezcla de inductores con las bacterias quitinolíticas, la mezcla de ASM con Biofun® no incluyó fungicidas convencionales, proyectando que la combinación de inducción de resistencia y el control biológico, podría llegar a reducir la dependencia por uso de fungicidas convencionales.
En los tratamientos que incluyeron la aplicación de ASM, se observó un bronceado en las hojas, siendo más severo este en las hojas bajeras o más viejas, encontrando que dichas hojas no presentaban grados avanzados de la enfermedad y en repetidas ocasiones se veían totalmente sanas; lo que hace que los valores de índice de severidad en estos tratamientos sean menores y que las plantas que recibieron estos tratamientos mostraran los valores más altos en la variable hojas sanas, siendo estadísticamente diferentes al testigo químico convencional (Figura 2). Sin embargo, no se midió el efecto de este bronceado sobre la producción de banano o en la capacidad fotosintética de la planta; por lo tanto, no se puede afirmar con los resultados obtenidos que esto constituya un beneficio para la planta en términos de producción y calidad de la fruta. Además, las plantas que recibieron ASM en mezcla y en rotación con fungicidas, fueron las que tardaron más en emitir la flor (bacota) y en donde faltó el mayor número de plantas por emitir la flor cuando se culminó el experimento, lo que indica que este inductor de resistencia retrasó la floración, pudiendo estar asociado con alteraciones del funcionamiento fisiológico de la planta como lo reportan Guedes, Richmond y Kuĉ, 1980; Smedegaard-Petersen y Tolstrup, 1985; Cole, 1999; Griesbach et al., 2000; Romero, Kousik y Ritchie, 2001; Bustamante y Patiño, 2001.
A pesar de que no fue posible con este estudio evaluar el efecto individual de las bacterias quitinolíticas, ya que no hubo un tratamiento donde estas se aplicaran solas, es probable que estas hayan ejercido una acción sinergística con los inductores de resistencia, pues en el estudio a partir del cual se seleccionaron las cepas (Osorio et al. 2004), se evaluó también el efecto individual de la aplicación de las mismas en condiciones de campo, sin encontrar diferencia con el tratamiento absoluto sin control químico, no obstante su rotación con la aplicación de fungicidas convencionales, si exhibió un control estadísticamente igual al control convencional. Estas bacterias fundamentan su potencial de biocontrol en la alta capacidad quitinolítica por la cual fueron seleccionadas y en su origen en la filosfera de banano y plátano en la zona de estudio, situación que les confiere el carácter de cepas nativas de la zona de estudio con mayor capacidad de adaptación para un establecimiento y acción exitosos (Andrews, 1992). Se enfatiza en el hecho que los tratamientos que incluyeron los inductores de resistencia en mezcla con las bacterias quitinolíticas hayan sido estadísticamente iguales al control convencional (Figura 1), en los cuales no se incluyó la aplicación de fungicidas convencionales, planteando un posible alivio al problema de la pérdida de sensibilidad a fungicidas, el cual está incrementando dramáticamente el número de ciclos de fungicidas necesarios para obtener una fruta con calidad de exportación (Marín et al., 2003; Patiño, 2003; Chica et al., 2004). No obstante es necesario confirmar estos resultados con más investigaciones que incluyan varios ciclos de producción del cultivo y la evaluación de los efectos de los tratamientos sobre variables como el peso del racimo y calidad de la fruta; de igual forma se requiere profundizar en la solución de interrogantes como el efecto que puede ejercer la inducción de resistencia sobre las poblaciones y expresión biocontroladora de las bacterias antagonistas que están en la filosfera, teniéndose como referencia el estudio realizado por Keniskern, Traw y Bergelson (2006), donde se determinó que la inducción de resistencia vía AS como sucede para el caso de ASM y AS (Van Loon, Baker y Pieterse, 1998), redujo el crecimiento y diversidad de bacterias en el interior de la hoja de Arabidopsis thaliana, mientras que la inducción vía ácido jasmónico (JA), no presentó efecto sobre las bacterias en el interior de la hoja, pero sí un incremento en la diversidad de bacterias en el exterior de la misma. Esta situación señala la importancia de determinar los efectos de la interacción inducción de resistencia con acción lítica de bacterias antagonistas, al proyectar una estrategia de control de Sigatoka Negra que integre estas dos medidas de manejo de enfermedades en la producción de cosechas.
Se hace un reconocimiento especial al Doctor Elkin Bustamante Rojas, investigador pionero en los estudios de filosfera e inducción de resistencia para el control de Sigatoka Negra. Así como a la memoria del estudiante Javier Osvaldo Peña, quién comenzó con este experimento. De igual forma, se extiende los agradecimientos a los ingenieros Ignacio Jiménez y Rubén Zapata de Sanvel S. A., por su valiosa colaboración.
Andrews, J.H. 1992. Biological control in the phyllosphere. Annu. Rev. Phytopathol. 30:603-635. [ Links ]
Arango, M.E. 2002. Alternativas de manejo para el control biológico de Sigatoka Negra (Mycosphaerella fijiensis Morelet) en el cultivo del banano (Musa AAA). p. 130-134. En: Memorias XV Reunión Internacional ACORBAT Cartagena de Indias, Colombia 2002, Augura. Medellín. [ Links ]
Benhamou, N. 1996. Elicitor-induced plant defense pathways. Trends in Plant Sci. 1(7):233-240. [ Links ]
Blakeman, J.P. and Fokkema, N.J. 1982. Potencial for biological control of diseases on the phylloplane. Annu. Rev. Phytopathol. 20:167-192. [ Links ]
Bustamante, E. y L.F. Patiño. 2001. En búsqueda de un sistema de resistencia estable en plantas cultivadas. Manejo Integrado de Plagas (Costa Rica). (60):3-14. [ Links ]
Chica, R., M. Herrera, I. Jiménez, S. Lizcano, J.A. Montoya, L.F. Patiño, P.A. Rodríguez y L.H. Ruíz. 2004. Impacto y manejo de la Sigatoka Negra en el cultivo del banano de exportación en Colombia. p. 53-62. En: Memorias XVI Reunión Internacional ACORBAT 2004. Acorbat, Oaxaca, México. [ Links ]
Cole, D.L. 1999. The efficacy of acibenzolar S-methyl, an inducer of systemic acquired resistance, against bacterial and fungal diseases of tobacco. Crop Prot. 18(4): 267-273. [ Links ]
Corrales, O., S. Knight and A. Madrigal. 2002. Manejo de Sigatoka N1egra (Mycosphaerella fijiensis Morelet) y el nematodo barrenador (Radopholus similis Cobb) en banano, usando el activador de resistencia boost 50 SC dentro de un programa de fotoprotección basado en menos uso de agroquímicos. p. 143-147. En: Memorias XV Reunión Internacional ACORBAT 2002.Cartagena de Indias, Colombia . Augura, Medellín. [ Links ]
Du, H. and D.F. Klessig. 1997. Identification of a soluble high-affinity salicylic acid-binding protein in tobacco. Plant Physiol. 113(4):1319-1327. [ Links ]
Gauhl, F. 1989. Epidemiología y ecología de la Sigatoka Negra (Mycosphaerella fijiensis Morelet) en plátano (Musa sp.) en Costa Rica. UPEB, Ciudad de Panamá. 114 p. [ Links ]
González, R., E. Bustamante, E. P. Shannon, P. S. Okumoto y G. Leandro. 1996. Evaluación de microorganismos quitinolíticos antagonistas a Mycosphaerella fijiensis en casa de mallas y en campo. Manejo Integrado de Plagas ( Costa Rica ). (4):12-16. [ Links ]
Görlach, J., S. Volrath, G. Knaufbeiter, G. Hengy, U. Beckhove, K.H. Kogel, M. Oostendorp, T. Staub, E. Ward, H. Kessmann, and J. Ryals. 1996. Benzothiadiazole, a novel class of inducers of systemic acquired resistance, activates gene expression and disease resistance in wheat. The Plant Cell 8(4): 629-643. [ Links ]Green Label. 2006. Biofun® fungicida orgánico 100% natural. The Carpet and Rug Institute-CRI. Dalton, Georgia, USA : 4 p. (Ficha Técnica).
[ Links ]Griesbach, E., K. Eisbein, I. Krämer, M. Ramm, J. Müller, and B. Völksch. 2000. Induction of resistance to bacterial pathogens in the pathosystem tomato Clavibacter michiganensis subsp. Michiganensis II. Caracterization of the resistance inductor. J. Plant Dis. Prot. 107(5): 464-483. [ Links ]
Guedes, M.E.M., S.Richmond, and J. Kuĉ. 1980. Induced systemic resistance to anthracnose in cucumber as influenced by the location of the inducer inoculation with Colletotrichum lagenarium and the onset of flowering and fruiting. Physiol. Plant Pathol. 17:229-233. [ Links ]
Guzmán, M. 2006. Estado actual y perspectivas futuras del manejo de la Sigatoka Negra en América Latina. p. 83-91. En: Memorias XVII Reunión Internacional ACORBAT, 2006. Acorbat-Acafruta, Joinville, Brasil. [ Links ]
Hincapié, A. 2003. Efecto del ácido salicílico y acibenzolar-s-metil como inductores de resistencia a Sigatoka Negra (Mycosphaerella fijiensis Morelet) en banano. Trabajo de grado Ingeniera Agrónoma. Facultad de Ciencias Agropecuarias. Universidad Nacional de Colombia, Medellín. 65 p. [ Links ]
Jiménez, M.I., J. Bermeo, E. Márquez, S. Cañarte, J. Encalada, H. Rodríguez, O. Ruíz, J. Ruíz, y R. Swennen. 2006. Contribución al conocimiento entre la nutrición del banano (Musa AAA) y el desarrollo de Mycosphaerella fijiensis, agente causal de la Sigatoka Negra. p. 60. En: Resúmenes Congreso Internacional Manejo de la Sigatoka Negra en Banano y Plátano en América Latina y el Caribe 2006. CORBANA-INIBAP. San José, Costa Rica . [ Links ]
Kessmannn, H., T. Staub, C. Hofman, T. Maetzke, J. Herzog, E. Ward, S. Uknes, and J. Ryals. 1994. Induction of systemic acquired disease resistance in plants by chemicals. Annu. Rev. Phytopathol. 32:439-459. [ Links ]
Keniskern, J., M.B. Traw and J. Bergelson. 2006. The effects of Salicilyc acid and jasmonic acid mediated defense on the natural bacterial community of Arabidopsis thaliana. Phytopathol. 96(12):1417-1440. [ Links ]
Madrigal, A.; W. Ruess and U. Staehle-Csech. 1998. CGA 245704, a new plant activator to improve natural resistance of banana against black Sigatoka (Mycosphaerella fijiensis). p. 266-274. En: Memorias XIII Reunión Internacional ACORBAT 1998. Acorbat, Quito, Ecuador . [ Links ]
Mahadevan, B. and Crawford, D.L. 1997. Propierties of the chitinase of the antifungal biocontrol agent Streptomyces lydicus WYEC108. Enzyme Microb. Technol. 20(7):89-493. [ Links ]
Małolepsza, U. 2006. Induction of disease resistance by acibenzolar-S-methyl and o-hydroxyethylorutin against Botrytis cinerea in tomato plants. Crop Prot. 25(9):56-962. [ Links ]
Manandhar, H. K.; H.J. Lyngs Jorgensen, S.B. Mathur, and V. Smedegaard-Petersen. 1998. Resistance to rice blast induced by ferric chloride, dipotassium hydrogen phosphate and salicylic acid. Crop Prot. 17(4): 323-329. [ Links ]
Marín, D. y R. Romero. 1992. El combate de la Sigatoka Negra. Boletín Departamento de Investigaciones CORBANA. N. 4; 22 p. [ Links ]
Marín, D., R. Romero, M. Guzmán and T.B. Sutton. 2003. Black Sigatoka: An increasing threat to banana cultivation. Plant Dis. 87(3):208-223. [ Links ]
Maurhofer, M., C. Reimmann, P. Schmidli-Sacherer, S. Heep, D. Hass, and G. Défago, 1998. Salicylic acid biosynthetic genes expressed in Pseudomonas fluorescens strain P3 improve the induction of systemic resistance in Tobacco Necrosis Virus. Phytopathol. 88(7):678-684. [ Links ]
Osorio, I., L.F. Patiño, E. Bustamante y P. Rodríguez. 2004. Selección y evaluación de bacterias quitinolíticas provenientes de la zona de Urabá, para el control de la Sigatoka Negra. Bol. Téc. Cenibabano. 6:8-13. [ Links ]
Pappu, H.R., A.S. Csinos, R.M. McPherson, D.C. Jones, and M.G. Stephenson, 2000. Effect of acibenzolar-S-methyl and imidacloprid on suppression of tomato spotted wilt Tospovirus in fluecured tobacco. Crop Prot. 19(5):349-354. [ Links ]
Patiño, L.F. 2002. Efecto de una fuente de energía, tres inductores de resistencia y un sustrato foliar sobre Sigatoka Negra en banano. p. 135-142. En: Memorias XV Reunión Internacional ACORBAT 2002. Cartagena de Indias, Colombia). Augura, Medellín. [ Links ]
Patiño, L.F. 2003. La resistencia a fungicidas, una continua amenaza al control de Sigatoka Negra. Bol. Téc. Cenibanano. 4:2-5. [ Links ]
Pérez, L., M.E. Rodríguez, F. Rodríguez y C. Roson. 2003. Efficacy of acibenzolar-S-methyl, an inducer of systemic acquired resistance against tobacco blue mould caused by Peronospora hyoscyami f.sp. tabacina. En: Crop Protection. 22(2):405-413. [ Links ]
Rizzo, A. N. N., M. Ferreira, e L. T. Braz. 2003. Ação de acibenzolar-s-methyl (BTH) isolado e em combinação com fungicidas no controle do cancro da haste em melão rendilhado. Hort. Bras. 21(2):1-7. [ Links ]
Romero, A.M., C.S. Kousik and D.F. Ritchie. 2001. Resistance to bacterial spot in bell pepper induced by acibenzolar-s-methyl. En: Plant Dis. 85(2):189-194. [ Links ]
Ruíz-Silvera, C., E. Bustamante, F. Jiménez, J. Saunders, S. Okumoto, y R. González, 1997. Sustratos y bacterias antagonistas para el manejo de Mycosphaerella fijiensis en banano. Manejo Integrado de Plagas (Costa Rica). (45):9-17. [ Links ]
Sahai, A.S. and M.S. Manocha. 1993. Chitinases of fungi and plants: their involvement in morphogenesis and host-parasite interaction. FEMS Microbiol. Rev. 11(4):317-338. [ Links ]
Salazar, L., L.F. Patiño y E. Bustamante. 2006. Sustratos foliares para el incremento de bacterias quitinolíticas y glucanolíticas en la filosfera de banano. Rev. Fac. Nal. Agr. Medellín 59 (2):3449-3465. [ Links ]
Smedegard-Petersen, V. and K. Tolstrup. 1985. The limiting effect of disease resistance on yield. Annu. Rev. Phytopathol. 23:475-490. [ Links ]
Spletzer, M.E. and A.J. Enyedi. 1999. Salicilic acid induced resistance to Alternaria solani in hydroponically grown tomato. Phytopathol. 89(3):722-727. [ Links ]
Sticher, L., B. Mauch-Mani, and J.P. Métraux. 1997. Systemic acquired resistance. Annu. Rev. Plant Pathol. 35: 235-270. [ Links ]
Vallad, G. E. and R. M. Goodman. 2004. Systemic acquired resistance and induced systemic resistance in conventional agriculture. Crop Sci. 44(6):1920-1934. [ Links ]
Van Loon, L.C., P.A.H.M Baker and C.M.J. Pieterse. 1998. Systemic resistance induced by rhizosphere bacteria. Annu. Rev. Phytopathol. 36:453-483. [ Links ]
White, R.F. 1979. Acetyl salicylic acid (aspirin) induces resistance to tobacco mosaic virus in tobacco. Virology. 99(2): 410-412. [ Links ]