Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Facultad Nacional de Agronomía Medellín
Print version ISSN 0304-2847
Rev. Fac. Nac. Agron. Medellín vol.61 no.2 Medellín July/Dec. 2008
FACTORES QUE INCIDEN EN LA LIBERACIÓN DE ZOOSPORAS DE Spongospora subterranea (Wallroth) Lagerheim f. sp. subterranea Tomlinson
FACTORS AFECTING THE ZOOSPORE RELEASE OF Spongospora subterranean (Wallroth) Lagerheim f. sp. subterranea Tomlinson
Daniel Esteban Alzate Velez1; Liliana Maria Hoyos Carvajal2 y Elena Paola González Jaimes3
1 Estudiante Ingeniería Agropecuaria. Politécnico Colombiano Jaime Isaza Cadavid. Facultad de Ciencias Agrarias. Carrera 48 N° 7-151. Medellín, Colombia. <danesalve@gmail.com>
2 Profesora Auxiliar. Universidad Nacional de Colombia, Sede Bogotá. Facultad de Agronomía. A.A. 14490. Bogotá, Colombia. <limhoyosca@unal.edu.co>
3 Profesora. Politécnico Colombiano Jaime Isaza Cadavid. Facultad de Ciencias Agrarias. Carrera 48 N° 7-151. Medellín, Colombia. <epgonzalez@elpoli.edu.co>
Recibido: Mayo 6 de 2008; Aceptado: Octubre 21 de 2008.
Resumen. Spongospora subterranea (Wallroth) Lagerheim f. sp. subterranea Tomlinson es el agente causal de la sarna polvosa de la papa. Este patógeno es un protozoario, su infección ocurre por medio de zoosporas las cuales se liberan a partir de quistosoros y son el principal modo de dispersión de la enfermedad. Estos pueden encontrarse en tubérculos, raíces y el suelo, donde permanecen como estructuras de resistencia por varios años, hasta cuando las condiciones ambientales favorecen la liberación de zoosporas, para dar inicio a nuevas infecciones. En este trabajo, se evaluó el efecto de los exudados de raíz de papa, temperatura y fuente de inóculo con quistosoros aislados de suelo, raíz y tubérculo con el objetivo de verificar las condiciones en las cuales ocurre la liberación de zoosporas. Para tal fin se realizaron dos experimentos, en el primero se evaluó el efecto del agua y extracto de raíces y en el segundo el extracto de raíces y las diferentes fuentes de inóculo. Las evaluaciones se hicieron por conteo de zoosporas móviles durante 120 horas cada 24 horas. Se observó que el exudado de raíz tiene una alta influencia en la liberación de zoosporas, la cual ocurre entre los 15 y 23 °C a partir de las 48 y hasta las 96 horas, no se detectaron diferencias entre las fuentes de inóculo, lo que indica que independiente de su origen, si existen las condiciones ambientales adecuadas los quistosoros, tienen la capacidad de liberar un número suficiente de zoosporas que potencialmente pueden iniciar el proceso de infección en el hospedero.
Palabras claves: Extracto de raíces, quistosoro, sarna polvosa, papa.
Abstract. Spongospora subterranea (Wallroth) Lagerheim f. sp. subterranea Tomlinson is the causal agent of potato powdery scab. This pathogen is worldwide distributed on the potato fields, infections occurs by zoospores which are inside resting spores called sporeballs or cystosori which are the principal way of disease spread. Sporeballs can be found on tubers, roots and soil as resistance structure, that can survive during many years until the weather conditions favor the zoospore release in order to start new infections on potato and wild host species. In this research was evaluated the temperature, cystosori inoculum source from tuber, potato roots and soil, and the effect of potato roots exudates in order to verify the conditions where the zoospore release occurs. Thus, two assays were carried out; in the first assay, the effect of water and potato root exudates were evaluated and in the second assay, was performed on potato root exudates at different inoculum sources. Mobile zoospores were counted in a Neubauer chamber during 120 hours at 24 h intervals. Both experiments showed that root exudates had a high influence in the zoospore release, the best releases were obtained between 15 and 23 °C from 48 to 96 hours. There was not difference among the inoculum sources, it means that any sporeball, if the weather conditions have been adequate, has the capacity to produce sufficient number of zoospores to start the infection process inside the host.
Key words: Roots extract, cystosori, powdery scab, potato
La sarna polvosa de la papa, causada por Spongospora subterranea (Wallroth) Lagerheim f. sp. subterranea Tomlinson, es una de las enfermedades que está aumentando en el cultivo de la papa (Solanum tuberosum) en todas las zonas productoras del mundo (Carling, 1996; Harrison et al., 1997). Este patógeno del suelo viene cobrando importancia ya que limita la producción de papa llegando a excluir zonas para este cultivo, además de ser vector del virus del Mop Top (PMTV). S. subterranea f. sp. subterranea es un protozoario perteneciente al phylum Plasmodiophoromycota del cual, la familia más importante es Plasmodiophoraceae, siendo las especies más conocidas Plasmodiophora brassicae, que causa la hernia de las crucíferas, Spongospora subterranea, que provoca la sarna polvosa de la papa y Polymyxa graminis, que causa diversas enfermedades en raíces de cereales y otras gramíneas (Gallego y Sánchez, 2008).
El síntoma típico de la enfermedad es la presencia de raíces deformadas, esféricas, ahusadas o más o menos amorfas en forma de agallas, aunque no huecas y tubérculos con pústulas que se juntan y pueden llegar a formar una sola lesión grande. La parte aérea no resulta afectada al principio, pero la absorción de agua es menor y puede darse una marchitez de mediodía (Gallego y Sánchez, 2008).
S. subterranea, f. sp. subterranea, es un parásito intracelular obligado con división celular cruciforme y que forma estructuras de resistencia llamadas quistosoros, los cuales según Merz (1997), son favorecidos por la presencia de condiciones medio-ambientales adecuadas como temperatura y humedad; estímulos inducidos por la planta y el periodo de latencia para la liberación de zoosporas. Los quistosoros son de forma ovoide, color ocre oscuro, con un diámetro de 20 a 80 µm con la apariencia de una pelota de golf; las zoosporas poseen 2 flagelos de diferente tamaño insertados lateralmente en un ángulo de 180º, el flagelo largo mide entre 0,8-16,4 µm y el pequeño entre 0,4-5 µm.
Según Hooker (1981), hay dos fases importantes del ciclo de vida de este patógeno, cada una iniciada por la infección de la célula huésped a través de un plasmodio unicelular. La fase esporogénica se presenta después de la división nuclear, produciendo esporas de pared gruesa, las cuales son altamente resistentes. Cada espora libera una sola zoospora primaria biflagelada, la cual entra en el sistema radical del huésped. En la fase esporangial, el esporangio de paredes delgadas se desarrolla entre células huéspedes, en las cuales se forman de una a ocho zoosporas desde un plasmodio esporangiogineo.
Las zoosporas secundarias también son biflageladas y pueden salir del huésped e iniciar otro ciclo de infección, estas pueden ser enquistadas por agentes artificiales que en condiciones de laboratorio se puede inducir por una alta concentración de químicos o agitación mecánica, pero en condiciones naturales se debe al reconocimiento de un componente de la superficie del huésped (Donaldson y Deacon, 1993). De acuerdo con estos mismos autores, varios eventos ocurren rápidamente durante el enquistamiento de las zoosporas, las células son preprogramadas a responder a una señal inicial de formación de quistes, liberando los flagelos, la zoospora se vuelve redonda y el núcleo migra a una posición central, algunas vesículas externas se fusionan con la membrana celular y depositan su contenido sobre la superficie de la célula. Dicho contenido incluye una membrana protectora glicoproteica de las vesículas dorsales pequeñas y una proteína adhesiva o glicoproteina de las vesículas ventrales. La producción de membrana normalmente se completa entre 5-6 minutos. El tubo germinativo emerge entre 20-30 minutos, luego se produce un apresorio (Donaldson y Deacon, 1993).
La persistencia de los quistosoros en el suelo y tubérculos hace que la sarna polvosa sea una enfermedad de difícil manejo (Harrison et al., 1997), estas estructuras de resistencia permanecen en el sustrato por mas de seis años y sobreviven al paso por el tracto intestinal de los animales alimentados con tubérculos infectados (Torres, 2002). La prevalencia de socas ha aumentado la contaminación de los suelos por la supervivencia de los quistosoros (De Wale, 2000), los cuales se distribuyen en parches y el desarrollo como tal de la enfermedad es altamente dependiente de las condiciones ambientales (Lees, 2000).
Según García y Navia (2002), en pruebas de bioensayo la liberación de zoosporas se vio influida por la presencia de diferentes hospederos, con plántulas de papa la liberación fue mayor a 11 °C y en un tiempo de 18 horas. La liberación a partir de raíces de papa con infección se vio influida por la temperatura a 6 °C, la liberación fue lenta y sostenida durante un periodo de 11 días, mientras que a 16 y 20 °C la liberación fue rápida, pero la concentración disminuyó más rápidamente. Girón y Robayo (2006), estudiando el efecto de los exudados de raíces de seis cultivares de plántulas de papa provenientes de cultivos in vitro sobre la liberación de las zoosporas, no encontraron diferencias significativas entre los extractos, pero al comparar el efecto de diversas soluciones nutritivas, estas presentaron diferencias en un primer ensayo, mientras que en un segundo ensayo, el efecto de los exudados de las raíces de los cultivares de papa presentaron diferencias significativas.
Con el fin de avanzar en el conocimiento de aspectos biológicos de S. subterranea f. sp. subterranea, se hace necesario obtener una cantidad suficiente de inóculo infectivo; por lo tanto, en este trabajo se pretende establecer bajo condiciones controladas la liberación de zoosporas como base para una efectiva inoculación del patógeno, definiendo el mejor medio, la fuente de quistosoros, la temperatura y el tiempo en el cual ocurre la mayor liberación de zoosporas.
MATERIALES Y MÉTODOS
Obtención de quistosoros. Para evaluar el mejor inóculo se establecieron tres fuentes de quistosoros a partir de agallas de raíces, pústulas de tubérculos y suelo colectados en 2007 para este experimento, haciendo la extracción de acuerdo con diferentes protocolos a saber: Para obtener los quistosoros a partir de suelo se siguió la metodología propuesta por Jaramillo y Botero (2007), a partir del tubérculo se utilizó la metodología propuesta por Van de Graaf (2005), para extraer quistosoros de raíces infectadas se modificó esta última metodología, en la cual se utilizaron agallas de raíz seca.
Estandarización de la concentración de quistosoros a utilizar en el experimento. Se preparó una suspensión de quistosoros purificados en un solución de Tween 80 al 0,1% de 10 mgml de quistosoros aislados a partir de las tres fuentes y se realizaron conteos en cámara de Neubauer, siguiendo la metodología de Castaño (1994), para obtener una concentración estándar de 2,4 x 104 quistosoros/ml de inóculo para todas las fuentes a utilizar; esta concentración se estableció con base en la muestra más limitante de inóculo, que en este caso fue tubérculo.
Obtención de extractos de papa. Los extractos se obtuvieron a partir de raíces sanas de papa (Solanum tuberosum), variedad Diacol Capiro, para lo cual se tomaron 75 g de peso fresco de raíz y se licuaron en 750 ml de agua destilada.
Descripción de los experimentos. Para estudiar la liberación de zoosporas a partir de tres fuentes diferentes de quistosoros, se implementaron dos experimentos variando el medio líquido y la temperatura.
Experimento 1. Las evaluaciones se realizaron en el laboratorio de Control Biológico de la Universidad Nacional de Colombia, Sede Medellín, haciendo conteos con cámara de Neubauer en cinco campos visuales. Se hicieron seis evaluaciones en el tiempo así: 6, 24, 48, 72, 96 y 120 horas. El diseño utilizado para este experimento, fue un completamente al azar con arreglo factorial de 2x3x4 con dos medios (agua y exudado de raíces), 3 fuentes de quistosoros (raíz, tubérculo y suelo) y 4 temperaturas (5, 20, 25 °C y ambiente que para las condiciones locales es de 15/23 °C) para un total de 24 tratamientos, cada tratamiento constó de 3 repeticiones, siendo cada repetición un tubo Falcon de 50 ml. Las diferentes temperaturas se alcanzaron utilizando nevera PHILIPS POLARIX, incubadoras DBO ref IDR-9 EIQ-EQUIPOS y MEMMERT ALEMANIA ref. 854SCHWABACH y estufa MEMMERT modelo INE 400. Para el conteo de zoosporas liberadas se tomó como parámetro el número de zoosporas móviles, tomando como criterio la forma, los flagelos y el movimiento de las zoosporas, descartando formas similares sin movimiento, microorganismos con flagelos diferentes y microorganismos de formas diferentes con flagelos en movimiento. Así de cada repetición en cada uno de los tratamientos se tomó una alícuota de 10 µl de la suspensión para cada conteo, realizando las observaciones en un microscopio OLYMPUS CH30 RF100 a 40X.
Experimento 2. Con base en los resultados obtenidos en el primer experimento se realizó un segundo, con cinco evaluaciones en el tiempo, a 24, 48, 72, 96 y 120 horas. Se empleó un diseño completamente el azar con arreglo factorial de 3 x 4, con 3 fuentes de inóculo, las mismas del primer experimento y 4 temperaturas (15, 20, 25 °C y ambiente). La evaluación se realizó con extracto de raíces. Los criterios y metodologías de toma de muestras fueron similares a los descritos para el Experimento 1.
El análisis estadístico de los resultados de ambos experimentos se llevó a cabo mediante el programa SAS System v.9.3.1 usando el procedimiento MIXED, utilizando un análisis de medias repetidas en el tiempo.
RESULTADOS Y DISCUSIÓN
Experimento 1. En la Tabla 1 se puede observar el efecto de cada una de las interacciones dobles en los parámetros evaluados indicando que hay diferencias significativas en todas ellas, menos en la que se involucran las variables fuente-temperatura, de cuatro interacciones triples, tres de ellas tienen diferencia estadística significativa: sustrato-fuente-tiempo, sustrato-tiempo-temperatura y fuente-tiempo-temperatura, lo que indica que existe un efecto diferencial del sustrato, las fuentes y las temperaturas evaluadas. En la Figura 1, se muestra la diferencia existente en cuanto a sustratos cuando se evalúa la interacción sustrato-fuente-tiempo. Se evidencia que hay una mayor liberación de zoosporas en las soluciones de extracto de raíz, comparado con los mismos tratamientos en agua, durante el tiempo evaluado. Resultados similares han sido encontrados por Merz (1993 y 1997) y Girón y Robayo (2006), en los cuales se demuestra que las zoosporas son atraídas por exudados radicales, lo cual puede ser la señal primaria para la invasión de hospedantes. Merz (1993), encontró que los exudados de plántulas de tomate y trigo favorecían la infección de la raíz por S. subterranea f. sp. subterranea, mientras que con agua se presentó la menor infección por las zoosporas. En el presente experimento, la liberación de zoosporas en agua no muestra ningún cambio significativo durante el tiempo de evaluación (96 horas), mientras que con extracto de raíz, la evaluación se prolongó hasta las 120 horas, momento en el cual se nota un descenso en el número de zoosporas móviles observadas. Para las condiciones experimentales llevadas a cabo en este estudio, el máximo de liberación de zoosporas ocurrió entre las 48 y las 96 horas, presentando diferencia en las fuentes de quistosoros, mostrando una mayor liberación a partir de aquellos provenientes de raíz a las 96 horas; sin embargo, al finalizar el experimento a nivel estadístico, no fue evidente la diferencia entre las fuentes de inóculo utilizado, indicando esto que cualquiera de las fuentes de inóculo puede ser infectiva, o por lo menos libera zoosporas indistintamente.
Tabla 1. Análisis de varianza para la evaluación de los factores que inciden en la liberación de zoosporas de Spongospora subterranea f. sp. subterranea. Experimento 1.
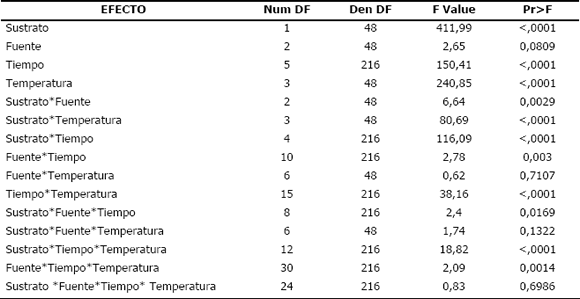
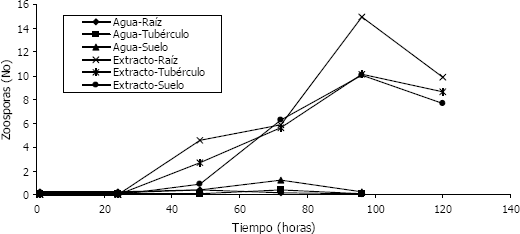
Figura 1. Relación entre el tipo de medio (agua-extracto), fuente de inóculo (raíz, tubérculo, suelo) y tiempo vs número de zoosporas observadas al evaluar los factores que inciden en la liberación de zoosporas de Spongospora subterranea f. sp. subterranea.. Experimento 1.
El primer evento de liberación se registró a las 24 horas, el cual continuó hasta las 120 horas. Cabe anotar que a partir de las 48 horas las zoosporas se encuentran turgentes y van aumentando levemente su tamaño, lo que hace la lectura más fácil en términos metodológicos. El medio de máxima liberación coincide con los mencionados por Girón y Robayo (2006), quienes observaron diferencias en los promedios de liberación de zoosporas con exudados de raíces entre los tratamientos agua, solución nutritiva completa y solución NPK, siendo todos significativamente diferentes. De otro lado, los tiempos de liberación de zoosporas difieren un poco de los señalados por Garcia y Navia (2002), quienes detectaron el inicio de liberación a las 18 horas, a una temperatura de 11 °C en presencia de plantas de papa en medio líquido. Aunque en el presente experimento a las 120 horas fue registrado movimiento de zoosporas, muchas de éstas presumiblemente ya se encontraban enquistadas por lo cual no fueron consideradas para la evaluación, este enquistamiento puede inducirse, como lo citan Donaldson y Deacon (1993), al no encontrar señales del hospedante.
Experimento 2. En la Tabla 2 se aprecia que al utilizar un menor número de factores se hacen evidentes el efecto significativo de las variables tiempo y temperatura pero no en fuentes de inóculo, siendo la temperatura de 15 °C diferente a las otras evaluadas, las cuales conformaron otro grupo, mientras que en el tiempo, la diferencia se observó entre las 72 horas y las otras evaluadas, donde se observó mayor liberación. En la Figura 2 se muestra que a los 15 °C se presentó la mayor liberación de zoosporas con una ligera disminución a 20 °C, no obstante a 23 °C, es decir a temperatura ambiente, hay un aumento en el número de zoosporas liberadas, lo que sugiere que los cambios de temperatura día/noche tienen un efecto positivo sobre la liberación de zoosporas, lo cual coincide con el resultado observado en el primer experimento, donde la mayor liberación se obtuvo también a temperatura ambiente, mientras que a 25 °C se nota la disminución en el número de zoosporas, lo que indica que este patógeno requiere de temperaturas menores a 23 °C o fluctuaciones de temperatura, para inducir la liberación de zoosporas en las condiciones de producción de tubérculo en el trópico.
Tabla 2. Análisis de varianza para los factores que inciden en la liberación de zoosporas de Spongospora subterranea f. sp. subterranea. Experimento 2.

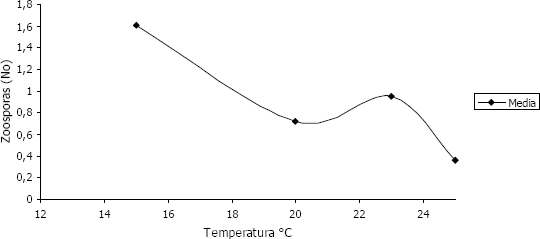
Grafica 2. Relación entre la temperatura y el número de zoosporas observadas al evaluar los factores que inciden en la liberación de zoosporas de Spongospora subterranea f. sp. subterranea. Experimento 2.
Harrison et al. (1997) en experimentos realizados en Escocia, observaron que las zoosporas nadan vigorosamente a temperaturas cercanas a 0 ºC, sugiriendo que es posible que S. subterranea f. sp. subterranea, cause infección, aunque sea muy lenta, a temperaturas inferiores a 11 ºC, sin embargo, y de acuerdo con Pérez (2006), en trabajos realizados en Colombia, temperaturas de 4 °C no favorecen la emergencia de zoosporas primarias, información que corrobora los datos encontrados en este experimento, donde en la temperatura de 5 ºC, no se observó liberación. Estas divergencias en los resultados sobre las temperaturas que favorecen la liberación de zoosporas, pueden deberse a que dichos estudios han sido realizados en diferentes condiciones de origen, lo que presumiblemente puede influir en la respuesta de este microorganismo a los estímulos por cambios drásticos de temperatura y humedad en su ambiente natural, así como a una posible diferencia entre las poblaciones de S. subterranea f. sp. subterranea estudiadas en Europa y las encontradas en América, específicamente en Colombia (Jaramillo et al., 2008).
Teniendo en cuenta que en el Experimento 2, no existió liberación significativa antes de las 48 horas para las condiciones experimentales probadas y que la liberación tuvo su mayor desarrollo a las 72 horas, conservando la tendencia de liberación hasta las 120 horas, se puede inferir que este fenómeno es dependiente de las interacciones de diferentes factores como temperatura, tiempo y medio de liberación, que para el caso son exudados de raíz. Posiblemente estas interacciones evaluadas son únicas y altamente influenciadas por los exudados de plantas, por lo cual se hace complejo determinar exactamente los elicitores de la liberación de zoosporas, y pueden ser la explicación de la divergencia o contraste de rangos que se encuentran en la literatura y aunque es evidente que hay condiciones en las cuales la liberación llega a su punto más alto, como generalidad, puede decirse que hay mayor liberación entre 15 y 23 °C y entre las 48 y las 96 h de evaluación en presencia de exudados de la planta. Así, puede concluirse que este evento biológico depende de factores físicos, bioquímicos y aunque no se evaluó la infectividad del inóculo liberado, es claro que no es sólo un factor el encargado de determinar el inicio de la liberación de zoosporas a partir de quistosoros, sino el conjunto de los mismos, lo que hace que el estudio de este fenómeno en condiciones controladas, pueda llegar a ser diferente a como ocurre en condiciones de campo; sin embargo, su estandarización en estas condiciones, permite realizar experimentos posteriores para verificar la infectividad del inóculo y otros factores que influyen en este evento.
CONCLUSIONES
Se logró establecer en condiciones controladas la liberación de zoosporas de S. subterranea f. sp. subterranea, lo que permitió estandarizar la metodología para ser utilizada en posteriores estudios de infección del patógeno.
Las mejores condiciones de liberación corresponden a una temperatura entre 15 a 23 °C (temperatura ambiente) y con fluctuaciones entre día y noche.
No existe diferencia en términos de liberación de zoosporas entre los quistosoros obtenidos de suelo, pústulas de tubérculo y agallas de raíz.
El tiempo requerido para lograr la liberación y posterior observación de zoosporas fluctúa entre las 48 y las 96 h después de poner el inóculo en contacto con el medio líquido.
El sustrato utilizado para una mayor liberación es el extracto de raíz de papa variedad Diacol Capiro, puesto que con agua, no se presenta el estímulo necesario para una liberación significativa.
La liberación puede lograrse con estas condiciones siempre y cuando se logre dar una interacción entre todos los factores sustrato, fuente de inoculo y temperatura y con el tiempo requerido.
BIBLIOGRAFÍA
Carling, D. 1996. First report the powdery scab of potatoes in Alaska. Plant Disease 80:1208. [ Links ]
Castaño Z.J. 1994. Prácticas de Laboratorio de Fitopatología. Segunda Edición. Escuela Agrícola Panamericana, Departamento de Protección Vegetal. Zamorano. 103 p. [ Links ]
Donaldson, S.P. and J.W. Deacon. 1993. Differential encystment of zoospores of Pythium species by saccharides in relation to establishment on roots. Physiological and Molecular Plant Pathology 42(3): 177-184. [ Links ]
Gallego, E. y J. Sánchez. 2008. MYCO-UAL. En: Universidad de Almería, Área de Botánica, http://www.ual.es/GruposInv/myco-ual/plasmoph.htm; consulta: Marzo 2008. [ Links ]
García, C. y E. Navia. 2002. Manejo integrado de plagas parte III. Evaluación de estrategias de manejo de la roña polvosa (Spongospora subterranea) en las tres regiones más productoras de papa en Colombia. En: Redepapa, http://www.redepapa.org/practicasculturalesred3.html; consulta: enero 2008. [ Links ]
Girón J.A. y N.J. Robayo. 2006. Efecto de los exudados de la raíz de seis cultivares de papa (Solanum tuberosum, tuberosum) en la liberación de zoosporas primarias de Spongospora subterranea f. sp. Subterranea, Trabajo de grado. Facultad de Ciencias Agropecuarias. Universidad Nacional de Colombia. Bogotá. 27 h. [ Links ]
Guerrero, O. 2000. La roña o sarna polvosa en el Departamento de Nariño. pp. 127-129. En: Fedepapa. Papas Colombianas. Segunda edición. Bogotá. [ Links ]
Harrison, J.G., R.J. Searle and N.A. Williams. 1997. Powdery scab disease potato a review. Plant Pathology 46: 1-25. [ Links ]
Hooker, W.J. 1981. Compendium of Potato Diseases. American Phytopathological Society Press, St. Paul. MN. 125 p. [ Links ]
Jaramillo, S. y J.M. Botero. 2007. Respuesta de diferentes poblaciones de Spongospora subterranea f. sp. Subterranea a la rotación entre dos variedades de papa (Solanum tuberosum ssp. andigena). Revista Facultad Nacional de Agronomía, Medellín 60(2): 3859-3876. [ Links ]
Jaramillo, S., G.A. Pérez y L. Hoyos. 2008. Variación morfológica de quistosoros de Spongospora subterranea (Wallr.) Lagerh f. sp. subterranea. Revista Facultad Nacional de Agronomía, Medellín 61(2):4510-4516. [ Links ]
Lees A.K. 2000. Summary of the session on past and present research on powdery scab. pp. 55-57. In: Merz U., A.K. Lees, (ed). Past and present research: Powderys scab. Proceedings of the First European powdery scab workshop. Aberdeen. Scotland . 110 p. [ Links ]
Merz, U. 1993. Epidemiological aspects of powdery scab of potatoes caused by Spongospora subterranea. pp. 104-106. En: Proceedings of the 2nd Symposium of the International Working Group on Plant Viruses with Fungal Vectors. Montreal. [ Links ]
Merz, U. 1997. Microscopical observations of the primary zoospores of Spongospora subterranea f. sp. subterranea. Plant Pathology 46(5): 670–674. [ Links ]
Pérez, G. 2006. Observaciones microscópicas de quistosoros de Spongospora subterranea (Wallr.) Lagerh f. sp. subterranea, agente causal de la sarna polvosa de la papa. Trabajo de grado. Facultad de Ciencias Agropecuarias. Universidad Nacional de Colombia. Medellín. 29 h. [ Links ]
SAS Institute INC. SAS/STAT®. 2004. Users Guide. Version 9.1. Cary, NC: SAS Institute Inc. 5136 p. [ Links ]
Torres, H., M.A. Pacheco and E.R. French. 1995. Resistance of potato to powdery scab (Spongospora subterranea) under Andean field conditions. American Journal of Potato Research 72 (6): 355-363 [ Links ]
Torres, H. 2002. Roña (Spongospora subterranea). pp. 27-31. En: Torres, H. Manual de las enfermedades más importantes de la papa en el Perú. Centro Internacional de la Papa (CIP). Lima. 59 p. [ Links ]
Van de Graaf, P., A.K. Lees, S.J. Wale and J.M. Duncan. 2005. Effect of soil inoculum level and environmental factors on potato powdery scab caused by Spongospora subterranea. Plant Pathology 54(1): 22–28. [ Links ]
Wale de S.J. 2000. Summary of the session on past and present research on powdery scab. pp. 3–9. In: Merz U., A.K. Lees, (ed). Past and present research: Powderys scab. Proceedings of the First European powdery scab workshop. Aberdeen. Scotland . 110 p. [ Links ]














