Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Facultad Nacional de Agronomía Medellín
Print version ISSN 0304-2847
Rev. Fac. Nac. Agron. Medellín vol.61 no.2 Medellín July/Dec. 2008
VARIACIÓN MORFOLÓGICA DE QUISTOSOROS DE Spongospora subterranea (Wallr.) Lagerh f. sp. subterranea.
MORPHOLOGIC VARIATION OF CYSTOSORUS OF Spongospora subterranea (Wallr.) Lagerh f. sp. subterranea.
Sonia Jaramillo Villegas1; Gustavo Alberto Pérez Avendaño2 y Liliana María Hoyos Carvajal3
1 Profesora Asociada. Universidad Nacional de Colombia, Sede Medellín. Facultad de Ciencias Agropecuarias. A.A. 1779. Medellín, Colombia. <sjaramal@unalmed.edu.co>
2 Ingeniero Agrónomo. Universidad Nacional de Colombia, Sede Medellín. Facultad de Ciencias Agropecuarias. A.A. 1779. Medellín, Colombia.
3 Profesora Auxiliar. Universidad Nacional de Colombia, Sede Bogotá. Facultad de Agronomía. A.A. 14490. Bogotá, Colombia. <limhoyosca@unal.edu.co>
Recibido: Mayo 16 de 2008; aceptado: Agosto 1 de 2008
Resumen. La sarna polvosa de la papa causada por Spongospora subterranea, f. sp. subterranea es uno de los principales patógenos en papa, por las pérdidas que causa al producir agallas en raíces y/o pústulas en los tubérculos, volviendo el producto no apto para el mercado, además de su alta sobrevivencia en el suelo por periodos de tiempo prolongados. El estudio de la variabilidad de S. subterranea es incipiente y aún no muy bien entendido, así como su biología y métodos de control en campo. Se detallan características morfológicas de algunas poblaciones de una mezcla de quistosoros tomados de pústulas de tubérculos o agallas de raíces infectadas con S. subterránea procedentes de Cundinamarca, Antioquia, Boyacá y Nariño, principales zonas productoras de papa en Colombia y se realizaron comparaciones con las observaciones de otros autores en Europa y Asia. Estos contrastes son llevados a cabo mediante las mediciones de quistosoros del patógeno con microscopía de luz y electrónica. Los resultados permitieron determinar los rangos de tamaño de las poblaciones colombianas, los cuales se encuentran entre 20 y 45 µm, indistintamente de sus procedencia geográfica, pero con menor tamaño para quistosoros de agallas de raíces comparados con quistosoros de tubérculos. A su vez ambos presentaron menores dimensiones que los reportados por otros autores para Europa y Asia. Detalles de ornamentación y morfología de poblaciones colombianas, difieren de las poblaciones europeas, sugiriendo algún grado de variabilidad entre las poblaciones de estas localidades.
Palabras claves: Quistosoros, sarna polvosa, zoosporas, tubérculos.
Abstract. Powdery scab caused by Spongospora subterranea f. sp. subterranea is one of the main pathogens on potato, by losses that cause to produce galls on roots and/or pustules tuber, turning the product no apt to market, beside its high survival underground per prolonged periods of time on soil. The study of variability of S. subterranea is incipient and not yet well understood, neither its biology and methods of control in field. In the following observations morphologic characteristics of some populations of a mixture of cystosorus taken from pustules of tuber or root galls infected with S. subterranea f. sp. subterranea from Cundinamarca, Antioquia, Boyacá and Nariño, main producing zones of potato in Colombia, and were performed comparisons with the observations of other authors in Europe and Asia. These assessments were carried out by means of the measurements of cystosorus of the pathogen with light and electronic microscopy. The results allowed to determine the ranks of size of the Colombian populations, which that are between 20 and 45 µm, indifferently of their geographic origin, but with so minor size for those from root galls compared with cystosorus from tuber. Both presented minor dimension that the reported by other authors for Europe and Asia. Details of ornamentation and morphology of Colombian populations, differ from the European populations, suggesting some degree of difference or variability between the populations of these localities.
Key words: Quistosoros, scabies dusty, zoosporas, tubers.
En Europa la sarna polvosa fue reportada por Wallroth en 1842, concluyendo que los síntomas eran causados por un hongo, en su momento llamado Erysibe subterranea. Luego en Brunchhorst en 1886, le da el nombre de Spongospora solani, que también ha tenido otros sinónimos como Sorosporium scabies, Spongospora scabies, Tuburcinia scabies y finalmente en 1891, Lagerheim propuso el nombre de Spongospora subterranea (Wallr.) Lagerh. Actualmente este organismo está ubicado en la familia Plasmodiophoridae perteneciente al reino Protozoa (Braselton, 1995; Merz, 2008) y cuenta con dos formas especiales S. subterranea f. sp. nasurtii y S. subterranea f. sp. subterranea; esta última ataca la papa causando pústulas en tubérculos y agallas en raíces.
La enfermedad causa pérdidas económicamente significativas, a los productores de papa en todo el mundo; sin embargo, el desconocimiento de la biología de este protozoo fitopatógeno, ha sido una de las desventajas para su control y erradicación. De igual manera sus variaciones morfológicas, patogénicas y moleculares son poco entendidas (Falloon et al., 2003; Merz 1997; Qu et al., 2001; Qu et al., 2006); razón por la cual, se han desarrollado métodos de diagnóstico temprano basados en técnicas inmuno-enzimáticas y moleculares (ELISA, PCR en sus diferentes variaciones), herramientas que pueden ser empleadas para detección, estudios epidemiológicos y programas de mejoramiento de variedades resistentes.
Los caracteres empleados en taxonomía de S. subterranea f. sp. subterranea y por ende para entender su variabilidad, son en primera instancia, caracteres morfológicos como la forma del quistosoro, su tamaño, la forma y tamaño del zoosporangio (Waterhouse, 1973). Los estudios realizados por Merz, (1997 y 2001) e Iftikar et al. (2002), ilustran la morfología de los quistosoros y zoosporas primarias de S. subterranea f. sp. subterranea, indicando que características como la ornamentación de los quistosoros y la forma característica de los flagelos de las zoosporas son factores para la identificación y aclaran aspectos morfológicos del patógeno y a su vez sugieren posibles mecanismos de penetración de órganos subterráneos (raíces, estolones y tubérculos en desarrollo) de la planta, dispersión y resistencia a condiciones ambientales adversas.
En este estudio se describen algunas características morfológicas de cinco poblaciones de S. subterranea f. sp. subterranea en Colombia y se realizan contrastes con las observaciones de Merz (1997 y 2001) de poblaciones Europeas y de Iftikhar et al., (2002), de poblaciones de Pakistán.
METODOLOGÍA
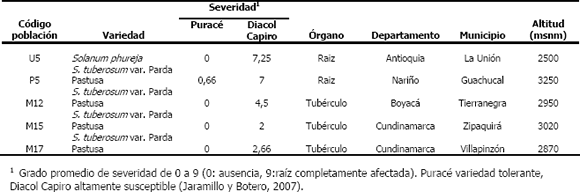
Microscopía de luz. Por cada población de origen, se utilizaron 20 quistosoros tomados al azar de una mezcla de agallas de varias raíces de papa o de pústulas de diferentes tubérculos procedentes de distintas localidades de Colombia (Tabla 1). Algunas raíces con agallas se fijaron en Carnoy (etanol 70% y ácido acético 95% en una proporción 3:1), de este tejido se separaron quistosoros y se observaron y midieron bajo microscopio de luz en 40X (Microscopio óptico Zeiss Axiostar Plus Remote Capture Versión 2.7.3.23 Cannon). Se compararon los tamaños de los quistosoros entre las poblaciones evaluadas y se hizo una prueba de comparación de medias, mediante el programa SAS (SAS Institute Inc. 1989). Para determinar la cantidad de absorción de agua de los quistosoros, entendida como cambio en el volumen de los mismos, se midió el diámetro de 20 quistosoros tomados al azar de una mezcla agallas de raíces de la muestra U5 y se imbibieron en agua corriente por 24 horas, al cabo de las cuales se realizó nuevamente la medición.
Tabla 1. Procedencia de tubérculos de papa empleados para estudiar la variabilidad morfológica de los quistosoros de Spongospora subterranea f. sp. subterranea.
Microscopía electrónica de barrido (MEB). Para los estudios de microscopía electrónica se tomó al azar una cantidad de quistosoros de una población (grupo de quistosoros de varias lesiones de una misma planta o de diferentes plantas de un mismo sitio), se secaron al aire y fueron llevadas a punto crítico de secado para ser orificado y observados mediante MEB (JEOL JSM-5910 LV Scanning Electron Microscope), cuyas condiciones de trabajo fueron 15 KVoltios, spot (señal) de 36 y distancia de trabajo de 10 mm, con aumentos variables.
RESULTADOS
Las observaciones de los quistosoros realizadas bajo microscopio de luz mostraron que la mayoría tienen autofluorescencia y son de forma poliédrica o ligeramente elipsoidal de color amarillo-marrón (Figura 1A y B). La microscopia electrónica de barrido indica que los soros son de forma ovoide, irregular y su unión y ornamentación confieren una apariencia rugosa al quistosoro (Figura 2 A y B). El tamaño promedio de las 20 quistosoros tomados al azar de cada población (Tabla 1), oscilaron en el rango de 20 a 45 mm indistintamente de su procedencia geográfica u órgano de la planta. Cabe destacar que estas poblaciones presentaron diferente grado de severidad en dos variedades de papa.
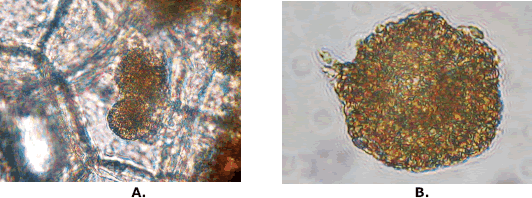
Figura 1: Observaciones de quistosoros de Spongospora subterranea f. sp. subterranea realizadas en tubérculos de papa bajo microscopia de luz.

Figura 2: Observaciones de soros de Spongospora subterranea f. sp. subterranea realizadas en tubérculos de papa bajo microscopia electrónica de barrido.
Las zoosporas observadas presentan dos flagelos heterocontos de tamaño diferente, con los cuales se movilizan a través del agua. El primer registro de liberación de zoosporas primarias ocurrió seis (6) horas después del primer montaje, sin embargo al realizar la fijación con el alcohol y el ácido acético, esta se enquistó liberando sus flagelos, cuyo tamaño fue alrededor de 3 mm.
Cuando los quistosoros se hidrataron durante 24 horas en agua potable, se observó un cambio (Δ) en su tamaño, esto obedece a ganancia de agua de la estructura que posiblemente se relaciona con el acondicionamiento previo a la liberación de zoosporas (Tabla 2), entendida el agua como posible mediadora en la activación de procesos bioquímicos.
Tabla 2. Cambios en el tamaño de los quistosoros de Spongospora subterranea f. sp. subterranea de la población U5, imbibidos en agua corriente.

DISCUSIÓN
Para el caso colombiano los quistosoros de las poblaciones evaluadas se encuentran en el límite inferior del rango reportado por Jones (1978) y Lahert y Kavanagh (1985), quienes encontraron tamaños entre 19 a 85 mm. Dentro de las poblaciones colombianas, los quistosoros no difieren estadísticamente en su tamaño por su origen geográfico, pero si por el órgano atacado, con aumento de volumen de los quistosoros de pústulas procedentes de tubérculos, en relación con los procedentes de agallas de raíces. Otros estudios con las mismas poblaciones evaluadas en este trabajo, demuestran que hay diferencias patogénicas (Jaramillo y Botero, 2007) y moleculares (Jaramillo et al., 2004).
Con respecto a la patogenicidad, se observó que las poblaciones procedentes de Antioquia y Nariño, las cuales son originadas en agallas de raíz, presentaron altos niveles de severidad en raíces de la variedad Diacol Capiro altamente susceptible. Las poblaciones de Cundinamarca y Boyacá procedentes de pústulas de tubérculos, tuvieron un nivel bajo de infección incluso para la variedad susceptible, lo anterior fue comprobado en tres ciclos de cosecha con rotación entre las variedades de papa ICA Puracé, muy tolerante a la infección en raíces y Diacol Capiro. Los experimentos permitieron comparar el comportamiento de severidad de la enfermedad (Figura 3), deduciéndose que la población M15 presenta niveles de infección en raíces y/o tubérculos muy bajos, con relación a las poblaciones U5 y P5. Paralelo a éste, se realizaron trabajos de variabilidad molecular, que muestran que los aislamientos de baja patogenicidad como M17 y M10 (no incluida en este estudio), muestran divergencias de 2 y 3 nucleótidos con respecto a la secuencia ITS de los aislamientos; también se observó un patrón diferente de restricciones de ADN con la enzima TaqI. Lo anterior sugiere diferencias en estas poblaciones traducidas en grados de severidad de la enfermedad en las distintas localidades y genotipos de papa, pero que no son traducidas en diferencias morfológicas de acuerdo con los experimentos realizados en el presente estudio.
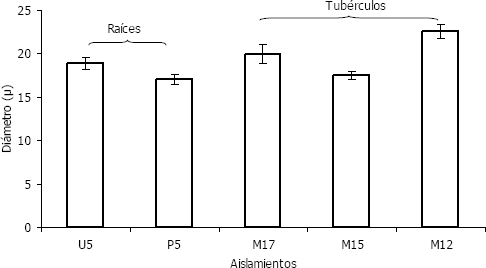
Figura 3. Tamaño de los Spongospora subterranea f. sp. subterranea presentes en tubérculos de papa procedentes de zonas productoras colombianas.
Es bien conocido que la hidratación de quistosoros es un evento previo a la liberación de zoosporas, esto se traduce también en un aumento de tamaño de esta estructura indicando que almacena agua en su interior, bien sea en los espacios huecos o en los soros mismos. Los suelos con propiedades ándicas, con altos contenido de Alofana de donde proceden las poblaciones de quistosoros de S. subterranea f. sp subterranea aquí evaluadas, tienen la capacidad de retener el agua en una proporción de 125% a capacidad de campo (30 kPa), y a punto de marchitez permanente (pmp o sea a 1.500 kPa) tienen un contenido de humedad del 75% y se han mencionado datos del 150% de agua a saturación, lo cual favorece el desarrollo de este microorganismo y potencia la enfermedad en época de lluvias, al propiciar condiciones adecuadas para la liberación y diseminación de zoosporas.
Análisis mas detallados de aspectos morfológicos por medio de MEB, evidencian cambios morfológicos en forma y ornato de los quistosoros de poblaciones colombianas con respecto a poblaciones europeas y de Pakistán de S. subterranea. Estas últimas presentan en la superficie, grupos de soros elevados, mientras que en las poblaciones colombianas se observan estos grupos en forma deprimida, contrastante con las suturas entre soros de poblaciones colombianas que son elevadas, y las suturas de los soros de las poblaciones europeas son hundidas. Los quistosoros observados en este estudio, tienen una forma poliédrica regular, en divergencia con las imágenes de los procedentes de poblaciones europeas que presentan formas irregulares. En ambas poblaciones las cavernas o agujeros presentan la misma arquitectura.
Diferencias en poblaciones de quistosoros de otros continentes han sido detectadas por Qu y Christ (2004), quienes encontraron dos grupos diferentes de S. subterranea, identificados mediante la diversidad de frecuencia de regiones ITS 1 y 2, denominados grupos I y II, ambos en muestras de Europa, pero en Norteamérica solo observaron el grupo II. Esto es coincidente con las observaciones de Bulman y Marshall (1998), quienes señalan que hay diferencias entre las poblaciones de S. spongospora de Australasia y Europa con respecto a las de algunas regiones de Escocia y del Perú. Es interesante anotar que en una comparación realizada entre secuencias de ambos estudios, las poblaciones de Australasia y Norteamérica son grupos genéticamente homogéneos, denominados como grupo II, mientras que los aislamientos de Suramérica son un solo grupo genético (grupo I), Europa cuenta con una mezcla de ambos tipos. Esto confirma la hipótesis de Karling (1942), quien sugiere que la sarna polvosa se originó en Suramérica en el Perú, y fue introducida a Europa en la época de la Colonia y luego vuelve a Norteamérica por importaciones de tubérculos infectados por sarna polvosa.
La ocurrencia de grupos genéticos de S. subterranea esta claramente relacionada con variedades de papa, aunque es conveniente ampliar el número de muestras empleadas, tanto del patógeno como de las variedades hospederos de las cuales proviene. Dentro de esta especie las formas especiales S. subterranea f. sp. subterranea y S. subterranea f. sp. nasurtii, se consideran así por su especificidad sobre hospederos y caracteres morfogenéticos, aunque los trabajos de Dick (2001) citados por Qu y Christ (2004) proponen que deben ser separados en dos especies diferentes. Estas variaciones son comunes en los plasmodiophoridos de interés agrícola como Polymixa betae y Plasmodiophora brassicae; por tanto, este trabajo es una aproximación al conocimiento de la variación morfológica que puede existir en Colombia, para lo cual es conveniente realizar investigaciones tendientes a dilucidar esta diferencias asociadas a las variedades y prácticas agrícolas y la forma como estas inciden en la selección de biotipos de S. subterranea, que permita determinar si hay ecotipos generados por condiciones ambientales o fisiotipos determinados por las variedades del hospedero o ambas condiciones. La pregunta, dado que hay variación morfológica suficiente, evidenciada en este trabajo, ¿podría ser considerada una nueva especie?.
AGRADECIMIENTOS
A la Universidad Nacional de Colombia, al Ministerio de Agricultura y Desarrollo Rural, a Cevipapa, como entidades que financiaron los trabajos, a los doctores Celsa García y Omar Guerrero por proporcionar muestras de papa con sarna polvosa, al doctor Ulei Merz por autorizar el uso y publicación de las fotografías de su pagina Web, al señor Medardo Pérez por la colaboración con la microscopía electrónica.
BIBLIOGRAFÍA
Braselton, J.P. 1995. Current status of the plasmodiophorids. Critical Reviews in Microbiology 21(4): 263-675. [ Links ]
Bulman, S.R. and J.W. Marshall. 1998. Detection of Spongospora subterranea in potato tuber lesions using the polymerase chain reaction (PCR). Plant Pathology 47(6): 759-766. [ Links ]
Falloon, R.E., R.A. Genet, A.R. Wallace and R.C. Butler. 2003. Susceptibility of potato (Solanum tuberosum) cultivars to powdery scab (caused by Spongospora subterranea f. sp. subterranea), and relationships between tuber and root infection. Australasian Plant Pathology 32(3): 377-385. [ Links ]
Iftikhar, S., F. Fahmeed, I. Ahmad and A. Hameed. 2002. Characterization of Spongospora subterranea f. sp. subterranea, the cause of powdery scab of potato in Pakistan . Online Journal of Biol. Sciences. 2(7): 441-443. [ Links ]
Jaramillo, S. y J.M. Botero. 2007. Respuesta de diferentes poblaciones de Spongospora subterranea f.sp.subterranea a la rotación entre dos variedades de papa (Solanum tuberosum ssp.andigena). Revista Facultad Nacional de Agronomía Medellín 60(2): 3659-3876. [ Links ]
Jaramillo, S., L.H. Hincapié, E. Calderón, L. Afanador, C. Narváez, A. Machuca y. G. Correa. 2004. Caracterización Patogénica y Molecular de diferentes poblaciones Spongospora subterranea en Colombia, Fase II. Informe Mimeografiado. Universidad Nacional de Colombia, Sede Medellín. 90 p. [ Links ]
Jones, D. 1978, Scanning electron microscopy of cystosori of Spongospora subterranea. En: Transactions of British Mycology Society 70: 292-293. [ Links ]
Karling, J.S. 1942. The Plasmodiophorales. Published by John S. Karling. New York. 144 p. [ Links ]
Lahert, H. and. J.A. Kavanagh. 1985. The fine structure of cystosorus of Spongospora subterranea, the cause of powdery scab of potatoes. Canadian Journal of Botany 63(12): 2278-2282. [ Links ]
Merz, U. 2008. Spongospora. En: http://www.spongospora.ethz.ch/intro.htm; consulta: abril 2008. [ Links ]
Merz, U. and A.K. Lees. 2001. Proceedings of the First European Powdery Scab Workshop. Scottish Crop Research Institute, Aberdeen. 104 p. [ Links ]
Merz, U. 1997. Microscopical observations of the primary zoospores of Spongospora subterranea f.sp. subterranea. Plant Pathology 46(5): 670-674. [ Links ]
Qu, X.S., J.A. Kavanagh, D. Egan and H. Lahert. 2001. Studies on amoebae and cysts associated with the isolation of Spongospora subterranea f. sp. subterranea in vitro. Plant Pathology 50(4): 420-426. [ Links ]
Qu, X.S. and B.J. Christ. 2004. Genetic variation and phylogeny of Spongospora subterranea f.sp. subterranea based on ribosomal DNA sequence analysis. American Journal of Potato Research 81(6): 385-394. [ Links ]
Qu, X.S., J.A. Kavanagh, D. Egan and B.J. Christ. 2006. Detection and quantification of Spongospora subterranea f. sp. subterranea by PCR in host tissue and naturally infested soil. American Journal of Potato Research 83(1): 21-30. [ Links ]
SAS Institute Inc. 1989. SAS/STAT Users Guide, Version 6. 4th ed., Vol. 1. SAS Institute Inc. Cary, NC. [ Links ]
Waterhouse, G. 1973. Plasmodiophoromycetes. pp. 75-82. En: G.C. Ainsworth, F.K. Sparrow and A.S. Sussman (eds.). The fungi: an advanced treatise. Volume IVB. A taxonomic review with keys: basidiomycetes and lower fungi. Academic Press. New York. 621 p. [ Links ]














