Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Revista Facultad Nacional de Agronomía Medellín
versão impressa ISSN 0304-2847
Rev. Fac. Nac. Agron. Medellín v.62 n.1 Medellín jan./jun. 2009
VARIABILIDAD GENÉTICA DE AISLAMIENTOS COLOMBIANOS DE Phytophthora infestans (Mont) de Bary EN SOLANÁCEAS CULTIVADAS EN COLOMBIA
GENETIC VARIABILITY OF ISOLATES OF Phytophthora infestans (Mont.) de Bary IN SOLANACEOUS CROPS FROM COLOMBIA
Natalia Raigosa Gómez1; María Cristina Amaya Mesa2; Sonia Jaramillo Villegas3, Luz Estela Lagos Mora4 y Mauricio Marín Montoya5
1 Ingeniera Agrónoma. Universidad Nacional de Colombia, Sede Medellín. Facultad de Ciencias Agropecuarias. A.A. 1027, Medellín, Colombia. <naraigos@yahoo.es>
2 Ingeniera Agrónoma. Universidad Nacional de Colombia, Sede Medellín. Facultad de Ciencias Agropecuarias. A.A. 1027, Medellín, Colombia. <marycrisa@hotmail.com>
3 Profesora Asociada. Universidad Nacional de Colombia, Sede Medellín. Facultad de Ciencias Agropecuarias. A.A. 1027, Medellín, Colombia. <sjaramal@unalmed.edu.co>
4 Profesora Asociada. Universidad de Nariño. Departamento de Biología. Ciudad Universitaria Torobajo Carrera 22 No. 18-109. Pasto, Colombia. <luzestela@udenar.edu.co>
5 Profesor Asistente. Universidad Nacional de Colombia, Sede Medellín. Facultad de Ciencias. A.A. 1779. Medellín, Colombia <mamarinm@unal.edu.co>
Recibido: Mayo 12 de 2008; Aceptado: Abril 4 de 2009
Resumen. Se estudio el nivel de variabilidad genética de una población de 35 aislamientos de Phytophthora infestans obtenidos en diferentes hospedantes y regiones geográficas de Colombia, mediante las técnicas de haplotipos mitocondriales y RAPD. Los resultados encontrados sugieren la existencia en el país de los haplotipos mitocondriales Ia en los aislamientos que afectan tomate de árbol (Solanum betaceum) y IIa en cultivos de papa; dichos haplotipos están asociados a los linajes genéticos EC-3 y EC-1, respectivamente. Sin embargo, tres aislamientos obtenidos en tomate de mesa (S. lycopersicum), pimentón (Capsicum sp.) y pepino de agua (S. muricatum) requieren de un análisis posterior, debido a la falta de correlación entre los perfiles de restricción generados con los cuatro pares de cebadores utilizados en esta prueba y los haplotipos mitocondriales mencionados en la literatura. De otra parte, mediante cuatro cebadores RAPD, fue posible encontrar variabilidad al interior de los dos linajes genéticos, siendo interesante el hecho que los aislamientos obtenidos en tomate de árbol (EC-3) fueron divididos en dos grupos, relacionados con una distancia genética de 0,17. Estos hallazgos indican que es importante contemplar las fuentes de variación asexual en el análisis de la estructura poblacional de este oomycete y por tanto en el diseño de las estrategias de control de las enfermedades que causa P. infestans en cultivos de solanáceas de importancia económica.
Palabras claves: Gota de la papa, haplotipos mitocondriales, marcadores moleculares, RAPD, Solanaceae
Abstract. The level of genetic variability of 35 isolates of Phytophthora infestans obtained from different hosts and geographical regions of Colombia was studied through mitochondrial haplotypes and RAPD techniques. Results suggested the existence of mitochondrial haplotypes Ia affecting tree tomato (Solanum betaceum) and IIa in potato, which are associated with genetic lineages EC-3 and EC-1, respectively. However, three isolates obtained from tomato (S. lycopersicum), capsicum (Capsicum sp.) and pear melon (S. muricatum), require an additional analysis, due to lack of correlation among the restriction profiles generated and the mitochondrial haplotypes reported in literature. RAPD analysis showed the occurrence of variability within the two genetic lineages. Interestingly, isolates obtained from tree tomato (EC-•3) were divided in two groups, related with a genetic distance of 0.17. These findings indicate that it is important to consider sources of asexual variation for analysis of population structure of this oomycete and therefore for designing control strategies of diseases caused by P. infestans in solanaceous crops of economic importance.
Key words: Late blight, mitochondrial haplotypes, molecular markers, RAPD, Solanaceae
La gota o tizón tardío de la papa, el tomate y otras solanáceas es la enfermedad más limitante de estas especies en las regiones húmedas de las zonas templadas y tropicales (Jaramillo, 2003). La enfermedad es causada por el oomycete Phytophthora infestans (Mont.) de Bary, que presenta como características morfológicas principales un micelio cenocítico, producción de esporangios limoniformes desarrollados a partir de esporangióforos con crecimiento indeterminado y la generación de oosporas a partir de un mecanismo de reproducción sexual de heterotalismo hormonal, en el que participan dos tipos de apareamiento, frecuentemente denominados A1 y A2 (Erwin y Ribeiro, 1996). Diferentes estudios recopilados por Grunwald y Flier (2005) han planteado que el centro de origen de este patógeno se ubica en el Valle de Toluca en la región central de México. Esta teoría es soportada por la presencia de los dos tipos de apareamiento en condición de equilibrio Hardy-Weinberg, por la alta variabilidad genética del patógeno en esta zona y por la presencia de diferentes hospedantes silvestres del oomycete. Sin embargo, existe una hipótesis alternativa que plantea que el centro de origen del patógeno corresponde a las montañas de los Andes suraméricanos, donde se ubica el origen de Solanum tuberosum y de un alto número de solanáceas silvestres (Forbes et al., 1997).
La intensa investigación que se ha desarrollado en P. infestans, comenzó desde mediados del siglo XIX, como resultado de las epidemias causadas por este patógeno en los cultivos de papa en Europa, siendo ampliamente conocida la denominada "Hambruna de Irlanda", en la cual murieron por inanición al menos 1,5 millones de personas y se desplazaron masivamente otro tanto hacia los EEUU (Fry et al., 1993). Un componente fundamental de dichos estudios ha sido la determinación mediante análisis genéticos de las poblaciones del patógeno que migraron a través del movimiento de semilla-tubérculo desde México y/o los Andes suramericanos a diferentes regiones del mundo. Sobre este aspecto, se ha determinado que en el período anterior a 1980, solamente el tipo A1 se había dispersado a otras regiones, de tal manera que se consideraba que estas poblaciones tenían un carácter netamente clonal. Sin embargo, en estudios posteriores a dicha fecha, se comenzaron a detectar en diferentes países del mundo (Korea, Inglaterra, EEUU, China, etc.) individuos del oomycete con el tipo de apareamiento A2, interpretándose dicha situación como producto de un nuevo evento masivo de migración del patógeno a partir del aumento de la globalización de la economía mundial (Hohl y Iselin, 1984; Turkensteen et al., 2000).
El grado de variación genética de P. infestans en Suramérica asociado con la aparición de linajes no registrados en otras latitudes, ha demostrado la necesidad de estudiar más profundamente las características de la estructura poblacional del patógeno en esta región, e incluso ha planteado la posibilidad que P. infestans represente un complejo críptico de especies con diferentes orígenes simpátricos (Adler et al., 2004).
Tradicionalmente las poblaciones de P. infestans han sido caracterizadas con base en diferentes marcadores fenotípicos y genotípicos, destacándose el patrón electroforético generado a partir de la sonda RG57 mediante el empleo de la técnica de RFLP, el análisis de las isoenzimas Gpi y Pep, el nivel de sensibilidad al fungicida Metalaxyl, la presencia de genes de virulencia determinados a partir de hospedantes diferenciales con genes R, la determinación del tipo de apareamiento y la evaluación de los haplotipos mitocondriales (Fry et al., 1991; Goodwin et al., 1994; Griffith y Shaw, 1998; Grunwald y Flier, 2005). El empleo de estas metodologías ha conducido a determinar que las poblaciones de P. infestans están posiblemente subestructuradas a partir de linajes clonales (Adler et al., 2004). Actualmente los linajes de P. infestans que han sido encontrados en Suramérica afectando cultivos de papa, son aquellos derivados del patrón electroforético RG57 EC-1, cuyos aislamientos se caracterizan por presentar tipo de apareamiento A1, perfiles isoenzimáticos Gpi 90/100 - Pep 96/100, y haplotipo mitocondrial IIa; mientras que en cultivos de tomate de mesa, el linaje del oomycete corresponde al US-1 (tipo de apareamiento A1, Gpi 86/100 - Pep 92/100, y haplotipo mitocondrial Ib) (Adler et al., 2004).
El estudio de la estructura metapoblacional de P. infestans en los Andes Sudamericanos ha aportado interesantes resultados sobre el nivel de diversidad del patógeno. En Ecuador se han descrito dos linajes EC-2 y EC-2.1 sobre solanáceas silvestres del complejo S. brevifolium (Sección Amarrhichomenum) caracterizados por compartir los mismos patrones isoenzimáticos (Gpi 100/100 - Pep 76/100) pero que divergen en sus haplotipos mitocondriales y tipo de apareamiento: Ia - A1 y Ic - A2, respectivamente (Ordóñez et al., 2000). Además se ha demostrado que la hipótesis de especificidad linaje clonal-hospedante no es absoluta, por cuanto sobre la especie cultivada S. muricatum (Pepino de agua) se detectaron aislamientos de P. infestans pertenecientes tanto al linaje clonal US-1 como al EC-2.1. (Adler et al., 2004).
En Colombia, los trabajos realizados con aislamientos de P. infestans procedentes de cultivos de papa en Antioquia, Cundinamarca, Boyacá y Nariño, han encontrado que el linaje del hongo predominante en el país corresponde al EC-1, mientras que en los cultivos de tomate, se presentan poblaciones del patógeno con haplotipos mitocondriales Ib y tipo de apareamiento A1, lo cual posiblemente corresponde al linaje clonal US-1 (González y García, 1998; Gilchrist, 2001; Lagos 2002; León, 2004).
A pesar de la condición predominantemente clonal de las poblaciones de P. infestans determinadas mediante las evaluaciones fenotípicas y genotípicas descritas anteriormente, estudios recientes que utilizan marcadores moleculares neutrales como RAPD y AFLP, han demostrado que existe un grado apreciable de variabilidad genética al interior de los linajes del oomycete, variación que incluso se ha manifestado en evaluaciones derivadas de poblaciones asexuales en las que sólo se presenta un tipo de apareamiento (Mahuku et al., 2000; Páez et al., 2005).
Con el fin de contribuir al conocimiento de las poblaciones de P. infestans en Colombia, en el presente estudio se evaluó el grado de variabilidad genética de una población de 35 aislamientos procedentes de diferentes hospedantes y regiones geográficas del país, a partir de la determinación de sus haplotipos mitocondriales y de la utilización de marcadores moleculares tipo RAPD.
MATERIALES Y MÉTODOS
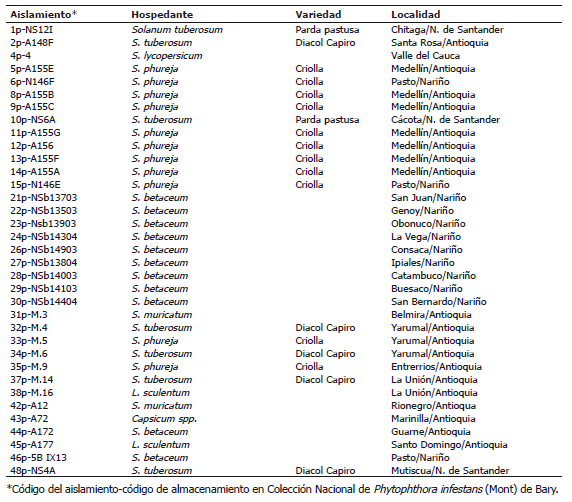
Aislamientos. Se utilizaron 35 aislamientos de P. infestans, de los cuales 20 fueron obtenidos a partir de plantas sintomáticas de diferentes localidades de Antioquia y Nariño, mientras que los 15 restantes se tomaron de la colección nacional de P. infestans de la Universidad Nacional de Colombia, Sede Medellín. Los hospedantes y localidades de procedencia de los aislamientos se presentan en la Tabla 1.
Tabla 1. Aislamientos de Phytophthora infestans (Mont) de Bary utilizados en el estudio de la variabilidad genética.
El proceso de aislamiento del oomycete a partir de plantas de papa consistió en la ubicación de los tejidos vegetales con síntomas de gota sobre rodajas de papa variedad Tuquerreña (sin genes mayores de resistencia a P. infestans) y en la siembra del micelio allí desarrollado sobre medio Agar centeno (18 g de harina de centeno, 18 g de agar, 18 g de azúcar, 1 L agua destilada), purificándose por transferencia a nuevas cajas de Petri. Cuando el hospedante correspondía a otra solanácea (S. betaceum, S. lycopersicum, S. muricatum, Capsicum sp.), las muestras se localizaban en cámaras húmedas para inducir la esporulación del patógeno, transfiriéndose luego a medio agar-centeno para continuar con su purificación.
Extracción de ADN. Los 35 aislamientos de P. infestans fueron transferidos a medio líquido de arveja (25 g de arveja, 20 g de azúcar, 1 L de agua destilada) e incubados a 18-20 °C por 15 días, para proceder con la filtración del micelio, a partir del cual se extrajó su ADN siguiendo el protocolo del Centro Internacional de la Papa (2000). Este procedimiento consistió en la maceración del micelio en nitrógeno líquido hasta obtener alrededor de 100 mg por cada aislamiento. Luego se adicionaron 400 mL de solución tampón CTAB 2X (CTAB 2% (p/v), 100 mM Tris HCl, pH 8, 1.4 M de NaCl, 20 mM EDTA pH 8) y se incubaron los tubos Eppendorf a 65 °C durante 30 min. Posteriormente se agregó 1 volumen de fenol: cloroformo (1:1) y se mezclaron los tubos por inversión durante 10 min, para proceder a centrifugar a 13,000 rpm por 15 min. Este procedimiento de separación de proteínas, se repitió dependiendo del grado de pureza del sobrenadante, el cual fue precipitado con 2 volúmenes de etanol absoluto 0,1 vol. de acetato de sodio 3 M y centrifugación a 13,000 rpm por 30 min. El precipitado generado se lavó con etanol al 70% y finalmente se resuspendió en 100 mL de agua destilada estéril, para digerir el ARN mediante la adición de 10 mL de ARNasa (10 mg•mL) e incubación a 37 °C durante 12 h. La integridad del ADN extraído fue determinada por medio de electroforesis en gel de agarosa al 0,8%, suplementado con 3 mL de bromuro de etidio [10 mg•mL] y se visualizó utilizando un transiluminador UV (Biometra, Göttingen, Alemania).
Determinación de haplotipos mitocondriales. Los haplotipos mitocondriales de cada aislamiento fueron determinados por la técnica PCR-RFLP usando los pares de cebadores F1-R1, F2-R2b, F3-R3y F4-R4 (Tabla 2) (Griffith y Shaw 1998). Las condiciones del PCR fueron: 25 mL de reacción total, 0,5 mM de cada cebador, 1X de buffer de PCR, 3 mM de MgCl2, 0,2 mM de dNTPs, 1 mL de Albúmina de Suero Bovino (BSA) (160 mg•mL), 1 U de Taq ADN polimerasa (Fermentas, Lituania) y una dilución 1/10 de ADN. Las amplificaciones se realizaron en el equipo PTC-100 (MJ Research, EEUU) y consistieron de una desnaturalización inicial a 94 °C por 1,5 min; 40 ciclos de 94 °C por 40 s, 57, 56, 58, 60 °C por 1 min, para los cebadores F1-R1, F2-R2b, F3-R3 y F4-R4 respectivamente, 72 °C por 1,5 min, y una extensión final a 72 °C por 2 min.
Tabla 2. Secuencia, longitud y posición de los cebadores empleados en la determinación de haplotipos mitocondriales en aislamientos de Phytophthora infestans (Mont) de Bary.

Para las digestiones del ADN mitocondrial amplificado, se tomaron 15 mL de cada producto de PCR y se adicionó 1 U de enzima de restricción y 2 mL de solución tampón de la enzima 1X, completando las reacciones a 20 mL con agua destilada estéril. Las enzimas de restricción utilizadas correspondieron a CfoI y MspI para los amplicones generados con los cebadores F1-R1 y F2-R2b respectivamente, mientras que para aquellos obtenidos con los cebadores F3-R3 y F4-R4 se empleó la enzima EcoRI. Las digestiones se realizaron a 37 °C durante 12 horas.
Evaluación de la variabilidad genética de Phytophthora infestans mediante RAPD. Para la determinación de la variabilidad genética de los aislamientos de P. infestans, se utilizó la técnica RAPD (polimorfismo del ADN amplificado al azar), evaluándose inicialmente 15 cebadores seleccionados al azar de las series AN, BA y E de la compañía Operon (Operon Technologies, Alameda, EEUU) en cinco aislamientos de P. infestans provenientes de diferentes regiones de recolección. En la Tabla 3 se presentan las secuencias de los cebadores evaluados. Las reacciones de PCR para RAPD incluyeron 3 mM de MgCl2, 0,2 mM de dNTPs, 0,8 mM de cebador RAPD, 1 U de Taq ADN polimerasa recombinante (Fermentas), 1X de solución tampón de la enzima (100 mM Tris-HCl (pH 8,8), 500 mM KCl, 0,8% Nonidet P40), 1 mL de una dilución 1/10 de ADN y agua destilada estéril tipo PCR, hasta completar un volumen de 25 mL. La amplificación de PCR incluyó una desnaturalización inicial a 94 °C por 3 min, seguida de 35 ciclos a 94 °C por 1 min, 36 °C por 1 min, 72 °C por 2 min y un período final de extensión a 72 °C por 7 min. Los productos amplificados fueron separados mediante electroforesis en geles de agarosa al 1,5% con 3 mL de bromuro de etidio (10 mg•mL).
Tabla 3. Cebadores empleados en la prueba de RAPD para la evaluación de la variabilidad genética de Phytophthora infestans (Mont) de Bary.

Análisis de datos. Para la determinación de los haplotipos mitocondriales se evaluaron los patrones electroforéticos obtenidos para cada enzima de restricción y se compararon con los perfiles encontrados en la literatura para los linajes genéticos descritos previamente en la literatura (Griffith y Shaw 1998; Ordóñez et al., 2000; Jaramillo, 2003; Adler et al., 2002). El análisis de los RAPD se realizó a partir de la construcción de una matriz binaria basada de ausencia/presencia de amplicones, que se utilizó para la elaboración de la matriz de similitud mediante el índice de Dice y el programa SimQual del paquete computacional NTSYS-pc Version 1•8 (Exeter Software, Setauket, NY, EEUU). Posteriormente se generó un dendrograma UPGMA con la ayuda del programa SAHN del paquete mencionado. El nivel de diversidad genética se calculó mediante el índice de Nei y la diversidad genotípica se cálculo mediante el índice de Shannon (Hennink y Zeven, 1991), utilizando el programa POPGENE (Universidad de Alberta, Canadá).
RESULTADOS
Determinación de haplotipos mitocondriales. Los productos amplificados para cada par de cebadores correspondieron a los previamente informados por Griffith y Shaw (1998), con tamaños de bandas de 1118 pb para F1-R1, 1070 para F2-R2b, 1308 pb para F3-R3 y 964 pb para F4-R4. En la determinación de los haplotipos mitocondriales se analizaron los perfiles de restricción de cada amplicón con las enzimas correspondientes, encontrándose que todos los aislamientos obtenidos en papa, independientemente de la región y de la variedad, correspondieron al haplotipo mitocondrial IIa (1118, 147-203-720, 1308, 361-603, para los amplicones F1-R1, F2-R2b, F3-R3y F4-R4, respectivamente) y que según evaluaciones realizadas en Colombia, está asociado con el linaje clonal EC-1 (Jaramillo, 2003). De otra parte, los aislamientos procedentes de Nariño y obtenidos de plantas de tomate de árbol, presentaron el haplotipo mitocondrial Ia, caracterizado por los perfiles de restricción 907-211, 350-720, 1078-230 y 361-394-209 para los amplicones F1-R1, F2-R2b, F3-R3y F4-R4, respectivamente (Figura 1), previamente asociado con el linaje clonal EC-3 por Ordoñez et al. (2000) en Ecuador.
Figura 1. Perfil de restricción con la enzima CfoI de los productos amplificados con el par de cebadores R1-F1. Líneas: 1: Marcador de peso molecular Gene Ruler 100 pb (Fermentas), 2 - 6: aislamientos de Phytophthora infestans (Mont) de Bary con el haplotipo mitondrial Ia, 7-17: aislamientos de Phytophthora infestans (Mont) de Bary con el haplotipo mitondrial IIa, 12 y 15: digestiones no observadas por baja concentración de los amplicones, 18: Control negativo. En la Tabla 1 se presentan los detalles de procedencia de los aislamientos.
Con respecto a los aislamientos de los otros hospedantes incluidos en este estudio, solamente se presentaron dos resultados concluyentes con el aislamiento 31 p de S. muricatum y 45 p de S. lycopersicum, que correspondieron al haplotipo IIa; los demás aislamientos presentaron resultados que no permitieron determinar su haplotipo mitocondrial, ya que no amplificaron o arrojaron mezclas de perfiles de restricción entre los diferentes haplotipos. Así por ejemplo, el aislamiento 42 p obtenido en S. muricatum presenta un perfil 1118, 1078-230, 361-394-209 para los fragmentos F1-R1, F3-R3 y F4-R4, respectivamente, mientras que el amplicon F2-R2b no fue posible de obtener bajo ninguna modificación del procedimiento. Para el aislamiento 43 p obtenido en Capsicum sp., ninguno de los cebadores amplificó las regiones mitocondriales, mientras que el aislamiento 38 p de S. lycopersicum presentó los perfiles de restricción 907-211, 1308, 361-603 para las regiones F1-R1, F3-R3y F4-R4, respectivamente; no lográndose obtener el amplicón F2-R2b.
Evaluación de la variabilidad genética de Phytophthora infestans mediante RAPD. De los 15 cebadores usados, cuatro fueron seleccionados debido a que detectaron polimorfismo entre los cinco aislamientos inicialmente evaluados. Los 10 cebadores restantes se presentaron como monomórficos o no amplificaron el ADN de alguno de los aislamientos evaluados (Tabla 3). A partir de los patrones electroforéticos generados con cada uno de los cuatro cebadores RAPD evaluados, se obtuvo un total de 57 marcadores que correspondieron a amplicones con tamaños entre 300 y 2400 pb, siendo los cebadores OPBA20 y OPBA14 los que presentaron mayor número de loci (17 y 15), mientras que con los cebadores OPE15 y OPBA03 se amplificaron 11 y 14 loci, respectivamente. De los 57 loci analizados, el 44,8% resultaron polimórficos (25 marcadores), obteniéndose un índice de diversidad genética de Nei de 0,16 y de diversidad genotípica de Shannon de 0,24. El dendrograma generado presentó 17 genotipos diferentes, que variaron en la frecuencia de sus aislamientos desde 1 (9 genotipos) hasta 5 (1 aislamiento). El dendrograma distribuyó los aislamientos en tres grupos (clados I, II y III) en cuyo interior los genotipos compartieron valores de similitud mayores a 0,91. Las distancias genéticas entre grupos correspondieron a 0,12 entre el clado I y II y 0,17 entre éstos y el clado III (Figura 2).
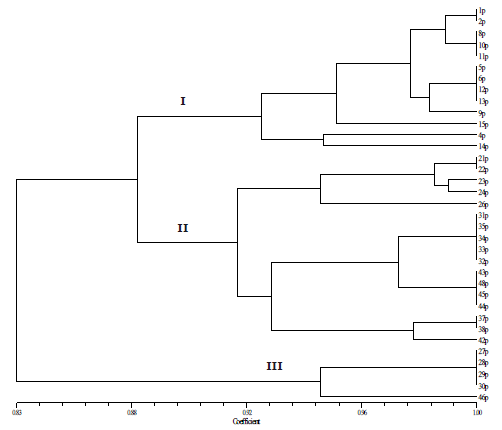
Figura 2. Dendrograma generado a partir del análisis con cuatro cebadores RAPD en una población de 35 aislamientos de Phytophthora infestans (Mont) de Bary de Colombia. Grupo I : aislamientos de tres variedades de Solanum tuberosum; II : aislamientos de Solanum tuberosum, Capsicum sp., Solanum muricatum y Solanum lycopersicum; Grupo III : aislamientos procedentes de Solanum betaceum. En la Tabla 1 se presentan los detalles de procedencia de los aislamientos.
El grupo III presentó sólo aislamientos obtenidos en tomate de árbol en el Departamento de Nariño, mientras que el grupo I incluyó predominantemente aislamientos de tres variedades de papa y de diferentes regiones geográficas. El grupo II presentó aislamientos de tomate de árbol, papa, tomate de mesa, pepino de agua y pimentón, así como aislamientos procedentes de diferentes regiones del país.
DISCUSIÓN
Tradicionalmente la estructura poblacional de P. infestans se ha considerado que esta conformada por linajes clonales, es decir por subpoblaciones originadas por mecanismos de reproducción asexual y que por tanto presentan gran similitud genética entre sus individuos (Goodwin, 1997). Esta concepción se ha derivado de la aplicación de diferentes marcadores fenotípicos y genotípicos entre los que se destaca el patrón electroforético generado a partir del uso de la sonda RG57 mediante la técnica RFLP (Goodwin et al., 1992). Sin embargo, la continua observación de diferencias en los niveles de patogenicidad, resistencia a fungicidas y capacidad de sobrepasar la resistencia de materiales vegetales mejorados, ha conducido recientemente a pensar que dichos linajes no representan la realidad del patógeno en el campo, y que por lo tanto, se requiere de estudios que permitan predecir en forma más precisa el comportamiento de las poblaciones de este oomycete, de manera que permitan diseñar estrategias de control más acordes con la realidad de la enfermedad (Cooke y Lees, 2004).
Esta situación es especialmente cierta para regiones geográficas como Colombia, en donde las investigaciones han demostrado que el patógeno sólo presenta el tipo de apareamiento A1 y mayoritariamente el linaje clonal EC-1 (Gilchrist, 2001; Lagos 2002; León, 2004), pero contradictoriamente registra altos niveles de razas fisiológicas y niveles de virulencia (Mazo y Patiño, 1995; Botero y Gilchrist 1997; Marín y Mira, 1998); así como diferencias en los grados de sensibilidad a fungicidas sistémicos como metalaxyl (Cortés y Madrid, 1999; González y García, 1998; Argel, 2002) y Fenamidone (Argel et al., 2004). Los resultados del presente estudio confirman la presencia de un solo haplotipo mitocondrial para los aislamientos obtenidos en papa, el cual está asociado al linaje EC-1 y muestran por primera vez en Colombia la presencia del linaje EC-3 previamente encontrado en Ecuador (Ordoñez et al., 2000) para los aislamientos de tomate de árbol.
De otra parte, la prueba de RAPD detectó la ocurrencia de 17 genotipos diferentes entre los 35 aislamientos evaluados, lo cual reafirma la existencia de niveles bajos de variación en las poblaciones del oomycete presentes en Colombia. Dicha variación puede ser interpretada a la luz de la investigación desarrollada por Abu-El Samen et al., (2003) quienes evaluaron la importancia de mecanismos parasexuales en la generación de variación genética en P. infestans a partir de aislamientos obtenidos de parentales monozoospóricos, mediante el empleo de marcadores AFLP y RAPD, encontrando la presencia de un nivel apreciable de variación derivado de la reproducción asexual del patógeno, que dado el corto período de tiempo en las evaluaciones, no solo podía ser explicado por la ocurrencia de mutaciones espontáneas, sino también por mecanismos activos de recombinación mitótica, conversión génica y elementos extracromosómicos móviles, pocas veces considerados como fuentes de variación en P. infestans (Newhouse et al., 1992; Goodwin, 1997).
El análisis de RAPD permitió además, discriminar la poblacion de P. infestans evaluada en tres grandes grupos, de los cuales el clado I, incluyó aislamientos de papa y un aislamiento de tomate (4p); el clado II presentó aislamientos de diferentes hospedantes y el clado III contuvo aislamientos de tomate de árbol; sin embargo, dichos grupos no correpondieron a los haplotipos hallados en este estudio, resultado que por lo demás ha sido registrado por diferentes investigaciones que han empleado marcadores neutros en poblaciones de P. infestans de varios países (Mahuku et al., 2000; Cooke y Lees, 2004; Paéz et al., 2005). Un resultado inesperado de la evaluación de RAPD, fue el hecho que los aislamientos obtenidos en tomate de árbol, fueron separados en dos grupos genéticos diferentes, uno de los cuales estuvo relacionado con aislamientos de papa y otros hospedantes en el denominado clado II, mientras que el segundo grupo sólo incluyó aislamientos de este hospedero (clado III). Este resultado difiere del hallado por Adler et al. (2004), quienes al evaluar la estructura poblacional de P. infestans en Ecuador mediante AFLP, determinaron que todos los aislamientos de tomate de árbol hacían parte de un mismo grupo genético, que además era diferencial para el linaje EC-3. Esta aparente contradicción, condujo recientemente a nuestro grupo a realizar una investigación empleando marcadores AFLP con una población de aislamientos de P. infestans recolectados en papa y tomate de árbol en el Sur de Colombia (Mesa et al., 2008). En dicho trabajo fue posible la separación genética de ambos grupos de aislamientos, confirmándose la especificidad detectada por Adler et al. (2004) y reafirmándose la necesidad de emplear diferentes tipos de marcadores moleculares para la caracterización de la estructura poblacional de los organismos fitopatógenos.
Este trabajo representa el primer estudio de variación intra-linaje genético desarrollado con aislamientos de la colección colombiana de P. infestans. Los resultados encontrados enfatizan en la necesidad de aumentar la investigación sobre las características poblacionales de este patógeno en Colombia y muy especialmente en el estudio de aquellos aislamientos que afectan hospedantes diferentes a papa. Afortunadamente los trabajos adelantos en Ecuador y Perú por Ordoñez et al. (2000), Oliva et al. (2002), Adler et al. (2004) y Garry et al. (2005), marcan un camino en este sentido y ofrecen diferentes estrategias metodológicas y analíticas que pueden ser aprovechadas en los futuros trabajos planteados para el estudio de P. infestans en Colombia.
CONCLUSIONES
La poblacional de P. infestans en Colombia está representada por al menos dos grupos de aislamientos genéticamente diferentes e identificables por sus haplotipos mitocondriales: Ia en aislamientos que afectan tomate de árbol (S. betaceum) y IIa en cultivos de papa. Es importante definir los linajes genéticos de aislamientos del patógeno que afectan otras solanáceas, especialmente especies silvestres.
La metodología de RAPD permitió detectar la existencia de variación genética al interior de los grupos genéticos encontrados en la población de P. infestans estudiada. Esta situación pone de manifiesto la importancia de actualizar el concepto de linajes clonales, empleado tradicionalmente en la caracterización de las poblaciones de P. infestans, de manera que se incorpore la variación intraespecífica en su definición.
La presencia de haplotipos mitocondriales de P. infestans diferenciales dependiendo del hospedante, plantean la necesidad de realizar estudios de patogenicidad cruzada que determinen la especificidad patógeno-hospedante de las poblaciones de aislamientos de P. infestans presentes en Colombia. Estos resultados permitirán ajustar las estrategias de control de la enfermedad en las regiones en donde se traslapan los cultivos de solanáceas susceptibles, a este patógeno.
AGRADECIMIENTOS
Esta investigación se realizó gracias al apoyo financiero de la Dirección Nacional de Investigaciones de la Universidad Nacional de Colombia (DINAIN-VRI) a través del proyecto "Variabilidad genetica de aislamientos colombianos de Phytophthora infestans y su relación con el nivel de sensibilidad al fungicida del grupo de resistencia cruzada QOI: Fenamidone" Código 20101005571. La colección de aislamientos del departamento de Nariño, se realizó gracias al apoyo económico de la Vicerrectoría de Investigaciones y Postgrados de la Universidad de Nariño.
BIBLIOGRAFÍA
Abu-El, Samen, F.M., G.A. Secor and N.C. Gudmestad. 2003. Variability in virulence among asexual progenies of Phytophthora infestans (Mont) De Bary. Phytopathology 93(3): 293-304. [ Links ]
Adler, N.E., L.J. Erselius, M.G. Chacón, W.G. Flier, M.E. Ordóñez, L.P. Kroon and G.A. Forbes. 2004. Genetic diversity of Phytophthora infestans sensu lato in Ecuador provides new insight into the origin of this important plant pathogen. Phytopathology 94(2): 154-162. [ Links ]
Adler, N., M. Chacón, G. Forbes and G. Flier. 2002. Phytophthora infestans sensu lato in South America population substructuring through host-specificity. pp. 13-17. In: Lizarraga, C. (ed.). Late blight: Managing the global threat. Proceedings of the Global Initiative on Late Blight Conference. Hamburg, Germany. [ Links ]
Argel, L.E. 2002. Evaluación de la resistencia/susceptibilidad a los fungicidas Metalaxyl y Cymoxanyl en aislamientos de Phytophthora infestans (Mont) de Bary de Cundinamarca y Boyacá. Tesis Biología. Instituto de Biología. Universidad de Antioquia. 24 p. [ Links ]
Argel, L.E., S. Jaramillo, J.G. Morales, B. Jacqmin y E. Guzmán. 2004. Línea base de sensibilidad de Phytophthora infestans al Fenamidone (S)-5-metil-2-metilltio-5-fenil-3-fenilamino-3,5-dihidroimidazol-4 en Colombia. pp. 7-12. En: Memorias. XXI Congreso de la Asociación Latinoamericana de la Papa (ALAP). Valdivia, Chile. [ Links ]
Botero, G. y E. Gilchrist. 1997. Evaluación de la compatibilidad de diferentes aislamientos del hongo Phytophthora infestans (Mont) de Bary con algunas especies de la familia Solanaceae. Trabajo de Grado Ingeniería Agronómica. Facultad de Ciencias Agropecuarias. Universidad Nacional de Colombia. Medellín. 64 p. [ Links ]
Centro Internacional de la Papa (CIP). 2000. Uso de marcadores moleculares en la caracterización de Phytophthora infestans (Mont) de Bary. Centro Internacional de la Papa. Lima, Perú. [ Links ]
Cooke, D.E. and A.K. Lees. 2004. Markers, old and new, for examining Phytophthora infestans diversity. Plant Pathology 53(6): 692-704. [ Links ]
Cortés, W.E. y N. Madrid. 1999. Comparación de dos metodologías para estimar la sensibilidad a fungicidas en poblaciones del hongo Phytophthora infestans (Mont) de Bary. Trabajo de Grado Ingeniería Agronómica. Facultad de Ciencias Agropecuarias. Universidad Nacional de Colombia. Medellín. 76 p. [ Links ]
Erwin, D.C. and O. Ribeiro. 1996. Phytophthora Diseases Worldwide. The American Phytopathological Society Press. St. Paul, Minnesota. 562 p. [ Links ]
Forbes, G.A., X. Escobar, C. Ayala, J. Revelo, M. Ordoñez, B. Fry, K. Doucett and W.E. Fry. 1997. Population genetic structure of Phytophthora infestans in Ecuador. Phytopathology 87(4): 375-380. [ Links ]
Fry, E.W., A. Drenth, J. Spielman, B. Mantel, L. Davidse and S. Goodwin. 1991. Population genetic structure of Phytophthora infestans in the Netherlands. Phytopathology 81(10): 1330-1336. [ Links ]
Fry, E.W., S. Goodwin, A. Dyer, J. Matuszak, A. Drenth, P.W. Tooley, L. Sujkowski, Y.J. Koh, B.A. Cohen, J. Spielman, K. Deahl, D. Inglis and K. Sandlan. 1993. Historical and recent migrations of Phytophthora infestans: chronology, pathways, and implications. Plant Disease 77(7): 653-661. [ Links ]
Garry, G., G. Forbes, A. Salas, M. Santa Cruz, W. Pérez and R.J. Nelson. 2005. Genetic diversity and host differentiation among isolates of Phytophthora infestans from cultivated potato and wild solanaceous hosts in Peru. Plant Pathology 54(6): 740-748. [ Links ]
Gilchrist, E. 2001. Evaluación de la diversidad genética y patogénica de las poblaciones de Phytophthora infestans (Mont.) de Bary en Antioquia. Tesis Magister en Biotecnología. Facultad de Ciencias. Universidad Nacional de Colombia. Medellín. 78 p. [ Links ]
González, C. y D. García. 1998. Caracterización de las poblaciones de Phytophthora infestans del altiplano Cundiboyacense con base en el tipo de apareamiento y sensibilidad al fungicida metalaxyl. Fitopatología Colombiana 22: 74-81. [ Links ]
Goodwin, S.B., A. Drenth y W.E. Fry. 1992. Cloning and genetic analysis of two highly polymorphic, moderately repetitive nuclear DNAs from Phytophthora infestans. Current Genetics 22(2): 107-115. [ Links ]
Goodwin, S.B., B.A. Cohen and W.E. Fry. 1994. Pan global distribution of a single clonal lineage of the Irish potato famine fungus. Proceedings of the National Academy of Sciences of the United States of America 91(24): 11591-11595. [ Links ]
Goodwin, S.B. 1997. The population genetics of Phytophthora. Phytopathology 87 (4): 462-473. [ Links ]
Griffith, G.W. and D. Shaw. 1998. Polymorphisms in Phytophthora infestans: Four mitochondrial haplotypes are detected after PCR amplification of DNA from pure cultures or from host lesions. Applied and Environmental Microbiology 64(10): 4007-4014. [ Links ]
Grunwald, N. and W. Flier. 2005. The biology of Phytophthora infestans at its center of origin. Annual Review of Phytopathology 43: 171-190 [ Links ]
Hennink, S. and A.C. Zeven. 1991. The interpretation of Nei and Shannon-Weaver within population variation indices. Euphytica 51(3): 235-240. [ Links ]
Hohl, H.R. and K. Iselin. 1984. Strains of Phytophthora infestans from Switzerland with A2 mating type behaviour. Transactions of the British Mycological Society 83(3): 529-530. [ Links ]
Jaramillo, S. 2003. Monografía sobre Phytophthora infestans (Mont) de Bary. Facultad de Ciencias Agropecuarias. Universidad Nacional de Colombia. Medellín. 141 p. [ Links ]
Lagos, L.E. 2002. Aislamiento y caracterización genética de las poblaciones de Phytophthora infestans (Mont) de Bary en las zonas productoras de papa Solanum tuberosum en el Departamento de Nariño. Tesis Magister en Ciencias Biológicas. Facultad de Ciencias. Universidad del Valle. Cali. 66p. [ Links ]
León, H.J. 2004. Evaluación de aislamientos de Phytophthora infestans (Mont) de Bary colectados en Antioquia mediante tipo de apareamiento y haplotipos mitocondriales. Trabajo de Grado Ingeniería Agronómica. Facultad de Ciencias Agropecuarias. Universidad Nacional de Colombia. Medellín. 39 p. [ Links ]
Mahuku, G., R. Peters, H. Platt and F. Daayf. 2000. Random amplified polymorphic DNA (RAPD) analysis of Phytophthora infestans isolates collected in Canada during 1994 to 1996. Plant Pathology 49(2): 252-260. [ Links ]
Marín, M., y J.J. Mira. 1998. Caracterización de razas fisiológicas y tipo de apareamiento en aislamientos de Phytophthora infestans (Mont) de Bary en diferentes pisos térmicos y hospederos, en el Departamento de Antioquia. Trabajo de Grado Ingeniería Agronómica. Facultad de Ciencias Agropecuarias. Universidad Nacional de Colombia. Medellín. 55 p. [ Links ]
Mazo, J.J. y L.F. Patiño. 1995. Determinación de razas fisiológicas y tipo de apareamiento en aislamientos de Phytophthora infestans (Mont) de Bary. Trabajo de Grado Ingeniería Agronómica. Facultad de Ciencias Agropecuarias. Universidad Nacional de Colombia. Medellín. 66 p. [ Links ]
Mesa, V., M.F. Mideros, S. Jaramillo, J.M. Cotes, L.E. Lagos, R. Pineda y M. Marín. 2008. Variabilidad genética de aislamientos de Phytophthora infestans procedentes del suroccidente de Colombia. Revista Iberoamericana de Micología 25(3): 167-172. [ Links ]
Newhouse, J.R., P. Tooley, O. Smith and R. Fishel. 1992. Characterization of double-stranded RNA in isolates of Phytophthora infestans from Mexico, the Netherlands, and Peru. Phytopathology 82(2): 164-169. [ Links ]
Oliva, R., L. Erselius, N. Adler and G. Forbes. 2002. Potential of sexual reproduction among host-adapted populations of Phytophthora infestans sensu lato in Ecuador. Plant Pathology 51(6): 710-719. [ Links ]
Ordoñez, M.E., H. Hohl, A. Velasco, M. Ramon, P. Oyarzun, C. Smart, W. Fry, G. Forbes and L. Erselius. 2000. A novel population of Phytophthora, similar to P. infestans, attacks wild Solanum species in Ecuador. Phytopathology 90(2):197-202. [ Links ]
Páez, O., R. Valverde, L. Gómez y A. Brenes. 2005. Diversidad genética de aislamientos de Phytophthora infestans en plantaciones de papa en Costa Rica con el uso de RAPDS. Agronomía Costarricense 29(1): 41-55. [ Links ]
Turkensteen, L.J., W. Flier, R. Wanningen y A. Mulder. 2000. Production, survival and infectivity of oospores of Phytophthora infestans. Plant Pathology 49(6): 688-696. [ Links ]














