Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Facultad Nacional de Agronomía Medellín
Print version ISSN 0304-2847
Rev. Fac. Nac. Agron. Medellín vol.62 no.1 Medellín Jan./June 2009
METODOLOGÍA DE EVALUACIÓN DE LA SENSIBILIDAD A FUNGICIDAS QoI - FENAMIDONE: CASO DE ESTUDIO Phytophthora infestans (Mont.) de Bary
A METHODOLOGY OF EVALUATION SENSITIVITY TO QoI FUNGICIDES - FENAMIDONE: A CASE STUDY OF Phytophthora infestans (Mont.) de Bary
Mariana Escudero Ramírez1; Mauricio Marín Montoya2; Sonia Jaramillo Villegas3 y José Miguel Cotes Torres4
1 Ingeniera Agrónoma. Universidad Nacional de Colombia, Sede Medellín. Facultad de Ciencias Agropecuarias. A.A.1779. Medellín, Colombia.
2 Profesor Asistente. Universidad Nacional de Colombia, Sede Medellín. Facultad de Ciencias. A.A. 3840. Medellín, Colombia. <mamarinm@unal.edu.co>
3 Profesora Asociada. Universidad Nacional de Colombia, Sede Medellín. Facultad de Ciencias Agropecuarias. A.A. 1779. Medellín, Colombia. <sjaramal@unalmed.edu.co>
4 Profesor Asociado. Universidad Nacional de Colombia, Sede Medellín. Facultad de Ciencias Agropecuarias. A.A. 1779. Medellín, Colombia. <jmcotes@unalmed.edu.co>
Recibido: Mayo 12 de 2008; Aceptado: Abril 14 de 2009
Resumen. Este trabajo se planteó con el fin de establecer en Colombia una metodología estándar que permita la evaluación de la sensibilidad de diferentes hongos y oomycetes fitopatógenos a los fungicidas QoI. Para esto se utilizó como modelo de estudio el agente causal de la gota de la papa Phytophthora infestans y el fungicida fenamidone, una imidazolinona recientemente introducida al mercado mundial. La metodología propuesta se basa en el empleo de discos de hoja inoculados con una suspensión de esporangios del patógeno, la evaluación de cinco dosis del fungicida en su grado técnico y de formulación comercial, el empleo de dos técnicas de aplicación del fungicida, el análisis estadístico de los resultados mediante el modelo Probit y la incorporación de una prueba molecular basada en la secuenciación de una región del gen citocromo b. Esta prueba puede ser utilizada en forma previa o posterior a la prueba biológica, dependiendo de la disponibilidad de un laboratorio de apoyo. Se espera que este trabajo estimule la aplicación en el país del monitoreo constante de las poblaciones de los fitopatógenos para cuyo manejo se utilizan fungicidas del grupo QoI.
Palabras claves: Citocromo b, dosis letal media, gota de la papa, imidazolinonas, secuenciación
Abstract. This study was proposed with the aim to establish in Colombia a standard methodology to evaluate the level of sensitivity of fungi and oomycetes to QoI fungicides. The used model was the causal agent of late blight of potato Phytophthora infestans and the fungicide fenamidone, an imidazolinone recently introduced in the world market. The methodology included inoculation of leaf discs with a suspension of pathogen's sporangia, evaluation of five doses of fungicide applied as active ingredient and commercial formulation, two techniques of application, statistical analysis using the Probit model and a molecular test based on sequencing the cytochrome b gene. This molecular test could be used both before or afterwards the biological evaluation, according to the availability of a supporting laboratory. We hope that this study can stimulate a continuous monitoring of the sensitivity level to QoI of populations of plant pathogens in Colombia.
Key words: Cytochrome b, imidazolinones, late blight, median lethal dose, sequencing
Una de las enfermedades más limitantes en los cultivos de papa (Solanum tuberosum) es la gota o tizón tardío, causada por el oomycete Phytophthora infestans (Mont) de Bary (Erwin y Ribeiro, 1996). El manejo de esta enfermedad se ha basado principalmente en la utilización de fungicidas de acción protectante y/o sistémica. Sin embargo, la efectividad de algunos de estos productos se ha venido reduciendo gradualmente como resultado de la aparición de resistencia en las poblaciones del patógeno, debido a la alta presión de selección ejercida por el uso continuo de dichas moléculas (Jaramillo, 2003). Estudios recientes han demostrado que la presencia de mutaciones puntuales en los genes que codifican para las proteínas blanco de la acción fungicida y de secuencias específicas de nucleótidos de las regiones promotoras de dichos genes, se encuentran asociadas con la aparición de fenotipos resistentes a diversas moléculas químicas en organismos fitopatógenos (Damicone, 2004).
En Colombia la gota de la papa es especialmente agresiva, debido a la ocurrencia de condiciones climáticas favorables para su desarrollo en los agroecosistemas donde se cultiva papa y a la siembra de materiales altamente susceptibles al patógeno como las variedades DIACOL Capiro, Parda pastusa, ICA Nevada y Tuquerreña. Es así, como bajo condiciones del Oriente Antioqueño, se ha estimado que los agricultores requieren de hasta 18 ciclos de aspersión de fungicidas protectantes y sistémicos para controlar la enfermedad, estimándose que el costo del control químico representa entre el 10 y 30% del valor de la producción de los cultivos de papa (Jaramillo, 2003).
Uno de los fungicidas recientemente introducidos en el mercado mundial para el control de P. infestans es el Fenamidone, molécula perteneciente al grupo químico de las imidazolinonas y que presenta como modo de acción la inhibición del sitio QoI (Quinone Outside Inhibitors) del complejo proteínico citocromo bc1.
Químicamente, el fungicida Fenamidone proviene de un nuevo grupo de moléculas derivadas de la química de la imidazolinona, siendo su nombre IUPAC (S)-5-Methyl-2-methylthio-5-phenyl-3-phenylamino-3, 5-dihydroimidazol-4-one, y su fórmula y peso molecular C17 H17 N3 OS y 311.4, respectivamente (Genix y Villier, 2003). La actividad biológica de este compuesto está asociada con el isómero óptico S (RPA 407213), el cual es ligeramente soluble en agua y presenta un bajo riesgo de bioacumulación (Genix y Villier, 2003). Su acción es especialmente eficaz contra un gran número de patógenos de la clase Oomycetes, incluyendo Plasmopara viticola, P. infestans y varias especies de Peronospora; aunque también controla algunos hongos pertenecientes a las clases Ascomycetes (ej: Mycosphaerella spp.) y a los hongos mitospóricos (ej: Alternaria spp.) (Mercer y Latorse, 2003). Dicha molécula actúa inhibiendo la respiración mitocondrial al bloquear el transporte de electrones a nivel de la ubihidroquinona en el complejo III (Citocromo C oxidoreductasa), también llamado complejo bc1. Este modo de acción es similar al que presentan las estrobilurinas (azoxystrobin, picoxystrobin, pyraclostrobin, kresoxim-metilo, trifloxystrobin, metominostrobin, fluoxastrobin) y el famoxadone (Neuburger et al., 2003), por lo que estos compuestos se han agrupado por parte de la FRAC (Fungicide Resistance Action Committee) dentro del grupo de resistencia cruzada QoI (FRAC, 2007).
El Fenamidone es eficiente al ser utilizado tanto en forma preventiva como curativa, ya que actúa sobre diferentes sitios del ciclo de vida de los patógenos que controla. En el caso de oomycetes, inhibe la liberación de zoosporas y la germinación directa a partir de esporangios, así como también tiene efecto antiesporulante y una muy alta acción translaminar (Mercer y Latorse 2003).
En Colombia, Argel et al. (2004) realizaron un trabajo de investigación tendiente a establecer la línea de sensibilidad al fungicida fenamidone de 31 aislamientos de P. infestans colectados en diferentes regiones cultivadoras de papa del país, encontrando una alta variabilidad en la respuesta de los aislamientos evaluados, aunque ninguno de ellos presentó características de resistencia a esta molécula. La concentración efectiva media (EC50) determinada para la totalidad de aislamientos correspondió a 1,83 mg•L-1, con valores extremos que oscilaron entre 0,14 y 3,51 mg•L-1. Estos valores contrastan con los resultado obtenidos por Latorse y González (2003), quienes al evaluar la sensibilidad al fenamidone de 26, 77, 69 y 45 aislamientos colectados en Europa durante los años 1996, 1997, 1998 y 1999, respectivamente, determinaron valores de EC50 que oscilaron entre 12 y 19 mg•L-1, lo cual puede ser un indicativo de un mayor grado de tolerancia natural de los genotipos europeos a esta molécula química o de la presencia de cierto nivel de resistencia inducido por la aplicación continua de esta u otras sustancias inhibidoras de QoI.
La resistencia a fungicidas se manifiesta como una variación genética en un hongo que resulta en la reducción de su sensibilidad a una molécula química, debido a la disminución en la tasa de ingreso del fungicida a las células del patógeno, la falta de afinidad química con su molécula blanco o la detoxificación del compuesto por parte del hongo. Estos cambios generalmente se encuentran asociados con la presencia de mutaciones genéticas que ocurren en forma natural o inducida como resultado de una alta presión de selección ejercida por la molécula química (Koller, 2000; Damicone, 2004). Dichas mutaciones pueden aparecer en uno o varios genes, dependiendo del modo de acción del fungicida. La resistencia a los fungicidas que actúan sobre un único sitio específico, tiene más probabilidades de ocurrir debido a que sólo es necesaria la generación de mutaciones puntuales sobre un solo gen (Damicone, 2004).
El nivel de resistencia puede medirse en el laboratorio exponiendo una población de aislamientos obtenida en el campo al fungicida en cuestión y midiendo su respuesta a diferentes dosis del compuesto. Las respuestas de toxicidad se miden generalmente por la inhibición del crecimiento del hongo, de la germinación de esporas o de la infección de la planta (Damicone, 2004). Frecuentemente, dichas respuestas se presentan como la concentración efectiva que inhibe el crecimiento, la germinación o la infección del patógeno en un 50%, valor que se denomina concentración efectiva media y se calcula tanto para cada individuo muestreado como para la población bajo estudio.
La resistencia también puede ser detectada utilizando técnicas basadas en PCR (Polymerase Chain Reaction), las cuales son más sensibles y generalmente requieren menor tiempo para realizarse. Estas técnicas se fundamentan en el análisis de las secuencias de los genes blanco, los cuales codifican para los transcritos o proteínas afectadas por el fungicida y pretenden identificar las mutaciones puntuales que conducen a los cambios en la secuencia de aminoácidos que confieren el fenotipo resistente (Sierotzki et al., 2000). Diferentes estrategias se han empleado para el diseño de pruebas de diagnóstico molecular de poblaciones resistentes a fungicidas, entre otras se destacan: CAPS (Cleaved Amplified Polymorphic Sequences) (Konieczny y Ausubel, 1993), DHPLC (Denaturing High Performance Liquid Chromatography) (Oefner y Underhill, 1995), PIRA-PCR (Primer-Introduced Restriction Enzyme Analyses) (Vuorio et al., 1999), PCR de alelos específicos (Delye et al., 1997) y detección de repeticiones en tandem de potenciadores transcripcionales de los promotores de los genes objetivo (Hamamoto et al., 2001). Adicionalmente, en los últimos años se han diseñado métodos que permiten detectar cuantitativamente los niveles de resistencia en las poblaciones bajo estudio mediante PCR en tiempo real (Gisi et al., 2002).
Para el caso particular del diagnóstico molecular de resistencia a fungicidas QoI, inicialmente se detectó una mutación en el gen citocromo b de individuos Saccharomyces cerevisiae con fenotipos resistentes a dichos fungicidas (Di Rago et al., 1995). Esta asociación fue confirmada en organismos fitopatógenos de las especies Blumeria graminis f.sp tritici y Pseudocercospora cubensis en cultivos de trigo y cucurbitáceas, respectivamente (Sierotski et al., 2000; Ishii et al., 2001). Estudios posteriores han identificado cerca de 11 mutaciones puntuales como potencialmente asociadas con resistencia a QoI, además de un posible mecanismo de detoxificación, que está mediado por un sistema alternativo de respiración, como respuesta a la inhibición de la cadena de transporte de electrones (Zheng y Köller, 1997; Sierotzki et al., 2000).
Diferentes investigaciones han determinado que los fenotipos resistentes a fungicidas QoI se encuentran estrechamente asociados a la sustitución de Guanina por Citosina en el codón 143 (GGT), que codifica para el aminoácido glicina de la proteína citocromo b y resulta en un cambio por alanina. Dicha mutación se ha encontrado en aislamientos resistentes a fungicidas QoI de los hongos Venturia inaequalis (Zheng y Köller, 1997), Mycosphaerella fijiensis (Sierotzki et al., 2000), B. graminis (Ishii et al., 2001) y en los oomycetes Pseudoperonospora cubensis (Sierotzki et al., 2000; Ishii et al., 2001) y P. viticola (Sirven y Beffa, 2003). Una segunda mutación que induce al cambio de fenilalanina por leucina en la posición 129, ha sido también asociada con la resistencia a estos fungicidas en Pyricularia grisea (Farman, 2001), Pythium aphanidermatum (Bartlett et al., 2002) y V. inaequalis (Zheng y Köller, 1997).
El fenómeno de resistencia de fitopatógenos a los fungicidas sistémicos es una situación que afecta la competitividad y sostenibilidad de los sistemas agrícolas. El alto riesgo que presentan los fungicidas del grupo de resistencia cruzada QoI de perder su efectividad sobre los hongos y oomycetes que controlan, plantean la necesidad de mantener un monitoreo constante de los niveles de sensibilidad a estas moléculas químicas en los cultivos donde se utilizan. El objetivo de la presente investigación fue evaluar una metodología con potencial para el empleo en Colombia de dicho monitoreo por parte de las agremiaciones de agricultores, compañías productoras de agroquímicos, centros de investigación y agencias estatales de sanidad vegetal.
MATERIALES Y MÉTODOS
Localización. Esta investigación se desarrolló en los laboratorios de Estudios Moleculares y de Biología Celular y Molecular de la Universidad Nacional de Colombia, Sede Medellín. Las plantas de papa variedad DIACOL Capiro empleadas para la obtención de los folíolos fueron sembradas en el Centro Agropecuario Paysandú, ubicado en el corregimiento Santa Elena, municipio de Medellín, que corresponde a la zona de vida bosque húmedo montano bajo (bh-MB), y presenta una altitud de 2.550 msnm, temperatura media de 14 °C y una precipitación promedio anual de 2.000 mm.
Aislamientos. De una colección de aislamientos realizada en las zonas paperas de los municipios Antioqueños, La Unión, Santa Rosa y San Pedro, se seleccionaron cuatro de ellos: C5 y C6 (papa var. DIACOL Capiro, La Unión), C7 (papa criolla, Santa Rosa), C8 (papa var. DIACOL Capiro, San Pedro). El proceso de aislamiento del oomycete consistió en la ubicación de los tejidos vegetales con síntomas de gota sobre rodajas de papa variedad Tuquerreña (sin genes mayores de resistencia a P. infestans) y en la siembra del micelio allí desarrollado sobre medio Agar centeno (18 g de harina de centeno, 18 g de agar, 18 g de azúcar, 1 L agua destilada), purificándose por transferencia a nuevas cajas de Petri.
Evaluación de sensibilidad al fungicida Fenamidone. El nivel de sensibilidad al fungicida Fenamidone de los cuatro aislamientos seleccionados fue determinado bajo condiciones in vitro, utilizando discos de hoja de 14 mm obtenidos a partir de plantas de papa variedad DIACOL Capiro de 8 a 10 semanas de edad (período antes de floración). Las dosis evaluadas correspondieron a: 0,1; 1; 5; 10 y 15 mg•L-1, y fueron preparadas a partir del ingrediente activo (i.a.) fenamidone y del producto comercial Mildex cuya formulación incluye 44,4 gr•kg-1 de i.a fenamidone y 667 gr•kg-1 de Fosetyl-Al.
Para la realización del ensayo se evaluaron dos metodologías de aplicación del fungicida. La primera de ellas consistió en la inmersión de cada disco en la respectiva solución durante un minuto; mientras que en la otra los discos fueron asperjados con un volumen homogéneo de la solución del fungicida, utilizando un frasco atomizador. Los discos tratados se localizaron en cajas de Petri con medio de sobrevivencia (2% Agar + 2 mg•L-1 de Kinetina) y se incubaron por 24 horas bajo condiciones controladas (19 °C, 80% de humedad relativa, luz constante). Para cada dosis se utilizaron tres cajas de Petri conteniendo cuatro discos y el experimento completo se repitió dos veces en el tiempo.
Transcurrido el período de incubación, cada disco de hoja se inoculó en la cara abaxial con una gota de 20 mL de una suspensión de 20.000 esporangios mL-1, previamente preparada a partir de conteos en un hematocitómetro. Las cajas de Petri fueron ubicadas bajo las condiciones antes descritas durante 6 días, tiempo después del cual se evaluó sobre cada disco el porcentaje de área foliar afectada con gota, por comparación con una escala 0-5, en donde cero se refiere a la ausencia de síntomas y cinco a un porcentaje de área foliar afectada superior al 50%. En los tratamientos control de las evaluaciones (0 mg•L-1) se sumergieron los discos de hoja en agua destilada estéril y se inocularon en forma similar a los demás tratamientos.
Para el análisis estadístico del experimento se procedió a transformar los valores discretos de la escala de severidad en una escala de porcentaje en donde 0-1 corresponde a valores de 0-20%, 1-2 (21-40%), 2-3 (41-60%), 3-4 (61-80%), 4-5 (81-100%). La información generada fue analizada mediante análisis Probit (Finney, 1971) y de esta forma calculados los valores de EC50 para cada aislamiento. La evaluación de diferencia significativa entre los valores de EC50 de los aislamientos se determinó mediante análisis con base en los intervalos fiduciales.
Por otro lado, para la determinación de diferencias significativas entre los métodos de aplicación, las dosis, los aislamientos y las formulaciones, se realizó un análisis de regresión logística, utilizándose la prueba de Wald para determinar la significancia de los efectos y sus interacciones en el modelo evaluado (Hosmer y Lemeshow, 2000).
Determinación de la secuencia parcial del gen citocromo b. El análisis molecular del gen citocromo b se realizó en los cuatro aislamientos evaluados en este estudio y en los aislamientos M158 (EC50=0,14, obtenido de S. juglandifolium en Manizales, Caldas a 2.200 msnm) y S001 (EC50=3,51, de plantas de S. tuberosum var. Pastusa, en Cerrito, Santander, a 3450 msnm) previamente identificados por Argel et al. (2004) como los que presentaron el menor y mayor valor de EC50, respectivamente, en el estudio de construcción de la línea base de sensibilidad al fenamidone de aislamientos Colombianos de P. infestans. En los seis aislamientos seleccionados, se procedió a la amplificación y secuenciación de una región del citocromo b, en la que previamente se han identificado mutaciones puntuales asociadas con resistencia a fungicidas QoI (Sierotski et al., 2000; Sirven y Beffa, 2003).
Extracción de ADN. Los aislamientos de P. infestans fueron transferidos a medio líquido de arveja (25 g de arveja, 20 g de azúcar, 1 L de agua destilada) e incubados a temperatura ambiente por 15 días, para proceder a la filtración del micelio y extraer el ADN siguiendo el protocolo del Centro internacional de la papa (2000).
Amplificación parcial del gen citocromo b. La amplificación del gen citocromo b se realizó empleando los cebadores: CB1: 5'ATT TTT TTG GAT TCG GTT CG 3' y CB2: 5'GTT TTC ATT GGA TTT GCT TC 3', mencionados por Sirven y Beffa (2003). Dichos cebadores amplifican una región de aproximadamente 700 pb que contiene los codones 129 a 146, región en la cual se han detectado mutaciones asociadas a resistencia a fungicidas QoI. La amplificación de PCR se realizó en un termociclador PTC-100 (MJ. Research, INC., Whaltam, EEUU) y consistió de una desnaturalización inicial a 94 ºC por 5 min, seguida por 30 ciclos de 94 ºC por 30 segundos, 52 ºC por 1 min, 72 ºC por 2 min y una extensión final a 72 ºC por 5 min. Las reacciones de PCR tuvieron un volumen total de 25 mL, conteniendo 0,1 mM de cada cebador, 1 U de Taq ADN polimerasa recombinante (Fermentas, Vilnius, Lithuania), 0,2 mM de cada dNTP, 1X de buffer de enzima (100 mM Tris-HCl (pH 8,8), 500 mM KCl, 0.8% Nonidet P40), 2 mM MgCl2 y 1 mL de una dilución de ADN 1/100. Luego de la amplificación se visualizaron los productos de reacción y se separaron por electroforesis en gel de agarosa al 1,5% suplementado con 3 mg de bromuro de etidio (10 mg•mL-1).
Los amplicones fueron purificados utilizando el kit Wizard PCR Preps DNA Purification System (Promega, Madison, EEUU) para proceder a su secuenciación directa en ambas direcciones utilizando los cebadores CB1 y CB2, mediante Big Dye Terminator Cycle Sequencing Ready Reaction Kit (PE Applied Biosystems, Foster City, CA). Su análisis se realizó en un secuenciador ABI Prism 3730xl (PE Applied Biosystems) de la compañía Macrogen (Corea del Sur).
Las secuencias obtenidas fueron editadas con la ayuda del software Editseq y se compararon utilizando el programa BLAST (http://www.ncbi.nlm.nih.gov/BLAST/Blast.cgi) con aquellas del gen citocromo b, previamente depositadas en las bases de datos moleculares para aislamientos de P. infestans y otros fitopatógenos. Las secuencias consenso se ensamblaron utilizando el programa MegAlign, se tradujeron a secuencia de aminoácidos y se ubicaron los codones 129 y 143, en los cuales se han detectado mutaciones asociadas con fenotipos resistentes a fungicidas QoI.
RESULTADOS Y DISCUSIÓN
Evaluación de sensibilidad al fungicida Fenamidone. En el tratamiento control los cuatro aislamientos de P. infestans causaron la necrosis de los discos de hoja inoculados con grados de severidad que alcanzaron valores en la escala de evaluación de cuatro a cinco, mientras que en los tratamientos con fungicida la acción del producto fue evidente, al reducirse la severidad de todos los aislamientos con el aumento de la dosis del fungicida aplicado tanto en grado técnico como en su formulación comercial (Figura 1). Así por ejemplo, bajo la dosis de 5 mg•L-1 de i.a. la reducción en la severidad alcanzó un rango del 50 al 75%, mientras que con la dosis de 15 mg•L-1 dicha reducción se aproximó al 90% en todos los aislamientos.
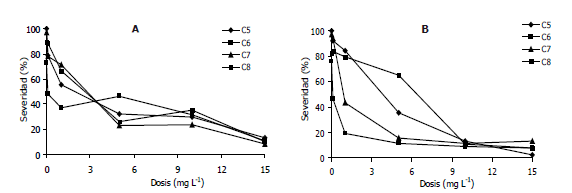
Figura 1. Evaluación de la sensibilidad al fungicida Fenamidone en su grado técnico (A) y formulación comercial de Mildex: 44,4 g kg-1 de i.a Fenamidone y 667 g kg-1 de Fosetyl-Al (B) en cuatro aislamientos de Phytophthora infestans procedentes de cultivos de papa del Departamento de Antioquia, Colombia.
Los valores de EC50 obtenidos en la prueba que utilizó el i.a. fenamidone en grado técnico variaron entre 0,13 mg•L-1 (aislamiento C6) y 2,03 mg•L-1 (aislamiento C8), mientras que en la evaluación utilizando Mildex, dicho rango osciló entre 0,07 mg•L-1 (aislamiento C6) y 2,9 mg•L-1 (aislamiento C8) (Figura 2). Estos valores se ubicaron en un rango muy similar a los obtenidos previamente por Argel et al. (2004), en la determinación de la línea base de la acción del fenamidone en una población Colombiana de P. infestans procedente de cultivos de papa; de tal manera que se puede inferir que el nivel de sensibilidad de este patógeno a dicho i.a. permanece estable, muy posiblemente gracias a que ha sido poco comercializado por las compañías agroquímicas para su empleo generalizado en los cultivos de papa, posiblemente debido entre otras razones, a la dificultad de hacer un seguimiento estricto de las recomendaciones anti-resistencia ofrecidas por FRAC (2007) para el empleo de fungicidas QoI. Estas recomendaciones se pueden resumir en los siguientes aspectos: a) utilizar el producto exclusivamente en los estados de desarrollo del cultivo y de la enfermedad indicados por el fabricante, siendo preferible su empleo bajo condiciones preventivas; b) no superar tres aplicaciones de estos fungicidas individuales por ciclo de cultivo, evitando su empleo en dos aplicaciones consecutivas; c) cuando se utilizan mezclas de productos, el número de aplicaciones conteniendo fungicidas QoI no debe exceder el 50% y bajo ninguna circunstancia debe superarse un número de seis aplicaciones de mezclas con QoI por ciclo de cultivo, ni tres aplicaciones consecutivas con dichas mezclas.
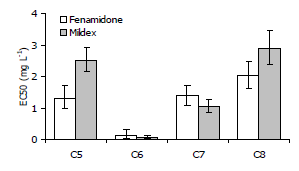
Figura 2. Valores de EC50 (mg•L-1) para el fungicida Fenamidone en su grado técnico y formulación comercial (Mildex: 44,4 g•kg-1 de i.a fenamidone y 667 g kg-1 de Fosetyl-Al) en cuatro aislamientos de Phytophthora infestans procedentes de cultivos de papa del Departamento de Antioquia, Colombia.
El seguimiento de estas recomendaciones permitirá mantener la efectividad de estos fungicidas como una herramienta para el control de estos organismos fitopatógenos en diversos cultivos. Aparentemente esta situación puede ser vista como de responsabilidad de las compañías de agroquímicos y de los profesionales que prestan asistencia técnica estatal, sin embargo el fenómeno de la resistencia de hongos y oomycetes a fungicidas genera unas implicaciones sociales, económicas y ambientales de tal importancia que debe ser abordado igualmente por las entidades de sanidad vegetal y protección ambiental de los países, por las agremiaciones de productores y por las entidades de investigación como universidades y centros estatales y privados. Esta fué la motivación para proponer el empleo de la metodología aquí presentada para el monitoreo de los niveles de sensibilidad de los fitopatógenos diana de los fungicidas QoI.
De otra parte los valores de EC50 encontrados en esta investigación, contrastan drásticamente con aquellos definidos para P. infestans en Europa, que en promedio alcanzan valores de 9 mg•L-1 en Holanda (Mercer y Latorse, 2003) a 15 mg•L-1 en Francia, Alemania y Reino Unido (Latorse y González, 2003) y se ubican a una distancia apreciable de la dosis de fenamidone establecida como el límite para calificar a los oomycetes con resistencia a dicho fungicida (50 mg•L-1) (Sirven y Beffa, 2003).
Con respecto a los resultados relacionados con las metodologías de aplicación evaluadas en esta investigación, no se encontraron diferencias significativas entre los métodos de inmersión y aspersión del fungicida y tampoco se observaron interacciones con los fungicidas o las dosis evaluadas (Tabla 1); de tal forma que para futuros estudios se recomienda la utilización del primero, por cuanto exige una menor cantidad de tiempo para el montaje del experimento. La gran similitud entre los valores de EC50 encontrados cuando se utilizó el fungicida en grado técnico, con respecto al uso del producto comercial Mildex, que incluye Fosetyl-Al como complemento, confirma que bajo un escenario de alta sensibilidad del patógeno, el fungicida principal actúa inicialmente sobre las poblaciones a controlar, mientras que la acción del fungicida acompañante es fundamental cuando se está en presencia de la aparición de poblaciones resistentes (Damicone, 2004). Finalmente la decisión de utilizar el i.a. en grado técnico ó en su formulación comercial para las evaluaciones de sensibilidad de fungicidas, depende del objetivo de la prueba, pues es posible que se desee conocer la condición del producto que se comercializa en el campo con el fin de evaluar la efectividad tanto de la molécula principal como de sus acompañantes o alternativamente es posible que sólo se requiera la evaluación de la sensibilidad de los fitopatógenos a una molécula fungicida particular.
Tabla 1. Análisis de efectos de los fungicidas Fenamidone en su grado técnico y formulación comercial (Mildex), dos métodos de aplicación y seis dosis, utilizando la prueba de Wald.

Determinación de la secuencia parcial del gen citocromo b. La cantidad y calidad del ADN obtenido a partir de la metodología de extracción de ácidos nucleicos fue adecuada para la amplificación de la región del gen mitocondrial citocromo b delimitada por los cebadores específicos CB1 y CB2. La reacción de PCR fue altamente específica, obteniéndose amplicones del tamaño esperado de 691 pb.
Las secuencias consenso, ensambladas a partir de la información generada con ambos cebadores fueron idénticas tanto para los cuatro aislamientos evaluados en este estudio (C5, C6, C7, C8) como para los aislamientos M158 y S001, utilizados como referencia a partir del trabajo previo de Argel et al. (2004). Una vez realizado el análisis BLAST, se determinó que existe un 99% de similitud de la región amplificada en este estudio y una secuencia localizada entre las posiciones 13193 y 14344 del ADN mitocondrial de aislamientos de P. infestans (haplotipo IIa) obtenidos en plantas de papa en Irlanda (Accesión AY898627). Esta región es identificada como parte del ORF que codifica para el citocromo b. Adicionalmente la secuencia compartió un porcentaje de similitud del 96% y 87%, con la secuencia de aminoácidos de este gen en los oomycetes Phytophthora megasperma y Saprolegnia ferax, respectivamente, lo cual corrobora el alto grado de conservación de este gen mitocondrial, dada su importante labor en la cadena de transporte de electrones de los organismos aeróbicos (Irwin et al., 1991).
Al analizarse la región correspondiente a los codones 129 a 146 del gen citocromo b, no se encontraron las mutaciones G143A y F129L, asociadas con resistencia a fungicidas QoI en otros hongos y pseudohongos (Figura 3) (Sierotzki et al., 2000; FRAC, 2007), lo cual coincidió con el alto nivel de sensibilidad presentado por los aislamientos de P. infestans evaluados tanto en este estudio como en aquel referente a la construcción de la línea base (Argel et al., 2004). Esta situación confirma los resultados de las pruebas in vitro realizadas en esta investigación y validan el potencial que ofrece el empleo de la prueba molecular para los programas de monitoreo de poblaciones de fitopatógenos resistentes a QoI. Desde el punto de vista rutinario su utilización podría efectuarse como un primer filtro para la determinación de la presencia de las mutaciones asociadas a la resistencia en las poblaciones del patógeno que se desean evaluar, sin necesidad del proceso de aislamiento, pues el ADN se puede extraer directamente de las estructuras del patógeno presentes en los tejidos afectados (Argel et al., 2007). El proceso desde la obtención de las muestras hasta la obtención de resultados se extiende a máximo una semana y su costo se estima en USD $15 por aislamiento analizado. Al compararse esta metodología con las pruebas in vitro, que necesitan de un mínimo de tres semanas al requerir el aislamiento del patógeno, el incremento de esporas para la preparación del inóculo, el mantenimiento constante de material vegetal libre de enfermedad y sin ninguna aplicación de productos químicos, un período de incubación de al menos siete días y el análisis estadístico posterior, se puede inferir su utilidad en la práctica. Por supuesto la propuesta planteada en este trabajo, no consiste en la eliminación de la evaluación in vitro, sino en su uso alternativo con la detección de la presencia de las mutaciones G143A y/o F129L.

Figura 3. Alineamiento de las secuencias de varios oomycetes y hongos entre las posiciones 129 y 146 del gen citocromo b. Las mutaciones en los codones 129 y 143 se han asociado previamente con fenotipos resistentes a fungicidas del tipo QoI.
CONCLUSIONES
Se presenta una propuesta metodológica que incluye el empleo conjunto de pruebas in vitro y de biología molecular para el monitoreo de los niveles de sensibilidad de las poblaciones de fitopatógenos contra los cuales se utilizan los fungicidas del grupo de resistencia cruzada QoI. La secuencia en la utilización de ambos sistemas de evaluación, depende de la disponibilidad de un laboratorio básico de biología molecular de soporte; sin embargo, la rapidez para la obtención de los resultados y la posibilidad de evaluar simultáneamente una gran cantidad de muestras, hacen del empleo de la técnica molecular una excelente herramienta para su uso en procesos de monitoreo rutinario con alcance regional, nacional o incluso internacional.
Se espera en el corto plazo evaluar una alternativa metodológica adicional para aumentar la eficiencia económica y de tiempo del proceso de evaluación de sensibilidad de hongos y pseudohongos fitopatógenos a diferentes fungicidas sistémicos, incluyendo los QoI. Para esto se empleará un sistema de PCR en tiempo real bajo el esquema de la técnica conocida como polimorfismo de nucleótidos simples (SNPs), que permite determinar la presencia de mutaciones puntuales mediante análisis de la curva de desnaturalización de los fragmentos amplificados.
AGRADECIMIENTOS
Esta investigación se realizó gracias al apoyo financiero de la Dirección Nacional de Investigaciones de la Universidad Nacional de Colombia (DINAIN-VRI) a través del proyecto "Variabilidad genética de aislamientos colombianos de Phytophthora infestans y su relación con el nivel de sensibilidad al fungicida del grupo de resistencia cruzada QoI: Fenamidone" Código 20101005571.
BIBLIOGRAFÍA
Argel, L.E., S. Jaramillo, J.G. Morales, B. Jacqmin y E. Guzmán. 2004. Línea base de sensibilidad de Phytophthora infestans al Fenamidone (S)-5-metil-2-metilltio-5-fenil-3-fenilamino-3,5-dihidroimidazol-4 en Colombia. pp. 7-12. En: Memorias. XXI Congreso de la Asociación Latinoamericana de la Papa (ALAP). Valdivia, Chile. [ Links ]
Argel, L.E., M. Marín, J.M. Cotes, S. Jaramillo y E. Guzmán. 2007. Evaluación molecular y fenotípica de la sensibilidad al fungicida Fenamidone en aislamientos de Peronospora sparsa. Agronomía Colombiana 25(1): 149-159. [ Links ]
Bartlett, D.W., J.M. Clough, J. Goodwin, A. Hall, M. Hammer and B. Parr-Dobrzanski. 2002. Review: the strobilurin fungicides. Pest Management Science 58: 649-662. [ Links ]
Centro Internacional de la Papa (CIP). 2000. Uso de marcadores moleculares en la caracterización de Phytophthora infestans (Mont.) de Bary. Centro Internacional de la Papa. Lima, Perú. [ Links ]
Damicone, J. 2004. Fungicide Resistance Management. Oklahoma State University. f-7663, 7 p. [ Links ]
Delye, C., F. Laigret and M.F. Corio-Costet. 1997. A mutation in the 14-alpha-demethylase gene of Uncinula necator that correlates with resistance to a sterol biosynthesis inhibitor. Applied and Environmental Microbiology 63(8): 2966-2970. [ Links ]
Di Rago, J.P., D. Hermann-Le, F. Paques, J. Risler, P. Netter and P. Slonimski. 1995. Genetic analysis of the folded structure of yeast mitochondrial cytochrome b by selection of intragenic second-site revertans. Journal of Molecular Biology 248: 804-811. [ Links ]
Erwin, D.C. and O.K. Ribeiro. 1996. Phytophthora Diseases Worldwide. The American Phytopathological Society Press, St. Paul, Minnesota. 562 p. [ Links ]
Farman, M.L. 2001. The molecular basis of field resistance to QoI fungicides in Pyrycularia grisea. Phytopathology 91: 110. [ Links ]
Finney, D.J. 1971. Probit Analysis. Tercera Edición. Cambridge University Press, London. 350 p. [ Links ]
Fungicide Resistance Action Committee (FRAC). 2007. FRAC QoI Working Group. En: http://www.frac.info; consulta: diciembre 2007. [ Links ]
Genix, P. and A. Villier. 2003. Fenamidone inhibits mitochondrial respiration, a property not shared by its metabolites. Pflanzenschutz Nachrichten Bayer 56 (3): 444-448. [ Links ]
Gisi, U., H. Sierotzki, A. Cook and A. McCaffery. 2002. Mechanisms influencing the evolution of resistance to Qo inhibitor fungicides. Pest Management Science 58(9): 859-867. [ Links ]
Hamamoto, H., K. Hasesawa, R. Nakaune, Y. Jin-Lee, K. Akutsu and T. Hibi. 2001. PCR-based detection of sterol demethylation inhibitor-resistant strains of Penicillium digitatum. Pest Management Science 57(9): 839-843. [ Links ]
Hosmer D.W. and S. Lemeshow. 2000. Applied logistic regression. Segunda edición. John Wiley and Sons Inc, New York. 373 p. [ Links ]
Irwin, D.M., T.D. Kocher and A.C. Wilson. 1991. Evolution of the cytochrome b gene of mammals. Journal of Molecular Evolution 32(2): 128-144. [ Links ]
Ishii, H., B. Fraaije, T. Sugiyama, K. Noguchi, K. Nishimura, T. Takeda, T. Amano and D. Hollomon. 2001. Occurrence and molecular characterization of strobilurin resistance in cucumber powdery mildew and downy mildew. Phytopathology 91(12): 1166-1171. [ Links ]
Jaramillo, S. 2003. Phytophthora infestans (Mont.) de Bary. Facultad de Ciencias Agropecuarias. Universidad Nacional de Colombia. Medellín. 137 p. [ Links ]
Koller, W. 2000. Fungicide resistance. 2: 483-488. Encyclopedia of plant pathology. John Wiley and Sons. 1368 p. [ Links ]
Latorse, M.P., and H. González. 2003. Sensitivity base line and resistance monitoring on Plasmopara viticola and Phytophthora infestans. Pflanzenschutz Nachrichten Bayer 56(3): 511-522. [ Links ]
Konieczny, A. and F. Ausubel. 1993. A procedure for mapping Arabidopsis mutations using co-dominant ecotype-specific PCR-based markers. Plant Journal 4(2): 403-410. [ Links ]
Mercer, R.T. and M.P. Latorse. 2003. Fungicidal properties of the active ingredient Fenamidone. Pflanzenschutz Nachrichten Bayer 56 (3): 465-476. [ Links ]
Neuburger, M., R. Beffa and A. Villier. 2003. Mode of action of fenamidone: similarities and differences with known QoI. Pflanzenschutz Nachrichten Bayer 56(3): 449-464. [ Links ]
Oefner, P.J. and P.A. Underhill. 1995. Comparative DNA sequencing by denaturing high-performance liquid chromatography (DHPLC). American Journal Human Genetics 57(Suppl.): A266 [ Links ]
Sierotzki, H., J. Wullschleger and U. Gisi. 2000. Point mutation in cytochrome b gene conferring resistance to strobilurin fungicides in Erysiphe graminis f. sp. tritici field isolates. Pesticide Biochemistry and Physiology 68(2): 107-112. [ Links ]
Sirven, C. and R. Beffa. 2003. Resistence to fenamidone: Monitoring by real-time quantitative PCR on Plasmopara viticola. Pflanzenschutz Nachrichten Bayer 56 (3): 523-532. [ Links ]
Vuorio, AF, L. Paulin, J. Saltevo and K. Kontula. 1999. Single-nucleotide polymorphisms may cause erroneous results in primer-introduced restriction enzyme analyses: a case of molecular misdiagnosis of homozygous vs heterozygous familial hypercholesterolemia. Molecular and Cellular Probes 13(6): 421-424. [ Links ]
Zheng, D. and W. Koller. 1997. Characterization of the mitochondrial cytochrome b gene from Venturia inaequalis. Current Genetics 32(5): 361-366. [ Links ]














