Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Facultad Nacional de Agronomía Medellín
Print version ISSN 0304-2847
Rev. Fac. Nac. Agron. Medellín vol.62 no.1 Medellín Jan./June 2009
EFECTO SOBRE LA SARNA POLVOSA DE CUATRO AISLAMIENTOS DEL HONGO Trichoderma asperellum EN TRES TIPOS DE SUELO
EFFECT ON THE POWDERY SCAB OF FOUR ISOLATES OF THE FUNGUS Trichoderma asperellum IN THREE TYPES OF SOILS
Elizabeth Gilchrist1; Sonia Jaramillo Villegas2 y Sebastián Reynaldi3
1 Ingeniera Agrónoma. Universidad Nacional de Colombia, Sede Medellín. Facultad de Ciencias Agropecuarias. A.A. 1779. Medellín, Colombia. <elygilchrist@hotmail.com>
2 Profesora Asociada. Universidad Nacional de Colombia, Sede Medellín. Facultad de Ciencias Agropecuarias. A.A. 1779. Medellín, Colombia. <sjaramal@unalmed.edu.co>
3 Profesor Asistente. Universidad Nacional de Colombia, Sede Medellín. Facultad de Ciencias Agropecuarias. A.A. 1779. Medellín, Colombia. <sreynaldi@unal.edu.co>
Recibido: Mayo 7 de 2008; Aceptado: Abril 2 de 2009.
Resumen. El protozoario Spongospora subterranea f. sp. subterranea es un parásito obligado que replica en raíces y tubérculos de papa causando la sarna polvosa. Esta enfermedad se ha difundido a escala global debido al comercio de tubérculos-semilla infectados y a la ausencia de tratamientos efectivos. En este trabajo se investigó la influencia sobre la sarna polvosa de cuatro aislamientos de Trichoderma asperellum en tres tipos de suelo: Andisol, Entisol e Inceptisol. Tubérculos de Solanum tuberosum variedad Diacol Capiro fueron plantados en parcelas infectadas con 1942 ± 226 quistosoros por gramo de suelo. No se observaron diferencias entre las plantas tratadas y no tratadas con T. asperellum. La superficie de raíz ocupada por agallas fue en promedio 2,2%, sin encontrarse diferencias significativas (P<0,05) entre los tipos de suelos. La reducción del crecimiento de las plantas fue de 41, 32 y 28% en el Andisol, el Entisol y el Inceptisol, respectivamente. La reducción de la producción fue de 40, 28 y 0,1 % en el Andisol, el Entisol y el Inceptisol, respectivamente. Un porcentaje similar de superficie de raíz cubierto por agallas resultó en reducciones de la producción tan disímiles como 40% o 0,1%, indicando necesidad de utilizar otros métodos para determinar la severidad de infección. La reducción del crecimiento y la producción estuvieron inversamente asociadas a la concentración de Al3+ en los suelos, sugiriendo que los efectos de la sarna polvosa están fuertemente relacionados con las condiciones del suelo.
Palabras claves: Spongospora subterranea, Solanum tuberosum, producción de papa, crecimiento de la planta, quistosoro.
Abstract. The protozoan Spongospora subterranea f. sp. subterranea is an obligate parasite that replicates in roots and tubers of potato causing the powdery scab. This disease has disseminated on a global scale, because the commercial traffic of infected tubers used as seed and the absence of effective treatments. The present work investigated the effects of four isolates of Trichoderma asperellum in three soil types: Andisol, Entisol and Inceptisol. The soils were infected with 1942 ± 226 cystosori per gram of soil. It was used Solanum tuberosum variety Diacol Capiro. No differences were observed between treated and non treated plants with T. asperellum. The root surface affected by galls was an average of 2.2 %, and no significant differences (p<0.05) were observed among the soils. The reduction of plant growth was of 41, 32 and 28 % for the Andisol, Entisol and Inceptisol, respectively. The reduction in tubers production was of 40, 28 and 0,1% for the Andisol, Entisol and Inceptisol, respectively. Similar percent of root surface covered with galls resulted in production reduction of 40%, but also of 0,1%, indicating the necessity of other methods to determine the infection severity. The growth and production reductions were inversely associated with the Al3+ concentration in the soils, suggesting that powdery scab effects are strongly related to soil characteristics.
Key words: Spongospora subterranea, Solanum tuberosum, potato production, plant growth, cystosori.
Spongospora subterranea forma especial subterranea (S. subterranea) es un parásito obligado que replica en raíces y tubérculos de papa causando la sarna polvosa. S. subterranea es un protozoario perteneciente al orden Plasmodioforales (Harrison et al., 1997). Su ciclo de replicación comienza cuando zoosporas biflageladas nadan en el agua del suelo hasta encontrar raíces y tubérculos para infectar (Merz, 1992). Una vez dentro del tejido vegetal, las zoosporas presentan una división nuclear cruciforme que origina un plasmodio multinucleado (Harrison et al., 1997; Merz y Falloon, 2009). Estos plasmodios multinucleados se tabican y forman nuevas zoosporas. Luego de formadas, las zoosporas se enquistan formando una gruesa pared celular (Merz y Falloon, 2009). Los grupos de zoosporas enquistadas se denominan quistosoros, unidades de resistencia del parásito que pueden permanecer latentes en el suelo durante años (Harrison et al., 1997).
La sarna polvosa fue registrada por primera vez en 1841 en Brauschweig, Alemania. En 1913 fue encontrada en América del Norte (Harrison et al., 1997), y 24 años más tarde fue hallada en Antioquia, Colombia (Castaño, 1978). La sarna polvosa se ha difundido y consolidado a escala global debido principalmente al comercio de tubérculos infectados que son usados como semillas, y a la ausencia de tratamientos efectivos (Harrison et al., 1997; Merz y Falloon, 2009). De esta forma investigar posibles estrategias de control para esta enfermedad es una prioridad en países productores de papa como Colombia.
Los hongos del género Trichoderma han mostrado eficaciaenlaregulaciónocontroldemicroorganismos del suelo que causan enfermedades en plantas (Paulitz y Belanger, 2001). Estos hongos presentan una amplia gama de modos de acción, entre las que se pueden mencionar el micoparasitismo, la antibiosis y la actividad quitinolítica (Paulitz y Belanger, 2001; Rey et al., 2001). Estas características hacen considerar a los hongos del género Trichoderma como potenciales controladores o reguladores de S. subterranea.
El contenido del agua del suelo es la característica ambiental más estrechamente relacionada con el desarrollo de la sarna polvosa (Harrison et al., 1997). Los suelos con alta capacidad de retener agua, como los Andisoles (Jaramillo et al., 1994), podrían favorecer el desplazamiento de las zoosporas hasta los tubérculos y las raíces favoreciendo la infección. De esta forma, los suelos con baja capacidad de retener agua deberían ser menos propicios para el desarrollo de la enfermedad. Las zonas de producción de papa en el departamento de Antioquia, Colombia, presentan suelos con diferente capacidad de retención de agua como son los suelos Andisol, Entisol e Inceptisol (Jaramillo et al., 1994). El desarrollo de la sarna polvosa en estos suelos debería ser diferente. Así, el objetivo del presente trabajo fue investigar el efecto sobre la sarna polvosa de cuatro aislamientos de Trichoderma asperellum en los suelos Andisol, Entisol e Inceptisol.
MATERIALES Y MÉTODOS
Diseño experimental. Las unidades experimentales fueron parcelas de 1 m2 por 40 cm de profundidad llenas con tres suelos procedentes de zonas productoras de papa de Antioquia, clasificados como Andisol, Entisol e Inceptisol (Jaramillo et al., 1994). El suelo Andisol fue colectado en el Centro Agropecuario Paysandú, Universidad Nacional de Colombia, Sede Medellín (corregimiento de Santa Elena-Medellín); el Entisol en el municipio de Santa Rosa de Osos; y el Inceptisol en el corregimiento de Llanos de Cuiba-Yarumal y Santa Rosa de Osos. En todas las parcelas se plantaron 24 tubérculos pequeños certificados de Solanum tuberosum variedad Diacol Capiro. Antes de comenzar el trabajo, las parcelas fueron inoculadas con cantidades iguales de quistosoros de S. subterranea extraídos de raíces infectadas, este inóculo se multiplicó luego de tres ciclos de infección (Jaramillo et al., 2006). El contenido de las parcelas correspondientes a cada tipo de suelo se retiró, mezcló y volvió a distribuirse para homogenizar el inóculo de S subterranea. El resultado de esta homogenización se analizó en 6 muestras independientes por tipo de suelo a las que les determinó la cantidad de quistosoros por gramo de suelo. Desde un inicio, tres parcelas por tipo de suelo no fueron infectadas para poder determinar los efectos de la sarna polvosa (Jaramillo et al., 2006). En el presente trabajo, este tratamiento se denominó control de S. subterranea (Ctrl S).
Para investigar los efectos Trichoderma asperellum sobre la sarna polvosa se utilizaron cuatro aislamientos T25, T46, T84 y T109, previamente descritos por Hoyos et al. (2009). Para cada aislamiento se destinaron seis parcelas por cada tipo de suelos. En cada parcela, se aplicaron 10 ml de una suspensión de 106 UFC/ml de agua por tubérculo plantado, con una frecuencia de aplicación semanal desde la siembra hasta la floración. Para determinar los efectos de los aislamientos sobre la sarna polvosa, se aplicaron 10 ml de agua por tubérculo plantado en seis parcelas infectadas con S. subterranea por tipo de suelo con la misma frecuencia de aplicación usada para los aislamientos. Este tratamiento se denominó el control de Trichoderma, Ctrl T.
En forma homogénea, durante la floración, se removió la mitad de las plantas de cada parcela para determinar el porcentaje de raíz cubierta por agallas y el peso seco de las plantas. Las agallas y el porcentaje de superficie de raíz que estas ocupaban se estimaron visualmente (Harrison et al., 1997; Álvarez y Rojas, 2001; Qu y Christ, 2007). El peso seco se determinó pesando las plantas luego de ser secadas por 24h a 70ºC y se expresó como gramos de peso seco por planta. El peso seco alcanzado a la floración se consideró como medida del crecimiento de las plantas. Durante la cosecha se determinó la producción de tubérculos expresándola como gramos de tubérculo por planta.
El efecto de la sarna polvosa en cada tipo de suelo se estableció calculando el porcentaje promedio de reducción del crecimiento y la producción, como lo indica la siguiente ecuación.
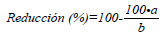
Donde a correspondió al peso seco o al peso de tubérculos por planta en las parcelas infectadas con S. subterranea; y b el promedio del peso seco o del peso de tubérculos por planta en las parcelas no infectadas con S. subterranea (Crtl S).
El experimento se llevó a cabo en el Centro Agropecuario Paysandú, Universidad Nacional de Colombia, Sede Medellín, localizado en el corregimiento de Santa Elena-Medellín, Antioquia. El terreno donde se trabajó presenta una altitud de 2.550 msnm, con un promedio anual de precipitación y temperatura de 2.500 mm y 14 ºC, respectivamente. La región pertenece a la zona de vida Bosque húmedo Montano Bajo (BhMB) (Espinal, 1992).
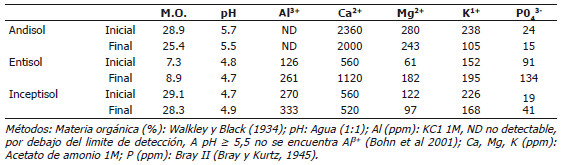
Las variables físico-químicas para cada tipo de suelo (Tabla 1) fueron determinadas al inicio del experimento en muestras colectadas antes de fertilizar y aplicar enmiendas según lo recomendado por González y Jaramillo (2008), para el cultivo de la papa en el oriente de Antioquia, Colombia. Adicionalmente, se colectaron y analizaron muestras de cada tipo de suelo al final del experimento. Los análisis se realizaron en el Laboratorio de Suelos, Facultad de Ciencias- Universidad Nacional de Colombia, sede Medellín.
Tabla 1. Análisis químico de tres tipos de suelo empleados para establecer el efecto sobre la sarna polvorosa de cuatro aislamientos de Trichoderma asperellum.
Determinación de la homogeneidad del inóculo de Spongospora subterranea. Se tomaron muestras de suelo de 300 g para determinar la homogeneidad del inóculo, presencia de S. subterranea en los tres tipos de suelo. Las muestras de suelo se secaron durante 48 horas a una temperatura de 25 ± 3 ºC y se pasaron sucesivamente por tres tamices de 600, 150 y 53 mm. Del tamizado resultante se tomó 0,1 g y se aforó a 10 ml con agua de red y se agitó fuertemente. Inmediatamente, 50 ml de esta suspensión se montaron en una cámara de Neubauer para contar los quistosoros utilizando un microscopio óptico con un aumento de 10x. El resultado del conteo se expresó como quistosoros por gramo de suelo, considerando los 300 g de suelo de los que se partió inicialmente.
Análisis estadístico. Se realizó un análisis de varianza (ANAVA) de dos vías, considerando los tipos del suelo y los aislamientos de T. asperellum como factores. Las medias de estos tratamientos fueron comparadas entre sí utilizando la prueba de Tukey (P<0,05). La homogeneidad del inóculo de S. subterranea entre los tipos de suelo fue analizado mediante un análisis de varianza de una vía (ANAVA). La relación entre la concentración de Al3+ en los diferentes suelos y los efectos de la sarna polvosa se ajustaron a un modelo lineal, considerando la concentración de Al3+ en el Andisol igual a cero porque a pH ≥ 5,5 no se encuentra el ión Al3+ en solución (Bohn et al., 2001). Esto se confirmó en el análisis de suelos donde Al3+ se reporta como no detectable en el Andisol (Tabla 1). La homocedasticidad y normalidad de los datos fueron analizados (P<0,05) utilizando las pruebas de Levene y Kolmogorov-Smirnov, respectivamente. Cuando estos requerimientos no fueron satisfechos se utilizó la transformación por rankings (Potvin y Roff, 1993). Todos los análisis y transformaciones se realizaron utilizando el programa de distribución libre R (CRAN, 2009).
RESULTADOS
Determinación de la homogeneidad del inóculo de Spongospora subterranea. El inóculo de S. subterranea en los tres suelos fue considerado como homogéneo, porque no se encontraron diferencias significativas (P<0,05) entre los inóculos determinados para cada uno de ellos. Esto permitió comparar los efectos de la sarna polvosa en los distintos suelos. En promedio se determinó un inóculo de 1942 ± 443 quistosoros por gramo de suelo.
Área de raíz cubierta por agallas. En el Andisol y el Inceptisol, no se observaron diferencias significativas (P<0,05) entre los tratamientos (Figura 1). En el Entisol, el aislamiento T109 presentó un porcentaje de superficie de raíz cubierto por agallas similar al del aislamiento T84, pero significativamente (P<0,05) mayor al observado en el resto de los tratamientos (Figura 1). En promedio, el 2,2% de la superficie de las raíces estuvo cubierta por agallas y no se observaron diferencias significativas (P<0,05) entre el promedio para cada tipo de suelo (Figura 2).
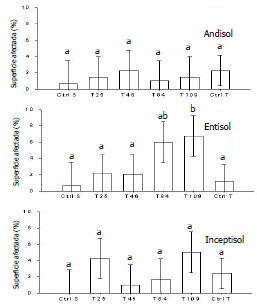
Figura 1. Superficie de raíz de papa afectada cubierta por agallas para cada tratamiento (Ctrl S, T25, T46, T84, T109, Ctrl T) en cada tipo de suelo (Andisol, Entisol e Inceptisol). Ctrl S: control sin Spongospora subterranea y sin aislamientos de Trichoderma asperellum. Ctrl T: control con Spongospora subterranea y sin aislamientos de Trichoderma asperellum. Letras diferentes indican diferencias significativas (P<0,05). Las barras de error representan los intervalos de confianza del 95%.
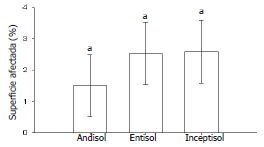
Figura 2. Superficie de raíz de papa cubierta por agallas para cada tipo de suelo (Andisol, Entisol e Inceptisol). Letras diferentes indican diferencias significativas (P<0,05). Las barras de error representan los intervalos de confianza del 95%.
Efecto de Spongospora subterranea sobre el crecimiento de las plantas. En el Andisol, el crecimiento fue afectado por la sarna polvosa porque el peso seco de las plantas en Ctrl T fue significativamente menor (P<0,05) al observado en Ctrl S (Figura 3). El peso seco de las plantas inoculadas con los aislamientos de T. asperellum no fue significativamente (P<0,05) mayor al observado en Ctrl T, pero tampoco significativamente (P<0,05) menor al observado en Ctrl S (Figura 3). En el Entisol, el peso seco observado para el aislamiento T25 fue significativamente (P<0,05) menor al observado en Ctrl S (Figura 3). En el Inceptisol, no se observaron diferencias entre los tratamientos (Figura 3). La reducción promedio del peso seco por tipo de suelo fue del 41, 32 y 28 % para el Andisol, el Entisol y el Inceptisol, respectivamente (Figura 4).
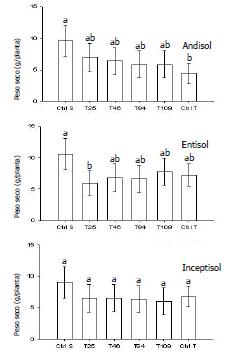
Figura 3. Peso seco para cada tratamiento (Ctrl S, T25, T46, T84, T109, Ctrl T) en cada tipo de suelo (Andisol, Entisol e Inceptisol). Ctrl S: control sin Spongospora subterranea y sin aislamientos de Trichoderma asperellum. Ctrl T: control con Spongospora subterranea y sin aislamientos de Trichoderma asperellum. Letras diferentes indican diferencias significativas (P<0,05). Las barras de error representan los intervalos de confianza del 95%.

Figura 4. Reducción del crecimiento (peso seco) en cada tipo de suelo (Andisol, Entisol e Inceptisol). Letras diferentes indican diferencias significativas (P<0,05). Las barras de error representan los intervalos de confianza del 95%.
Efecto de Spongospora subterranea sobre la producción de tubérculos. En el Andisol, la producción de tubérculos fue afectada por la sarna polvosa porque las plantas en el Ctrl T produjeron significativamente (P<0,05) menos que las plantas en el Ctrl S (Figura 5). Las plantas tratadas con los aislamientos de T. asperellum no produjeron significativamente (P<0,05) más que las plantas no tratadas (Ctrl T), pero tampoco significativamente (P<0,05) menos que las plantas no infectadas con S. subterranea (Ctrl S) (Figura 5). En el Entisol, las plantas tratadas con los aislamientos T46 y T109 produjeron significativamente (P<0,05) menos que las plantas no infectadas (Ctrl S), pero no se observaron diferencias significativas (P<0,05) entre los tratamientos Ctrl T y Ctrl S (Figura 5). En el Inceptisol no se observaron diferencias significativas (P<0,05) entre ninguno de los tratamientos (Figura 5). La reducción promedio de la producción por tipo de suelo fue del 40, 28 y 0.1 % para el Andisol, el Entisol y el Inceptisol, respectivamente. La reducción de la producción en el Andisol y en el Entisol fue significativamente (P<0,05) mayor que la reducción observada en el Inceptisol (Figura 6).

Figura 5. Producción de tubérculos para cada tratamiento (Ctrl S, T25, T46, T84, T109, Ctrl T) en cada tipo de suelo (Andisol, Entisol e Inceptisol). Ctrl S: control sin Spongospora subterranea y sin aislamientos de Trichoderma asperellum. Ctrl T: control con Spongospora subterranea y sin aislamientos de Trichoderma asperellum. Letras diferentes indican diferencias significativas (P<0,05). Las barras de error representan los intervalos de confianza del 95%.
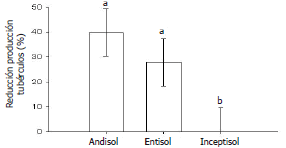
Figura 6. Reducción de la producción de tubérculos en cada tipo de suelo (Andisol, Entisol e Inceptisol). Letras diferentes indican diferencias significativas (P<0,05). Las barras de error representan los intervalos de confianza del 95%.
Relación entre los efectos de la sarna polvosa y la concentración de Al3+ del suelo. La reducción del crecimiento y la producción de las parcelas correspondientes al Ctrl T estuvieron inversamente asociadas con la concentración de Al3+ en el suelo (Figura 7). Para la reducción de la producción los datos pudieron ser significativamente (P<0,05) ajustados a un modelo lineal, y=-0,14x+47,44; donde y corresponde al porcentaje de reducción de la producción y x corresponde a la concentración de Al3+. A este modelo lineal le correspondió un coeficiente de correlación ajustado (r2) de 0,99.
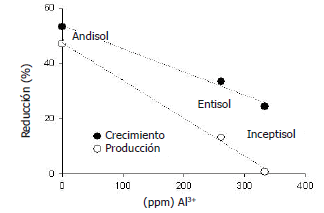
Figura 7. Relación entre la concentración de Al3+ en el suelo y la reducción del crecimiento y la producción en papa para los tres tipos de suelo empleados para establecer el efecto sobre la sarna polvorosa de cuatro aislamientos de Trichoderma asperellum.
DISCUSIÓN
Uso de las agallas para cuantificar la severidad de infección. Los efectos de la sarna polvosa de la papa sobre la producción de tubérculos fue muy variable, fluctuando entre un 40 % de reducción en el Andisol hasta un 0,1 % de reducción en el Inceptisol, pasando por un 30 % de reducción en el Entisol (Figura 6). Esta gran variabilidad no fue reflejada por el porcentaje de superficie de raíz cubierto por agallas (Figura 2). Igualmente controversial fue la presencia de agallas en las raíces en el Ctrl S (Figura 1). Esto puedo deberse a la contaminación o a una mala identificación de las agallas. La presencia de agallas indican que el parásito se está dividiendo (Harrison et al., 1997; Bell et al., 1999; Van de Graaf et al., 2005), pero las agallas producidas por S. subterranea se pueden confundir con otras lesiones presentes en las raíces (Bulman y Marshall, 1998). Los resultados del trabajo mostraron que la cuantificación visual de las agallas no es un método confiable para determinar la severidad de la infección. Se ha desarrollado detección de proteínas o polisacáridos específicos de S. subterranea mediante anticuerpos, pero se producen reacciones cruzadas con la matriz de la muestra (Ward et al., 2004). Para evitar esto, existe la posibilidad de identificar secuencias específicas del ADN de S. subterranea, mediante su amplificación por Polymerase Chain Reaction (PCR) (Bulman y Marshall, 1998; Bell et al., 1999). Este método ha mostrado ser muy sensible y específico, pero no permite cuantificar el parásito presente en una planta infectada, inconveniente que se soluciona incorporando PCR en tiempo real (Qu et al. 2006).
Efecto de la sarna polvosa sobre el crecimiento y la producción. En todos los suelos, las plantas sembradas en el control con S. subterranea y sin Trichoderma (Ctrl T) fueron de menor crecimiento que las plantas en el control sin S. subterranea y sin Trichoderma (Ctrl S) (Figura 3). Pero en el Andisol, estas diferencias fueron significativas (P<0,05), indicando que la sarna polvosa afectó el crecimiento de las plantas (Figura 3). Las diferencias significativas (P<0,05) entre Ctrl S y Ctrl T también se observaron para la producción (Figura 5). Confirmando esta tendencia, la reducción promedio de la producción fue significativamente (P<0,05) mayor en el suelo Andisol en comparación con los otros dos suelos (Figura 6). Probablemente la reducción de la producción sea consecuencia de la reducción del crecimiento de las plantas. Similar reducción en el crecimiento fue previamente reportada por Nielsen y Larsen (2004), en plántulas de tomate con plasmodios multicelulados de S. subterranea en las raíces. Esto sugiere que la reducción del crecimiento y la producción se originan en la pérdida de funcionalidad de las raíces como consecuencia de la replicación de S. subterranea.
Efecto de los aislamientos de Trichoderma asperellum sobre la sarna polvosa. En el Andisol, las plantas tratadas con los aislamientos presentaron un tamaño intermedio. Estas no fueron significativamente (P<0,05) mayores a las plantas en el Ctrl T, pero tampoco significativamente (P<0,05) menores a las plantas en el Ctrl S (Figura 3). En un trabajo previo, la aplicación de formulaciones de hongos del género Trichoderma no alcanzó a compensar la reducción de peso seco de plantas de tomate infectadas con S. subterranea, pero redujo significativamente (P<0,05) la presencia del parásito en las raíces (Nielsen y Larsen, 2004). En el presente trabajo, los aislamientos de T. asperellum tampoco lograron compensar la reducción del crecimiento causada por la sarna polvosa. Esto contrasta, con el reconocimiento que tienen estos hongos como estimuladores del crecimiento vegetal (Yedidia et al., 2001). Posiblemente condiciones ambientales, el inóculo y/o la frecuencia de aplicación hayan limitado las capacidades de estos hongos. De esta forma, futuras investigaciones deberán considerar la influencia de las condiciones ambientales y de las estrategias de aplicación en la capacidad de T. asperellum de controlar o regular la sarna polvosa.
Influencia de la capacidad de retención de agua del suelo sobre la sarna polvosa. La reducción del crecimiento y la producción ocurrieron significativamente (P<0,05) sólo en el Andisol (Figuras 3 y 5), que es el suelo con mayor capacidad de retener agua de los investigados (USDA, 1999). En trabajos previos, se observó que el aumento del contenido de agua del suelo incrementó la severidad de infección medida por PCR en tiempo real (Van de Graaf et al., 2005 y 2007). Esto contrasta con lo encontrado en el presente trabajo donde no se observaron diferencias para la severidad de infección entre los tipos de suelo (Figura 2). Más aun, la severidad promedio en el Andisol estuvo por debajo del promedio general (Figura 2). Esto podría ser una evidencia más para demostrar inconsistencia del uso de las agallas para determinar la severidad de infección. El Inceptisol, que le sigue al Andisol en su capacidad de retención de agua (USDA, 1999), fue el suelo que menores reducciones de crecimiento y producción presentó (Figuras 3 y 5). Esto sugiere que otros factores también pueden condicionar los efectos de la sarna polvosa.
Influencia de la concentración de del suelo sobre la sarna polvosa. En el Entisol y el Inceptisol, el peso seco y la producción de las plantas no presentaron diferencias significativas (P<0,05) entre los controles Ctrl T y Ctrl S, indicando que en estos suelos la sarna polvosa se desarrolló en un nivel menor al observado en el Andisol. Los suelos pueden presentar características que favorezcan el desarrollo de la sarna polvosa como es la capacidad de retener agua (Harrison et al., 2007). Pero, también, podrían existir características que afecten a S. subterranea limitando el desarrollo de la sarna polvosa. En este trabajo, los suelos investigados presentaron concentraciones de Al3+ que estuvieron inversamente asociadas con los efectos de la sarna polvosa sobre el crecimiento y la producción de las plantas en Ctrl T (Figura 7). Más aun, la reducción de la producción se ajustó significativamente (P<0,05) a un modelo lineal que la relaciona en forma inversamente proporcional a la concentración de Al3+. Esto sugiere que el aluminio puede ser tóxico para S. subterranea, como lo es para Phytophthora infestans (Andrivon, 1995) y Streptomyces scabies (Mizuno y Yoshida, 1993).
En una zona con alta incidencia de sarna polvosa, no se detectó S. subterranea en suelos con altas concentraciones Al3+, aun cuando se utilizaron técnicas altamente sensibles como PCR (Nakayama et al., 2007). Esto sugiere que mantener una alta concentración de Al3+ en el suelo podría formar parte de una estrategia de control de la sarna polvosa. Sin embargo, Al3+ es tóxico para las plantas de papa (Lee, 1971). En el presente trabajo, esto explicaría porque la menor producción de tubérculos se observó en el suelo Inceptisol (Figura 5), que fue el suelo con la mayor concentración de Al3+ (Tabla 1). De esta forma, futuras investigaciones deberán constatar la toxicidad de Al3+ para S. subterranea en concentraciones que no afecten las plantas de papa.
CONCLUSIONES
Las inconsistencias observadas en el porcentaje de raíz cubierto por agallas, muestran la necesidad de utilizar nuevos métodos para evaluar la severidad de infección de S. subterranea. La determinación de la severidad de infección es muy importante para evaluar posibles tratamientos que disminuyan la capacidad infectiva del patógeno.
Para comprender la enfermedad se debería investigar la relación entre la replicación de parásito en las raíces, y la reducción del crecimiento y producción. Esto permitiría entender el desarrollo de la enfermedad a lo largo del ciclo de cultivo con el fin de identificar características de las plantas que confieran resistencia al parásito.
Los tratamientos de T. asperellum mostraron una tendencia a compensar los efectos de la sarna polvosa en el Andisol, pero no lograron igualar el tamaño y la producción observados en las plantas no infectadas. Posiblemente la concentración y/o la frecuencia de aplicación del inóculo no fueron las adecuadas, o alguna condición ambiental limitó la funcionalidad de los aislamientos. En los suelos Entisol e Inceptisol los aislamientos no presentaron ninguna tendencia, posiblemente porque el Al3+ es tóxico para T. asperellum.
Los resultados registrados en el Andisol confirman la importancia que tiene la capacidad de retención de agua del suelo en el desarrollo de la sarna polvosa. Pero los resultados observados en el Inceptisol indican que ésta no es la única característica del suelo que puede influenciar la sarna polvosa. En este suelo, la baja producción y los escasos efectos de la sarna polvosa sobre ella señalan que las concentraciones Al3+ encontradas pueden ser tóxicas no solo para S. subterranea sino también para las plantas de papa. Si se piensa utilizar Al3+ como parte de estrategias de control de la sarna polvosa, se deberán encontrar concentraciones efectivas contra S. subterranea que no sean tóxicas para las plantas de papa
AGRADECIMIENTOS
Este trabajo fue parcialmente realizado con fondos del Ministerio de Agricultura y Desarrollo Rural, el Fondo Nacional Hortifruticola. Se agradece a los alumnos del grupo BIODES de la Universidad Nacional de Colombia, sede Medellín por su colaboración durante el desarrollo de los experimentos.
BIBLIOGRAFÍA
Álvarez, C.A. y C.M. Rojas. 2001. Evaluación de los efectos del cinc sobre la sarna polvosa en raíces de papa variedad Diacol Capiro. Trabajo de grado de Ingeniero Agrónomo. Facultad de Ciencias Agropecuarias. Universidad Nacional de Colombia. Medellín. 234 p. [ Links ]
Andrivon, D. 1995. Inhibition by aluminum of mycelial growth and of sporangial production and germination in Phytophthora infestans. European Journal of Plant Pathology 101(5): 527-533. [ Links ]
Bell, K.S., J. Roberts, S.Verrall, D.W.Cullen,N.A. Williams, J.G. Harrison, I.K. Toth, D.E.L. Cooke, J.M. Duncan and
J.R. Claxton. 1999. Detection and quantification of Spongospora subterranea f. sp. subterranea in soils and on tubers using specific PCR primers. European Journal of Plant Pathology 105(9): 905–915.
Bohn, H.L., B.L. McNeal and G.A. O'Connor. 2001. Soil chemistry. Third edition. John Wiley and Sons, New York. 307 p. [ Links ]
Bray, R.H. and L.T. Kurtz. 1945. Determination of total, organic, and available forms of phosphorus in soils. Soil Science 59: 39-45. [ Links ]
Bulman, S.R. and J.W. Marshall. 1998. Detection of Spongospora subterranea in potato tuber lesions using the polymerase chain reaction (PCR). Plant Pathology 47(6): 759-766. [ Links ]
CRAN. 2009. The comprehensive R archive network. En: http://cran.r-project.org/; Consulta: julio 2009. [ Links ]
Castaño, J.L. 1978. Trayectoria de la fitopatología en Colombia (1571-1974). Editorial Letras, Medellín. 164 p. [ Links ]
Espinal, L.S. 1992. Geografía Ecológica de Antioquia: Zonas de vida. Universidad Nacional de Colombia, Medellín. 146 p. [ Links ]
González, L.H. y S. Jaramillo. 2008. El cultivo de la papa: Una reflexión desde lo ambiental. Bases para el manejo integrado de suelos cultivados con papa en Antioquia. En: Ministerio de Agricultura y Desarrollo Rural, http://www.gobant.gov.co/organismos/agricultura/papa/cadena%20papa/investigaciones/FOLLETO%20FINAL%20.pdf. 10 p.; consulta: Julio 2009. [ Links ]
Harrison, J.G., R.J. Searle and N.A. Williams. 1997. Powdery scab disease of potato. A review. Plant Pathology 46(1): 1-25. [ Links ]
Hoyos, L., S. Orduz and J. Bissett. 2009. Genetic and metabolic biodiversity of Trichoderma from Colombia and adjacent neotropic regions. Fungal Genetics and Biology. (En prensa). [ Links ]
Jaramillo, D.F., L.N. Parra y H. González. 1994. El recurso suelo en Colombia: distribución y evaluación. Universidad Nacional de Colombia, ICNE. Medellín. 88 p. [ Links ]
Jaramillo, S., J.M. Cotes, L.H. González, R. Zapata y O. Ruiz. 2006. Proyecto: Efecto de las enmiendas y el tipo de suelos sobre la producción y expresión de síntomas de la sarna polvosa (Spongospora subterranea) en tres cultivariares de papa. Universidad Nacional de Colombia, Sede Medellín. Cevipapa, MADR. 110 p. [ Links ]
Lee, C.R. 1971. Influence of aluminum on plant growth and mineral nutrition of potatoes. Agronomy Journal 63: 604-608. [ Links ]
Merz, U. 1992. Observations on swimming pattern and morphology of secondary zoospores of Spongospora subterranea. Plant Pathology 41(4): 490-494. [ Links ]
Merz, U. and R.E. Falloon. 2009. Review: Powdery scab of potato-increased knowledge of pathogen biology and disease epidemiology for effective disease management. Potato Research 52(1): 17-37. [ Links ]
Mizuno, N. and H. Yoshida. 1993. Effect of exchangeable aluminium on the reduction of potato scab. Plant and Soil 155-156(1): 505-508. [ Links ]
Nakayama, T., M. Horita and T. Shimanuki. 2007. Spongospora subterranea soil contamination and its relationship to severity of powdery scab on potatoes. Journal of General Plant Pathology. 73(4): 229-234. [ Links ]
Nielsen, S.L. and J. Larsen. 2004. Two Trichoderma harzianum-based bio-control agents reduce tomato root infection with Spongospora subterranea (Wallr.) Lagerh., f. sp. subterranea, the vector of potato mop-top virus. Journal of Plant Diseases and Protection 111(2): 145-150. [ Links ]
Paulitz, T.C. and R.R. Belanger. 2001. Biological control in greenhouse systems. Annu. Rev. Phytopathology 39: 103-133. [ Links ]
Potvin, C. and D.A. Roff. 1993. Distribution-free and robust statistical methods: Viable alternatives to parametric statistics. Ecology 74(6): 1617–1628. [ Links ]
Qu, X. and B.J. Christ. 2007. In vitro culture of the obligate parasite Spongospora subterranea (Cercozoa; Plasmodiophorida) associated with rootinducing transferred-DNA transformed potato hairy roots. Journal of Eukaryotic Microbiology 54(6): 465-467. [ Links ]
Rey, M., J. Delgado and T. Benitez. 2001. Improved antifungal activity of a mutant of Trichoderma harzianum CECT 2413 which produces more extracellular proteins. Applied Microbiology and Biotechnology 55(5): 604-608. [ Links ]
USDA. 1999. Soil taxonomy: A basic system of soil classification for making and interpreting soil surveys. Second edition. The United States Department of Agriculture. 869 p. [ Links ]
Van de Graaf, P., A.K. Lees and J.M. Duncan. 2005. Effect of soil inoculum level and environmental factors on potato powdery scab caused by Spongospora subterranea. Plant Pathology 54(1): 22-28. [ Links ]
Van de Graaf, P., S.J. Wale and A.K. Lees. 2007. Factors affecting the incidence and severity of Spongospora subterranea infection and galling in potato roots. Plant Pathology 56(6): 1005-1013. [ Links ]
Walkley, A. and A.I. Black. 1934. An examination of the Degtjareff method for determining soil organic matter and a proposed modification of the chromic acid titration method. Soil Science 37(1): 29-38. [ Links ]
Ward, L.I., P.A. Beales, A.V. Barnes and C.R. Lane. 2004. A real-time pcr assay based method for routine diagnosis of Spongospora subterranea on potato tubers. Journal of Phytopathology 152 (1112): 633 – 638. [ Links ]
Yedidia, I., A. Srivastva, Y. Kapulnik and I. Chet. 2001. Effect of Trichoderma harzianum on microelement concentrations and increased growth of cucumber plants. Plant and Soil 235(2): 235-242. [ Links ]














