Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Facultad Nacional de Agronomía Medellín
Print version ISSN 0304-2847
Rev. Fac. Nac. Agron. Medellín vol.62 no.1 Medellín Jan./June 2009
EL ÁCIDO ABSCÍSICO ACELERA EL DESARROLLO FLORAL DE SOLIDAGO EN DÍAS CORTOS
ABSCISIC ACID SPEED UP FLORAL DEVELOPMENT OF SOLIDAGO UNDER SHORT DAYS
Víctor Julio Flórez Roncancio1 y Maria de Fátima Aleixo Pereira2
1 Profesor Asociado. Universidad Nacional de Colombia, Sede Bogotá. Facultad de Agronomía. A. A. 14490, Bogotá, Colombia. <vjflorezr@unal.edu.co>
2 Profesora Titular. Universidade Estadual de Campinas (Unicamp). Departamento de Fisiología Vegetal. Rua Monteiro Lobato, 255, CEP 13083-862 - Campinas - SP - Brasil
Recibido: Noviembre 6 de 2007; Aceptado: Marzo 30 de 2009.
Resumen. Solidago x luteus (M. L. Greene) Broulliet y Semple (= x Solidaster hybridus, x S. luteus) es una planta que responde a días cortos (DC) para el desarrollo floral. En este proceso se ha establecido la participación de varias fitohormonas, entre éstas, la presencia del ácido abscísico (ABA) en zonas y periodos específicos durante el desarrollo de la flor lo cual sugiere su acción promotora en la velocidad de antesis floral de esta especie en DC. En este trabajo se buscaron nuevos indicios de la participación de fitohormonas presentes en la fracción ácida con el proceso de floración. En una primera etapa, extractos foliares provenientes de hojas de plantas en días largos (caracterizadas por menor velocidad de antesis floral) se aplicaron en botones florales de plantas en días cortos (caracterizadas por una mayor velocidad de antesis floral). Se realizaron ocho aplicaciones con diferentes frecuencias totalizando un periodo de tratamiento de 25 días. Los resultados mostraron que las sustancias presentes en los extractos de la fracción ácida, no alteran la velocidad promedio de antesis floral en los botones florales de plantas en DC. En la segunda etapa del experimento, la cuantificación de los extractos por ELISA, permitió establecer una mayor concentración de ABA en los extractos de hojas y de botones florales de plantas en DC y de botones florales en el inicio del tratamiento. Estos resultados confirman la relación del ABA con la mayor velocidad de antesis floral en plantas de Solidago x luteus en condiciones de DC.
Palabras claves: Solidaster, desarrollo floral, ácido abscísico, ELISA.
Abstract. Solidago x luteus (M.L. Greene) Broulliet & Semple (= x Solidaster hybridus, x S. luteus) is a plant that respond to short days (SD) for flower development. In this process, there has been established the involvement of many phytohormones, between these, the presence of the abscisic acid (ABA) in zones and specific periods during flower development, suggests its promoter roll on the floral anthesis period of this species under SD. In this work new indications of the relationship between phytohormones present in the acid fraction and flowering process were explored. In the first assay, leaf extracts of plants under long days (LD) (characterized by slower time of floral anthesis), were applied in flower buds of plants under short days (characterized by speeding up floral anthesis). On the whole, eight applications were carried out with different frequencies summarizing a treatment period of 25 days. The results showed that the substances present in the extracts of the acid fraction do not alter the time of floral anthesis in the flower buds of plants kept in SD; likewise, was confirmed a longer time for floral anthesis in plants control under LD. In the second assay, the ELISA quantification allowed to establish higher concentrations of ABA in leaf and flower buds extracts of plants under SD and in flower buds at the beginning of the treatments. These results confirm the relation of ABA with speeding up floral anthesis in Solidago x luteus plants kept in SD conditions.
Key words: Solidaster, floral development, abscisic acid, ELISA.
A diferencia de las auxinas y de las citoquininas que actúan principalmente como promotores del crecimiento, el ácido abscísico (ABA) es una fitohormona clásicamente asociada con la inhibición de varios procesos. El ABA es importante en la aclimatación de las plantas a condiciones de sequía, frío y salinidad, y en el desarrollo de la latencia e inhibición de la germinación de semillas (Assmann, 2004); regula el balance de agua en plantas en condiciones de estrés: con el cierre estomático y con la manutención de absorción de agua por la raíz (Li et al., 2006). La forma cis (+) ABA presente naturalmente en plantas es sintetizada en casi todas las células que contienen plastidios, y es transportado vía xilema y floema (Taiz y Zeiger, 1998). Aunque los receptores de ABA no están completamente caracterizados, varios resultados indican que los efectos de esta fitohormona que son mediados a través de su acción, estarían localizados en la membrana y/o en el citoplasma, donde desencadenan diferentes vías de señalización y, en última instancia, regulan respuestas genómicas y no genómicas (Razem et al., 2006). Peng et al. (2006) mostraron la localización celular de ABA durante el desarrollo floral de Arabidopsis thaliana, identificando su presencia principalmente en las células del primordio; lo que indica, por la naturaleza activa del tipo celular, una acción promotora para el ABA. Además, su localización en células en proceso de diferenciación señala su posible acción en la regulación del flujo y distribución de asimilados en las fases iniciales del desarrollo de algunos órganos (Peng et al., 2006).
En Solidago x luteus (M. L. Greene) Brouillet y Semple (= x Solidaster hybridus, x S. luteus), híbrido interespecífico entre Solidago ptarmicoides (= Aster ptarmicoides) y Solidago canadensis (Brouillet y Semple, 1981), la velocidad promedio de antesis floral está bajo el control fotoperiódico, siendo menor en fotoperiodos largos (16 h, 18 h y 20 h) que en fotoperíodos cortos (8 h, 10 h y 12 h) (Flórez y Pereira, 2008). Un posible factor asociado con esta mayor velocidad de antesis floral en plantas en días cortos (DC), es la presencia de ABA en mayores concentraciones en botones florales de plantas en estas condiciones, que en los botones florales de plantas en días largos (DL), demostrando una estrecha relación de esta fitohormona con la inducción del proceso de floración en plantas de esta especie (Flórez et al., 1996).
En este trabajo se determinó el efecto de sustancias presentes en los extractos foliares de la fracción ácida de plantas de Solidago x luteus mantenidas en DL sobre los botones florales de plantas en DC, con la finalidad de obtener indicios de la posible participación de fitohormonas en el desarrollo floral de esta especie. Por otro lado, se aporta información sobre las concentraciones endógenas de ABA en hojas y botones florales de plantas en condiciones fotoperiódicas opuestas (DL (18 h) y DC (8 h)).
MATERIALES Y MÉTODOS
Material vegetal. En condiciones de invernadero, esquejes con raíz de S. x luteus se trasplantaron a macetas con capacidad de 2 L, conteniendo una mezcla de partes equivalentes de suelo, arena y materia orgánica. Las plantas se regaron quincenalmente con solución de Hoagland (Hoagland y Arnon, 1938) y se mantuvieron en fotoperiodo de 18 h hasta el estadio de formación del botón floral. En esta etapa, un lote de plantas se mantuvo en este mismo fotoperiodo y otro se transfirió para la condición de DC (8 h). Los DC de 8 h se obtuvieron cubriendo los bancos, donde estaban acondicionadas las macetas, con una cortina de tejido negro; y las condiciones de DL (18 h) se lograron completando el fotoperiodo natural con iluminación artificial suministrada por lámparas incandescentes (53 W•m-2). Para el análisis de las sustancias presentes en la fracción ácida se colectaron muestras de hojas y botones florales de las plantas en el inicio de los tratamientos fotoperiódicos (botones florales con 1,5 ± 0,12 mm de diámetro y 736 ± 159,5 botones florales por gramo) y 15 ± 2,3 días después, de plantas en condiciones de DL (botones florales con 2,1 ± 0,10 mm de diámetro y 196 ± 34,9 botones florales por gramo) y DC (botones florales con 2,4 ± 0,17 mm de diámetro y 122 ± 16,4 botones florales por gramo). Las muestras de hojas se tomaron del tallo, en la base de las ramificaciones florales y en el tercio superior de la planta, de forma simultánea con el muestreo de botones florales.
Extracción de sustancias presentes en la fracción ácida. Para la extracción y fraccionamiento del extracto, se colectaron 3 g de hojas o botones florales para luego macerarlos con una solución acuosa de metanol al 80% (1 g: 10 mL). Después de 24 h se realizó un primer filtrado, cuyo residuo se colocó en solución de metanol 80% para un segundo filtrado 24 h más tarde; el extracto total fue el producto de los dos filtrados. Después de remover el metanol en evaporador rotativo a baja presión y a temperatura de 30 a 35 °C, se procedió al fraccionamiento del extracto acuoso, para la obtención de la fracción ácida, de acuerdo con Felippe et al. (1985).
Aplicación de sustancias presentes en la fracción ácida. Con la finalidad de obtener indicios de la posible participación de reguladores de crecimiento presentes en la fracción ácida en el desarrollo floral en plantas en DL, con ayuda de un pincel, se aplicó el extracto acuoso proveniente de la fracción ácida de hojas de plantas en DL (18 h) a los botones florales de plantas en DC (8 h), para un total de ocho aplicaciones: las tres primeras aplicaciones con frecuencia de cinco días y las cinco restantes cada dos días.
Análisis de sustancias presentes en la fracción ácida por inmunoensayo. Para determinar la concentración de ABA en forma libre y establecer su posible participación en el control del desarrollo floral de plantas en DL (18 h) y de plantas en DC (8 h), extractos de la fracción ácida, obtenidos de hojas y de botones florales de plantas en el inicio de los tratamientos fotoperiódicos, en DL y en DC se sometieron a separación por cromatografia líquida de alta eficiencia (CLAE), conforme a lo expuesto por Flórez y Pereira (2008). En este proceso se colectaron las alícuotas respectivas de acuerdo con el tiempo de retención de la fitohormona patrón ABA, para luego cuantificarlas por el ensayo inmunoenzimático de ELISA, con el auxilio de kits Mayoli Spindler. Se usó el protocolo establecido por Clark y Engvall (1985), así: 1) Fijación del conjugado. El conjugado ovalbumina (OVA) - ABA se diluyó con tampón carbonato-bicarbonato (carbonato de sodio 0,05 M a pH 9,6) y, posteriormente, se fijó en la placa (200 mL/pozo) con incubación a 4 °C durante la noche; 2) Bloqueo de sitios de ligación inespecíficos. Después de tres enjuagues con aproximadamente 400 mL/pozo de PBS-Tween (tampón fosfato 0,01 M + NaCl 0,15 M a pH 7,4 más Tween-20 0,05%) se realizó el bloqueo con 250 mL/pozo de caseína 2 % en PBS, durante 30 min a 37 °C; 3) Competición. Después de tres enjuagues con PBS-Tween con unos 400 mL por pozo, a cada pozo se le adicionaron 50 mL de tampón PBS-Tween, 100 mL de patrón o de muestra y 50 mL del anticuerpo monoclonal específico (anti-ABA). Se mantuvo la placa a 4 °C durante 2 h y en seguida a cada pozo se le hicieron cinco enjuagues con unos 400 mL de PBS-Tween; 4) Anticuerpo secundario. En cada pozo se adicionaron 200 mL del anticuerpo conjugado con peroxidasa (anti-ratón IgG), disuelto en PBS + Tween. Se incubó la placa a 37 °C por 1 h y en seguida cada pozo se enjuagó 5 veces con unos 400 mL de PBS-Tween; 5) Sustrato. Se adicionaron 200 mL/pozo de la solución sustrato, compuesta por partes iguales de ABTS (2,2'-azino-bis (3-etilbenzotiazolina-6-ácido sulfónico)) y H2O2. Por último, la placa se incubó a 37 °C por 1 h y luego se le midió la absorbancia a 405 nm, en un lector de placa de Elisa (Labsystems MutiSkan MS).
Curva patrón y cálculo de los resultados. Con el fin de establecer la curva patrón para ABA se realizaron una serie de diluciones, desde 100 pmoles hasta 30 fmoles, para cada 100 mL de solución, a partir de una solución 100 mM de fitohormona patrón ABA. El promedio de la densidad óptica de los pozos con 100 pmol/0,1 mL de hormona (hormona libre en exceso), se consideró como control de coloración no específica (CNE) y el promedio de la densidad óptica de los pozos con 0,1 mL de agua destilada (sin hormona libre) como Bo. Así:
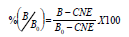
Donde, B es la densidad óptica del patrón o muestra; Bo, la densidad óptica de la ligación máxima del anticuerpo anti-hormona, en ausencia de fitohormona libre (coloración fuerte) y CNE, la densidad óptica de coloración no específica, ligación residual del anticuerpo anti-hormona en exceso de fitohormona libre (coloración débil).
La relación entre el porcentaje B/Bo y la concentración de la fitohormona de la curva patrón se transformó en una relación linear usando la función Logit, que permite extrapolar la concentración de la fitohormona en la muestra del valor de su densidad óptica a través de una curva patrón linear (Weiler et al., 1981).
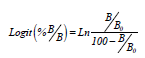
Los cálculos de los resultados incluyeron los valores obtenidos en la cuantificación por medio de la curva patrón, el factor de dilución y la masa inicial de la muestra.
Análisis estadístico. Se usó el diseño experimental completamente al azar, con número de tratamientos y de repeticiones (diez plantas) por tratamiento de acuerdo con cada experimento. Posterior al análisis de varianza, los promedios de los tratamientos se compararon por medio de la prueba de Tukey (P<0,05).
RESULTADOS Y DISCUSIÓN
Efecto de la aplicación del extracto foliar sobre el desarrollo floral. Considerando que la velocidad promedio de antesis floral es más lenta en fotoperiodos largos (16 h, 18 h y 20 h) que en fotoperiodos cortos (8 h, 10 h y 12 h) (Flórez et al., 1996), se aplicó el extracto de la fracción ácida obtenido de hojas de plantas en DL (18 h) en los botones florales de las plantas mantenidas en DC (8 h), con la finalidad de obtener indicios de la participación de fitohormonas de la fracción ácida en el desarrollo floral de plantas bajo DL.
Sin embargo, no se encontró diferencia estadística significativa en la velocidad promedio de antesis floral de botones florales de plantas en DC en comparación con el tratamiento control (botones florales de plantas en DC); entretanto, como era de esperarse, las plantas en DL presentaron una menor velocidad de antesis floral estadísticamente significativa (Tabla 1). De igual manera, no se observó malformación floral ni diferencias significativas en el número de flores abiertas en los diferentes tratamientos (Tabla 1 y Figura 2). Esta fracción ácida del extracto se utilizó para la posterior separación de ácido indol-3-acético (AIA) y ABA (Flórez y Pereira, 2008), por lo que se infiere que estas fitohormonas, en la concentración presente en el extracto, como formas libres y/o conjugadas, no actúan retardando la velocidad de antesis floral en plantas en DC, sugiriendo, la presencia de otra(s) sustancia(s) con acción inhibidora.
Tabla 1. Número de flores abiertas, porcentaje de flores normales y tiempo medio de antesis (t- medio) en plantas de Solidago x luteus sometidas a diferentes tratamientos. Las tres primeras aplicaciones del extracto foliar de plantas en DL (EFDL) se hicieron cada cinco días y las cinco aplicaciones restantes cada dos días (DL = 18 h; DC = 8 h).

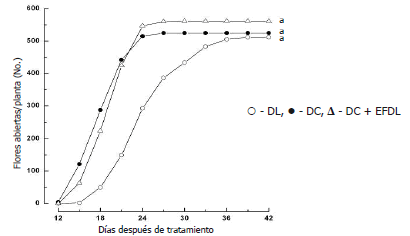
Figura 2. Efecto del fotoperiodo y de las aplicaciones del extracto foliar obtenido de plantas en DL sobre botones florales de plantas en DC, en el desarrollo floral de Solidago x luteus (DL = 18 h; DC = 8 h). Valores seguidos de la misma letra no difieren entre si por la prueba de Turkey (P<0,05).
Mayak y Halevy (1972) estudiaron los efectos de ABA exógeno sobre el desarrollo floral en rosas cv. Golden Wave, encontrando un aumento en la velocidad de la apertura floral y en la promoción de la senescencia en las flores tratadas; también detectaron disminución del tamaño de los pétalos de las flores, con relación a los pétalos de las flores control.
Por otro lado, es necesario establecer que además de los mecanismos de control hormonal sobre el proceso de floración, también está involucrado el control genético. En plantas de DC el proceso de floración está dirigido por la acción del regulador transcripcional Heading date1 (Hd1), el cual promueve la inducción floral activando la expresión de integradores de señal de floración, como Heading date3 (Hd3). Hd1 se expresa de forma circadiana, acumulándose en periodos oscuros en DC y en el crepúsculo en DL. La concentración elevada de Hd1 promueve respuestas diferentes: en periodos oscuros activa la expresión de Hd3, estimulando el proceso de floración, mientras que en periodos de luminosidad la inhibe (Ausín et al., 2005).
Análisis de ABA por inmunoensayo. Los extractos de la fracción ácida obtenidos de hojas y de botones florales de plantas en el inicio de los tratamientos fotoperiódicos, de hojas y de botones florales de plantas en DL (18 h) y de plantas en DC (8 h), se sometieron a separación por CLAE, se colectaron de acuerdo con el tiempo de retención de la fitohormona patrón ABA, según Flórez y Pereira (2008), y se cuantificaron por medio del ensayo inmuno-enzimático de ELISA. Esto con la finalidad de determinar la concentración de ABA libre y así establecer su posible participación en el control del desarrollo floral en condiciones fotoperiódicas opuestas.
En la Figura 1A se observa la curva patrón en función del porcentaje de B/Bo. También se presenta el ajuste de la curva patrón (Figura 1B), de acuerdo con la función logit del porcentaje de B/Bo, usada en la cuantificación de los extractos.
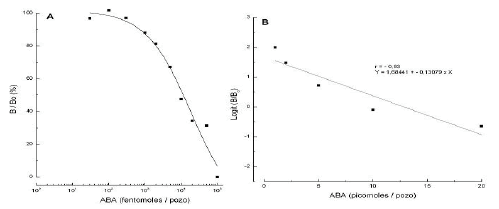
Figura 1. Curva patrón en función del porcentaje B/Bo y del logaritmo de la concentración de ABA en fentomoles/pozo (A) y datos transformados en una relación linear usando la función logit de B/Bo (B).
En los análisis de ELISA se verificó una concentración significativamente alta de ABA en los extractos foliares de plantas en DC, en comparación con el extracto foliar de plantas en el inicio de los tratamientos fotoperiódicos. La concentración de ABA encontrada en el extracto foliar de plantas en DL también fue superior a la encontrada en el extracto foliar de plantas en el inicio de los tratamientos, sin embargo, significativamente menor que la encontrada en los extractos del plantas en DC (Tabla 2).
Tabla 2. Promedios de densidad óptica en la cuantificación de ABA a través de ELISA en extractos (dilución 1:1) de hojas de plantas en el inicio de los tratamientos fotoperiódicos (FIT), en días largos (FDL); así como en días cortos (FDC) y en extractos de botones florales de plantas en el inicio de los tratamientos fotoperiódicos (BIT), en días largos (BDL) y en días cortos (BDC).
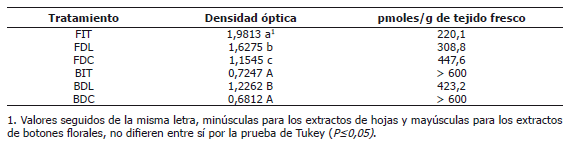
Para los extractos de botones florales se observaron concentraciones significativamente mayores de ABA en las plantas en el inicio de los tratamientos fotoperiódicos y en las plantas en DC, con relación al extracto de botones florales de plantas en DL (Tabla 2).
Estos resultados concuerdan con trabajos previos en la misma especie (Flórez y Pereira, 2008) quienes encontraron, a través de CLAE, mayores concentraciones de ABA en extractos de hojas y de botones florales de plantas en DC, en comparación con plantas de DL. La técnica de ELISA por su alta sensibilidad confirma esta tendencia (Tabla 2).
Varios trabajos relacionan ABA con el proceso de antesis floral: se detectó en altas concentraciones en botones florales de Vicia durante la antesis (Dathe y Sembdner, 1980); su concentración también aumenta en botones florales de café antes de la antesis (Browning, 1973, citado por Kinet et al., 1985) y en rosas, la concentración de ABA es mayor en las hojas de los ramos no florales que en las de ramos florales, particularmente después de la iniciación de los órganos florales (Zieslin y Halevy, 1976).
La acción del ABA no se puede considerar de forma aislada, y su participación en varios procesos depende de antagonismo con otras fitohormonas. Por ejemplo, se ha propuesto que las concentraciones opuestas entre ABA y AIA aceleran el desarrollo floral de S. x luteus (Flórez y Pereira, 2008); también, Sharp et al. (2000) indican una acción importante del ABA endógeno al limitar la producción de etileno, favoreciendo el mantenimiento del desarrollo vegetal.
De otro lado, se reconoce la participación del ABA en la regulación de las vías metabólicas de azúcares, aumentando la sensibilidad en la respuesta de los tejidos (Rook et al., 2001); de igual forma, se le relaciona con el aumento del flujo de fotoasimilados hacia los tejidos en desarrollo: Al aplicar un inhibidor de su biosíntesis en Triticum aestivum se detectó su acción regulando algunas enzimas clave en el metabolismo de los azúcares (Yang et al., 2004).
De acuerdo con los resultados obtenidos, las sustancias presentes en la fracción ácida de hojas de plantas en DL no estarían asociadas con la desaceleración de la antesis floral en S. x luteus, por lo tanto, deben existir otros mecanismos involucrados en su control en las plantas de días largos. Por otro lado, se sugiere que concentraciones altas de ABA en hojas y en botones florales de plantas S. x luteus en DC producen efectos promotores propios de tejidos en desarrollo, que estarían relacionados con la mayor velocidad de antesis floral en plantas de S. x luteus en DC.
BIBLIOGRAFÍA
Assmann, S.M. 2004. Abscisic acid signal transduction in stomatal responses. pp. 391-412. In: Davies, P.J. (ed.). Plant hormones. Kluwer Academic, Dordrecht. 750 p. [ Links ]
Ausín, I., C. Alonso and J.M. Martínez. 2005. Environmental regulation of flowering. Int. J. Dev. Biol. 49: 689-705. [ Links ]
Brouillet, L. and J.C. Semple. 1981. A propos du status taxonomique de Solidago ptarmicoides. Can. J. Bot. 59(1): 17-21. [ Links ]
Clark, B. and E. Engvall. 1985. Enzyme-linked immunosorbent assay (ELISA): theoretical and practical aspects. pp. 167-79. In: Maggio, E. T. (ed.). Enzyme - Immunoassay. CRC Press. [ Links ]
Dathe, W. and G. Sembdner. 1980. Endogenous plant hormones of the broad bean, Vicia faba L. II. gibberellins and plant growth inhibitors in floral organs during their development. Biochem. Physiol. Pflanzen. 175:599-610. [ Links ]
Felippe, G.M., I.F.M. Válio, M.F.D.A. Pereira, R. R. Sharif e S.R. Vieira. 1985. Fisiologia do desenvolvimento vegetal. Segunda edición. Editora da Unicamp, Campinas. 66 p. [ Links ]
Flórez, V.J., L.E.P. Peres, L.B.P. Zaidan e M.F.D.A. Pereira. 1996. Influência do fotoperíodo em interação com a temperatura no desenvolvimento de plantas de Solidaster luteus. Rev. Bras. Fisiol. Veg. 8(2): 131-138. [ Links ]
Flórez, V.J. y M.F. Pereira. 2008. Concentraciones opuestas de AIA-ABA aceleran el desarrollo floral de Solidago x luteus. Agron. Colomb. 26(2): 237-245. [ Links ]
Hoagland, D.R. and D.I. Arnon. 1938. The water-culture method for growing plants without soil. University of California Agricultural Experimental Station Circular, Berkeley. Circular 347. 39 p. [ Links ]
Kinet, J. M., R.M. Sachs and G. Bernier. 1985. The physiology of flowering. The development of flowers. Vol. 3. CRC Press, Boca Raton, Florida. 274 p. [ Links ]
Li, S., S.M. Assmann and R. Albert. 2006. Predicting essential components of signal transduction networks: A dynamic model of guard cell abscisic acid signaling. PLoS Biology 4(10): 1732-1748. [ Links ]
Mayak, S. and A.H. Halevy. 1972. Interrelationships of ethylene and abscisic acid in the control of rose petal senescence. Plant Physiology 50: 341-346. [ Links ]
Merck, E. 1971. Dyeing reagents for thin layer and paper chromatography. E. Merck, Darmstadt. 118 p. [ Links ]
Peng, Y.B., C. Zou, D.H. Wang, H.Q. Gong, Z.H. Xu and S.N. Bai. 2006. Preferential localization of abscisic acid in primordial and nursing cells of reproductive organs of Arabidopsis and cucumber. New Phytologist 170(3): 459-466. [ Links ]
Razem, F.A., K. Baron and R.D. Hill. 2006. Turning on gibberellin and abscisic acid signaling. Current Opinion in Plant Biology 9(5): 454-459. [ Links ]
Rook, F., F. Corke, R. Card, G. Munz, C. Smith and M.W. Bevan. 2001. Impaired sucrose-induction mutants reveal the modulation of sugar-induced starch biosynthetic gene expression by abscisic acid signaling. The Plant Journal 26(4): 421-433. [ Links ]
Sharp, R.E., M.E. LeNoble, M.A. Else, E.T. Thorne and F. Gherardi. 2000. Endogenous ABA maintains shoot growth in tomato independently of effects on plant water balance: evidence for an interaction with ethylene. Journal of Experimental Botany 51(350):1575-1584. [ Links ]
Taiz, L. and E. Zeiger. 1998. Plant physiology. Second edition. Sinauer Associates Inc., Sunderland. 792 p. [ Links ]
Weiler, E.W., P.S. Jourdan and W. Conrad. 1981. Levels of indole-3-acetic acid in intact and decapitated coleoptiles as determined by a specific and highly sensitive solid-phase enzyme immunoassay. Planta 153(6): 561-571. [ Links ]
Yang, J., J. Zhang, Z. Wang, G. Xu and Q. Zhu. 2004. Activities of key enzymes in sucrose-to-starch conversion in wheat grains subjected to water deficit during grain filling. Plant Physiology 135:1621-1629. [ Links ]
Zieslin, N. and A.H. Halevy. 1976. Flower bud atrophy in Baccara roses. IV. The activity of various growth substances in leaves of flowering and non-flowering shoots. Physiol. Plant. 37: 317-25. [ Links ]














