Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Facultad Nacional de Agronomía Medellín
Print version ISSN 0304-2847
Rev. Fac. Nac. Agron. Medellín vol.62 no.1 Medellín Jan./June 2009
EVALUACIÓN DE NUEVA TECNOLOGÍA PARA MITIGAR LAS ESPINAS INTRAMUSCULARES EN FILETES DE CACHAMA Piaractus brachypomus (Pisces: Characidae)
EVALUATION OF NEW TECHNOLOGY TO MITIGATE INTRAMUSCULAR THORNS IN CACHAMA FILLETS
Héctor Suárez Mahecha1; Sandra Clemencia Pardo Carrasco2; Misael Cortés Rodríguez3; Sandra Catalina Ricaurte4 y Benjamín Rojano5
1 Profesor Asistente. Universidad Nacional de Colombia, Sede Bogotá. Instituto de Ciencia y Tecnología de Alimentos. Carrera 30 No. 45-03, Edificio 500, Bogotá, Colombia. <hsuarezm@unal.edu.co>
2 Profesora Asistente. Universidad Nacional de Colombia, Sede Medellín. Facultad de Ciencias Agropecuarias. Departamento de Producción Animal. A.A. 1779, Medellín, Colombia. <scpardoc@unalmed.edu.co>
3 Profesor Asistente. Universidad Nacional de Colombia, Sede Medellín. Facultad de Ciencias Agropecuarias. Departamento de Ingeniería Agrícola y de Alimentos. A.A. 1779, Medellín, Colombia. <mcortesro@unalmed.edu.co>
4 Ingeniera Química. Universidad Nacional de Colombia, Sede Medellín. Facultad de Ciencias. Escuela de Ciencias Químicas. A.A. 3840, Medellín, Colombia. <scricaur@unalmed.edu.co>
5 Profesor Asociado. Universidad Nacional de Colombia, Sede Medellín. Facultad de Ciencias. Escuela de Ciencias Químicas. A.A. 3840, Medellín, Colombia.<borjano@unalmed.edu.co>
Recibido: Diciembre 17 de 2008; Aceptado: Junio 2 de 2009
Resumen. La presencia de espinas intramusculares en filetes de cachama dificulta la comercializacion y demanda por parte de los consumidores. Hasta el momento no existen tecnologías que permitan ofrecer filetes de cachama que garanticen condiciones de seguridad frente a las espinas. El objetivo del presente trabajo fue evaluar una nueva tecnología para mitigar la presencia de espinas en filetes de cachama Piaractus brachypomus empacados al vacío y almacenados durante 30 días a 3±0,5 °C. A filetes en presentación lateral interna fueron realizados cortes profundos, paralelos y perpendiculares al eje longitudinal, a una distancia de 3 mm entre cada corte, en sentido dorso-ventral. Fueron realizados análisis microbiológico, fisicoquímico y sensorial. El análisis microbiológico muestra condiciones aceptables para el final del periodo de almacenamiento. Los valores obtenidos para este periodo, fueron de log UFC/g 7,07; 4,7 y 1100 NMP, 18 NMP para organismos psicrotrofilos, mesófilos, coliformes totales y coliformes fecales, respectivamente. No fue determinada presencia de Salmonella ni de organismos sulfito reductores. El análisis fisicoquímico mostró valores de 39,36 para BVT-N; 6,22 pH; 3,3% de pérdida de humedad 1,52; ácido tiobarbitúrico mg MA/kg. El efecto del sajado no incrementó los valores de oxidación de ácidos grasos, ni aumentó las BVT que pudiesen indicar degradación de la proteína. En el análisis sensorial los filetes sometidos a cocción fueron rechazados solamente a partir del día 25 del periodo de almacenamiento, para los atributos aroma y sabor. Durante la evaluación los panelistas no encontraron presencia de espinas, mostrando que la temperatura de cocción utilizada y los cortes en las espinas, permiten degradar la espina intramuscular evitando que sea detectada.
Palabras claves: Pescado, espinas intramusculares, vida útil, sajado.
Abstract. The presence of pin bones in cachama fillets makes marketing and demand difficult by the consumers. So far, there are no technologies to provide cachama fillets to ensure security conditions about thorns. This work had as objective to assess a new technology to mitigate the presence of thorns in cachama fillets Piaractus brachypomus vacuum packed and stored for 30 days at 3±0.5 °C. To fillets in lateral internal presentation were made deep cuts, parallel and perpendicular to the longitudinal axis, at a distance of 3 mm between each court, in a back-ventral. Microbiological, physicochemical and sensory analysis were made. Microbiological analysis shows acceptable conditions at the end of storage period. The obtained values for this storage period were 7.07x106 CFU mL, 4.7x106 CFU mL, 1100 NMP, 18 NMP for psychrotrophics organisms, mesophiles, total and fecal coliforms, respectively. There was no presence of Salmonella nor sulphite reductor organisms. Physicochemical analysis showed values of 39.36 for BVT-N; 6.22 pH; 3.3% of moisture loss; 1.52 thiobarbituric acid mg MA/kg. Cutting effect did not increase oxidation values of fatty acids, nor increased the BVT that could indicate protein degradation. In sensory analysis, fillets subjected to cooking were rejected only since the day 25 of storage period for aroma and flavor attributes. During the assay panelists found no presence of thorns, showing that cooking temperature used and cuts in thorns, allow degrade pin bones avoiding their detection.
Key words: Fish, pin bone, shelf-life, cut.
En los últimos años el uso de métodos combinados como la refrigeración y el empaque al vacío (EV) o en atmósferas modificadas (AM) para empacar diversos alimentos ha ido en incremento, mejorando las condiciones de seguridad, el almacenamiento y ampliando la vida útil (Gould, 2000). La seguridad de alimentos para los consumidores como el filete de pescado es una de las principales prioridades en el desarrollo de nuevas tecnologías en alimentos. En este sentido, el contenido de espinas en los filetes debe estar sometido a pruebas de calidad por parte de las industrias procesadoras de pescado. Métodos de inspección como cabinas de fluorescencia son utilizadas para garantizar la detección de filetes defectuosos que presentan espinas, evitando que lleguen al consumidor final.
El filete de pescado es altamente susceptible al deterioro que puede ser causado por reacciones químicas y crecimiento microbiológico (Gram y Dalgaard, 2002). Cerca del 25% de los productos de la pesca y la acuicultura pierden calidad, debido al deterioro químico y microbiano (Baird-Parker, 2000). Evento que podría ser minimizado por la utilización de métodos combinados de empaque al vacío y refrigeración. La carne de peces, procedente de zonas tropicales es más estable a temperaturas de refrigeración que la de peces de climas templados. Esto probablemente sucede por la baja incidencia de microorganismos psicrotróficos en los trópicos. En estos casos el deterioro de los peces puede ser demorado y seguido de toxigénesis. De acuerdo con Liston (1992), la mayor conservación de peces provenientes de aguas tropicales, es debida a la presencia de una microbiota típicamente mesófila, poco adaptada a las temperaturas de refrigeración. Además, esta microbiota tendría actividad metabólica diferente a la psicrotrófica, con menor producción de compuestos de degradación.
La cachama blanca Piaractus brachypomus es una especie de importancia económica para la acuicultura de varios países de Suramérica, como Brasil, Venezuela, Perú, entre otros. En Colombia, esta especie es de gran demanda por el valor nutricional y calidades organolépticas, sin embargo, el filete no es comercializado debido a la presencia de espinas intramusculares (Suárez et al., 2008). Además, son pocos los trabajos sobre aspectos de calidad y nuevas tecnologías de peces tropicales nativos empacados al vacío bajo refrigeración. La vida útil bajo refrigeración del pescado es corta debido al rápido crecimiento de microorganismos gram negativos, como Pseudomonas, Shawanella putrefaciens y Aeromonas bajo condiciones de aerobiosis.
También es reconocido que el empaque al vacío extiende la vida útil y facilita la distribución a diferentes mercados (Lalitha et al., 2005). El CO2 generado después de 24 a 36 horas en el empaque al vacío por la respiración del tejido, convierte el EV en AM, este co2 causa una disminución del pH intra y extracelular que interfiere en el metabolismo celular (Dixon y Kell, 1989).
Sobre la seguridad del empaque en AM para carne de pescado, Sivertsvik et al. (2002) encontraron que el empaque de estos productos bajo AM no incrementa los riesgos de patógenos como Salmonella, Staphylococcus, Clostridium perfringens y Enterococcus. En este sentido los productos diferenciados de pescado son generalmente susceptibles a una rápida descomposición. El deterioro de la carne de pescado es un complejo proceso en el cual están involucrados mecanismos físicos, químicos y microbiológicos. Las reacciones enzimáticas y químicas son generalmente responsables de la pérdida inicial de frescura. Además, la actividad microbiana es responsable por el inicio del deterioro que disminuye la vida útil del producto (Gram, 1995; Gram y Huss, 1996). Los métodos microbiológico, bioquímico y sensorial han sido utilizados para valorar la calidad de filetes de pescado y sus productos durante la manipulación y almacenamiento. El empleo de métodos fisicoquímicos y sensoriales para la evaluación de la calidad de productos acuícolas esta relacionado a la evaluación cuantitativa de los estándares de calidad (Huss et al., 2000).
El objetivo del trabajo fue evaluar una nueva tecnología para mitigar la presencia de espinas en filetes de cachama P. brachypomus empacados al vacío y almacenados durante 30 días a 3±0,5 0C.
MATERIALES Y MÉTODOS
Evaluación de nueva tecnología. El trabajo fue realizado en el laboratorio de productos cárnicos y acuícolas de la Universidad Nacional de Colombia, Sede Medellin. Para evaluar la nueva alternativa para mitigar la detección de espinas intramusculares, fueron utilizados filetes de cachama P. brachypomus con peso de 89±27 g. En cada filete en presentación lateral interna fueron realizados cortes profundos, paralelos y perpendiculares a la espina dorsal, a una distancia de 3 mm entre cada corte, en sentido dorso-ventral, utilizando un cuchillo. La piel fue conservada intacta para proporcionar estabilidad al filete.
Cada filete sajado fue empacado al vacío en bolsas de polietileno de baja densidad con barrera de transmisión de oxígeno de 29-45 ml/O2/m2/ 24h/atm medido a 23 ºC y barrera de permeabilidad a gases de 10-15 g/m2 / 24h /medido a 38 ºC marca CRYOVAC, utilizando una empacadora de vacío WEBOMATIC 82246 (West Germany), y almacenado bajo refrigeración (3 ± 0,5 ºC) por un periodo de 30 días. Los análisis fueron realizados a los 0, 5, 10, 15, 20, 25 y 30 días de almacenamiento. Los filetes por triplicado fueron sometidos a análisis microbiológico, químico y sensorial.
Análisis microbiológicos. Se realizaron los siguientes análisis microbiológicos: recuento de mesófilos (heterótrofos) en placa, psicrotrófilos, coliformes totales, coliformes fecales, esporas sulfitoreductoras y presencia de Salmonella, según las Normas del Instituto Nacional de Vigilancia de Medicamentos y Alimentos (INVIMA) destinados para el consumo humano (INVIMA, 1998).
Recuento de mesófilos en placa y psicrotrófilos. 10 g de la muestra fueron adicionados a 90 mL de agua peptonada 0,1% p/v, y sembrados en cajas de Petri con agar Plate Count e incubadas a 35 ± 2 °C durante 48 horas. Para psicrotrófilos fueron incubados a 4 ± 0,5 °C durante 5-7 días. Los resultados fueron expresados en unidades formadoras de colonia /mL, "UFC/mL".
Determinación de Salmonella. 25 g de filete fueron homogeneizados en 225 mL de peptona buferada e incubados a 35 ± 2 °C por 16 a 24 horas. Un mL del cultivo, se adicionó a un tubo de ensayo con 10 mL de caldo tetrationato, agregando 2 gotas de Lugol y 2 gotas de verde brillante al 0,1% p/v, incubados a 35 ± 2 °C por 18 a 24 horas. El medio de cultivo selectivo utilizado fue agar XLD y agar SS por el método de agotamiento de superficie y se incubó a 35 ± 2 °C por 24 horas.
Determinación de esporas sulfito reductoras. Fueron utilizados 10 g de muestra homogeneizada a 90 mL de peptona universal 0,1 p/v y sembradas diluciones de 1 mL en cajas de Petri con agar SPS por el método de profundidad, incubado a 35 ± 2 °C por 72 horas en anaerobiosis.
Determinación de coliformes totales y fecales. Se usaron 10 g de muestra homogeneizada en caldo Fluorocult LMX. Se homogenizaron utilizando el vortex y se incubaron a 35 ± 2 ºC por 24 a 48 horas. La lectura fue determinada por fluorescencia y presencia de indol, y los datos reportados como número más probable (NMP).
Análisis fisicoquímico.
Determinación de pH. Fue determinado usando un electrodo de 6 mm insertándolo directamente en el filete (Crison, España).
Pérdida de agua. Fue determinada modificando la ecuación propuesta por Roth et al. (2006), en donde los filetes son pesados en las diferentes fechas de muestreo, determinando el peso inicial y final mediante la siguiente ecuación:
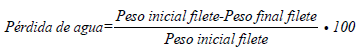
Determinación de bases volátiles totales de nitrógeno BVT-N. fue utilizado el método propuesto por Goulas y Kontominas (2005), en donde se molieron 10 g de muestra de carne de pescado con 50 mL de agua destilada usando un picador Moulinex®. El material fue transferido con 200 mL de agua destilada a un baker de 500 mL y destilado después de la adición de 2 g de MgO y una gota de silicona para prevenir la formación de espuma. Luego se llevó a un erlemeyer de 250 mL, que contenía 25 mL de solución de ácido bórico 3% p/v, 0,04 mL de rojo metilo y azul de metileno como indicadores para el tratamiento del amonio. La destilación se continuó llevando a un volumen final de 125 mL del destilado obtenido. La solución de ácido bórico vira a verde cuando es alcalina por el destilado de BVT-N. La solución fue tratada posteriormente con solución 0,1 N de ácido hidroclórico. La destilación se concluyó cuando el color del destilado cambió a rosado por la adición gota a gota del ácido hidroclórico (16). La cantidad de BVTN en mg/100 g de carne de pescado, fue calculada del volumen (V) de ácido hidroclórico adicionado y su concentración (C) por la siguiente ecuación:
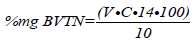
Determinación de acido 2-tiobarbitúrico. Fue usado el método basado en la cuantificación espectrofotométrica del complejo Rosado después de la reacción de una molécula de malonaldehido producto de la destilación, con dos moléculas de ácido 2-tiobarbitúrico adicionado al destilado (Goulas y Kontominas, 2007).
Preparación de la solución de ácido tiobarbitúrico TBA. Fue preparada pesando 0,3 g de TBA (Merck, Alemania) y transfiriéndola a un beaker de 100 mL con 90 mL de agua destilada. El beaker fue colocado en un baño de agua a 80 °C hasta la completa disolución. La solución fue transferida a 100 mL hasta completar el volumen con agua destilada y la concentración 0,021 M.
Determinación de TBA. La muestra de 50 g carne de pescado fue picada después de la adición de 6 mL de solución etanólica de hidroxitolueno butilado (BHT, 1 g/l) para prevenir la autoxidación. Una fracción homogenizada de 10 g fue transferida a un beaker, se agregó una gota de agente antiespumante de silicona (Merck, Alemania), 2,5 mL de HCl 4 N y 97,5 mL de agua destilada. Esta muestra fue destilada y los primeros 50 mL del destilado fueron colectados. La destilación fue realizada por triplicado. Posteriormente a 5 mL del destilado se adicionaron 0,6 mL BHT (1 g/l) y 5 mL de 0,021 M TBA a un tubo de ensayo con tapa rosca y calentado en baño María (90 ºC) por 40 min para el desarrollo de color rosa. Posteriormente fue determinada la densidad óptica a 532 nm en un espectrofotómetro SECOMAM ANTHELIE modelo 70ST0375 (Secomam, Francia) usando como control la solución que contenía 5 mL de agua destilada, 5 mL de solución de TBA y 0,6 mL BHT (1 g/l). Los valores de TBA fueron expresados como mg de malondialdehido (MDA)/kg de muestra. La concentración MDA fue calculada de la curva estándar usando 1,1,3,3-tetraetoxy- propano (TEP) como compuesto estándar (Goulas y Kontominas, 2007).
Evaluación sensorial. El análisis sensorial se llevó a cabo por el método tradicional de juzgar la calidad de filetes de pescado. Fueron evaluadas las características sensoriales como apariencia, color y aroma por cinco panelistas entrenados. Para la evaluación de la presencia de espinas intramusculares, los filetes fueron cocidos en horno micro ondas a máxima potencia durante tres minutos. El puntaje se basó en una escala hedónica de nueve puntos, donde 1 corresponde a "disgusté extremadamente" y 9 "gusté extremadamente". El valor sensorial de 4 fue tomado como el rango mínimo de aceptabilidad (Amerine et al., 1965).
Análisis estadístico. Todos los ensayos fueron realizados por triplicado. Los valores obtenidos fueron analizados con estadística descriptiva. Posteriormente comparadas las medias obtenidas entre los días del análisis a través del test de mínima diferencia significativa (LSD), aceptando como diferencia significativa P≤0,05; se utilizó, el sofware Statgraphics (Statistical Graphics Corp. Rockville, MD, USA).
RESULTADOS Y DISCUSIÓN
Cambios microbiológicos. Los cambios en la microbiología de los filetes de cachama durante el almacenamiento son mostrados en la Tabla 1.
Tabla 1. Análisis microbiológico para filetes sajados de cachama Piaractus brachypomus, empacados al vacío y almacenados a 3 ± 0,5 °C durante 30 días.
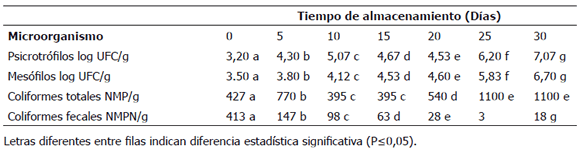
El recuento inicial para mesófilos (3,50 log UFC/g) indica un buen estado inicial de calidad para los filetes. Para el final del periodo de almacenamiento alcanzaron 6,70 log UFC/g. El conteo inicial para psicrotrófilos fue de 3,20 log UFC/g y alcanzó valores finales de 7,07 log UFC/g para el día 30 de almacenamiento.
Para coliformes totales se obtuvo un conteo inicial de 427 NMP/g valor que fue incrementando a lo largo del periodo de almacenamiento, para concluir con valores de 1100 NMP/g. Los coliformes fecales iniciaron con recuento de 413 NMP/g, al finalizar el periodo de almacenamiento fue de 18 NMP/g. Es evidente que la disminución a lo largo del tiempo se debió a las condiciones generadas por el empaque al vacío, como es el efecto del CO2 producido por los filetes debido a la respiración anaeróbica y al desarrollo de bacterias ácido lácticas que serían antagonistas de coliformes fecales. En las muestras de filete sajado no se detectaron Salmonella ni organismos sulfitoreductores.
En términos generales es considerado que la extensión de la vida útil de peces embalados a vacío depende de la especie de pescado, de la carga microbiológica inicial, los microorganismos presentes y la temperatura de almacenamiento.
Resultados presentados por Lyhs et al. (2001) con trucha arco iris embalada al vacío y mantenida en refrigeración a 3 °C y 8 °C, muestran que el deterioración del producto aumentó después de 27 y 20 días respectivamente. El recuento de bacterias mesófílas y psicrotrófilas fue de 106-107 UFC a 3°C y 107 - 108 UFC a 8°C. Los resultados sensoriales determinaron impropia esta trucha para el consumo humano con recuentos para mesófilos y psicrotrófilos superiores a 106 e 107 UFC/g para las muestras a 3 °C y 8 °C, respectivamente. La principal razón para el rechazo sensorial fue por olores amoniacales y cambios en la coloración. Los organismos sulfito reductores no detectados en ninguna de las muestras coincide con trabajos de Lilly y Kautter (1990) y Reddy et al. (1997). Estudios realizados por Ozogul et al. (2004) en sardinas empacadas al vacío muestran valores aceptables para psicrotrófilos y mesófilos hasta el día 15 de almacenamiento bajo refrigeración.
Cambios fisicoquímicos.
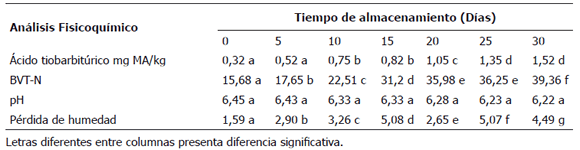
Cambios en los valores de ácido tiobarbitúrico (TBA). El TBA es un indicador utilizado para valorar el grado secundario de oxidación lipídica. El valor inicial de TBA para los filetes de cachama fue de 0,32 mg de MA/kg, estos valores incrementaron hasta el final del periodo de almacenamiento 1,52 mg de MA/kg (Tabla 2).
Tabla 2. Analisis Fisicoquímico para filetes sajados de cachama Piaractus brachypomus, empacados al vacío y almacenados a 3 ± 0,5 °C durante 30 días.
Valores de TBA indicando buena calidad de filetes de pescado están alrededor de 5 mg de MA/kg, mientras que pueden ser aceptados para consumo valores hasta 8 mg de MA/kg (Schormuller, 1969). En el presente estudio los valores de TBA para los filetes sajados fueron más bajos que el límite establecido, al final de los 30 días de almacenamiento. Los resultados de Ramanathan y Das (1992) en filetes de carpa empacados al vacío a 5 °C, mencionan la producción de olores y sabores indeseables, relacionados con la oxidación de los ácidos grasos polinsaturados en la carne de pescado al final de 25 días de almacenamiento, estos resultados no concuerdan con los aquí obtenidos, donde los olores y sabores indeseados fueron asociados con los productos del deterioro microbiano.
Estos resultados, coinciden con los obtenidos por Gómez-Estaca et al. (2008), donde bajos valores de TBA fueron obtenidos con productos alcanzados de atún y bacalao y con los de Pantazi et al. (2008) donde igualmente bajos valores fueron encontrados para el pez espada (Xiphias gladius) almacenado durante 18 días en empaque al vacío.
Cambios en valores de pH y bases volátiles totales de nitrógeno (BVT-N). Los resultados del análisis de bases volátiles totales de nitrógeno en filetes sajados de cachama empacado al vacío durante 30 días de almacenamiento a 3 ºC son mostrados en la Tabla 2.
Las bases volátiles totales presentan el valor inicial de 15,68 mg BVT-N/100 mg siendo un valor de buena calidad. Al final del periodo de almacenamiento el valor fue de 39,36 mg BVT-N/100 mg en el día 15, sobrepasando el límite aceptado (30 mg BVT-N/100 g). Similares resultados fueron obtenidos por Pantazi et al. (2008) trabajando con el pez espada (Xiphias gladius), donde se observaron valores de 38 mg BVT-N/100 mg despues de 18 días de almacenamiento a 4 ± 0,5 °C y empacado al vacío. Igualmente, Stamatis y Arkoudelos (2007) consideran a los compuestos amoniacales como responsables del deterioro en caballa (Colias japonicus), empacado al vacío durante 15 días y mantenido a 3 ± 0,5 °C.
Las bases volátiles de nitrógeno (BVT-N) son producidas por la degradación de las proteínas y nitrógeno de compuestos no proteicos, principalmente como resultado de la actividad de microorganismos (Connell, 1975). Estos compuestos son utilizados para evaluar la calidad de la carne en los peces. El contenido de BVT-N de 25-35 mg/100 g es aceptado como el límite máximo permitido como aceptación de calidad en carne de pescado. La variación de estos valores depende del grado de procesamiento y origen de la carne de pescado (Dalgaard, 2000). La producción de compuestos volátiles de nitrógeno podría indicar el crecimiento de bacterias psicrotrófilas, especialmente Shewanella putrefaciens o Protobacterium phosphoreum, según estudios realizados por Rodríguez et al. (2003), en rodaballo (Psetta maxima), que coinciden con los resultados obtenidos en el presente trabajo.
Estudios realizados por diferentes investigadores muestran incremento para BVT a lo largo del periodo de almacenamiento. Ozogul et al. (2004) encontraron que valores de TVB-N para sardina almacenada a 4 °C fue superior a 35 mg N/100 g de carne después de 9 días de almacenamiento. Fagan et al. (2003) determinaron que TVB-N de filetes de macarela (Scomber scombrus) y porciones de salmón (Salmo spp.) almacenados a 4 °C incrementaron a 22,7 mg N/100 g para el día 3 de almacenamiento en hielo. Otras investigaciones muestran diferentes valores para el inicio y final del periodo de almacenamiento entre 5,5 y 17,0 mg N/100 g en carne, sugiriendo que la diferencia de estos valores y la asociación al deterioro esta influido por la manipulación (Benjakul et al., 2003).
Los resultados del presente estudio muestran que los valores de TVB-N y pH tienen una relación inversa durante el almacenamiento (Tabla 2) frente al valor inicial de pH 6,45 y final de 6,22. Hultmann y Rustad (2004) registran que los cambios en el contenido de TVB-N durante el almacenamiento pueden estar relacionados a los cambios en el pH. Por el contrario, los resultados obtenidos, indican que el empaque al vacío puede controlar el incremento del pH, manteniendo niveles bajos hasta el final del periodo estudiado.
La vida útil de filetes de peces también está determinada por el pH pos mortem y el generado durante el almacenamiento. Según Wheaton y Lawson (1985) la glicólisis pos mortem resulta en la acumulación de ácido láctico con reduccion del pH muscular. Para el bacalao (Gadus morhua), la reduccion del pH puede variar de 6,8 a 6,1 y en otras espécies la reducción puede ser más acentuada. Para la cavalla (Decaptereus macarellus), el pH puede llegar desde 5,8 a 6 y para el atun (Thunnus thynnus), 5,4 a 5,6.
El estado nutricional del pescado y el estrés durante la captura tienen un importante efecto en el glicógeno residual acumulado y posteriormente en la vida útil. Chiba et al. (1991) comprobaron que algunos minutos de estrés antes de la captura resultan en disminución de 0,5 unidades de pH en 3 horas, para 0,1 unidades en el mismo período relacionado con una captura no estresada. La reduccion del pH de la carne de pescado pos mortem tiene un efecto sobre las propiedades físicas del músculo. Cuando el pH disminuye, existe desnaturalizacion parcial de las proteínas con reduccion de la capacidad de absorcion de agua.
Análisis sensorial. Los resultados del análisis sensorial de filetes de cachama empacado al vacío durante 30 días de almacenamiento a 3 ºC son mostrados en la Tabla 3.
Tabla 3. Atributos sensoriales para filetes sajados de cachama Piaractus brachypomus, empacados al vacío y almacenados a 3 ± 0,5 °C durante 30 días.
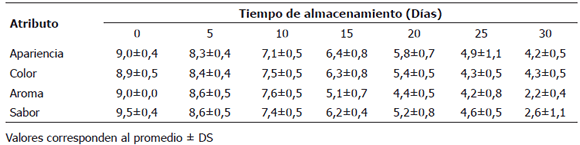
Con el incremento del periodo de almacenamiento, disminuyó la vida útil de los filetes de cachama. Los atributos sensoriales evaluados por los panelistas durante el periodo analizado para los filetes frescos fueron: apariencia, color y aroma y para los filetes cocinados, fue sabor. Los menores puntajes fueron obtenidos para los atributos de apariencia y color al final del periodo de almacenamiento, siendo superiores al límite de aceptabilidad estimado en 4. En los filetes cocinados, el atributo sabor, fue rechazado por el panel sensorial al finalizar el periodo de almacenamiento. Los jugadores no encontraron presencia de espinas intermusculares durante la valoración.
Similares resultados fueron encontrados por Arkoudelos et al. (2007) trabajando con anguilla (Anguilla anguilla), alcanzando 28 días de almacenamiento en empaque al vacío a 0 °C según criterios microbianos. Sin embargo, la evaluación sensorial mostró una vida útil mas corta de 11 días. Estos hallazgos indican que el proceso de deterioro pareciera estar dominado por el proceso de autólisis bajo un rechazo más rápido que el crecimiento microbiano. Vaz-Pires y Barbosa (2004) realizaron observaciones similares trabajando con pulpo (Octopus vulgaris) almacenado en hielo. Periodos de vida útil para carne de varias especies de peces han sido estimados entre 4 y 21 días, por varios investigadores. Masniyom et al. (2002) en medallones de mero, Ozogul et al. (2004) en sardinas y Reddy et al. (1994) en filetes de tilapia.
La presentacion de filetes sajados de cachama muestra atributos positivos aceptados por el panel sensorial, en concordancia con los resultados microbiológicos y fisicoquímicos. La aceptacion sensorial fue alta hasta el día 20 de almacenamiento, mostrando que este nuevo tratamiento para las espinas intramusculares puede ser una adecuada tecnología para obtener un nuevo producto con especiales atributos deseables para el consumo.
BIBLIOGRAFÍA
Amerine, A., R. Pangborn and B. Roessler. 1965. Principles of sensory evaluation of food. Second edition. Academic Press, New York. 602 p. [ Links ]
Arkoudelos, J., N. Stamatis and F. Sâmaras. 2007. Quality attributes of farmed eel (Anguilla anguilla) stored under air, vacuum and modified atmosphere packaging at 0 °C. Food Microbiology 24(7-8): 728-735. [ Links ]
Baird-Parker, T.C. 2000. The production of microbiologically safe and stable foods. pp. 3-18. In: Lund, B.M. and T.C. Baird-Parker (Eds.). The microbiological safety and quality of food. Aspen Publishers Inc., Gaithersburg. 2080 p. [ Links ]
Benjakul, S., W. Visessanguan and J. Tueksuban. 2003. Changes in physico-chemical properties and gel-forming ability of lizardfish (Saurida tumbil) during post-mortem storage in ice. Food Chemistry 80(4): 535-544. [ Links ]
Chiba, A.M., M. Hamaguchi, M. Kosaka, T. Tokuno, T. Asai, S. Chichibu. 1991. Quality evaluation of fish meat by phosphorus-nuclear magnetic resonance. Journal of Food Science 56(3): 660-664. [ Links ]
Connell, J.J. 1975. Control of fish quality. Fourth Edition. Fishing News Books Limited, London. 179 p. [ Links ]
Dalgaard, P. 2000. Freshness, quality and safety in seafoods. In: Flair-flow Europe technical manual. F-FE 380A/00. [ Links ]
Dixon, N.M. and D.B. Kell. 1989. The inhibition by CO2 of the growth and metabolism of micro-organisms: a review. J. Appl. Bacteriol. 67(2):109-136. [ Links ]
Fagan, J.D., T.R. Gormley and M.U. Mhuircheartaigh. 2003. Effect of freeze-chilling, in comparison with fresh, chilling and freezing, on some quality parameters of raw whiting, mackerel and salmon portion. Lebensmittel-Wissenschaft und- Technologie 36(7): 647-655. [ Links ]
Gómez-Estaca, J., M.E. López-Caballero, M.C. Gómez-Guillén, A. López de Lacey and P. Montero. 2008. High pressure technology as a tool to obtain high quality carpaccio and carpaccio-like products from fish. Innovative Food Science and Emerging Technologies 10(2): 148-154. [ Links ]
Goulas, A.E. and M.G. Kontominas 2007. Combined effect of light salting, modified atmosphere packaging and oregano essential oil on the shelf-life of sea bream (Sparus aurata): Biochemical and sensory attributes. Food Chemistry 100(1): 287-296. [ Links ]
Goulas, A.E. and M.G. Kontominas. 2005. Effect of salting and smoking-method on the keeping quality of chub mackerel (Scomber japonicus): Biochemical and sensory attributes. Food Chemistry 93(3): 511-520. [ Links ]
Gould, G.W. 2000. Strategies for food preservation. pp. 19-35. In: Lund, B.M., T.C. Bair-Parker and G.W. Gould (eds.). The Microbiological Safety and Quality of Food. Aspen Publishers, Inc., Gaithersburg. 2080 p. [ Links ]
Gram, L. and P. Dalgaard. 2002. Fish spoilage bacteria problems and solutions. Current Opinion in Biotechnology 13(3): 262-266. [ Links ]
Gram, L. and H.H. Huss. 1996. Microbiological spoilage of fish and fish products. International Journal of Food Microbiology 33(1): 121-137. [ Links ]
Gram, L. 1995. Bacteriological changes. pp. 51-64. In: Huss, H.H. (Ed.). Quality and quality changes in fresh fish. FAO Fisheries Technical Paper No. 348. Food and Agriculture Organization (FAO) of the United Nations, Rome. 195 p. [ Links ]
Hultmann, L. and T. Rustad. 2004. Iced storage of Atlantic salmon (Salmo salar)-effects on endogenous enzymes and their impact on muscle proteins and texture. Food Chemistry 87(1): 31-41. [ Links ]
Huss, H.H., A. Reilly and P.K. Ben Embarek. 2000. Prevention and control of hazards in seafood. Food Control 11(2):149-156. [ Links ]
INVIMA. 1998. Manual de técnicas de análisis para control de calidad microbiológica de alimentos para consumo humano. INVIMA, Bogotá. [ Links ]
Lalitha, K.V., E.R. Sonaji, S. Manju, L. Jose, T.K.S. Gopal and C.N. Ravisankar. 2005. Microbiological and biochemical changes in pearl spot (Etroplus suratensis Bloch) stored under modified atmosphere, Journal of Applied Microbiology 99(5): 1222-1228. [ Links ]
Lilly, T.J. and D.A. Kautter. 1990. Outgrowth of naturally occurring Clostridium botulinum in vacuum packaged fresh fish. Journal of Association of Official Analytical Chemistry 73(2): 211-212. [ Links ]
Liston, J. 1992. Bacterial spoilage of seafood. pp. 93-105. In: Huss, H.H. M. Jakobsen and J. Liston (eds.). Developments in food science. Vol. 30: Quality assurance in the fish industry. Proceedings of an International Conference. Elsiever Science Publishing, Copenhagen, Denmark. [ Links ]
Lyhs, U., J. Lahtinen, M. Fredriksson-Ahomaa, E. Hyytia-Trees, K. Elfing and H. Korkeala. 2001. Microbiological quality and shelf-life of vacuum-packaged 'gravad' rainbow trout stored at 3 and 8 ºC. International Journal of Food Microbiology 70(3): 221-230. [ Links ]
Masniyom, P., S. Benjakul and W. Visessanguan. 2002. Shelf life extension of refrigerated seabass slices under modified atmosphere packaging. Journal of the Science of Food and Agriculture 82(8): 873-880. [ Links ]
Ozogul, F., A. Polat and Y. Ozogul. 2004. The effects of modified atmosphere packaging and vacuum packaging on chemical, sensory and microbiological changes of sardines (Sardina pilchardus). Food Chemistry 85(1): 49-57. [ Links ]
Pantazi, D., A. Papavergou, N. Pournis, M.G. Kontominas and I.N. Savvaidis. 2008. Shelf-life of chilled fresh mediterranean swordfish (Xiphias gladius) stored under various packaging conditions: Microbiological, biochemical and sensory attributes. Food Microbiology 25(1): 136-143. [ Links ]
Ramanathan, L. and N. Das. 1992. Studies on the control of lipid oxidation in ground fish by some polyphenolic natural products. Journal of Agricultural and Food Chemistry 40(1): 17-21. [ Links ]
Reddy, N.R., H.M. Solomon, H. Yep, M.G. Roman and E.J. Rhodehamel. 1997. Shelf life and toxin development by Clostridium botulinum during storage of modified atmosphere - packaged fresh aquacultured salmon fillets. Journal of Food Protection 60(9): 1055-1063. [ Links ]
Reddy, N.R., C.L. Schreiber, K.S. Buzard, G.E. Skinner and D.J. Armstrong. 1994. Shelf life of fresh tilapia fillets packaged in high barrier film with modified atmospheres. Journal of Food Science 59(2): 260-264. [ Links ]
Rodríguez, O., J. Barros-Velázquez, A. Ojea, C. Piñeiro and S.P. Aubourg. 2003. Evaluation of sensory and microbiological changes and identification of proteolytic bacteria during the iced storage of farmed turbot (Psetta maxima). Journal of Food Science 68(9): 2764-2771. [ Links ]
Roth, B., E. Slinde and J. Arildsen. 2006. Pre or post mortem muscle activity in Atlantic salmon (Salmo salar). The effect on rigor mortis and the physical properties of flesh. Aquaculture 257(1-4): 504-510. [ Links ]
Schormuller, J. 1969. Handbuch der lebensmittelchemie (Band IV). Springer Verlag. Heidelberg, Berlin. [ Links ]
Sivertsvik, M., J.T. Rosnes and K.J. Willy. 2002. A review of modified atmosphere packaging of fish and fishery products-significance of microbial growth, activities and safety. International Journal of Food Science and Technology 37(2): 107-127. [ Links ]
Stamatis, N. and J. Arkoudelos. 2007. Quality assessment of Scomber colias japonicus under modified atmosphere and vacuum packaging. Food Control 18(4): 292-300. [ Links ]
Suárez, M.H., C.S. Pardo y R.M. Cortes. 2008. Calidad físico-química y atributos sensoriales de filetes sajados biopreservados de cachama, empacados al vacío bajo refrigeración. Revista Colombiana de Ciencias Pecuarias 21(3): 330-339 [ Links ]
Vaz-Pires, P. and A. Barbosa. 2004. Sensory, microbiological, physical and nutritional properties of iced whole common octopus (Octopus vulgaris). LWT- Lebensmittel-Wissenschaft und-Technologie 37(1): 105-114. [ Links ]
Wheaton, F.W. and T.B. Lawson. 1985. Processing aquatic food products. John Wiley and Sons, Canada. 497 p. [ Links ]














