Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista Facultad Nacional de Agronomía Medellín
Print version ISSN 0304-2847
Rev. Fac. Nac. Agron. Medellín vol.62 no.2 Medellín July/Dec. 2009
OBSERVACIONES HISTOLÓGICAS DE ESTRUCTURAS CELULARES ASOCIADAS A Spongospora subterranea f sp. subterranea EN PAPA
HISTOLOGY OBSERVATIONS OF CELLULAR STRUCTURES ASSOCIATED TO Spongospora subterranea f sp. subterranea IN POTATO
Liliana Hoyos Carvajal1; Marcela Villegas Ochoa2 y Elena Paola González Jaimes3
1 Profesora Auxiliar. Universidad Nacional de Colombia, Sede Bogotá. Facultad de Agronomía. A.A. 14490. Bogotá, Colombia. <limhoyosca@unal.edu.co>
2 Estudiante Ingeniería Agropecuaria. Politécnico Colombiano “Jaime Isaza Cadavid”. Facultad de Ciencias Agrarias. Carrera 48 No. 7-151. Medellín, Colombia. <marcelavillegas41@hotmail.com>
3 Profesora Asistente. Politécnico Colombiano “Jaime Isaza Cadavid”. Facultad de Ciencias Agrarias. Carrera 48 No. 7-151. Medellín, Colombia. <epgonzalez@elpoli.edu.co>
Recibido: Mayo 6 de 2008; Aceptado: Septiembre 15 de 2009
Resumen. Spongospora subterranea (Wallroth) Lagerheim f. sp. subterranea Tomlinson, agente causal de la sarna polvosa de la papa, es un parásito obligado el cual por sus características biológicas y reproductivas, posee una gran capacidad de sobrevivencia e infección no solo en su principal hospedero, sino también en diversas especies silvestres. El objetivo de este estudio fue realizar observaciones de estructuras celulares asociadas a S. subterranea f. sp. subterranea en plantas de papa en diferentes estados fenológicos naturalmente infectadas por el patógeno, sintomáticas o asintomáticas. Para este propósito se realizaron observaciones al microscopio de luz haciendo tinción de estos tejidos con azul de tripano, mediante lo cual fue posible identificar todas las fases de S. subterranea en las plantas analizadas. Lo anterior demuestra que en los tejidos radicales de papa, no siempre la presencia de agallas es indicativo de la infección, aun plantas asintomáticas pueden ser portadores de estructuras del protozoo; además, algunas estructuras asociadas a S. subterranea como plasmodios o células únicas, son de ocurrencia común y coinciden con las mencionadas frecuentemente en la literatura también en hospederos silvestres, lo que lleva a proponer la hipótesis de que este es un microorganismo común en suelos, que causa disturbios importantes puntualmente en cultivos de papa y cuyas estrategias de control deben orientarse el conocimiento de la ecología de las interacciones del protozoo, sus hospederos y el suelo.
Palabras claves: Sarna polvosa, Solanum tuberosum, protozoo, ciclo de vida.
Abstract. Spongospora subterranea (Wallroth) Lagerheim f. sp. subterranea Tomlinson, is the causal agent of powdery scab in potato and is an obligate parasite, because the biological and reproductive characteristic, it has a great survival and infection capacity in both, natural and wilds host which, can belong in different ecosystems and climatic conditions. The goal in this study was to make observations of cellular associate structures to S. subterranea f. sp. subterranea in potato plants in different phenologycal stages naturally infected by the pathogen, with root galls or symptomless. For this proposal were carried out observations at light microscopy, means by were identified all phases of S. subterranea in all symptomless plants. It was demostrated that in radicular tissues of potato not always galls are indicative of infection, plants without symptoms can have protozoa structures, beside associated structures to S. subterranea as plasmodium an sporangium aggregate, are commonly found and coincident with some structures frequently reporter in wild hosts; this appreciations, allows to propose that this microorganism is common in soils, associated with wild and cultivate species, causing important disturbs specially on potato plants, where control strategies should be oriented towards the knowledge of ecology of interactions protozoa, its host and soil.
Key words: Powdery scab, Solanum tuberosum, protozoa, life cycle.
Spongospora subterranea (Wallroth) Lagerheim f. sp. subterranea Tomlinson, es un parásito obligado que pertenece al orden Plasmodiophorales, el cual es un grupo monofilético, cuyos miembros comparten en común características como la división nuclear cruciforme, zoospora con dos flagelos anteriores, fase ameboidal, protoplasto multinucleado, plasmodios, parasitismo intracelular obligado y esporas de resistencia en quistes (Karling, 1942; Braselton, 2007). Este patógeno causa la sarna polvosa de la papa, enfermedad que se encuentra distribuida en casi todas las regiones productoras de papa en el mundo, originando pérdidas en tubérculos para consumo y semilla (Wale, 2000).
El mecanismo de infección ha sido bien estudiado en otros miembros de los plasmodiophorales como Plasmodiophora brassicae (Aist y Williams, 1971), Polymyxa betae (Keskin y Fuchs, 1969) y en Spongospora subterranea f. sp. nasturtii (Claxton et al., 1996), todos estos autores describen mecanismos similares de penetración de las zoosporas en la célula y el desarrollo posterior de estructuras especializadas; sin embargo, son pocos los estudios que se han hecho de S. subterranea f. sp. subterranea y se han centrado en aspectos microscópicos de las zoosporas primarias y secundarias, las cuales son morfológicamente idénticas y solo difieren en su origen (Merz, 1992, 1997; Braselton, 1998). Uno de los estudios más detallados es el realizado por Karling (1942), quien hizo una descripción detallada de la variación de estructuras a nivel morfológico que existe en el ciclo de vida de S. subterranea f.sp. subterranea mencionando estados plasmodiales, plasmodio nucleado, células únicas, zoosporas primarias (ciclo esporangial), plasmodios secundarios, plasmodios esporangiales, soros en quistosoros y zoosporas secundarias (fase esporogénica). Por mucho tiempo se pensó que solo las zoosporas secundarias eran capaces de formar infección en los tubérculos, pero Diriwaechter y Parbery (1991), demostraron que también puede darse con zoosporas primarias.
Posteriormente, Hooker (1980), estableció que cada una de estas fases son de importancia en el ciclo de vida del patógeno, ya que cada una es iniciada por la infección de la célula huésped a través de un plasmodio unicelular, indicando que existen dos fases importantes del ciclo de vida de S. subterranea. La fase esporogénica se presenta después de la división nuclear, produciendo esporas de pared gruesa, las cuales son altamente resistentes. Cada espora libera una sola zoospora primaria biflagelada, la cual entra en el sistema radical del huésped. En la fase esporangial, el esporangio de paredes delgadas se desarrolla entre células huéspedes, en las cuales se forman ocho zoosporas desde un plasmodio esporangiogénico. Las zoosporas secundarias también son biflageladas y pueden salir del huésped e iniciar otro ciclo de infección.
Cuando maduran, las pústulas de los tubérculos forman masas polvorientas de estructuras de resistencia con paredes delgadas llamadas esporosoros o quistosoros, los cuales contienen un gran número de esporas de resistencia que son una fuente de inóculo importante ya que son muy persistentes y pueden sobrevivir en el suelo por décadas, haciendo de esta una enfermedad de difícil control (Boer, 2000). Bajo condiciones de humedad, los quistosoros producen zoosporas primarias que pueden infectar papa y un amplio rango de otras plantas hospederas (Kole, 1954; Jones y Harrison, 1969; Iftikhar y Ahmad, 2005; Qu y Crist, 2006). Además de los tubérculos, las zoosporas de S. subterranea también pueden infectar raíces de papa donde eventualmente generan zoosporangios los cuales producen zoosporas secundarias o plasmodios esporangiales. La aparición de estos últimos, se asocia con hiperplasias e hipertrofias de las células de la raíz, lo que genera la formación de agallas que al igual que las pústulas de los tubérculos pueden formar quistosoros que permanecen en el suelo (Van de Graff et al., 2007).
La enfermedad afecta raíces, estolones y tubérculos. Las raíces de las plantas enfermas muestran agallas o tumores lisos, de 0,5 a 1,5 cm de tamaño y de forma mas o menos irregular; al inicio las agallas son de color blanquecino y cuando alcanzan la madurez fisiológica se vuelven oscuras, debido al color marrón de las paredes de las estructuras de resistencia (Harrison et al., 1997). El alto nivel de infección de las raíces tiene efecto detrimental en la absorción de agua y nutrientes y sobre la producción, ya que en un estado avanzado de la enfermedad, se desintegran las raíces con una liberación masiva de quistosoros al suelo.
En este trabajo mediante la observación de estructuras del patógeno al interior de las raíces de papa en plantas sintomáticas y asintomáticas, se hace una descripción morfológica de S. subterránea mediante la cual se ilustra el ciclo de vida y tipos de estructuras en cultivos de papa en diferentes localidades de Antioquia (Colombia), como aporte al conocimiento en la biología del patógeno en las condiciones del trópico.
MATERIALES Y MÉTODOS
Para analizar estructuras asociadas con S. subterranea f. sp. subterranea, de campos naturalmente infectados con el patógeno, se obtuvieron plantas de papa (Solanum tuberosum) de las variedades Diacol Capiro e Ica Puracé, en diferentes estados fenológicos y de infección, tanto con síntomas en raíces y tubérculos como plantas asíntomaticas. El muestreo se realizó en el segundo semestre de 2007 en el municipio de La Unión (Antioquia), en lotes con alta incidencia de la enfermedad y en el infectario de S. subterranea ubicado en el Centro Agropecuario Paysandú, en Santa Elena (Antioquia). Las muestras se lavaron y se sumergieron en una solución de KOH 10% hasta su análisis en laboratorio. Para la detección de estructuras intracelulares asociadas a S. subterranea se utilizaron los protocolos de tinción descritos por Qu et al. (2001) con azul de lactofenol y otro descrito por Brundrett et al. (1996) con azul de tripano al 0,05% modificando en este último, los tiempos de clarificación de las raíces. Las raíces una vez teñidas, se montaron en placas cubreobjetos y se analizaron bajo microscopía de luz con un microscopio OLYMPUS BX 60. En total fueron analizadas alrededor de 100 muestras de los diferentes lotes en donde se identificaron cada una de las estructuras asociadas a S. subterranea.
RESULTADOS Y DISCUSIÓN
Se encontraron estados de S. subterranea como: plasmodios, plasmodios enquistados, plasmodios en estado de división y células únicas, los cuales son procesos de transformación o cambios del patógeno dentro o fuera de sus hospedantes, tomando como base los informes anteriores de Braselton (2007), Merz (1997, 2006) y Qu et al. (2001). Ilustrando el ciclo de vida del patógeno en la Figura 1, se muestran las diferentes estructuras observadas del patógeno, partiendo de la zoospora primaria que, por estímulo de la presencia de un hospedero y en condiciones ambientales favorables para que se dé el proceso de liberación a partir de un quistosoro, infecta el tejido. Una vez esta zoospora coloniza, se genera un plasmodio en la célula del hospedante (Figura 2A) que puede seguir dos rutas, una puede ser su enquistamiento dentro de las células del hospedante (Figura 2B) como ha sido encontrado por Qu et al. (2001), o como segunda ruta, el plasmodio puede presentar crecimiento y divisiones sucesivas (Figura 2C), hasta formar zoosporangios en células únicas, que se encuentran en diferentes estados de división del plasmodio (Figuras 2D y 2E), estas estructuras fueron encontradas con alta frecuencia en raíces asintomáticas de papa; siendo estas observaciones, coincidentes con lo mencionado por varios autores en diferentes tipos de hospederos silvestres (Tabla 1). Siguiendo el proceso de transformación, cada célula única da origen a una zoospora secundaria que es infectiva en tejido nuevo dentro del mismo huésped, esta zoospora originó plasmodios esporogénicos en agallas (Figura 2F) o en tejidos asintomáticos, aunque en los hospederos donde no se ha observado la generación de quistosoros, hipotéticamente existe la posibilidad de que la ruta sea de nuevo hacia un plasmodio esporangial (línea punteada Figura 1) y no se formen plasmodios esporogénicos, por tanto podría ser este un ciclo o fase asexual para este protozoo, dependiendo del ambiente, de las señales químicas y otras características del hospedero en el cual se encuentre.
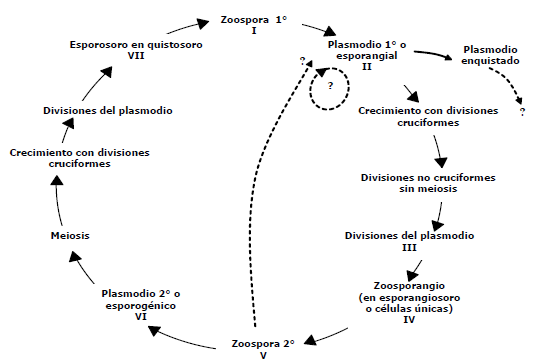
Figura 1. Ciclo de vida teórico de Spongospora subterranea. (Braselton, 2007; Merz 1997, 2006, Qu et al., 2001).

Figura 2. Diferentes tipos de estructuras celulares compatibles con Spongospora subterranea teñidos con azul de trypano. A. Plasmodio típico irregular multinucleado (100X). B. Plasmodio enquistado dentro de células del hospedante papa (20X). C. Plasmodio esporangial en divisiones iniciales en papa (20X) D. Células únicas en papa (20X). E. Células únicas en papa (100X). F. Microagalla en papa (20X). G. Células de agallas en papa con plasmodios en su interior (20X). H. Células de agallas en papa con plasmodios en su interior (40X). I. Células de raíz con quistosoros en su interior con tinción de estructuras amiloides (puntos negros al interior de la célula) (10X).
Tabla 1. Hospederos alternos asociados a Spongospora subterranea en familias que muestran diferentes estructuras del patógeno.

Del análisis de este ciclo se deriva que pueden existir 7 estados de S. subterranea; 3 de ellos estan fuera de su hospedante y 4 son intracelulares obligados, lo que coincide con los ciclos de vida e imágenes de S. subterranea mostrados por Karling (1942), estudios histológicos de Qu et al. (2001) y Braselton (2007), no obstante se requiere confirmación de la identidad o compatibilidad de estas estructuras con el patógeno, bien sea por métodos moleculares o de inmunotinción en tejidos.
Cuando la zoospora secundaria infecta, da origen a un plasmodio esporogénico (Figuras 2G y 2H), este se recombina con otro plasmodio de su misma clase, dando lugar a mitosis y a divisiones cruciformes para formar soros en esporocarpos denominados quistosoros (Figura 2I). Con frecuencia estas estructuras se encuentran en agallas y se puede afirmar que los plasmodios encontrados en estas, son de origen secundario o esporogénicos, lo cual no se puede afirmar sobre los plasmodios encontrados en tejidos asintomáticos en los cuales puede haber ocurrencia de ambos tipos de plasmodio. Cabe aclarar que igual que entre zoosporas primarias y secundarias, en el caso de los plasmodios tampoco existen diferencias morfológicas conspicuas en observaciones en microscopía de luz.
Los quistosoros son estructuras poliédricas, globosas u ovoides huecas formadas por grupos de soros, cada soro o esporosoro da origen a ocho zoosporas (Hooker, 1980) y son la estructura mas estudiada en términos de control y epidemiología de la enfermedad. Esto es explicable porque son comparativamente más sencillas de ver con respecto a plasmodios, zoosporas y zoosporangios o células únicas, además son la estructura más notoria en los tejidos sintomáticos. No obstante, en el ciclo de vida de S. subterranea, el quistosoro es la estructura en la cual el organismo basa su estrategia de sobrevivencia siendo el estado de menor susceptibilidad en términos biológicos, por tanto, no es un blanco sencillo para agentes de biorregulación, tampoco así lo son las zoosporas, las cuales del mismo modo pueden enquistarse y su duración es relativamente corta comparada con la de otras estructuras; los plasmodios primarios son la tercera estructura que se enquista cuando no hay condiciones favorables para su crecimiento, indicando que en términos de sobrevivencia para S. subterranea el enquistamiento de estructuras, es un mecanismo de defensa y perdurabilidad en suelos o tejidos de sus hospedantes, lo que al mismo tiempo las convierte en estructuras de difícil control.
Aunado a lo anterior, S. subterranea presenta una amplia gama de hospedantes que incluyen plantas silvestres y cultivadas en diferentes taxones y en varias zonas climáticas (Tabla 1), por lo cual su especificidad de hospedante puede ser relativa e indicar que este es un organismo común en suelos, cuya manifestación patogénica en cultivos de papa y otras solanáceas puede ser producto del desequilibrio del suelo entre otros, tal como ocurre con otros patógenos (Garbeva et al., 2004).
En un trabajo paralelo a este, se han encontrado plasmodios y células únicas o zoosporangios en arvenses comunes al cultivo de la papa en Colombia, como Polygonum nepalense y Rumex crispus (resultados no mostrados), entre otras, sugiriendo la existencia de estrategias de permanencia del patógeno en suelo muy variadas, las cuales garantizan su subsistencia en términos de cantidad y presencia permanente de este organismo en los agroecosistemas de cultivos de papa, pero además indica que S. subterranea puede ser un protozoo común en suelos o en plantas. Esta afirmación se sustenta en los hallazgos de estructuras infectivas, principalmente zoosporangios, en órganos infectados pero asintomáticos de papa como estolones y raíces, lo cual es coincidente con lo señalado por Qu y Christ (2006) y Andersen et al. (2002), entre otros. En el caso de los quistosoros, aunque son limitados a hospedantes como papa, tomate y otras solanáceas, Qu y Christ (2006) encontraron estas estructuras en gramíneas en un estudio en Norteamérica, mientras que Harrison (1997), los identificó en espinaca, remolacha y Solanum nigrum. Estos escasos informes, en comparación con los hallazgos de zooporangios o células únicas, demuestran que esta última es la estructura prevalente en tejidos de plantas. La presencia de estas estructuras pasa inadvertida, salvo en análisis y tinciones específicas, ya que las plantas infectadas tampoco manifiestan síntomas alternos a la presencia de agallas o pústulas; lo que puede indicar un relativo estado de equilibrio con sus hospedantes y deberse a la fisiología de la interacción planta-microorganismo o de homeostasis o bioregulación de poblaciones de microorganismos (Gilbert, 2002).
En el ciclo de vida aquí planteado, basado en observaciones morfológicas, se muestra que existen estructuras como zoosporangios y plasmodios asociadas a S. subterranea además de los quistosoros y zoosporas, cuya ocurrencia es común y frecuentemente mencionada en la literatura sobre hospederos silvestres, sugiriendo que este es un microorganismo ampliamente distribuido en suelo, asociado a plantas silvestres y cultivadas, que puede causar disturbios importantes puntualmente en cultivos de papa, donde las estrategias de control deben ser direccionadas al reestablecimiento del equilibrio que existe entre S. subterranea y sus hospederos en los cuales no hay impacto biológico evidente ni económico, siendo esto posible en primera instancia usando dos vías: propiciando cambios en el agroecosistema que favorezcan la planta y el suelo y/o planteando como blanco de control estructuras diferentes a los quistosoros.
Sin embargo, para cualquiera que sea la estrategia a utilizar, es de vital importancia conocer el ciclo de este patógeno no solo en su hospedero principal y en las condiciones del trópico, sino también en aquellos hospederos donde está garantizando su supervivencia, para así establecer un manejo de la enfermedad coherente con su biología.
CONCLUSIONES
Es posible observar diversas estructuras asociadas a Spongospora subterranea, tales como plasmodios, plasmodios enquistados, plasmodios en estado de división, células únicas y quistosoros, en raíces de plantas asintomáticas, indicando que la infección puede estar presente sin desarrollo evidente de síntomas y que los quistosoros no son solamente los tipos de estructuras mas frecuentes en tejidos.
El protocolo de tinción con azul de tripano utilizado permite observar diferentes estructuras asociadas a Spongospora subterranea en raíces de papa.
BIBLIOGRAFÍA
Aist, J.R. and P.H. Williams. 1971. The cytology and kinetics of cabbage root hair penetration by Plasmodiophora brasiccae. Canadian Journal of Botany 49(11): 2023-2034. [ Links ]
Andersen, B.A.B., M. Nicolaisen, S.L. Nielsen. 2002. Alternative hosts for potato mop-top virus, genus Pomovirus and its vector Spongospora subterranea f.sp. subterranea. Potato Research 45(1): 37–43.
Boer, R.F. de. 2000. Research into the biology and control of powdery scab of potatoes in Australia. pp. 79–83. In: Merz, U. and A.K. Lees (eds.). Proceedings of the First European Powdery Scab Workshop, SAC, Aberdeen, Scotland.
Braselton, J.P. 1998. Kariology and systematics of Plasmodiophoromycetes. pp. 139-152. In: Cooper, J.I. and M.J.Z. Asher (eds.). Development in Applied Biology II Viruses with fungal vectors. Suffolk, UK: The Lavenham Press Ltd. [ Links ]
Braselton, J.P. 2007. Generalized plasmodiophorid life cycle based on several sources. In: Plasmodiophorid Home Page; http://oak.cats.ohiou.edu/~braselto/plasmos/; consulta: febrero 2008. [ Links ]
Brundrett, M., N. Bougher, B. Dell, T. Grove, N. Malajczuk. 1996. Clearing and staining mycorrhizal roots. pp. 179-183. In: M. Brundrett, N. Bougher, B. Dell, T. Grave, N. Malajczuk (eds.). Working with mycorrhizas in forestry and agriculture. Monograph 32. Australian Centre for International Agricultural Research. Canberra, Australia. 374 p. [ Links ]
Claxton, J.R., U.J. Potter, D. Blakesley, J.M. Clarkson. 1996. An ultrastructural study of the interaction between Spongospora subterranea f sp nasturtii and watercress roots. Mycological Research 100(12): 1431-1439 [ Links ]
Diriwaechter, G. and D.G. Parbery. 1991. Infection of potato by Spongospora subterranea. Mycological Research 95(6): 762-764 [ Links ]
Garbeva, P., J.A. Van Veen and J.D. Van Elsas. 2004. Microbial diversity in soil: selection of microbial populations by plant and soil type and implications for suppressiveness. Annual Review of Phytopathology 42: 243-270. [ Links ]
Gilbert, G.S. 2002. Evolutionary ecology of plant diseases in natural ecosystems. Annual Review Phytopathology 40: 13-43. [ Links ]
Harrison, J.G., R.J. Searle and N.A. Williams. 1997. Powdery scab disease of potato–A review. Plant Pathology 46(1): 1-25.
Hooker, W.J. 1980. Compendium of potato diseases. American Phytopathological Society Press, St. Paul. MN. 125 p. [ Links ]
Iftikhar, S. and I. Ahmad. 2005. Alternate hosts of Spongospora subterranea f.sp. subterranea, the causal organism of powdery scab of potato. American Journal of Potato Research 82: 74–75.
Jones, R.A.C. and B.D. Harrison. 1969. The behaviour of potato mop-top virus in soil, and evidence for its transmission by Spongospora subterranea (Wallr.) Lagerh. Annals of Applied Biology 63(1): 1-17. [ Links ]
Karling, J.S. 1942. The plasmodiophorales: including a complete host index, bibliography and a description of diseases caused by species of this order. The author, New York. 144 p. [ Links ]
Keskin, B. and W.H. Fusch. 1969. Der infektionsvorgang bie Polymixia betae. Archives fur mikrobiologie 68: 218-226. [ Links ]
Kole, A.P. 1954. A contribution to the knowledge of Spongospora subterranea (Wallr.) Lagerh., the cause of powdery scab of potatoes. Tijdschrift over Plantenziekten 60: 1-65 [ Links ]
Merz, U., 1992. Observation on swimming pattern and morphology of secondary zoospore of Spongospora subterranea. Plant Pathology 41(4): 490-494 [ Links ]
Merz, U. 1997. Microscopical observation of the primary zoospore of Spongospora subterranea f.sp. subterranean. Plant Pathology 46(5): 670-674. [ Links ]
Merz, U. 2006. General description of the genus spongospora. In: Spongospora Home Page, http://www.spongospora.ethz.ch/index.html; consulta: febrero 2008 [ Links ]
Qu, X.S., J.A. Kavanagh, D. Egan and H. Lahert. 2001. Studies on amoebae and cysts associated with the isolation of Spongospora subterranea f.sp. subterranea in vitro. Plant Pathology 50(4): 420-426. [ Links ]
Qu, X. and B.J. Christ. 2006. The host range of Spongospora subterranea f.sp. subterranea in the United States. American Journal of Potato Research 83(4): 343-347. [ Links ]
Van de Graff, P., S.J. Wale and A.K. Lees. 2007. Factors affecting the incidence and severity of Spongospora subterranea infection and galling in potato roots. Plant Pathology 56(6): 1005-1013. [ Links ]
Wale, S.J. 2000. Summary of the session on national potato production and the powdery scab situation. pp. 3-9. In: Merz, U. and A.K. Lees (eds.). Proceedings of the First European Powdery Scab Workshop, SAC, Aberdeen, Scotland. [ Links ]














